中国79个小麦品种(系)抗条锈病评价及基因分子检测
黄亮,刘太国,肖星芷,屈春艳,刘博,高利,罗培高,陈万权
中国79个小麦品种(系)抗条锈病评价及基因分子检测
黄亮1,2,刘太国1,肖星芷3,屈春艳4,刘博1,高利1,罗培高1,2,陈万权1
(1中国农业科学院植物保护研究所植物病虫害生物学国家重点实验室,北京 100193;2四川农业大学农学院,成都 611130;3西南大学植物保护学院,重庆 400715;4山东农业大学作物生物学国家重点实验室,山东泰安 271018)
【目的】了解中国小麦品种的条锈病抗性水平,掌握条锈病抗性基因的分布与利用情况,加强小麦品种的合理应用,促进品种布局与推广,延长品种使用年限,保障小麦生产安全。【方法】在温室中采用条锈菌CYR32、CYR33、G22-9、G22-14对中国小麦主产区的79个小麦品种(系)进行苗期抗性鉴定,喷雾接种的幼苗在(10±1)℃的黑暗保温桶中保湿12—18 h,取出置于白天16—18℃,夜晚14—16℃温室中,光周期为L﹕D=16 h﹕8 h,15 d后按0—9级分级标准进行调查;在河北廊坊大田中采用条锈菌CYR32、CYR33对79个小麦品种(系)进行成株期抗性鉴定,接种适期为小麦拔节期,接种前3 d灌水确保田间土壤温度。采用1 g夏孢子﹕300 mL矿物油的条锈菌夏孢子悬浮液喷雾接种诱发行感病品种铭贤169,待矿物油晾干后,喷水并覆塑料薄膜保湿12—16 h,待充分发病后调查病害的普遍率、严重度和侵染型,调查两次,以最高等级作为病情发病的级数;利用小麦抗条锈病基因、、、和易位系的相应分子标记Wmc175F/R、SC200F/R、csLv34 F/R、We173 F/R和AF1/AF4对供试小麦进行分子检测;结合系谱分析、抗病性鉴定和分子检测结果分析确定参试小麦品种的抗性基因情况。【结果】在所有的参试小麦品(系)中,苗期对CYR32和CYR33均具有抗性的16份,占20.3%;对条锈菌致病类型G22-9和G22-14均具有抗性的4份,占5.1%;对CYR32、CYR33、G22-9和G22-14这4个小种均具有抗性的4份,占5.1%;成株期对CYR32和CYR33表现中抗及以上水平的24份,占30.4%;对CYR32表现全生育期抗性的12份,占15.2%;对CYR33表现全生育期抗性的16份,占20.3%;对CYR32和CYR33均表现全生育期抗性的11份,占14.0%。苗期对4个菌系均具有抗性并且成株期对CYR32和CYR33表现中抗或以上水平的共4份,占5.1%。结合系谱分析、抗病性鉴定和分子检测结果得出,供试小麦品种中4份携带,占5.1%;8份携带,占10.1%;3份携带,占3.8%;仅1份携带,占1.3%;35份携带/,占44.3%;4份携带2个抗性基因;远丰139携带、和。【结论】中国主产麦区的79个小麦品种(系)对当前条锈菌流行小种抗性水平普遍较低,/易位系使用率依然较高,在今后的育种工作中应加大、等有效抗性基因的利用,育成多基因聚合的有效持久抗性品种,进一步减少对/易位系的使用。
小麦;小麦条锈病;抗病鉴定;抗病基因;分子检测
0 引言
【研究意义】小麦条锈病是一种由小麦条锈菌(f. sp.)引起的、发生范围广、流行程度大、危害损失重的小麦真菌病害,在病害流行年份可造成小麦减产40%以上甚至绝收。小麦条锈病在全球范围内均有分布,中国是小麦条锈病发病面积最广、损失程度最重的国家[1]。1949年以来,先后发生了9次小麦条锈病大流行,对小麦生产造成了重大损失,直接影响口粮安全生产工作。【前人研究进展】条锈病菌变异是引起中国小麦对条锈病抗性丧失的主要原因,目前,选育并合理运用优良抗病品种依然是防治小麦条锈病最经济、安全、有效的方法[2],明确小麦品种的抗病性和抗病基因是实现小麦品种合理布局、优化小麦生产结构的关键环节和重要前提。条中32号(CYR32)和条中33号(CYR33)小种的出现频率年度间虽有变化,但仍然是当前优势生理小种[3-6],其对条锈病抗病基因、、、、和一些未知的抗性基因不具有毒性[7-8]。2009年,在四川发现了对中国小麦条锈菌鉴别寄主贵农22有毒性的新菌株(代号V26,现称为G22致病类群),其主要特点是对重要抗条锈病基因和具有联合毒性[9-10],导致贵农系、92R系和Moro等主要抗锈性材料抗条锈性“丧失”,并极有可能上升为中国流行小种[4,11],其中来自小麦品种Moro的抗条锈基因在四川和贵州等地作为有效抗源得到广泛应用,占四川小麦主栽品种的17.2%[12]和贵州高抗条锈小麦品种的8.3%[13];来自四倍体圆锥小麦6VS/6AL易位系的抗条锈基因在黄淮海麦区和西南地区尤其依赖,其中黄淮海麦区带有的小麦品种多达30%[14],云贵川地区推广的带有的云麦52、川麦42、川麦47、川麦38以及绵麦37、绵麦168和贵农21、贵农775等品种均有广泛应用。采用基因推导和分子标记相结合的方式进行抗性基因的确定可大大提高研究的可靠性和准确性[15]。【本研究切入点】新小种的产生为小麦条锈病防治工作带来了严峻的挑战,可能引起小麦生产品种的再一次更替,而目前中国主产区小麦品种对新小种的抗性表现和主效基因还有待明确。【拟解决的关键问题】通过对79份小麦生产品种(系)所含的抗条锈基因、、、和携带的/易位系进行分子检测并结合系谱分析和抗性鉴定结果,分析中国当前小麦生产品种的抗条锈基因分布情况,为新形势下小麦品种合理布局和品种推广提供参考。
1 材料与方法
1.1 材料
供试菌种CYR32、CYR33、G22-9、G22-14由中国农业科学院植物保护研究所麦类病害组收集、鉴定、繁存。
供试小麦为中国小麦主产区部分小麦品种,共79份,阳性对照材料为Avocet S*6/、Avocet S*6/、Avocet S*6/、Avocet S*6/、Avocet S*6/,阴性对照材料为Avocet S。所有小麦品种均由中国农业科学院植物保护研究所麦类病害组收集、繁存。
1.2 小麦抗条锈病鉴定
1.2.1 苗期鉴定 苗期抗性鉴定于2016年3—6月在中国农业科学院植物保护研究所廊坊科研基地麦类病害组低温温室完成。采用72穴的育苗盘种植小麦种子,每穴7—9粒,放于育苗间内待小麦第一片叶完全展开时人工接菌。接种采用刘太国等[10]方法,按照9 mg条锈菌新鲜夏孢子比1 ml矿物油(Soltrol®170)的比例配制混合液,并用喷雾装置均匀喷洒在小麦叶片上,待矿物油完全晾干后(约4—6 h)放入保湿间,均匀喷上吐温水(1 ml 2.0%吐温溶液﹕2 L水)溶液,10℃保湿24 h后取出放于低温室培养,温度14—18℃,光照16 h·d-1,培养15 d,待对照品种铭贤169完全发病后调查。调查标准按照0—9级标准[16]进行,即0—6为抗病,7—9为感病。
1.2.2 成株期鉴定 成株期抗性鉴定于2015—2016年在中国农业科学院植物保护研究所廊坊科研基地完成。每个品种种植一行,每行长1 m,行距0.33 m,每隔20个品种种植一行铭贤169,在两个品种中间垂直于行种植一行铭贤169(铭贤169均作为诱发行),在4月中旬小麦进入返青、拔节期时按照1 g条锈菌新鲜夏孢子﹕300 ml矿物油(Soltrol®170)的比例配制混合液,均匀喷撒在诱发行小麦叶片上,待矿物油完全晾干后,均匀喷上0.05%吐温20水溶液,覆盖薄膜保湿过夜,第2天清晨揭去薄膜,10 d灌水一次保持田间湿度利于病菌进行再侵染,于铭贤169充分发病(5月下旬和6月上旬)调查病害的普遍率、严重度和侵染型[17],调查两次,以最高等级作为病情发病的级数。
1.3 分子标记检测
分子标记检测试验于2016年3—9月在中国农业科学院植物保护研究所麦类病害组实验室完成。
1.3.1 引物序列、、、和携带的/易位系分子检测引物(表1)均由上海生工生物工程有限公司合成。

表1 小麦抗条锈病基因Yr5、Yr9、Yr10、Yr18和Yr26的特异性引物序列
1.3.2 小麦基因组提取 待小麦苗长至2—3叶期时取小麦叶片,采用CTAB法提取小麦基因组DNA,用Nano Drop(ND-1000)测定浓度后稀释至100 ng·µL-1备用。
1.3.3 PCR检测 PCR检测采用25 µL体系,包含12.5 µL® PCR SuperMix,上游引物和下游引物各1 µL(引物浓度为100 ng·µL-1),模板DNA 1 µl,ddH2O 9.5 µL。产物均用2.0%的琼脂糖凝胶进行检测,并在WSE-5200一体式凝胶成像系统上观察拍照。
2 结果
2.1 小麦抗条锈病鉴定
苗期对CYR32具有抗性(0—6)的小麦18份,占22.8%,不具有抗性(7—9)的61份,占77.2%;对CYR33具有抗性的34份,占43%,不具有抗性的45份,占57%;对G22-9具有抗性的15份,占19%,不具有抗性的64份,占81.0%;对G22-14具有抗性的10份,占12.7%,不具有抗性的69份,占87.3%。成株期对CYR32表现免疫(0)的11份,占14%,表现高抗(R)的12份,占15.2%,表现中抗(MR)的6份,占7.6%,表现中感(MS)的19份,占24.1%,表现高感(S)的31份,占39.2%;对CYR33表现免疫的9份,占11.4%,表现高抗的9份,占11.4%,表现中抗的18份,占22.8%,表现中感的20份,占25.3%,表现高感的23份,占29.1%。其中苗期对CYR32和CYR33均具有抗性的16份,占20.3%;对条锈菌毒性类型G22-9和G22-14均具有抗性的4份,占5.1%;对CYR32、CYR33、G22-9和G22-14这4个小种均具有抗性的4份,占5.1%;成株期对CYR32和CYR33表现中抗及以上水平(0、R、MR)的24份,占30.4%;对CYR32表现全生育期抗性的12份,占15.2%;对CYR33表现全生育期抗性的16份,占20.3%;对CYR32和CYR33均表现全生育期抗性的11份,占14.0%。苗期对4个菌种均具有抗性并且成株期对CYR32和CYR33表现中抗或以上水平的共4份,分别为廊研43、西农889、远丰139和西农223(表2)。
2.2 小麦抗条锈基因分子检测
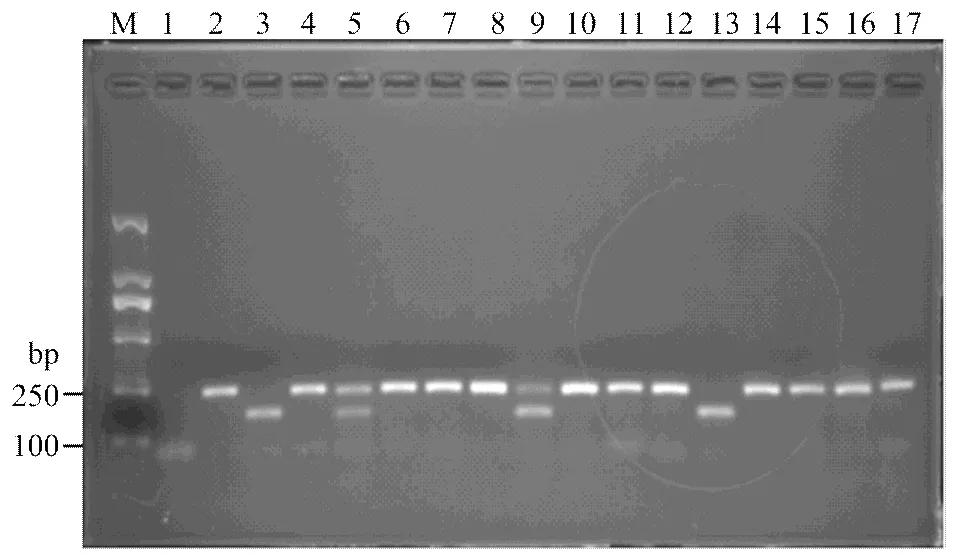
2.2.1/易位系分子检测 Francis等[19]开发了一个长度为1 500 bp的易位系SCAR显性标记AF1/4,利用该标记对79份供试小麦进行检测(表2、图1),发现石4185、烟农22等共35份材料带有该标记,占检测总数的44.3%。
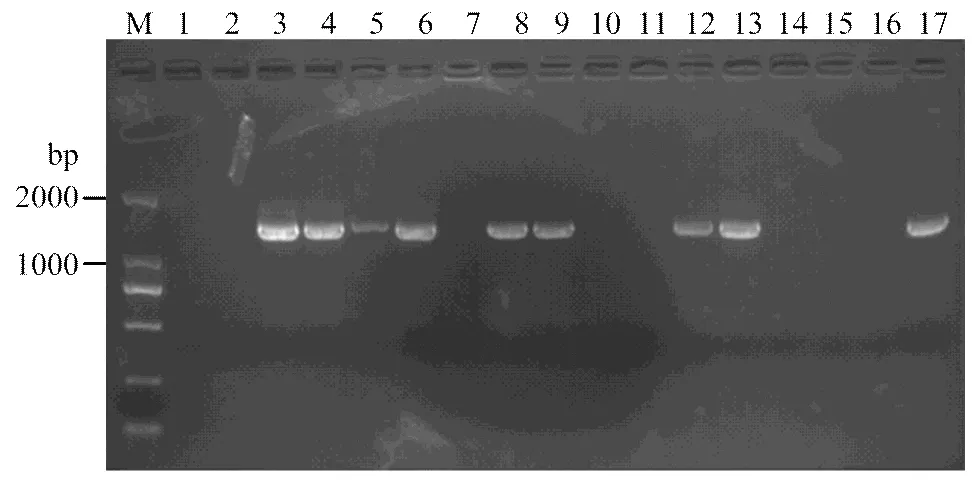
M:DL2000;1:ddH2O;2:Avocet S;3:Avocet S*6/Yr9;4:烟农22 Yannong 22;5:科农199 Kenong 199;6:石4185 Shi 4185; 7:西农889 Xinong 889;8:石新616 Shixin 616;9:石新618 Shixin 618;10:小偃216 Xiaoyan 216;11:淮麦16 Huaimai 16; 12:西农9871 Xinong 9871;13:莱州137 Laizhou 137;14:澳大利亚红麦Red wheat from Australia;15:加拿大超强筋小麦Extra-strong gluten wheat from Canada;16:泰农18 Tainong 18;17:新麦16 Xinmai 16
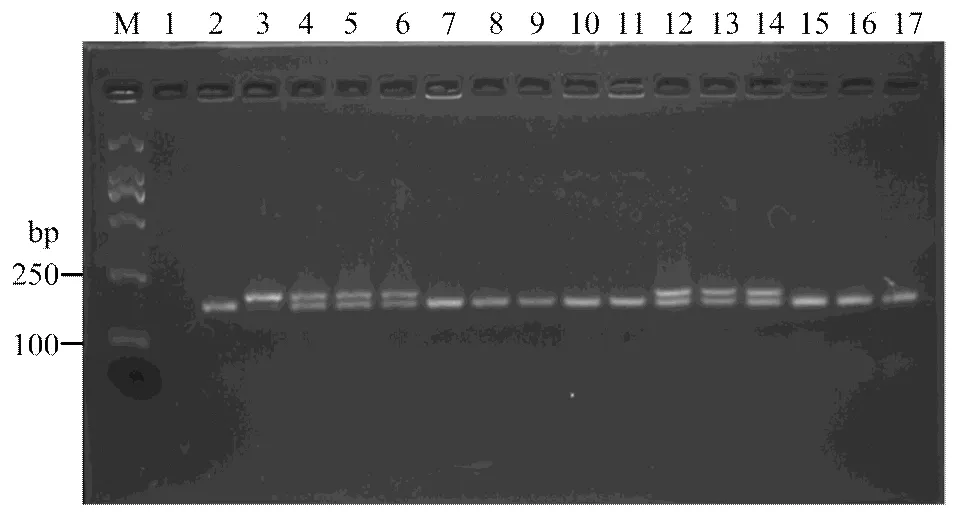
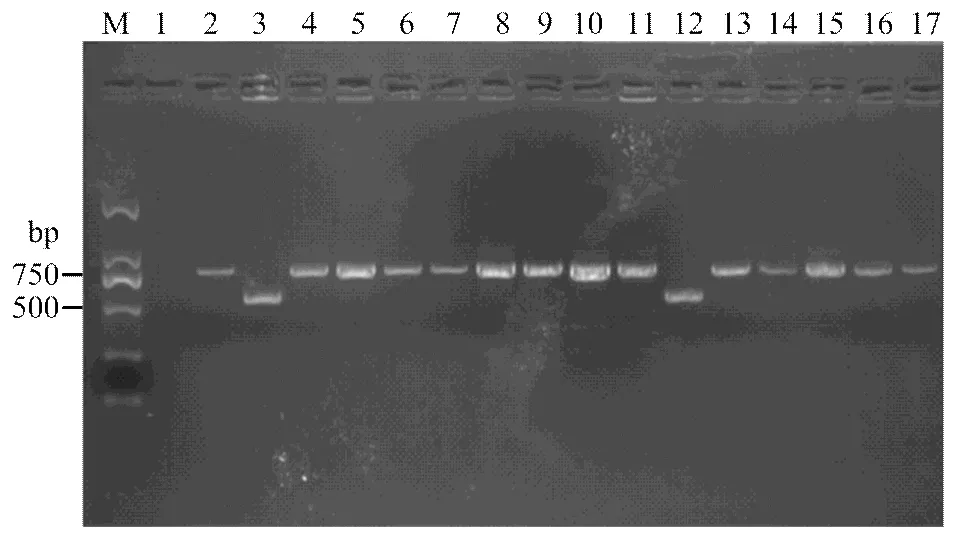
2.2.2、、、分子检测 利用共显性标记Wmc175、SC200、csLv34、We173分别对、、、基因进行分子检测,并结合系谱分析和抗性鉴定结果发现4份材料带有(表2、图2),占5.1%;8份材料带有(表2、图3),占10.1%;3份材料带有(表2、图4),占3.8%;仅1份材料带有(表2、图5),占1.3%;4份材料同时携带2个抗条锈病基因;1份材料同时携带3个抗条锈病基因。
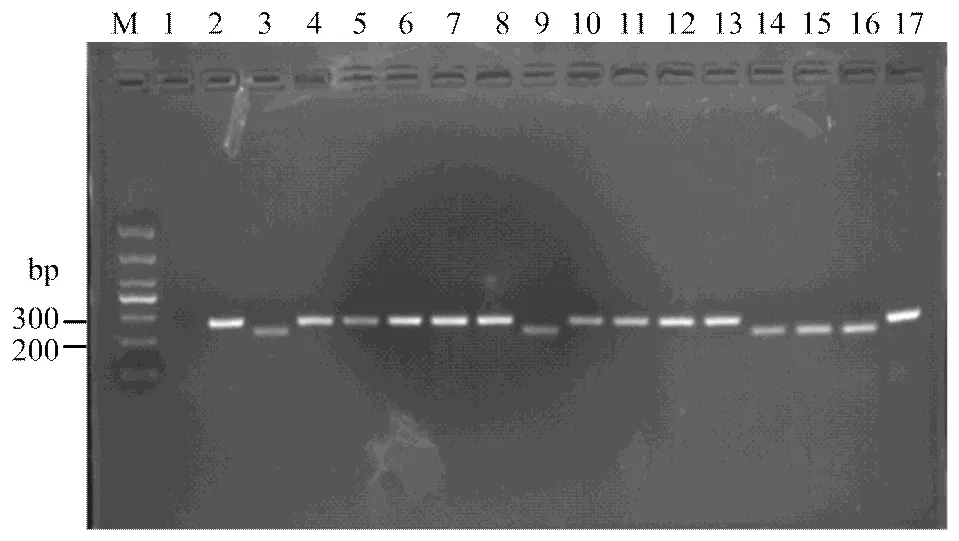
M:DL1000;1:ddH2O;2:Avocet S;3:Avocet S*6/Yr5;4:烟农19 Yannong 19;5:鲁麦22 Lumai 22;6:济宁16 Jining 16;7:良星99 Liangxing 99;8:烟农21 Yannong 21;9:廊研43 Langyan 43;10:山农15 Shannong 15;11:烟农836 Yannong 836;12:豫麦49 Yumai 49;13:豫麦54 Yumai 54;14:西农889 Xinong 889;15:西农223 Xinong 223;16:远丰139 Yuanfeng 139;17:石54 Shi 54
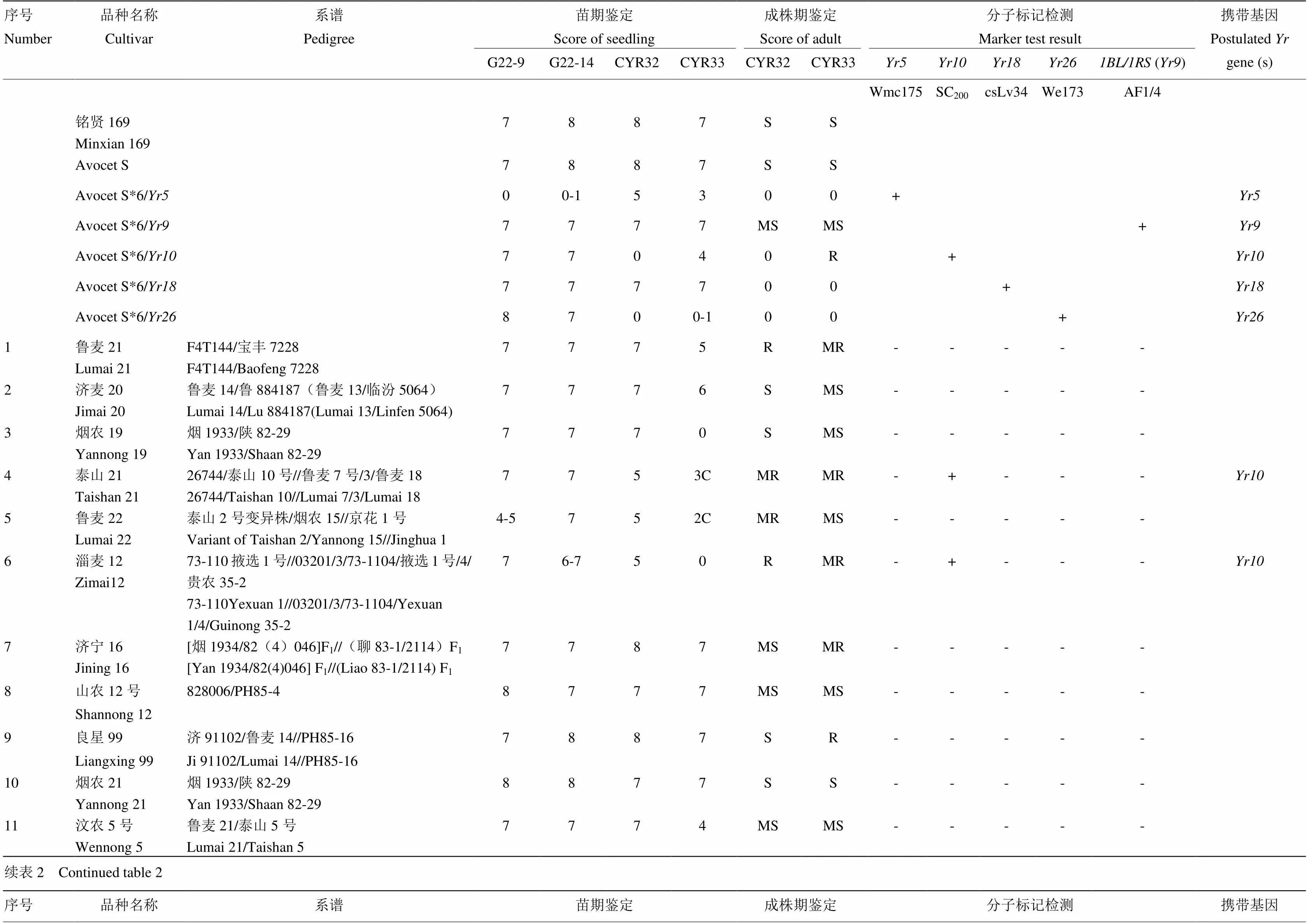
表2 79份小麦品种(系)对中国条锈菌主要流行小种的抗病性及抗性基因分子检测
“+”:存在Present;“-”:不存在Absent
M:DL2000;1:ddH2O;2:Avocet S;3:Avocet S*6/Yr10;4:泰山21 Taishan 21;5:淄麦12 Zimai 12;6:河农4198 Henong 4198;7:烟农19 Yannong 19;8:良星 99 Liangxing 99;9:山农17 Shannong 17;10:烟农836 Yannong 836;11:烟9102 Yan 9102;12:临抗16 Linkang 16;13:临优145 Linyou 145;14:西农889 Xinong 889;15:豫麦49 Yumai 49;16:豫麦54 Yumai 54;17:小偃216 Xiaoyan 216
M:DL2000;1:ddH2O;2:Avocet S;3:Avocet S*6/Yr18;4:河农4198 Henong 4198;5:西农223 Xinong 223;6:临优145 Linyou145;7:临旱 822 Linhan 822;8:泰农18 Tainong 18;9:澳大利亚红麦Red wheat from Australia;10:石54 Shi 54;11:山农1186 Shannong 1186;12:晋麦33 Jinmai 33;13:加拿大超强筋脉Extra-strong gluten wheat from Canada;14:鲁麦22 Lumai 22;15:济麦22 Jimai 22; 16:烟99102 Yan 99102;17:烟农836 Yannong 836
3 讨论
近年来分子标记辅助育种在小麦条锈病抗性遗传改良领域取得了广泛进展,对于实现多个抗性基因的聚合具有显著作用。研究表明即使所用分子标记与目标基因的遗传距离为10 cM,其检测准确率依然能够达到90%以上[23],本研究利用特异性分子标记,辅以分生理小种抗条锈病鉴定和系谱分析确定供试小麦抗条锈病基因的方法可以大大提高结果的可靠性与准确性。供试材料良星99和石麦15号分子检测结果与张玉薇等[24]的研究结果一致,虽然石麦15号苗期对CYR32、CYR33具有抗性而对G22-9和G22-14不具抗病性,有可能携带或,但分子检测并没有发现这两个基因的分子标记,且成株期该品种对CYR32和CYR33两个条锈菌小种均没有抗性,所以其抗性可能是由其他基因控制,不携带和两个基因,虽然在系谱分析时发现石麦15号具有“92R系”的血统,但是根据分子检测和抗性鉴定的结果,推测该品种的抗性基因可能在育种过程中丢失。
M:DL2000;1:ddH2O;2:Avocet S;3:Avocet S*6/Yr26;4:鲁麦21 Lumai 21;5:济麦20 Jimai 20;6:烟农19 Yannong 19;7:鲁麦22 Lumai 22;8:济宁16 Jining 16;9:烟农21 Yannong 21;10:烟农836 Yannong 836;11:烟农0428 Yannong 0428;12:远丰139 Yuanfeng 139;13:烟99102 Yan 99102;14:豫麦49 Yumai 49;15:豫麦54 Yumai 54;16:淮麦16 Huaimai 16;17:临旱822 Linhan 822
3.1/易位系分子检测
易位系是由位于黑麦染色体上的特异性片段通过染色体代换或易位转移到普通小麦染色体上形成的,于1965年和1970年分两次引入中国,兼具抗条锈基因、抗白粉基因、抗叶锈基因以及抗秆锈基因,且具有很好的丰产性,所以在当时深受育种工作者的喜爱并将其大范围应用于小麦育种中[25]。大量的使用导致中国多数小麦品种带有该易位系,张玉薇等的研究结果均证实中国的小麦种质中/易位系携带量在33%以上[24,26-27],本研究参试品种中/易位系占44.3%。其中,烟农22具有洛夫林13的遗传背景,其/易位系可能来自于洛夫林13;漯珍1号和周黑麦1号都具有山前麦的遗传背景,其/易位系可能来自于山前麦;石麦15号和石家庄8号都具有阿夫乐尔和洛夫林10的遗传背景,其/易位系可能来自于阿芙乐尔或洛夫林10;石麦18号、科农199、石4185都具有洛夫林10的遗传背景,它们的/易位系可能来自洛夫林10;洛旱21号、洛旱24号都具有矮孟牛的遗传背景,它们的/易位系可能来自矮孟牛。然而,由于/易位系上的基因控制的黑麦碱表达以及蛋白质质量降低等原因导致面筋强度减弱、面团发黏、耐揉性差等使小麦加工品质变劣的特点[28-30],已不符合当前对高品质面粉需求,因此应进一步减少/易位系在中国小麦育种中的应用,对已育成的小麦品种可通过对/易位系上劣质基因的改良达到优化品种的目的。
3.2 携带、、、的材料
至2016年,全球共正式定名了76个条锈病抗病基因(—)[31],然而多数抗病基因都具有小种专化性,目前对中国流行小种CYR32和CYR33均具有抗病性的抗条锈基因仅有、、、以及等少数基因[32]。G22毒性类群的出现使和丧失抗性,导致中国小麦生产再次受到条锈病的威胁,及时调整育种思路和策略,寻找开发新抗源,尽量延长已有品种的使用年限,是应对挑战的合理途径。
本研究对全国79份小麦品种(系)进行分子检测,发现其中临优145、新麦26、济南17虽然能够检测到的分子标记,但是它们对G22-14均没有抗性,且系谱分析也不具有遗传背景,所以认为它们不携带,原因可能是由于在非分离群体中利用分子标记进行筛选时,在不具有抗性基因的材料中检测到标记基因的概率会更大[33];而临优145和新麦26均对CYR32和CYR33表现全生育期抗性,分子检测发现它们带有分子标记,系谱分析发现这两个品种均有陕优225的遗传背景,所以推测该抗性基因来源于陕优225[34];济南17也表现出对CYR32、CYR33、G22-9的抗性,其抗性基因可能来自于遗传背景较复杂的鲁麦13。西农889和远丰139两个品种均抗所有小种且分子检测带有基因标记,系谱分析发现它们均为小偃6号的后代,但小偃6号苗期不抗CYR32,所以它们的抗性基因可能来自于其他亲本。西农223也对所有小种具有抗性,其苗期抗性主要由决定,成株期抗性主要由和共同决定,该结果与李敏州等[27]的研究一致。泰山21、河农4198对CYR32和CYR33表现全生育期抗性而对G22-9和G22-14不具抗性,且分子检测表明它们均带有标记,系谱分析泰山21具有鲁麦18的遗传背景,所以其抗性基因可能来自于鲁麦18;河农4198具有河农326的遗传背景,所以其抗性基因可能来自于河农326。澳大利亚红麦、加拿大超强筋麦均为国外引进品种,并具有成株抗条锈病基因,是优良的育种材料。
4 结论
中国小麦主栽品种对当前条锈菌流行小种抗性水平普遍较低,/易位系出现频率达44.3%;有效基因和使用率分别为5.1%和3.8%,出现频率为10.1%,仅远丰139检测到。尽管如此,G22-9和G22-14对和具有联合毒性,在今后的小麦育种工作中应注意减少对和的依赖,聚合多种抗条锈病基因,倡导利用成株抗条锈病基因。对已育成的品种,如本文提到的远丰139、临抗16号、淄麦12、河农4198、泰山21等应加以改良,培育出兼抗多种病害的品种,保障小麦的生产安全。
References
[1] 陈万权, 康振生, 马占鸿, 徐世昌, 金社林, 姜玉英. 中国小麦条锈病综合治理理论与实践. 中国农业科学, 2013, 46(20): 4254-4262.
CHEN W Q, KANG Z S, MA Z H, XU S C, JIN S L, JIANG Y Y. Integrated management of wheat stripe rust caused byf. sp.in China., 2013, 46(20): 4254-4262. (in Chinese)
[2] 吴立人, 牛永春. 我国小麦条锈病持续控制的策略. 中国农业科学, 2000, 33(5): 46-54.
WU L R, NIU Y C. Strategies of sustainable control of wheat stripe rust in china., 2000, 33(5): 46-54. (in Chinese)
[3] 李强, 李高宝, 岳维云, 杜久元, 杨立军, 康振生, 井金学, 王保通. 2002-2014年陕西省小麦条锈菌生理小种变化动态和小麦品种(系)的抗病性. 植物病理学报, 2016, 46(3): 374-383.
LI Q, LI G B, YUE W Y, DU J Y, YANG L J, KANG Z S, JING J X, WANG B T. Pathogenicity changes of wheat stripe rust fungus and disease resistance of wheat cultivars (lines) in Shaanxi province during 2002-2014., 2016, 46(3): 374-383. (in Chinese)
[4] 刘太国, 王保通, 贾秋珍, 章振羽, 李强, 曹世勤, 彭云良, 金社林, 李明菊, 刘博, 高利, 胡小平, 陈万权. 2010-2011年度我国小麦条锈菌生理专化研究. 麦类作物学报, 2012, 32(3): 574-578.
LIU T G, WANG B T, JIA Q Z, ZHANG Z Y, LI Q, CAO S Q, PENG Y L, JIN S L, LI M J, LIU B, GAO L, HU X P, CHEN W Q. Physiologic specialization off. sp.in China during 2010-2011., 2012, 32(3): 574-578. (in Chinese)
[5] 左希, 蒋选利, 李星星, 李红玫, 丁海霞, 孙涛. 2009年贵州小麦条锈菌生理小种的鉴定. 贵州农业科学, 2011(3): 91-93.
ZUO X, JIANG X L, LI X X, LI H M, DING H X, SUN T. Identification of wheatphysiological races in Guizhou in 2009., 2011(3): 91-93. (in Chinese)
[6] 贾秋珍, 金社林, 曹世勤, 骆惠生, 金明安, 张勃, 黄瑾. 2004- 2009年甘肃省小麦条锈菌生理专化研究. 中国农学通报, 2011, 27(9): 85-90.
JIA Q Z, JIN S L, CAO S Q, LUO H S, JIN M A, ZHANG B, HUANG J. Physiologic specialization of wheat stripe rust in Gansu Province during 2004-2009., 2011, 27(9): 85-90. (in Chinese)
[7] CHEN W Q, WU L R, LIU T G, XU S C, JIN S L, PENG Y L, WANG B T. Race dynamics, diversity, and virulence evolution inf. sp., the causal agent of wheat stripe rust in China from 2003 to 2007., 2009, 93(11): 1093-1101.
[8] 贾秋珍, 金社林, 曹世勤, 骆惠生, 金明安. 小麦条锈菌生理小种条中32号及水源14致病类型在甘肃的流行与发展趋势. 植物保护学报, 2007, 34(3): 263-267.
JIA Q Z, JIN S L, CAO S Q, LUO H S, JIN M A. Tending to prevalence and progress of CY32 and Shuiyuan14 pathotypes in Gansu Province., 2007, 34(3): 263-267. (in Chinese)
[9] LIU T G, PENG Y L, CHEN W Q, ZHANG Z Y. First detection of virulence inf. sp.in China to resistance genes(=) present in wheat cultivar Chuanmai 42., 2010, 94(9): 1163.
[10] 刘太国, 章振羽, 刘博, 高利, 彭云良, 陈万权. 小麦抗条锈病基因毒性小种的发现及其对我国小麦主栽品种苗期致病性分析. 植物病理学报, 2015, 45(1): 41-47.
LIU T G, ZHANG Z Y, LIU B, GAO L, PENG Y L, CHEN W Q. Detection of virulence toand pathogenicity to Chinese commercial winter wheat cultivars at seedling stage., 2015, 45(1): 41-47. (in Chinese)
[11] 张勃, 贾秋珍, 黄瑾, 曹世勤, 孙振宇, 骆惠生, 王晓明, 金社林. 小麦条锈菌新菌系贵22-9和贵22-14发展趋势与毒性分析. 西北农业学报, 2015, 24(7): 125-130.
ZHANG B, JIA Q Z, HUANG J, CAO S Q, SUN Z Y, LUO H S, WANG X M, JIN S L. Trends and toxicity analysis of new strains G22-9 and G22-14 inf. sp.., 2015, 24(7): 125-130. (in Chinese)
[12] 章振羽, 姬红丽, 沈丽, 徐世昌, 倪建英, 彭云良. 四川58个小麦品种苗期抗条锈基因推导及成株期抗性表现. 植物保护学报, 2012, 39(1): 13-23.
ZHANG Z Y, JI H L, SHEN L, XU S C, NI J Y, PENG Y L. Postulation of resistance genes and evaluation of adult resistance to stripe rust in 58 cultivars from Sichuan., 2012, 39(1): 13-23. (in Chinese)
[13] 万江华, 任明见, 陈涛, 徐如宏. 108份小麦种质抗条锈病基因的分子检测. 贵州农业科学, 2011, 39(5): 22-26.
WAN J H, REN M J, CHEN T, XU R H. Molecular detection of stripe rust resistant genes in 108 wheat germplasms., 2011, 39(5): 22-26. (in Chinese)
[14] 刘丽娟, 王竹林, 奚亚军, 刘曙东. 黄淮麦区小麦品种(系)中基因的SSR检测. 西北植物学报, 2008, 28(7): 1308-1312.
LIU L J, WANG Z L, XI Y J, LIU S D. Detection of stripe rust resistant genewith SSR markers in wheat cultivars of Huanghuai Region., 2008, 28(7): 1308-1312. (in Chinese)
[15] 白玉路, 章振羽, 徐世昌, 林凤. 小麦锈病抗性基因推导研究进展. 植物保护, 2010, 36(4): 36-40, 48.
BAI Y L, ZHANG Z Y, XU S C, LIN F. Advances in gene postulation in the wheat rust., 2010, 36(4): 36-40, 48. (in Chinese)
[16] Line R F, Qayoum A.. USDA Technical Bulletin No. 1788. National Technical Information Service, 1992.
[17] 陈万权, 刘太国, 陈巨莲, 徐世昌. 小麦抗病虫性评价技术规范. 第1部分: 小麦抗条锈病评价技术规范: NT/T1443.1-2007[S]. 2007-09-14[2017-03-03].
CHEN W Q, LIU T G, CHEN J L, XU S C. Rules for resistance evaluation of wheat to diseases and insect pests. Part 1: Rule for resistance evaluation of wheat to yellow rust (West. f. sp.Eriks. et Henn.) : NT/T1443.1-2007[S]. 2007-09- 14[2017-03-03]. (in Chinese)
[18] MURPHY L R, SANTRA D, KIDWELL K Y G, CHEN X, CAMPBELL K G. Linkage maps of wheat stripe rust resistance genesandfor use in marker-assisted selection., 2009, 49(5): 1786-1790.
[19] FRANCIS H A, LEITCH A R, KOEBNER R M D. Conversion of a RAPD-generated PCR product, containing a novel dispersed repetitive element, into a fast and robust assay for the presence of rye chromatin in wheat., 1995, 90(5): 636-642.
[20] SHAO Y T, NIU Y C, ZHU L H, ZHAI W X, XU S C, WU L R. Identification of an AFLP marker linked to the stripe rust resistance gene Yr10 in wheat., 2001, 46(17): 1466-1469.
[21] LAGUDAH E S, MCFADDEN H, SINGG R P, HUERTA-ESPINO J, BARIANA H S, SPIELMEYER W. Molecular genetic characterization of the/slow rusting resistance gene region in wheat., 2006, 114(1): 21-30.
[22] WANG C, ZHANG Y P, HAN D J, KANG Z S, LI G P, CAO A Z, CHEN P D. SSR and STS markers for wheat stripe rust resistance gene., 2008, 159(3): 359-366.
[23] LANDRY B S, KESSEL R V, FARRARA B, MICHELMORE R W. A genetic map of lettuce (L.) with restriction fragment length polymorphism, isozyme, disease resistance and morphological markers., 1987, 116(2): 331-337.
[24] 张玉薇, 刘博, 刘太国, 高利, 陈万权. 小麦品种抗条锈病基因、及/易位的分子检测. 植物保护, 2014, 40(1): 54-59, 94.
ZHANG Y W, LIU B, LIU T G, GAO L, CHEN W Q. Molecular detection ofandgenes and/translocation in wheat cultivars., 2014, 40(1): 54-59, 94. (in Chinese)
[25] 李振岐, 曾士迈. 中国小麦锈病. 北京: 中国农业出版社, 2002: 302.
LI Z Q, ZENG S M.. Beijing: China Agriculture Press, 2002: 302. (in Chinese)
[26] 李峰奇, 韩德俊, 魏国荣, 曾庆东, 黄丽丽, 康振生. 黄淮麦区126个小麦品种(系)抗条锈病基因的分子检测. 中国农业科学, 2008, 41(10): 3060-3069.
LI F Q, HAN D J, WEI G R, ZENG Q D, HUANG L L, KANG Z S. Molecular detection of stripe rust resistant genes in 126 winter wheat varieties from the Huanghuai Wheat Region., 2008, 41(10): 3060-3069. (in Chinese)
[27] 李敏州, 李强, 巢凯翔, 申雪雪, 樊玉, 王阳, 王保通. 陕西省115个小麦品种(系)抗条锈病基因的分子检测. 植物病理学报, 2015, 45(6): 632-640.
LI M Z, LI Q, CAO K X, SHEN X X, FAN Y, WANG Y, WANG B T. Molecular detection of stripe rust resistance genes in 115 wheat varieties (lines) from Shaanxi Province., 2015, 45(6): 632-640. (in Chinese)
[28] 柴建芳, 王海波, 马秀英, 张翠绵, 董福双.-黑麦碱基因沉默对小麦/易位系加工品质的影响. 作物学报, 2016, 42(5): 627-632.
CHAI J F, WANG H B, MA X Y, ZHANG C M, DONG F S. Effect of-secalin gene silencing on processing quality of wheat/translocation line., 2016, 42(5): 627-632. (in Chinese)
[29] 赵德辉, 阎俊, 黄玉莲, 夏先春, 张艳, 田宇兵, 何中虎, 张勇./易位对小麦贮藏蛋白组分含量和面团流变学特性的影响. 作物学报, 2015, 41(11): 1648-1656.
ZHAO D H, YAN J, HUANG Y L, XIA X C, ZHANG Y, TIAN Y B, HE Z H, ZHANG Y. Effect of/translocation on gluten protein fraction quantities and dough rheological properties., 2015, 41(11): 1648-1656. (in Chinese)
[30] 刘建军, 何中虎, Pena R J, 赵振东./易位对小麦加工品质的影响. 作物学报, 2004, 30(2): 149-153.
LIU J J, HE Z H, PENA R J, ZHAO Z D. Effect of/translocation on grain quality and noodle quality in bread wheat., 2004, 30(2): 149-153. (in Chinese)
[31] MCINTOSH R A, DUBCOVSKY J, ROGERS W J, MORRIS C, APPELS R, XIA X C. Catalogue of gene symbols for wheat: 2015-2016 supplement. https://shigennigacjp/wheat/komugi/genes/ macgene/supplement2015pdf, 2016.
[32] 杨作民, 解超杰, 孙其信. 后条中32时期我国小麦条锈抗源之现状. 作物学报, 2003, 29(2): 161-168.
YANG Z M, XIE C J, SUN Q X. Situation of the sources of stripe rust resistance of wheat in the post-CY32 era in China., 2003, 29(2): 161-168. (in Chinese)
[33] 伍玲, 谭君, 朱华忠, 王中烈, 蒲晓蓉. 四川近年小麦区试品系中、和的分子标记检测. 西南农业学报, 2007, 20(2): 316-320.
WU L, TAN J, ZHU H Z, WANG Z L, PU X R. Detection of stripe rust resistant genes of,, and, 2007, 20(2): 316-320. (in Chinese)
[34] 李世平, 杨玉景, 董双全, 程麦凤. 山西省优质小麦品种系谱分析及品质遗传改良. 麦类作物学报, 2003, 23(4): 136-138.
LI S P, YANG Y J, DONG S Q, CHENG M F. Pedigree of high quality wheat varieties and genetic improvement in Shanxi Province., 2003, 23(4): 136-138. (in Chinese)
(责任编辑 岳梅)
Evaluation of stripe rust resistance and molecular detection ofgenes of 79 wheat varieties (lines) in China
Huang Liang1, 2, Liu Taiguo1, Xiao Xingzhi3, Qu Chunyan4, Liu Bo1, Gao Li1, Luo Peigao1,2, Chen Wanquan1
(1State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193;2College of Agronomy, Sichuan Agricultural University, Chengdu 611130;3College of Plant Protection, Southwest University, Chongqing 400715;4State Key Laboratory of Crop Biology, Shandong Agricultural University, Taian 271018, Shandong)
【Objective】The objectives of this study are to understand the resistance toof wheat cultivars and the distribution and application ofgenes in the main wheat growing regions, to give some suggestions for the farmers and governors when they choose cultivars, and to prolong the planting years of cultivars based on the harboredgenes. 【Method】 There were four races, designating CYR32, CYR33, G22-9 and G22-14 used to identify stripe rust resistance of 79 wheat cultivars or lines from main wheat producing areas in China at seedling stage in greenhouse. The seedlings were put into barrels for keeping humidity in dark for 12-18 h at (10±1)℃ after inoculation, then they were put into greenhouse at 16 to 18℃ in the day time and 14 to 16℃ in the nighttime with 16 hours’ light and 8 hour’s darkness. The investigation was carried out 15 days after inoculation as 0-9 scales. And CYR32 and CYR33 were used for further resistance evaluation at the adult stage at Langfang Station of Hebei Province. In order to keep soil humidity, enough water should be irrigated before the inoculation of adult plants was carried out at jointing stage. The urediniospore suspensions were adjusted to 1 g urediniospores﹕300 mL mineral oil and sprayed the susceptible control cv. Mingxian 169. After the mineral oil evaporated thoroughly, the plants were sprayed water by hand-hold sprayer and covered with plastic film for 12-16 h for keeping moisture. The incidence, severity and infection type were recorded at least twice to keep the severer records as the final data. Then the authors screened these wheat cultivars with the closely linked molecular markers of wheat stripe rust resistance genes(Wmc175F/R),(SC200F/R),(csLv34 F/R),(We173) and(AF1/AF4) translocation lines. With all data were integrated, such as pedigree of cultivars (lines), resistance to the 4 races, and molecular detection, the yellow rust resistance genes were postulated. 【Result】Among all tested cultivars or lines at seedling stage, 16 (20.3%) were resistant to CYR32 and CYR33, 4 (5.1%) were resistant to G22-9 and G22-14, only 4 (5.1%) cultivars showed resistance to 4 races off. sp.(). However, there were 24 (30.4%) showed resistance to CYR32 and CYR33 at adult stage. As for wheat cultivars at all growth stages, 12 (15.2%) were resistant to CYR32, 16 (20.3%) were resistant to CYR33 and only 11 (14.0%) were resistant to both CYR32 and CYR33. Only 4 (5.1%) cultivars showed resistance to CYR32, CYR33, G22-9 and G22-14 at seedling stage and CYR32 and CYR33 at adult stage, respectively. After all the information integrated, such as pedigree of cultivars (lines), resistance to the 4 races, and molecular detection, it showed that 4 (5.1%) tested cultivars contained, 8 (10.1%) contained, 3 (3.8%) contained, 1 (1.3%) contained, 35 (44.3%) contained, and 4 cultivars contained 2genes, and Yuanfeng 139 contained,and.【Conclusion】The 79 cultivars (lines) have low resistance to the prevalent 4 races and the usage of/translocation line was still high. In the future breeding, the utilization of effective resistance genes such asandshould be increased. Pyramiding multi-gene varieties with effective durable resistance should be strengthened and the use of/translocation line should be decreased.
wheat; wheat stripe rust; resistance evaluation; resistance gene; molecular detection
2017-03-03;接受日期:2017-05-19
国家自然科学基金(31371884,31611130039)、国家重点研发计划(2016YFD0300705)、国家转基因重大专项课题(2014ZX0801101B)、现代农业产业技术体系(CARS-3)
黄亮,E-mail:553204236@qq.com。通信作者刘太国,E-mail:tgliu@ippcaas.cn

