玉米大斑病菌环腺苷酸磷酸二酯酶基因克隆及表达分析
申珅, 李贞杨, 赵玉兰, 李盼, 韩建民, 郝志敏, 董金皋
玉米大斑病菌环腺苷酸磷酸二酯酶基因克隆及表达分析
申珅, 李贞杨, 赵玉兰, 李盼, 韩建民, 郝志敏, 董金皋
(河北农业大学生命科学学院/河北省植物生理与分子病理学重点实验室,河北保定071001)
【目的】获得玉米大斑病菌()环腺苷酸磷酸二酯酶(cAMP phosphodiesterase, PDE)基因,并分析其在病菌侵染结构发育过程及侵染寄主早期阶段中的表达,为深入探索cAMP信号途径调控病菌致病性的作用机制打下基础。【方法】根据酿酒酵母()、白色念珠菌()、灰霉病菌()、稻瘟病菌()、绿僵菌()和黑曲霉()6种真菌PDE基因的保守序列,利用简并引物PCR对基因保守片段进行扩增,结合RACE和Genome Walking技术获得基因全长及其侧翼序列;利用MEGA 5.0软件对PDE蛋白预测编码产物进行多重序列比对,并采用邻近法构建系统发育树;利用GSDS分析基因结构,ProtParam分析理化性质,SOMPA预测二级结构,SMART数据库在线分析保守结构域;收集人造疏水介质诱导下侵染结构发育不同时期以及侵染感病寄主叶片不同时间的玉米大斑病菌材料,利用qRT-PCR技术研究在病菌侵染结构形成过程中不同阶段的转录水平。【结果】玉米大斑病菌基因组中存在1个高亲和力磷酸二酯酶基因()和1个低亲和力磷酸二酯酶基因()。其中,全长3 208 bp,包含5个内含子和6个外显子,ORF为2 898 bp。全长5 054 bp,包含4个内含子和5个外显子,ORF为3 090 bp。和分别含有保守的Ⅰ型和Ⅱ型cAMP磷酸二酯酶催化结构域。不同的植物病原真菌中PDE同源基因分别呈现出高度的相似性,其中,与、、等病原真菌的高亲和力磷酸二酯酶基因聚于同一进化支,与、、、等病原真菌的低亲和力磷酸二酯酶基因聚于相同进化支。人造疏水介质诱导下,与菌丝相比,和在分生孢子中的表达水平均显著上调,其中和分别上调了约2倍和52倍。孢子萌发初期两个基因表达水平显著下调,随着萌发的进行,表达水平缓慢回升,至附着胞形成阶段,基因表达出现了第2次高峰,随后表达水平再次下调。在整个过程中,的最高表达水平则出现在附着胞形成时期,达到了菌丝体中的近7倍、分生孢子中的近2倍,而的表达水平始终低于其在分生孢子中的表达水平。和在病菌侵染寄主过程中的表达水平变化趋势与其在人工疏水介质诱导下的表现基本一致。在孢子萌发早期表达显著下调,随着时间延长,缓慢回升,至接种后18和24 h表达水平上调,超过萌发初期。【结论】在病菌侵染结构发育过程中,和均呈现下调-上调-下调的表达水平变化趋势。在附着胞时期表达水平最高,在分生孢子中的相对表达水平最高。
玉米大斑病菌; 环腺苷酸磷酸二酯酶; qRT-PCR; 基因表达
0 引言
【研究意义】环核苷酸磷酸二酯酶(cAMP phosphodiesterase,PDE)作为cAMP信号转导途径中的重要元件,能够特异地催化cAMP/cGMP 3′, 5′环磷酸的3′环磷酸键水解,进而与腺苷酸环化酶协同调节胞内cAMP的浓度。PDE通过调控基础cAMP水平,对真菌的营养感知、假菌丝的分化、细胞周期进程以及胁迫信号起主要调控作用[1],故而对致病真菌的生长、发育和成功侵染至关重要。【前人研究进展】在真菌中普遍存在两种磷酸二酯酶,分别为高亲和力磷酸二酯酶和低亲和力磷酸二酯酶。酿酒酵母()中二者共同调控胞内cAMP水平[2],调控基础cAMP水平,该基因的缺失能够导致酿酒酵母细胞壁和细胞膜的完整性缺陷;则负责调控葡萄糖存在下的cAMP水平,且受PKA催化亚基正调控[3]。在稻瘟病菌()中,和通过共同调控病菌的侵染过程和有性发育而影响其致病性[4-5],不仅对胞内cAMP水平及病菌致病性有重要作用,而且对维持细胞壁完整性至关重要,MoPdeH与MAPK途径中的MoMck1直接互作进而对CWI进行调控[6]。在白色念珠菌()中,参与调控次生代谢、转录、胁迫应答、细胞壁和细胞膜形态建成以及侵染和毒力[7-9]。在灰霉病菌()中,对病菌的生长、分化以及毒力具有重要调控作用,而在这些过程中发挥作用较小[10]。在黄曲霉()中,主要调控病菌的营养生长和黄曲霉毒素生物合成,与其功能有重叠但作用较弱[11]。【本研究切入点】笔者课题组前期通过药物学试验初步阐明cAMP信号途径与玉米大斑病菌的侵染过程有关,并对该途径中的保守元件编码基因[12]、[13-14]开展了功能研究,进一步证实cAMP信号途径调控玉米大斑病菌的营养生长及分生孢子发育。但是,作为负性调节因子的PDE在该病菌中的功能尚待明晰。【拟解决的关键问题】克隆玉米大斑病菌的PDE编码基因,利用生物信息学的方法分析其基因结构、编码产物的二级结构及理化性质,系统分析基因在病菌不同发育时期及在侵染寄主早期阶段的转录水平,为深入研究PDE基因的功能及其调控病菌发育的机制打下基础,同时为进一步阐明cAMP途径功能提供证据。
1 材料与方法
试验于2016年在河北农业大学生命科学学院完成。
1.1 供试菌株及寄主
玉米大斑病菌野生型菌株01-23、感病寄主玉米OH43自交系均由河北农业大学真菌毒素与植物分子病理学实验室保存。
1.2 供试主要培养基及试剂
PDA培养基用于玉米大斑病菌的培养。
总RNA提取试剂盒、RNA反转录试剂盒购于生工生物工程(上海)股份有限公司;SMARTTMRACE cDNA Amplification Kit(CLONTECH,Catalog#: K1811-1)、3′-Full RACE Core Set(TaKaRa,Code No. D6121)、Prime Script®RT reagent Kit和SYBR Premix ExTMII(perfect real-time)均购自TaKaRa(中国大连)公司;DNA胶回收试剂盒购自全式金生物技术有限公司;引物均由生工生物工程(上海)股份有限公司合成。
1.3 DNA和RNA的提取
收集在PDA培养基上25℃黑暗培养10 d的玉米大斑病菌菌丝体,参照Zhang等[15]的方法提取DNA及RNA,用于基因的克隆、RACE及Genome Walking。
参考Hao等[14]的方法将浓度为10个/μL的病菌孢悬液以20 μL/滴的液滴接种于无菌复印膜上,25℃黑暗保湿孵育,分别于接种后0(分生孢子)、3 h(芽管形成率>80%)、12 h(附着胞形成率>80%)、24 h(侵染菌丝形成率>80%)收集菌丝体;按照同样的接种方法将病菌孢悬液接种于感病寄主叶片表面,分别于接种后1、3、6、9、12、18、24 h从叶片上收集菌丝体,置于无菌Eppendorf管中,-80℃保存备用。用Trizol试剂盒分别提取人造疏水介质诱导下不同发育时期菌丝体及接种感病寄主叶片不同时间后菌丝体的总RNA,反转录合成第一链cDNA,用于实时定量PCR(quantitative real-time PCR)分析基因的表达情况。所有试验均设3次重复。
1.4 玉米大斑病菌PDE基因的克隆
根据酿酒酵母、白色念珠菌、灰霉病菌、稻瘟病菌、绿僵菌()和黑曲霉(r)6种真菌PDE基因的保守序列,设计2对简并引物H-PDE-F/R和L-PDE-F/R(表1),以基因组DNA为模板,扩增同源片段。25 μL PCR反应体系:DNA(20 ng·μL-1)1 μL,引物F、R(10 μmol·L-1)各2 μL,dNTP Mixture(2.5 mmol·L-1)2 μL,10×PCR buffer 2.5 μL,TaKaRaDNA聚合酶(5 U·μL-1)0.3 μL,ddH2O 15.2 μL。PCR反应条件:95℃预变性5 min;94℃30 s,55℃30 s,72℃5 min,共35个循环;72℃10 min。
根据基因同源片段设计特异引物(表1),按照SMARTTMRACE cDNA Amplification Kit试剂盒说明书扩增基因cDNA末端片段。参考郝志敏等[16]的方法,利用Genome Walking技术对同源片段进行延伸。所得序列用DNAMAN5.0进行拼接。根据所得的基因全长序列设计引物H-PDE-DNA-F/R和L-PDE-DNA-F/R(表1)克隆PDE的全长基因。
上述所有扩增产物均经过1%琼脂糖凝胶电泳后回收目的条带,连接pMD-19载体并测序。
1.5 PDE基因及编码产物的生物信息学分析
利用MEGA 5.0软件对PDE蛋白预测编码产物进行多重序列比对,并采用邻近法构建系统发育树,Bootstrap值设置为1 000。利用GSDS(http://gsds.cbi. pku.edu.cn/chinese.php?input=seq)[17]分析基因结构。利用ProtParam(http://web.expasy.org/protparam/)分析理化性质,利用SOMPA(https://npsa-prabi.ibcp.fr/ cgi-bin/ npsa_automat.pl?Page=/NPSA/npsa_sopma.html)预测二级结构。利用SMART数据库在线分析保守结构域。
1.6 PDE基因表达水平的real-time PCR分析
利用NCBI(http://www.ncbi.nlm.nih.gov/tools/primer-blast/)设计特异性引物用于qRT-PCR(表1),以18s rDNA为参照基因。采用ABI Step One-Real-Time PCR System,以各时期cDNA为模板,SYBR Premix Ex TaqTMII2770(perfect real-time)试剂盒进行qRT-PCR扩增。20 μL qPCR反应体系:SYBR Premix Ex Taq 10 μL、引物F、R(10 μmol·L-1)各0.4 μL、cDNA(300 ng·μL-1)模板2 μL、ROX 0.4 μL,加水至20 μL。PCR程序:95℃ 5 min;95℃ 10 s,60℃ 30 s(此处收集荧光),共40个循环;然后从60℃上升至95℃,每秒上升0.3℃,并收集一次荧光。每个样品均设3次重复。根据基因相对表达量分析方法2-ΔΔCt,对不同发育时期及侵染寄主过程中的表达量进行统计,试验数据通过SPSS软件进行差异显著性分析。

表1 试验所用引物
2 结果
2.1 玉米大斑病菌全长PDE基因的克隆与序列分析
分别利用2对简并引物进行扩增,得到0.75 kb(图1-A)和0.7 kb(图2-A)产物,经BlastX分析表明,2个扩增产物与酿酒酵母、白色念珠菌、灰霉病菌、稻瘟病菌、绿僵菌和黑曲霉的PDE基因相似性均达到80%以上,初步认定2个片段为PDE编码基因,将其命名为、。
对进行RACE扩增,3′ RACE获得2.5 kb的扩增产物(图1-B),该产物与所得基因片段间有125 bp的完全重叠区,且含有终止密码子TGA;5′ RACE未获得扩增产物。继而,利用引物H-PDE-GW-GSP1和H-PDE-GW-GSP2(表1)进行两次5′ Genome Walking延伸,分别得到约0.8和1.0 kb的条带(图1-C、1-D),最终拼接序列经BlastX分析表明,起始密码子ATG位于序列的171 bp处。对进行5′及3′ Genome Walking延伸,分别得到约1和2.5 kb的扩增产物(图2-B、2-C),拼接结果表明,序列中含有起始密码子ATG和终止密码子TGA。
根据基因的预测ORF设计特异引物,分别对ORF的DNA及cDNA全长进行扩增,获得3.2和5.0 kb的扩增产物(图3)。测序结果表明,扩增产物均为完整的ORF。ORF全长3 208 bp,包含5个内含子和6个外显子,编码区为2 898 bp,内含子长度分别为78、46、59、76、51 bp。ORF全长5 054 bp,共包含4个内含子和5个外显子(图4),编码区为3 090 bp,4个内含子大小分别为63、182、50、1 669 bp。

M:DL 2000 DNA Marker;1、2:StH-PDE同源片段扩增产物The amplification products of StH-PDE homologous fragment;3:3′ RACE扩增产物Products of 3′ RACE of StH-PDE;4—7:5′ Genome walking扩增产物的电泳检测Products of 5′ Genome walking of StH-PDE

M:DL 2000 DNA Marker;1、2:StL-PDE同源片段扩增产物The amplification products of StL-PDE homologous fragment;3、4:3′ Genome Walking 扩增产物Products of 3′ Genome Walking of StL-PDE;5:5′ Genome Walking扩增产物的电泳检测Products of 5′ Genome Walking of StL-PDE
2.2和的系统进化分析
将和与其他真菌物种中的PDE基因构建系统发育树,结果表明不同的植物病原真菌中PDE同源基因分别呈现出高度的相似性(图5),其中,与、、等病原真菌的高亲和力磷酸二酯酶基因聚于同一进化支。与、、、等病原真菌的低亲和力磷酸二酯酶基因聚于相同进化支。

M:DL 2000 DNA Marker;1、2:StH-PDE同源片段扩增产物The amplification products of StH-PDE homologous fragment;3:StL-PDE同源片段扩增产物The amplification products of StL-PDE homologous fragment

图4 玉米大斑病菌PDE基因结构特征
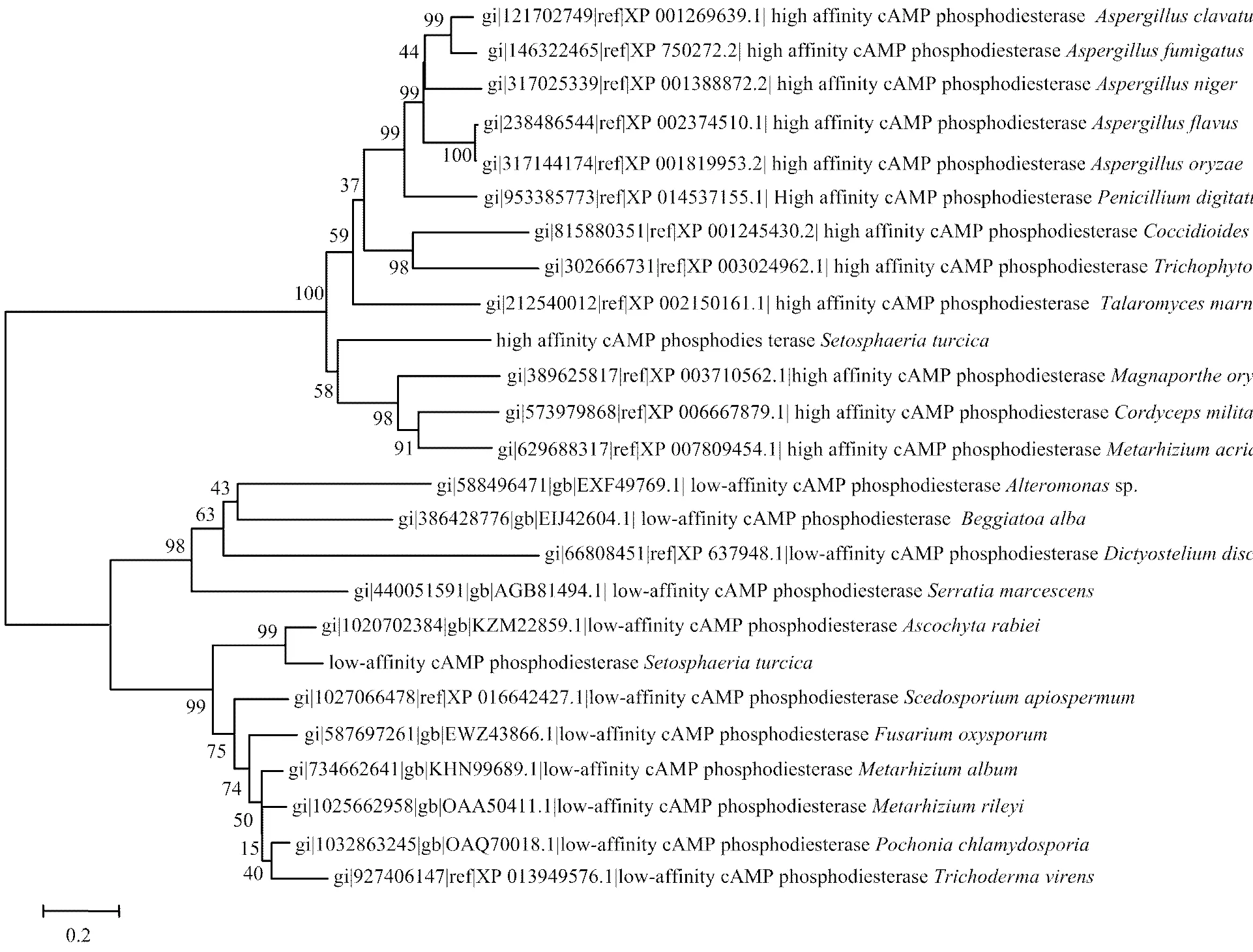
图5 磷酸二酯酶基因的系统发育分析
2.3和编码产物的生物信息学分析
编码965个氨基酸,分子量约为107.16 kD;编码1 029个氨基酸,分子量约为110.77 kD。其二级结构均以无规卷曲(random coil,Cc)为主,分别占65.38%和73.13%,其次为-螺旋(Alpha helix,Hh),分别占30.25%和18.03%。等电点(pI)分别为7.9和8.88,说明二者均为碱性蛋白质。StH-PDE氨基酸残基中极性氨基酸占60.21%,疏水性氨基酸占39.79%,带电荷氨基酸占26.74%;StL-PDE氨基酸残基中极性氨基酸占60.65%,疏水性氨基酸占39.35%,带电荷氨基酸占26.10%,其中包括10.11%的酸性氨基酸及11.38%的碱性氨基酸。
保守结构域分析表明,StH-PDE的418—429位氨基酸构成了典型的Class IPDE保守催化结构域H-D-[LIVMFY]-x-H-x-[AG]-x(2)-[NQ]-x-[LIVMFY](图6-A),StL-PDE的542—556位氨基酸构成了Class II PDE保守催化结构域H-x-H-L-D-H-[LIVM]-x- [GS]-[LIVMA]-[LIVM](2)-x-S-[AP](图6-B)。

下划线标识部分为催化结构域The catalytic domains were underlined
2.4和的表达分析
2.4.1 人造疏水介质诱导下病菌侵染结构发育过程中的相对表达量 与菌丝体相比,和在分生孢子中的表达水平均显著上调,其中和分别上调了约2倍和52倍。当孢子开始萌发时两基因表达水平均明显下调,随着萌发的进行,表达水平缓慢回升,至附着胞形成阶段,基因表达出现了第2次高峰,随后表达水平再次下调。但在整个过程中,的最高表达水平则出现在附着胞形成时期,达到了菌丝体中的近7倍、分生孢子中的近2倍,而的表达水平始终低于其在分生孢子中的表达水平(图7-A)。说明和共同调控病菌的分生孢子发育及附着胞形成。尤其在附着胞形成过程中,表现更加活跃。
2.4.2 在病菌侵染感病寄主叶片过程中的相对表达量 为了进一步验证和在病菌侵染过程中的表达情况,选取与感病寄主互作24 h内的病菌材料,分析表达水平。结果表明,和在此过程中的表达水平变化趋势与其在人工疏水介质诱导下的模拟侵染过程中的表现基本一致。在孢子萌发早期表达水平显著下调,随着时间延长,缓慢回升,至接种后18和24 h表达水平上调,超过萌发初期(图7-B)。

A:疏水介质诱导下玉米大斑病菌不同发育时期的表达量Expression at different developmental stages induced by hydrophobic medium;B:接种后不同时间的表达量Expression in different times after inoculation of maize leaves
3 讨论
真菌PDE被划分为高亲和力磷酸二酯酶和低亲和力磷酸二酯酶2类。在病原真菌中,磷酸二酯酶的功能已经初步明确,新生隐球菌()中主要由低亲和力的磷酸二酯酶调控胞内cAMP进而调节整个信号通路[18],而在白色念珠菌[9]、酿酒酵母[3]裂殖酵母()[19]稻瘟病菌[4-5]等真菌中,均主要由高亲和力的磷酸二酯酶调控胞内cAMP水平。研究表明,PDE家族催化域的氨基酸序列相似性较低,但是具有一些共同的结构特征[20-22]。这些保守结构域均可以作为识别环核苷酸磷酸二酯酶的特征序列[23-25]。本研究发现,StH-PDE具有Ⅰ型cAMP磷酸二酯酶催化结构域和依赖金属离子的磷酸水解酶保守“HD”基序,属高亲和力磷酸二酯酶;StL-PDE具有特有的Ⅱ型cAMP磷酸二酯酶催化结构域和翻译延长因子EF1B-gamma保守基序,属低亲和力磷酸二酯酶。此外,PDE在哺乳动物、果蝇细胞内同样分布广泛,依据其序列、底物特异性、抑制物敏感性和辅助因子等特征,PDE被划分为11 个家族,包括21个基因的编码产物,然而,由于可变的转录起始位点和mRNA前体的可变剪接,这些基因可以产生多于21种的mRNA及蛋白产物,目前已发现了100种以上的mRNA产物,其中绝大部分可以翻译成蛋白。但是丝状真菌中的PDE是否存在类似现象尚未见报道。本研究克隆的与2013年完成基因组测序的Et28A菌株[26-27]的相应基因(SETTUDRAFT_91803)DNA序列相同,但CDS序列不同。前者为3 090 bp,由5个外显子拼接组成;而后者为3 027 bp,由6个外显子拼接而成。相差的63 bp位于的4 714—4 776 bp处,是第5个外显子的片段;而该片段在SETTUDRAFT_91803中为第5个内含子。说明该基因可能存在可变剪接现象,而01-23菌株属于1号小种,Et28A菌株为23N小种,该基因的不同剪接方式是否与生理小种差异有关尚有待进一步验证。
在黄曲霉中,缺失后表现为产孢量降低,菌核形成减少;在野生型菌株中表达量明显高于,并且对于的转录有重要影响[11]。Ramanujam等提出,稻瘟病菌的磷酸二酯酶和在调控cAMP水平以及致病性则发挥不同的作用,其中在分生孢子发育、附着胞以及侵染结构形成时的表达量最高,而在菌丝的表达量最低,说明在稻瘟病菌中,主要通过调控病菌的侵染结构的形成影响致病性[4-5]。本研究表明,和在大斑病菌侵染结构发育过程中,无论是人造疏水介质诱导条件下还是与感病寄主互作过程中,其转录水平的变化趋势是基本一致的,只不过可能由于疏水介质和寄主叶片的疏水性及结构的差异,导致基因表达变化的程度存在一定差异。总体来说,随着孢子萌发、侵染过程的进行,和均表现出下调-上调-下调的变化趋势。其中,的表达最高峰出现在分生孢子时期,而则在附着胞阶段表达水平最高,说明可能主要参与分生孢子发育,而则在附着胞发育过程中发挥重要作用。根据基因表达水平的变化趋势,在病菌-寄主互作过程中表达量峰值的出现比其在人工介质上略显滞后,说明在叶片上病菌附着胞发育的进程可能比人工介质上迟缓,推测是由于两种物质表面的疏水性差异所致,那么,是否与疏水性表面识别有关值得进一步探索。此外,病菌侵染结构发育至附着胞形成后期,人工介质上的病菌表达水平迅速下调,叶片上的病菌仍保持了较高的表达水平。出现这种差异有可能是由于在人工介质上病菌侵入钉无法真正穿透,只能停留在介质表面,叶片上的侵入钉则可以进一步生长至叶片细胞中吸取营养,而cAMP信号途径的主要功能之一即调控营养物质的识别与代谢,前期研究已证明,cAMP/PKA负调控大斑病菌的菌丝生长[28],那么较高的表达水平将有利于降低胞内cAMP水平,从而减弱PKA活性,促使菌丝的生长。下一步将利用分子生物学手段,对这一推测加以证实。
4 结论
玉米大斑病菌中含有1个高亲和力磷酸二酯酶基因和1个低亲和力磷酸二酯酶基因。全长3 208 bp,编码965个氨基酸。全长5 054 bp,编码1 029个氨基酸。在玉米大斑病菌生长发育过程中,主要在附着胞的形成阶段发挥调控作用,而主要在分生孢子阶段发挥调控作用。
References
[1] Park J I, Grant C M, Dawes I W. The high-affinity cAMP phosphodiesterase ofis the major determinant of cAMP levels in stationary phase: involvement of different branches of the Ras-cyclic AMP pathway in stress responses., 2005, 327(1): 311-319.
[2] Namy O, Duchateau-Nguyen G, Rousset J P. Translational readthrough of thestop codon modulates cAMP levels in., 2002, 43(3): 641-652.
[3] Hu Y, Liu E, Bai X J,Zhang A LThe localization and concentration of the-encoded high-affinity cAMP phosphodiesterase is regulated by cAMP-dependent protein kinase A in the yeast., 2010, 10(2): 177-187.
[4] Ramanujam R, Naqvi N I. PdeH a high-affinity cAMP phosphodiesterase, is a key regulator of asexual and pathogenic differentiation in., 2010, 6(5): e1000897.
[5] Zhang H, Liu K, Zhang X, Tang W, Wang J S, Guo M, Zhao Q, Zheng X B, Wang P, Zhang Z G. Two phosphodiesterase genes,and, regulate development and pathogenicity by modulating intracellular cyclic AMP levels in., 2011, 6(2): e17241.
[6] Yin Z Y, Tang W, Wang J Z, Liu X Y, Yang L N, Guo C Y, Zhang J L, Zhang H F, Zhang X B, Wang P, Zhang Z G. Phosphodiesterase MoPdeH targets MoMck1 of the conserved mitogen-activated protein (MAP) kinase signalling pathway to regulate cell wall integrity in rice blast fungus., 2015, 17(5): 654.
[7] Bahn Y S, Staab J, Sundstrom P. Increased high-affinity phosphodiesterasegene expression in germ tubes counteracts CAP1-dependent synthesis of cyclic AMP, limits hypha production and promotes virulence of., 2003, 50(2): 391-409.
[8] Jung W H, Warn P, Ragni EPopolo L, Nunn C D, Turner M P, Stateva LDeletion of, the gene encoding the high-affinity cAMP phosphodiesterase, results in changes of the cell wall and membrane in., 2005, 22(4): 285-294.
[9] Wilson D, Tutulan-Cunita A, Jung W, Hauser N, Hernandez R, Williamson T, Piekarska K, Rupp S, Young T, Stateva L. Deletion of the high-affinity cAMP phosphodiesterase encoded by PDE2 affects stress responses and virulence in., 2007, 65(4): 841-856.
[10] Harren K, Brandhoff B, Knödler M, Tudzynski B. The high-affinity phosphodiesterase BcPde2 has impact on growth, differentiation and virulence of the phytopathogenic ascomycete., 2013, 8(11): e78525.
[11] Yang K L, Liu Y H, Liang L L, Li Z G, Qin Q P, Nie X Y, Wang S H. The high-affinity phosphodiesterase PdeH regulates development and aflatoxin biosynthesis in., 2017, 101: 7-19.
[12] 申珅, 王晶晶, 佟亚萌, 李坡, 郝志敏, 董金皋. 玉米大斑病菌腺苷酸环化酶基因的克隆与功能分析. 中国农业科学, 2013, 46(5): 881-888.
Shen S, Wang J J, Tong Y M, Li P, Hao Z M, Dong J G. Cloning and functional analysis ofgene in., 2013, 46(5): 881-888. (in Chinese)
[13] Wang Q, Zhao W, Hao Z, Dong J.mRNA level of PKA-c gene inwith different nutrition sources under metalion or osmotic stress., 2011, 5(3): 361-365.
[14] Hao Z M, Tong Y M, Han Y, Wu D, Yang Z, Shen S, Gong X D, Cao Z Y, Li Z Y, Gu S Q,Dong J G.Molecular characterization of StpkaC2 and expression patterns of both PKA-c isoforms during the invasive growth of., 2015, 40(4): 244-250.
[15] Zhang S R, Hao Z M, Wang L H, Shen S, Cao Z Y, Xin Y Y, Hou M L, Gu S Q, Han J M, Dong J G.StRas2 regulates morphogenesis, conidiation and appressorium development in., 2012, 167(8): 478-486.
[16] 郝志敏, 申珅, 李志勇, 董金皋.玉米大斑病菌及其启动子的克隆与基因表达分析. 中国农业科学, 2010, 43(18): 3705-3712.
Hao Z M, Shen S, Li Z Y, Dong J G. Isolation and characterization ofgene fromand its expression., 2010, 43(18): 3705-3712. (in Chinese)
[17] 郭安源, 朱其慧, 陈新, 罗静初. GSDS: 基因结构显示系统. 遗传, 2007, 29(8): 1023-1026.
Guo A Y, Zhu Q H, Chen X, Luo J C. GSDS: a gene structure display server., 2007, 29(8): 1023-1026. (in Chinese)
[18] Hicks J K, Bahn Y S, Heitman J. Pde1 phosphodiesterase modulates cyclic AMP levels through a protein kinase A-mediated negative feedback loop in., 2005, 4(12): 1971-1981.
[19] Wang L, Griffiths K J, Zhang Y H,Ivey F D, Hoffman C S.adenylate cyclase suppressor mutations suggest a role for cAMP phosphodiesterase regulation in feedback control of glucose/cAMP signaling., 2005, 171(4): 1523-1533.
[20] Kobayashi T, Gamanuma M, Sasaki T,Yamashita Y, Yuasa K, Kotera J, Omori K. Molecular comparison of rat cyclic nucleotide phosphodiesterase 8 family: unique expression of PDE8B in rat brain., 2003, 319(22): 21-31.
[21] Swinnen J V, Joseph D R, Conti M. Molecular cloning of rat homologues of thedunce cAMP phosphodiesterase: evidence for a family of genes., 1989, 86(14): 5325-5329.
[22] Sakamoto Y, Tanaka N, Ichimiya TKurihara T, Nakamura K T. Structural comparison analysis of 2H phosphodiesterase family proteins., 2007, 5(1): 447-448.
[23] Yakunin A F, Proudfoot M, Kuznetsova ESavchenko A, Brown G, Arrowsmith C H, Edwards A M. The HD domain of thetRNA nucleotidyltransferase has 2’, 3’-cyclic phosphodiesterase, 2’-nucleotidase, and phosphatase activities., 2004, 279(35): 36819-36827.
[24] Thomas J, Rigden D J, Cronan J E. Acyl carrier protein phosphodiesterase (AcpH) ofis a non-canonical member of the HD phosphatase/phosphodiesterase family., 2007, 46(1): 129-136.
[25] Sultan S Z, Pitzer J E, Boquoi T,Hobbs G, Miller M R, Motaleb M A. Analysis of the HD-GYP domain cyclic dimeric GMP phosphodiesterase reveals a role in motility and the enzootic life cycle of., 2011, 79(8): 3273-3283.
[26] Ohm R A, Feau N, Henrissat B, Schoch C L, Horwitz B A, Barry K W, Condon B J, Copeland A C, Dhillon B, Glaser F, Hesse C N, Kosti I, LaButti K, Lindquist E A, Lucas S, Salamov A A, Bradshaw R E, Ciuffetti L, Hamelin R C, Kema G H, Lawrence C, Scott J A, Spatafora J W, Turgeon B G, Wit P J, Zhong S, Goodwin S B, Grigoriev I V. Diverse lifestyles and strategies of plant pathogenesis encoded in the genomes of eighteen Dothideomycetes fungi., 2012, 8(12): e1003037.
[27] Condon B J, Leng Y, Wu D, Bushley K E, Ohm R A, Otillar R, Martin J, Schackwitz W, Grimwood J, Mohdzainnudin N, Xue C, Wang R, Manning V A, Dhillon B, Tu Z J, Steffenson B J, Salamov A, Sun H, Lowry S, Labutti K, Han J, Copeland A, Lindquist E, Barry K, Schmutz J, Baker S E, Ciuffetti L M, Grigoriev I V, Zhong S, Turgeon B G. Comparative genome structure, secondary metabolite, and effector coding capacity across., 2013, 9(1): e1003233.
[28] Shen S, Hao Z M, Gu S Q, Wang J J, Cao Z Y, Li Z Y, Wang Q, Li P, Hao J, Dong J G. The catalytic subunit of cAMP-dependent protein kinase Acontributes to conidiation and early invasion in the phytopathogenic fungus., 2013, 343(2): 135-144.
(责任编辑 岳梅)
Cloning and Expression Pattern analysis of cAMP Phosphodiesterase Coding Genes in
Shen Shen, Li Zhenyang, Zhao Yulan, Li Pan, Han Jianmin, Hao Zhimin, Dong Jingao
(College of life science, Agricultural University of Hebei/Hebei Key Laboratory of plant physiology and molecular pathology, Baoding 071001, Hebei)
【Objective】The objective of this study is to clarify the function of cAMP phosphodiesterase (PDE) and cAMP signal pathway in regulating the pathogenicity of, the genes encoding cAMP phosphodiesterase were cloned and the expression pattern of these genes were analyzed during the development of infective structures and the early stage of infecting the host. 【Method】Based on conserved sequence ofgenes from,,,,, the homologous fragments were amplified by degenerate primers PCR, and the full length PDE genes and flanking sequences were obtained by combining RACE and Genome Walking. Multiple sequence alignment for prediction coding product of the protein was constructed by Mega 5.0 software and phylogenetic tree was constructed by adjacent method. Gene structure was analyzed by GSDS. Physical and chemical properties were analyzed by ProtParam. Secondary structure was predicted by SOMPA. Conserved domains were analyzed by SMART on line.The material of different development periods fromwas collected under the induction on artificialhydrophobic medium and on the susceptible host surface. Quantitative real-time(qRT-PCR) was used to analyze the gene expression patterns.【Result】There were one high-affinity phosphodiesterase gene () and one low-affinity phosphodiesterase gene () in the genome of. Full-length ofwas 3 208 bp, which consisted of 5 introns and 6 exons, the coding region was 2 898 bp. The full length ofwas 5 054 bp, which contained 4 introns and 5 exons, with the coding region of 3 090 bp. StH-PDE protein contained conservative type I cAMP phosphodiesterase, and StL-PDE contained L-PDE specific type II cAMP phosphodiesterase catalytic domain.homologous genes in different plant pathogenic fungi presented a high degree of similarity.and the high affinity phosphodiesterase gene from,,were clustered in the same evolution.and the low affinity phosphodiesterase gene from,,,were clustered in the same evolution. Compared with the mycelia, the expression levels ofandin conidia were significantly up-regulated, andandwere up-regulated by about 52-fold and 2-fold under the induction on artificialhydrophobic medium, respectively. The expression of both genes at the early stage of spore germination was significantly down-regulated. With the germination process, the expression level gradually increased, and the second peak appeared at the appressorial formation stage, and then the expression level was down again. However, in the whole process, the highest expression level ofappeared in the appressorial formation period, reaching nearly 7-fold and 2-fold of that in the mycelia and the conidia, respectively, and the expression level ofwas always lower than that in conidia. During the interaction ofwith the susceptible host, the expression ofandin the process of pathogen infection was consistent with that under the induction of artificial hydrophobic material. The expression of both genes in the early stage of spore germination was significantly down-regulated. With the germination process, the expression level gradually increased. The expression ofwas down-regulated in 18 and 24 h post-inoculation beyond the early stage of spore germination. 【Conclusion】andshowed a down-regulation-up-regulated-down-regulated expression pattern in the development of pathogen infection. The relative expression level ofwas the highest during the appressorial formation, and the expression level ofin conidia was the highest.
; cAMP phosphodiesterase; quantitative real-time; gene expression
2017-02-28;接受日期:2017-05-02
国家自然科学基金(31301616,31601598)、河北省自然科学基金(C2016204160)、河北省高等学校科学技术研究项目(QN2016071)
申珅,E-mail:shenshen0428@163.com。李贞杨,E-mail:1543639761@qq.com。申珅和李贞杨为同等贡献作者。通信作者郝志敏,E-mail:hzm_0322@163.com。通信作者董金皋,E-mail:dongjingao@126.com

