南疆传统发酵酸奶中可产生生物膜乳酸菌的筛选及鉴定
西热娜依·阿布力克木,穆耶赛尔·玉苏普,努尔古丽·热合曼
(新疆师范大学 生命科学学院,新疆特殊环境物种保护与调控生物学实验室,新疆 乌鲁木齐,830054)
南疆传统发酵酸奶中可产生生物膜乳酸菌的筛选及鉴定
西热娜依·阿布力克木,穆耶赛尔·玉苏普,努尔古丽·热合曼*
(新疆师范大学 生命科学学院,新疆特殊环境物种保护与调控生物学实验室,新疆 乌鲁木齐,830054)
为了探索新疆长寿地区传统发酵酸奶中优势乳酸菌的生物膜形成能力,采用纯培养法、96 孔微量板定量检测法、扫描电子显微镜观察法及16S rRNA基因序列分析法,对3份阿图什和1份乌什传统发酵酸奶中可产生生物膜的乳酸菌进行了筛选、分子鉴定及生物膜结构图片观察。最终从4份样品中分离出57 株乳酸菌,其中38 株(73.68%)乳酸菌均有不同程度的生物膜形成能力,16 株(28.07%)乳酸菌为强黏附成生物膜菌株、22 株(38.59%)为中等黏附成生物膜菌株。分子鉴定实验结果显示,可形成生物膜的乳酸菌共有3 个属、6 个种,其中16 株为Enterococcusdurans、1 株为Enterococcusfaecium、7 株为Enterococcusthailandicus、3 株为Enterococcuslactis、6 株为Lactobacillusplantarum、5 株为Streptococcusthermophilus。可产生生物膜乳酸菌中肠球菌(Enterococcus)为优势菌属,其次为乳杆菌属(Lactobacillus)和链球菌属(Streptococcus)。
乳酸菌;生物膜;电子显微镜
新疆为多民族居住的重要的牧业基地,地理位置独特,不同地区气候差异较大。这里的少数民族千百年以来食用以传统方法制作的酸奶,酸奶中有芳香物质、壁外多糖、多种乳酸、乳糖、氨基酸、矿物质、维生素、酶等营养物质,营养价值甚至超过纯牛奶[1]。酸奶里面营养物质丰富、促进调节肠道微生态、可以有效地降低胆固醇、抗衰老、在人体健康中起着重要作用[2]。
不同的民族特色发酵乳制品中均蕴含着丰富的乳酸菌资源。乳酸菌能够产生多种有益的代谢产物,例如乳酸、细菌素、胞外多糖等。胞外多糖是分泌于细胞外的一类糖类化合物,它对改善发酵乳制品的组织状态起着重要作用[3]。胞外多糖(EPS)的存在有利于细胞与细胞之间的黏附及生物膜的形成和成熟、使细胞免受恶劣环境的影响[4],即作为生物膜形成中关键的组成部分[5]。
生物膜(Biofilm)指细菌黏附于接触表面,分泌多糖基质、纤维蛋白、脂质蛋白等,将其自身包绕其中而形成的大量细菌聚集膜样物,是微生物在宿主体内形成的一种具有复杂结构并附着在宿主表面的微生物群落[6]。乳酸菌生物膜黏附定居在人体肠道并起益生作用,在连续接种等发酵工业中也具有十分重要的意义。
截至目前为止,关于新疆各地区酸奶中筛选出可产生物膜乳酸菌的研究较少。任晓镤等探索能诱导植物乳杆菌形成生物膜的外界环境因素[7]。本实验采用纯培养法、96 孔微量板定量检测法、扫描电子显微镜观察法及16S rRNA基因序列分析法,对3份阿图什和1份乌什传统发酵酸奶中可产生生物膜乳酸菌进行了筛选、分子鉴定及生物膜结构图片观察。
1 材料与方法
1.1实验材料
样品来源:从居住于新疆阿图什、乌什等地区的农民家庭采集4份样品,样品详细信息见表1。

表1 样品采集信息表
样品采集:用无菌吸管将样品吸取并立刻装在50 mL无菌离心管中,用封口膜紧密包装并立即装在冰袋中运输到实验室。
改良MRS培养基、 改良Lee氏培养基[8]。
1.2仪器与设备
LRH-250生化培养箱,上海一恒科技有限公司;光学显微镜,宁波舜宇仪器有限公司;PCR仪、凝胶成像系统、离心机、振荡培养箱,上海天呈实验仪器制造有限公司; 96 孔平底培养板、酶标仪,基因有限公司;扫描电镜(JSM-6390),日本JEOL公司。
1.3方法
1.3.1 乳酸菌的分离及染色镜检
先取4.5 mL 无菌生理盐水分别装入7个试管里,再取500 μL酸奶加入第1个试管充分混匀,按稀释梯度法准备10-3、10-4、10-5、10-6、10-7稀释液,接着依次取100 μL稀释度为 10-5、10-6、10-7的样品,涂布改良MRS、Lee氏培养基琼脂平板,最后把MRS、Lee氏平板放于37 ℃培养48 h[9]。培养完毕后菌落根据于MRS平板上是否有明显的容钙圈以及Lee氏培养基颜色是否由紫色变为黄色等特征来挑取。形态不同的菌落再纯化培养几次,至到菌落形态一直为止(以染色镜检法判断是否纯化)。最后通过过氧化氢酶、革兰氏染色等试验来筛选并初步鉴定乳酸菌。
1.3.2 96孔微量板定量检测法筛选可产生生物膜的菌株
1)通过分离纯化得到的乳酸菌于37 ℃条件下静置培养48 h后,取菌悬液1 μL加入装有MRS液体培养基(100 μL/孔)的标准96 孔微量滴定板进行培养48 h,以未接菌的MRS培养基为空白对照。
2)培养完成后用酶标仪测定培养物于波长为630 nm处的光密度值OD1,接着弃去原培养基并以蒸馏水洗涤除去浮游状态的菌(重复进行3~4次),96 微孔板置于室温干燥2 h。
3)取100 μL 1%结晶紫溶液依次加入每个孔,染色20 min后用蒸馏水去除孔壁染液(重复进行4~5次)并将96微孔板置于室温干燥30 min。
4)每孔中依次加入100μL 95%乙醇,同时微量振荡30 min。最后采用酶标仪测定OD630 nm处的 OD2。 做3次平行实验。

(1)
(2)
OD1c,OD2c为空白对照吸光度值,B<0.1为不黏附成膜,B≥0.1为黏附成膜,0.1
1.3.3 扫描电子显微镜观察生物膜结构
无菌六孔板内放置无菌盖玻片,按比例为1∶100接种乳酸菌后37 ℃条件下静置培养48 h。将培养皿用0.1% PBS(pH 7.2)洗3次,每次5 min,以处理未粘附菌,再加4%戊二醛固定液固定并过夜。以0.1 mol/L PBS 冲洗培养皿,加1%四氧化锇固定2 h (20 ℃),以0.1 mol/L PBS再洗2次。最后每隔10 min于50%、70%、80%、90%、100%乙醇系列中脱水后通过JFD-320冷冻干燥仪干燥5 min,真空喷金,并于扫描电镜(JSM-6390,日本JEOL公司)下拍照[13-14]。
1.3.4 16S rRNA 基因序列分析
采用TIAN GEN 细菌基因组DNA提取试剂盒,对具有生物膜形成能力的菌株进行16S rRNA基因序列分析。以成功提取的DNA 为细菌模板进行PCR扩增。16S rRNA 基因序列扩增设计引物:上游引物为27F (5′-AGAGTTTGATCCTGGCTCAG-3′);下游引物为1495r(5′-CTACGGCTACCTTGTTACGA-3′)[15-16]。扩增循环为94 ℃,5 min;(94 ℃,1 min;55 ℃,1 min;72 ℃,1.5 min;30个循环);72 ℃,5 min[17],扩增体系见表2。扩增完成后,取6 μL PCR产物和3 μL溴酚蓝,混合点样1.0%琼脂糖凝胶电泳来确认PCR产物质量,以在1 500 bp左右出现清晰的条带为对照。扩增产物由上海生工有限公司测序。

表2 16S rRNA基因序列 PCR扩增体系
PCR扩增产物送给上海生物工程有限公司进行测序。待测菌测序序列后提交到GenBank,采用Blast程序与己知序列进行相似性比对分析。GenBank将按照与测得序列的相似性高低列出己知序列名单、相似性程度以及这些序列相对应的微生物种类。最后采用Mega7.0软件绘制出(Neighbor-Joining)系统发育树,因而对所可形成生物膜菌进行鉴定。
2 结果与分析
2.1乳酸菌的分离纯化
根据改良MRS 及Lee氏平板上是否有明显的溶钙圈及颜色是否变成为黄色等2种实验结果随机挑取并纯化菌落,通过简单染色确认是否已纯化,最后4个样品从不同稀释度中筛选出57 个菌落。用光学显微镜来观察细胞形态,部分菌株形态结果如图1,有短杆状,长杆状,球状,连球状,表面光滑,半透明或不透明,凸起,边缘整齐等。最后实验结果显示,这57 株菌均为接触酶阴性、革兰氏阳性,初步鉴定为乳酸菌。
图注:13为球状菌;111为链球状菌;120为短杆状菌图1 传统发酵酸奶中乳酸菌细胞形态(放大×100)Fig.1 The morphology of lactic acid bacteria in fermented milk
2.2筛选具有生物摸形成能力的乳酸菌
菌株根据生物膜形成能力分成4组:B<0.1为不黏附成膜,B≥0.1为黏附成膜,0.1

表3 分离菌株根据生物膜形成能力分组

图2 阿图什酸奶中可形成生物膜的菌株Fig.2 Biofilm formation ability of LAB in Atux fermented milk
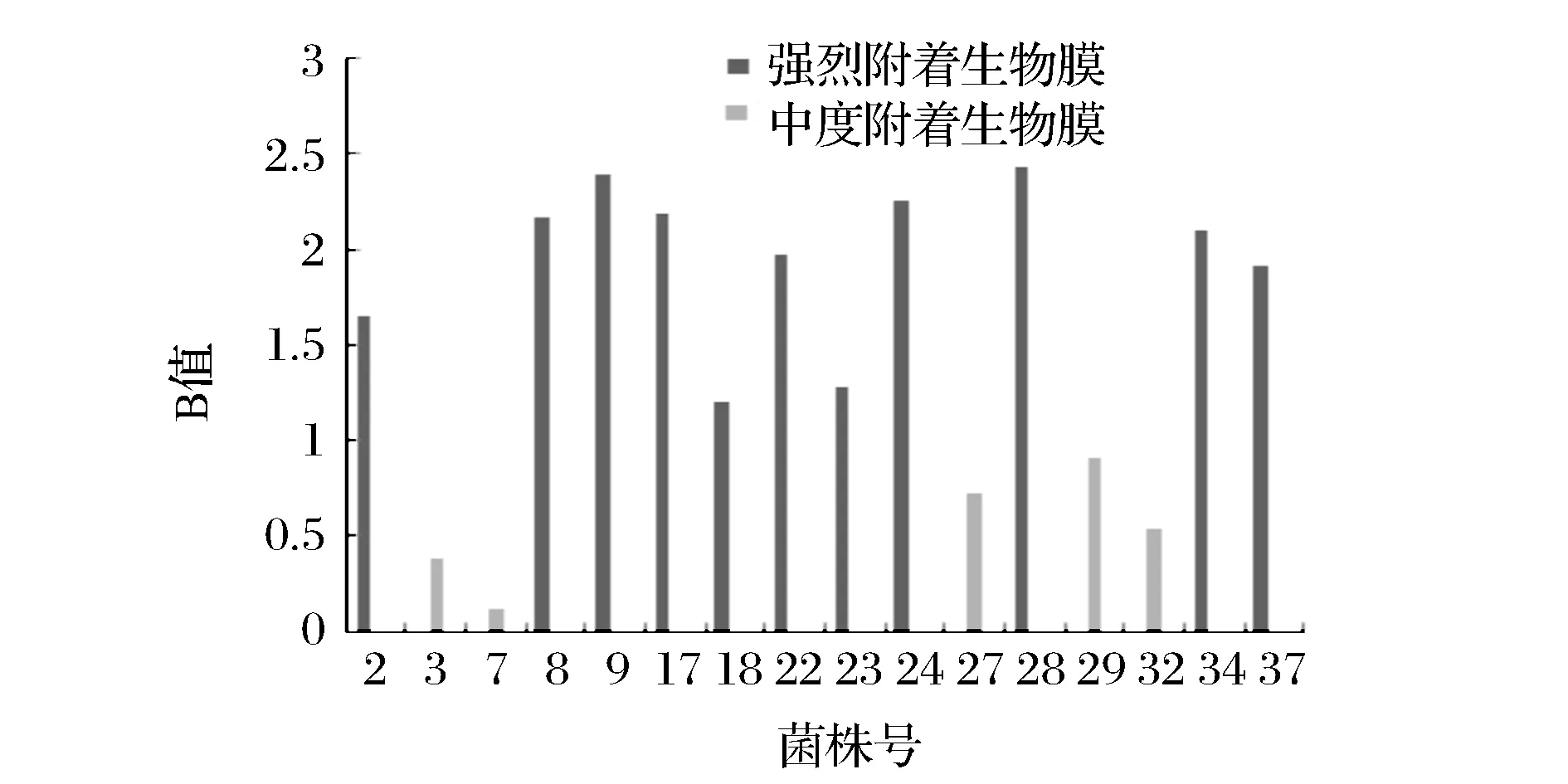
图3 乌什酸奶中可形成生物膜的菌株Fig.3 Biofilm formation ability of LAB in Uqturpan fermented milk

A-28号株;B-76号株;C-M63株;D-132号株;E-L5株;F-L2株图4 生物膜电子显微镜图片Fig.4 Biofilm picture of electron microscophy
2.3扫描电子显微镜观察生物膜结构
扫描电镜可以直接观察生物膜结构。本研究利用扫描电子显微镜,对强黏附成膜乳酸菌代表菌株(28;76;M63),中等强度黏附成膜乳酸菌代表菌株(132;L5)及不黏附成膜乳酸菌代表菌株(L2)进行电镜拍照。由图4可知, A 、B、C等强黏附成膜乳酸菌菌落相互聚集,表面细菌密集,菌落增厚,聚集成团,形成大块的生物膜。D、E等中等强度黏附成膜乳酸菌中少部分开始粘附聚集并开始包裹在代谢产物中,菌落之间间隙较大,而不黏附成膜乳酸菌代表菌株(F)菌细胞黏附很少,与中、强黏附成膜乳酸菌相比具有显著的差异。
2.416SrRNA分子鉴定
对38株可产生生物膜乳酸菌16S rRNA基因序列进行扩增鉴定,并用1%琼脂糖凝胶,将扩增产物进行电泳检测,以1 500 bp左右出现清晰的条带为准。采用DNAStar 4.0软件,对待测菌株的16S rRNA基因序列进行整理,并将得到的有效序列提交到GenBank,采用Blast程序与己知序列进行相似性比对。结果显示,38株菌16S rRNA 基因序列同源性均≥99%。相似度及分离菌株在GenBank中的登录号见表4。

表4 可产生生物膜乳酸菌16S rDNA序列与GenBank数据库中相关序列相似性分析
最后,采用MEGA7.0 软件绘制(Neighbor-Joining)系统发育树(系统发育树见图5)。结果表明,所可产生生物膜菌株归属于3 个属6 个种,其中3个属分别是肠球菌属(Enterococcus)、乳杆菌属(Lactobacillus)和链球属 (Streptococcus),6个种分别为耐久肠球菌 (E.durans)、屎肠球菌 (E.faecium)、E.thailandicus、Enterococcuslactis、植物乳杆菌(L.Plantarum)、嗜热链球菌(S.thermophilus)。
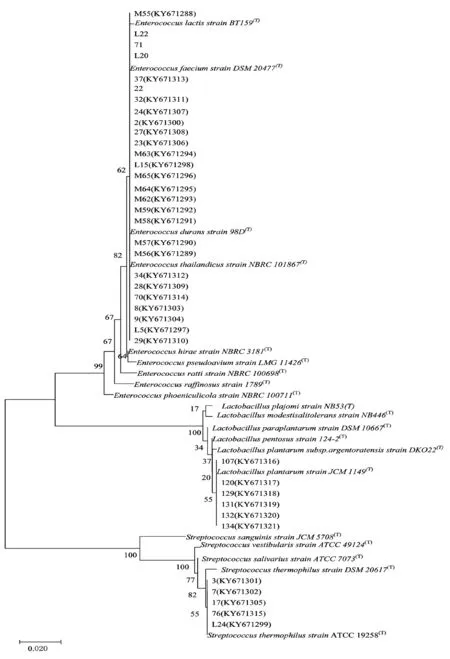
图5 乳酸菌(可形成生物膜)的16S rRNA 基因序列系统发育树 Fig.5 Phylogenetic analysis of 16S rRNA gene sequences of biofilm forming LAB
由图5可知, M55、32、24、2、27、23 、M63、L15、M65、M64、M62、M59、M58、M57、M56、22与标准菌株Enterococcusduransstrain98D(T)相似性100%或99%,将其鉴定为Enterococcusdurans。34、28、70、9、8、L5、29与标准菌株Enterococcusthailandicus聚为一类,且相似度均为99%,所以归属于Enterococcusthailandicus。37 与EnterococcusfaeciumDSM 20477(T) 相似度是100%,并在进化树上同支上,将其鉴定为Enterococcusfaecium。L22 、L20、71与标准菌株EnterococcuslactisBT159(T)在同支上,并相似度分别为99%,因此鉴定为Enterococcuslactis。菌株107、120、129、131、132、134与标准菌株LactobacillusplantarumJCM 1149聚为一类并相似性均为100%,将其鉴定为Lactobacillusplantarum。 菌株3、7、17、76、L24与标准菌株StreptococcusthermophilusATCC 19258(T) 聚为一类并相似性均为100%,将其鉴定为Streptococcusthermophilus。
3 讨论
研究发现,在食品表面上形成益生菌生物膜可以有效地改善其表面的物理化学特性,并能抑制不良浮游微生物的黏附[18]。乳酸菌生物膜由蛋白质、多糖和磷酸盐分子组成,其可以合成酸、细菌素及表面活性剂等拮抗化合物,因而得到国内外的高度重视[19-20]。 RANGASWAMY等人将德氏乳杆菌固定于网状聚氨酷泡沫材料上后包装在生物反应器中并用于乳酸发酵,乳酸生产的速率有了显著的提高[21]。FURUKAWA等研究者发现酿酒酵母与植物乳杆菌混合生物膜的形成促进于Fukumaya米醋发酵[22]。
本研究以新疆阿图什及乌什传统发酵酸奶中分离出57 株乳酸菌并采用96孔微量检测法检测其生物膜形成能力,接着以分子鉴定法鉴定可产生生物膜的乳酸菌,最后进行电子显微镜观察生物膜结构图。研究结果显示,分离纯化出的57 株菌中,16 株为强等黏附成膜菌,22 株为中等黏附成膜菌株。16 株强等黏附成膜乳酸菌中10 株为从乌什酸奶中分离到的,占总菌含量的17.54%,6 株为从阿图什酸奶中分离到的,占总菌含量的10.52%。此实验结果可进一步说明以乌什酸奶为来源的乳酸菌与阿图什酸奶为来源的乳酸菌相比乌什酸奶为来源的乳酸菌显出较高的生物膜形成能力,乌什酸奶拉丝性也强于阿图什酸奶,实验结果与原样品特性一致。
本研究中可产生生物膜的乳酸菌归属于3 个属6 种,其中15 株为耐久肠球、 3 株为屎肠球菌、 7 株为为Enterococcusthailandicus、2 株为Enterococcuslactis、6 株为植物乳杆菌、5 株为嗜热链球菌。实验结果表明8、9、18、22、23、25、26、28、29、34、35、37、L22、L30、M62、M63、70、71等18 株强黏附成膜菌株都属于肠球菌;NG-107、118、120、129、131、132等6 株中等粘附成膜菌株属于植物乳杆菌。此结果进一步说明肠球菌与植物乳杆菌相比具有较强的粘附成膜能力。丁武蓉等研究者实验结果显示乳杆菌属产EPS产量为100~150 mg/L,肠球菌属EPS产量为200~300 mg/L,227株乳酸菌中球菌产胞外多糖的能力高于杆菌[23],与本研究结果一致。耐久肠球菌生物膜形成能力可能基于肠球菌属EPS产量。
2个地区酸奶样品中的乳酸菌菌群在种类、数量及生物膜形成能力方面具有显著差异的可能性包括以下几点:地区地理环境、酸奶制作环境、制作酸奶工艺过程中的习惯性细节(如接种、发酵温度,使用的容器等)、牛奶浓度及质地和成分等。以上因素均能影响乳酸菌生物膜的形成能力。生物膜形成的原因及其机理待进一步深入研究。
[1] 董晓婉. 新疆和布克赛尔县哈萨克族和蒙古族传统乳制品中乳酸菌菌群多样性的研究[D]. 石河子:石河子大学, 2014.
[2] 李敬芳. 浅谈酸奶的营养价值与保健功能[J]. 健康必读月刊, 2011(6):424-424.
[3] 任晓镤, 妥彦峰, 李明杨,等. 外界环境因素对戊糖乳杆菌生物膜形成的影响[J]. 农业机械学报, 2014, 45(11):230-234.
[4] SUTHERLAND I W. The biofilm matrix-an immobilized but dynamic microbial environment.[J]. Trends in Microbiology, 2001, 9(5):222-227.
[5] 戚韩英, 汪文斌, 郑昱,等. 生物膜形成机理及影响因素探究[J]. 微生物学通报, 2013, 40(4):677-685.
[6] 徐文生, 张艳艳, 黄漫青,等. 双歧杆菌在不同材料上形成生物膜的研究[J]. 中国食品学报, 2011, 11(3):50-57.
[7] 任晓镤, 李明杨, 任少东,等. 诱导植物乳杆菌生物膜形成的环境因素探索[J]. 食品与发酵工业, 2014, 40(7):11-15.
[8] 谢丽斯. 发酵食品中乳酸菌分离鉴定及生物被膜介导其耐药性的研究[D]. 广州:广东工业大学, 2012:10-20
[9] 呼斯楞,刘红新,于洁,等. 内蒙古呼伦贝尔地区传统发酵乳中乳酸菌的多样性分析[J]. 微生物学通报,2016,(5):984-990.
[10] 孙凤军. 大肠杆菌生物膜的形成及其耐药质粒传递和调控的研究[D]. 重庆:第三军医大学, 2009:30-33.
[11] KADAM S R, BESTEN H M W D, VEEN S V D, et al. Diversity assessment ofListeriamonocytogenes, biofilm formation: Impact of growth condition, serotype and strain origin[J]. International Journal of Food Microbiology, 2013, 165(3):259-264.
[12] 卢艳, 刘蕾, 刘文博,等. 1株可形成生物膜鸡白痢沙门菌的分离鉴定[J]. 中国兽医杂志, 2010, 46(9):19-21.
[13] 景春娥, 李萍, 杜欣军,等. 硅胶表面阪崎克罗诺杆菌生物膜的形态观察[J]. 食品研究与开发, 2016, 37(14):144-148.
[14] ÉDER Galinari, JULIANA Escarião da Nóbrega, Nélio José de Andrade, et al.Microbiological aspects of the biofilm on wooden utensils used to make a Brazilian artisanal cheese[J].Brazilian Journal of Microbiology,2014,45(2):713-720
[15] H.KSONTINIA, F. KACHOURIA, A. GUESMIB, et al. Dairy Biofilm: bacterial community diversity assessment and impact of theLactococcuslactisbio adhesion on biofilm growth[J]. Microbiology, 2013, 82(3): 364-372.
[16] 陈孝勇, 李键, 赵欣,等. 传统发酵牦牛酸乳中益生性乳酸菌的体外筛选[J]. 食品与发酵工业, 2016, 42(4):85-90.
[17] CAY Y, Benno Y, Ogawa M, et al. Effect of applying lactic acid bacteria isolated from forage crops on fermentation characteristics and aerobic deterioration of silage[J]. Journal of Dairy Science, 1999, 82(3):520-526.
[18] BRIANDET R, HENRY J M, BELLON-Fontaine M N. Determination of the van der Waals, electron donor and electron acceptor surface tension components of static Gram-positive microbial biofilms[J]. Colloids and Surfaces B: Biointerfaces, 2001, 21(4):299-310.
[19] RODRIGUES L, VAN d M H, TEIXEIRA J A, et al. Biosurfactant fromLactococcuslactis53 inhibits microbial adhesion on silicone rubber[J]. Applied Microbiology and Biotechnology, 2004, 66(3):306-311.
[20] 谢丽斯, 张宏梅, 刘学禄,等. 从腐败食品中分离的乳酸菌生物被膜形成的影响因素[J]. 食品与发酵工业, 2011, 37(3):6-8.
[21] RANGASWAMY V, RAMAKRISHNA S V. Lactic acid production byLactobacillusdelbrueckiiin a dual reactor system using packed bed biofilm reactor[J]. Letters in Applied Microbiology, 2008, 46(6):661-666.
[22] FURUKAWA S, YOSHIDA K, OGIHARAg H, et al. Mixed-species biofilm formation by direct cell-cell contact between brewing yeasts and lactic acid bacteria[J].Bioscience Biotechnology & Biochemistry, 2010, 74(11):2 316-2 319.
[23] 丁武蓉. 青藏高原传统发酵牦牛奶中乳酸菌多样性及其益生功能研究[D]. 兰州:兰州大学, 2014:11-130
ScreeningandidentificationoflacticacidbacteriaformingbiofilmintraditionalfermentedmilkinSouthXinjiang
XIRINAY·Ablikim, MUYESSER·Yusup, NURGUL·Rahman*
(College of Life Sciences Xinjiang Normal University, Xinjiang Key Laboratory of Special Species Conservation and Regulatory Biology, Urumqi 830054, China)
To explore the Lactic acid bacteria diversity and biofilm formation in traditional fermented milk from Xinjiang longevity region, the samples were analyzed using pure culture and 16S rRNA gene sequence analysis, 96 well micro-plate semi -quantitative methods and scanning electron microscopy. Finally 57 strains were isolated from four samples. The micro-plate semi -quantitative method was used to investigate biofilm formation of strains. The results showed that 38 strains (73.68%) of the LAB showed biofilm formation ability, of which 16 strains (28.07%) strongly adhered to biofilm and 22strains (38.59%)were moderately adherent. The strains which can form biofilm were belonging to three species of six genera includingEnterococcusdurans(16 strains),Enterococcusffaecium(1 strains),Enterococcusthailandicus(7 strains),Enterococcuslactis(3 strains),Lactobacillusplantarum(6 strains),Streptococcusthermophilius(5strains),in whichEnterococcuswas the dominant species and was followed byLactobacillusandStreptococcus. These provided foundation for the development and utilization of LAB resources and their biofilm characteristics.
lactic acid bacteria;biofilm;ESM
10.13995/j.cnki.11-1802/ts.013974
硕士研究生(努尔古丽·热合曼副教授为通讯作者,E-mail:Nurgulum@163.com)。
国家自然科学基金(31460448);国家自然科学基金(31160333)
2017-02-04,改回日期:2017-04-19

