TRPV4对脑血管平滑肌增殖及凋亡的影响
冯 辉, 臧 莉, 赵振霞
TRPV4对脑血管平滑肌增殖及凋亡的影响
冯 辉, 臧 莉, 赵振霞
目的 探究新型钙离子通道香草醛受体4(transient receptor potential vanilloid receptor,TRPV4)对自发性高血压(spontaneously hypertensive rats,SHR)大鼠脑血管平滑肌增殖及凋亡的影响。方法 分离并培养大鼠脑基底动脉平滑肌细胞(basilar arterial smooth muscle cells,BASMCs),采用实时定量聚合酶链式反应(qRT-PCR)及免疫印迹(Western blot)法检测细胞中TRPV4的表达。转染TRPV4 siRNA沉默TRPV4基因,CCK-8检测细胞增殖、流式细胞术检测细胞周期及凋亡;Western blot检测cyclinD1、p-Rb、Bcl-2、cleaved-caspase-3/caspase-3、p-AKT/AKT、p-GSK3β/GSK3β蛋白表达。结果 qRT-PCR及Western blot结果显示自发性高血压大鼠BASMCs中TRPV4的表达明显高于对照组大鼠。而在自发性高血压大鼠BASMCs中,沉默TRPV4可抑制细胞增殖,阻滞细胞周期并诱导其凋亡;此外还可下调cyclinD1、p-Rb、Bcl-2、p-AKT、p-GSK3β蛋白的表达,同时上调cleaved-caspase-3蛋白的表达。 结论 沉默TRPV4能够抑制自发性高血压大鼠BASMCs细胞增殖,同时促进细胞凋亡,机制可能与抑制AKT/GSK3β信号通路的激活有关,所以新型钙离子通道TRPV4可为今后靶向诊疗高血压脑血管疾病提供依据。
TRPV4; 脑血管平滑肌细胞; 细胞增殖及凋亡; AKT/GSK3β信号通路
以脑卒中为主的脑血管疾病成为威胁人们的健康主要杀手之一,而高血压则被认为是引起脑卒中的关键性独立危险因素[1,2]。卒中过程中多伴有明显的基底动脉和大脑中动脉重构,研究显示血管重构与血管平滑肌细胞的异常增殖及凋亡、炎症反应、纤维化等密切相关,但其具体机制尚不明确[3~5]。
近年来发现许多离子通道与高血压脑血管重构密切相关,其中瞬时性受体电位通道(transient receptor potential,TRP)超家族即为其中之一[6,7],TRPV4是其中香草醛受体(transient receptor potential vanilloid receptor,TRPV)亚族的成员之一,广泛分布于神经系统、肝脏、肾脏、心脏等多种组织,激活时可促进钙离子内流,钙离子是调节平滑肌收缩的主要物质,并参与调控细胞的增殖、迁移等病理生理过程[8,9]。但TRPV4在脑血管平滑肌中的作用还并不明确。本研究首先检测了TRPV4蛋白在脑血管平滑肌细胞中表达,初步分析其表达与高血压的联系。通过siRNA沉默TRPV4进一步分析其对脑血管平滑肌细胞的作用及可能的作用机制。
1 材料与方法
1.1 材料与试剂 胎牛血清(FBS),F12培养基及Opti-NEM培养基均购自美国Gibco公司;LipofectAMINE2000及相关转染试剂购自Invitrogen;小鼠抗大鼠平滑肌α-actin单克隆抗体及FITC荧光二抗均购自武汉博士德公司;TRPV4、cyclinD1、p-Rb、Bcl-2、cleaved-caspase-3/caspase-3、p-AKT/AKT、p-GSK3β/GSK3β抗体均购自英国Abcam公司;CCK-8细胞增殖分析试剂盒购自日本同仁化学研究所;细胞周期及凋亡检测试剂盒购自南京凯基科技发展有限公司;TRPV4 siRNA及其阴性对照质粒由美国Dharmacon公司提供;SYBR Green I real-time PCR kit由上海吉玛制药技术有限公司提供;其余试剂均为国产分析纯。
1.2 实验方法
1.2.1 细胞分离、鉴定及培养 水合氯醛麻醉6只自发性高血压(spontaneously hypertensive rats,SHR)大鼠(18 w龄、SPF级、200~220 g)和6只正常血压(Wistar-Kyoto rats,WKY)大鼠(18 w龄、SPF级、200~220 g)后,断头处死,开颅并迅速取出脑基底动脉。将其转移至冰Krebs液中小心分离血管周围的结缔组织和分支并漂洗两次,再次转移至含20%FBS的F12培养基中,用剪刀将血管反复剪碎后,转入培养瓶中,常规培养于37 ℃、5% CO2的恒温培养箱中。3~4 d可见细胞爬出并半数换液,7 d之后正常传代,通常第8~12代细胞用于实验。鉴定:取第二代细胞接种于Confocal专用小皿中,贴壁后去除培养基并用PBS漂洗3×5 min。4%多聚甲醛固定后加0.1% Triton 100 μl穿孔3~5 min,加PBS漂洗后,用5%BSA封闭细胞30 min。加α-actin一抗(1∶500)4 ℃孵育过夜。PBS漂洗3×10 min。加FITC荧光二抗(1∶2000)室温下避光孵育细胞60 min, PBS漂洗3×10 min。用Confocal显微镜观察并拍照。仅孵育荧光二抗的细胞作为阴性对照。
1.2.2 TRPV4 siRNA转染和分组 取对数生长期细胞接种于6孔板中,待细胞融合至60%~80%,换无血清的培养基同步化12 h,随后进行转染。组别设为空白对照组(Ctrl)、阴性对照组(Negative siRNA,Neg)、转染组(TRPV4 siRNA,siRNA),每组6孔。将TRPV4 siRNA和Negative siRNA分别溶解于Opti-MEM培养基中孵育5 min,同时另取LipofectAMINE2000加入Opti-MEM培养基中室温孵育5 min,将两者轻柔混合,室温孵育20 min。然后将混合物加入各组细胞中,于培养箱中培养6 h后,更换为正常完全培养基继续培养48 h。提取细胞蛋白测定转染效率并用于后续实验分析。
1.2.3 CCK-8法测定细胞活力 取对数生长期细胞以2×103/孔的密度接种于96孔板中,经相应处理后继续培养22 h,随后向每孔中加入10 μl 的CCK-8试剂,置于培养箱中继续培养2 h。用酶标仪检测各孔在450 nm波长处的吸光度值(OD)。每组设置3个复孔取均值,另设单孔只加入培养基作空白对照。
1.2.4 流式细胞术检测细胞周期 用不含EDTA的胰酶消化、离心收集各组细胞,PBS漂洗后离心并重悬细胞,用70%冰乙醇于4 ℃下避光固定过夜。离心洗去乙醇,避光的条件下加入碘化丙啶(PI)染色液,37 ℃避光孵育30 min,用流式细胞仪检测Ex=488 nm处的荧光强度。
1.2.5 Annexin V/PI 双染色法检测细胞凋亡 消化、离心收集各组细胞,PBS漂洗后离心并加Binding Buffer重悬细胞,先后加入Annexin V-FITC室温避光孵育10 min及PI 避光反应5 min。流式细胞仪检测Ex=488 nm及Em=530 nm处的荧光强度。
1.2.6 Western blot检测蛋白表达水平 RIPA裂解、提取各组细胞蛋白, BCA蛋白定量试剂盒定量后调整各组蛋白上样总量至60 μg,同时加入4倍体积的loading buffer进行SDS-PAGE电泳。然后通过电转将蛋白转移至PVDF膜上,加5%脱脂牛奶室温条件下封闭90 min,依据说明书要求加入一抗TRPV4、cyclinD1、Bcl-2、caspase-3、AKT、GSK3β(1∶2000)和cleaved-caspase-3、p-Rb、p-AKT、p-GSK3β(1∶1000)4 ℃下孵育过夜,TBST洗涤3×5 min。加入相对应的二抗(1∶2000)室温条件下孵育90 min,TBST洗涤3×10 min,暗室中加ECL发光液显影,定影并冲洗胶片,而后用Image J进行灰度分析。
1.2.7 qRT-PCR检测mRNA表达水平 依据说明书加Trizol提取总RNA,纯化后用全波段酶标仪测定所提RNA样品的OD280值并进行核酸定量。取2 μg总RNA在逆转录酶的作用下逆转录至终体积为20 μl,而后采用SYBR Green I real-time PCR的方法检测mRNA的相对表达。引物设计如下,TRPV4正向引物:5’-CCTTTGCTGCCTGTGTGAAC-3’;反向引物5’-GCTGGAGGATGAGGATGTGT-3’。 GAPDH作为内参,正向引物:5’-GGGTGATGCTGGTGCTGAGTATGT-3’;反向引物:5’-AAGAATGGGAGTTGCTGTTGAAGT-3’。PCR反应条件:95 ℃预变性5 min,然后进行40个循环(95 ℃ 30 s,60 ℃ 30 s,72 ℃ 90 s)。采用2-△△CT法分析mRNA的相对表达量。

2 结 果
2.1 TRPV4的表达 显微镜下可见组织块边缘爬出的细胞呈梭形,细胞融合后呈典型的“谷”、“峰”状生长。使用平滑肌细胞特异的α-actin免疫荧光染色鉴定细胞,可在Confocal镜下观察到95%以上的细胞胞浆呈绿色丝状、条状荧光(见图1A、B)。证明培养的细胞是大鼠脑基底动脉的平滑肌细胞。qRT-PCR及Western blot结果显示(见图1C、D)自发性高血压大鼠BASMCs中TRPV4的表达明显高于对照组大鼠。
2.2 沉默TRPV4抑制细胞增殖 通过转染TRPV4 siRNA沉默SHR大鼠BASMCs中TRPV4的表达,采用Western blot检测转染效率。结果显示(见图2A),转染了TRPV4 siRNA可显著降低细胞中TRPV4的表达水平(P<0.05)。CCK-8检测TRPV4沉默后的细胞活力,结果显示(见图2B),沉默TRPV4后,细胞活力显著低于阴性对照组(P<0.05)。进一步采用流式细胞术检测细胞的周期分布,结果所示(见图2C),沉默TRPV4后,G0/G1期的细胞所占百分比增加至86.52%±4.86%(P<0.05),S期细胞所占百分比减少至8.39%±1.31%,说明沉默TRPV4可抑制SHR大鼠BASMCs周期由G0/G1期向S期转化。此外我们还检测了细胞周期相关蛋白的表达情况,结果显示(见图2D),沉默TRPV4后,cyclinD1及p-Rb的蛋白表达水平显著降低(P<0.05)。
2.3 沉默TRPV4促进细胞凋亡 采用流式细胞术AnnexinV/PI 双染法检测细胞的凋亡情况。结果显示(见图3A),沉默TRPV4后,早期凋亡率由14.57%±1.82%增加至37.78%±2.21%(P<0.05)。而中晚期细胞凋亡/细胞坏死率则由6.42%±1.19%增加至14.32%±1.23%。结果表明,沉默TRPV4可促进SHR大鼠BASMCs的凋亡。此外我们还检测了细胞凋亡相关蛋白的表达情况,结果显示(见图3B),沉默TRPV4后,抗凋亡蛋白Bcl-2的表达水平显著降低,而效应蛋白cleaved-caspase-3的表达则明显增加。
2.4 沉默TRPV4对AKT/GSK3β信号通路的影响 为进一步探讨沉默TRPV4抑制细胞增殖,并促进凋亡的可能作用机制,我们通过Western blot检测了增殖及凋亡相关信号通路AKT/GSK3β的表达情况。结果显示所示(见图4),沉默TRPV4后AKT及GSK3β蛋白的磷酸化水平均显著降低(P<0.05),提示沉默TRPV4可抑制AKT/GSK3β信号通路的活性。


图1 TRPV4的表达


图2 沉默TRPV4对细胞活力及周期的影响

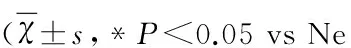
图3 沉默TRPV4对细胞凋亡的影响


3 讨 论
TRPV4是瞬时性受体电位通道超家族的一员,广泛表达于多种哺乳动物组织中,包括钙离子调控、炎症反应、纤维化及肿瘤等[10~12]。既往研究表明[13,14],TRPV4可表达于大鼠肺动脉平滑肌细胞,促进细胞迁移,并参与肺动脉重构。但探讨TRPV4与高血压及脑血管重构之间关系的研究较少,本研究检测了SHR大鼠脑基底动脉平滑肌细胞上TRPV4的表达情况。结果显示,相比于对照组,SHR大鼠BASMCs中TRPV4的表达明显升高。结果提示TRPV4可能参与调控自发性高血压大鼠脑基底动脉平滑肌细胞的生理功能。
本研究通过TRPV4 siRNA干扰SHR大鼠BASMCs中TRPV4的表达,以研究其具体功能。结果显示,沉默TRPV4可明显抑制SHR大鼠BASMCs细胞活力并抑制细胞周期由G0/G1期向S期转化,提示沉默TRPV4可抑制SHR大鼠BASMCs细胞增殖。细胞周期的G1/S转换主要受到D型周期素(cyclinD)的调控,cyclinD可通过与CDK结合形成复合物,促进Rb的磷酸化,促使细胞进入S期DNA复制[15,16]。故而我们检测了细胞中细胞周期相关蛋白cyclinD1及p-Rb的表达,结果显示沉默TRPV4后,细胞中cyclinD1及磷酸化视网膜母细胞瘤(phosphorylation retinoblastoma,p-Rb)的蛋白表达水平显著降低。说明TRPV4可通过细胞周期相关因子来调控细胞周期。进一步采用流式细胞术检测细胞凋亡情况,结果还显示沉默TRPV4可促进SHR大鼠BASMCs的凋亡,且抗凋亡蛋白Bcl-2的表达水平显著降低,而效应蛋白cleaved-caspase-3的表达则明显增加。
离子通道对于细胞增殖及凋亡的影响通常是通过相关的信号通路来发挥作用的,如:有丝分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、MAPK系统激活因子(MAPKKK,Raf)/细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)、磷脂酰肌醇(-3)激酶、磷脂酰肌醇3 激酶(phosphatidylinositol 3 kinase,PI-3K)/蛋白激酶B(protein kinase B,PKB)等在细胞周期及细胞凋亡的调节中发挥重要作用[17~19]。本研究发现,沉默TRPV4后AKT及GSK3β蛋白的磷酸化水平均显著降低,提示沉默TRPV4可抑制AKT/GSK3β信号通路的活性。因此推测新型钙离子通道TRPV4可能通过AKT/GSK3β通路调控细胞的增殖及凋亡,但具体机制仍需进一步深入研究。
综上所述,沉默TRPV4能够抑制自发性高血压大鼠BASMCs细胞增殖,同时促进细胞凋亡,机制可能与抑制AKT/GSK3β信号通路的激活有关,所以新型钙离子通道TRPV4可为今后靶向诊疗高血压脑血管疾病提供依据。
[1]Lackland DT,Voeks JH,Boan AD.Hypertension and stroke: an appraisal of the evidence and implications for clinical management[J].Expert Rev Cardiovasc Ther,2016,14(5):609-616.
[2]Aronow WS.Hypertension-related stroke prevention in the elderly[J].Curr Hypertens Rep,2013,15(6):582-589.
[3]Shimoda LA,Laurie SS.Vascular remodeling in pulmonary hypertension[J].J Mol Med (Berl),2013,91(3):297-309.
[4]Batchu SN,Korshunov VA.Novel tyrosine kinase signaling pathways: implications in vascular remodeling[J].Curr Opin Nephrol Hypertens,2012,21(2):122-127.
[5]Li MX,Jiang DQ,Wang Y,et al.Signal mechanisms of vascular remodeling in the development of pulmonary arterial hypertension[J].J Cardiovasc Pharmacol,2016,67(2):182-190.
[6]Watanabe H,Murakami M,Ohba T,et al.TRP channel and cardiovascular disease[J].Pharmacol Ther,2008,118(3):337-351.
[7]Wang M,Tang YB,Ma MM,et al.TRPC3 channel confers cerebrovascular remodelling during hypertension via transactivation of EGF receptor signalling[J].Cardiovasc Res,2016,109(1):34-43.
[8]Kanju P,Liedtke W.Pleiotropic function of TRPV4 ion channels in the central nervous system[J].Exp Physiol,2016,101(12):1472-1476.
[9]Shibasaki K.TRPV4 ion channel as important cell sensors[J].J Anesth,2016,30(6):1014-1019.
[10]Dunn KM,Hill-Eubanks DC,Liedtke WB,et al.TRPV4 channels stimulate Ca2+-induced Ca2+release in astrocytic endfeet and amplify neurovascular coupling responses[J].Proc Natl Acad Sci USA,2013,110(15):6157-6162.
[11]Kanju P,Chen Y,Lee W,et al.Small molecule dual-inhibitors of TRPV4 and TRPA1 for attenuation of inflammation and pain[J].Sci Rep,2016,6:26894.
[12]Thoppil RJ,Cappelli HC,Adapala RK,et al.TRPV4 channels regulate tumor angiogenesis via modulation of Rho/Rho kinase pathway[J].Oncotarget,2016,7(18):25849-25861.
[13]Parpaite T,Cardouat G,Mauroux M,et al.Effect of hypoxia on TRPV1 and TRPV4 channels in rat pulmonary arterial smooth muscle cells[J].Pflugers Arch,2016,468(1):111-130.
[14]Martin E,Dahan D,Cardouat G,et al.Involvement of TRPV1 and TRPV4 channels in migration of rat pulmonary arterial smooth musclecells[J].Pflugers Arch,2012,464(3):261-272.
[15]Dubey RK,Fingerle J,Gillespie DG,et al.Adenosine attenuates human coronary artery smooth muscle cell proliferation by inhibiting multiple signaling pathways that converge on cyclin D[J].Hypertension,2015,66(6):1207-1219.
[16]Kong BS,Im SJ,Lee YJ,et al.Vasculoprotective effects of 3-hydroxybenzaldehyde against VSMCs proliferation and ECs inflammation[J].PLoS One,2016,11(3):e0149394.
[17]Zhang W,Shu C,Li Q,et al.Adiponectin affects vascular smooth muscle cell proliferation and apoptosis through modulation of the mitofusin-2-mediated Ras-Raf-Erk1/2 signaling pathway[J].Mol Med Rep,2015,12(3):4703-4707.
[18]Zhang Y,Zhang T,Wu C,et al.ASIC1a mediates the drug resistance of human hepatocellular carcinoma via the Ca2+/PI3-kinase/AKT signaling pathway[J].Lab Invest,2017,97(1):53-69.
[19]Fang X,Chen X,Zhong G,et al.Mitofusin 2 downregulation triggers pulmonary artery smooth muscle cell proliferation and apoptosis imbalance in rats with hypoxic pulmonary hypertension via the PI3K/Akt and mitochondrial apoptosis pathways[J].J Cardiovasc Pharmacol,2016,67(2):164-174.
Effect of TRPV4 on the proliferation and apoptosis of basilar arterial smooth muscle cells
FENG Hui,ZANG Li,ZHAO Zhen-xia.
(No.5 Department of Neurology,First Affiliated Hospital of Xinxiang Medical University,Xinxiang 453100,China)
Objective To study the expression and effect of a novel calcium channel TRPV4 on the proliferation and apoptosis of BASMCs in spontaneous hypertension rat(SHR).Methods The expression of TRPV4 in BASMCs was checked by qRT-PCR and Western blot assay.TRPV4 siRNA was used to block TRPV4 channel in BASMCs.Cell survival was determined by the CCK-8 assay,while cell cycle and apoptosis was detected by flow cytometry.The expressions of cyclinD1,p-Rb,bcl-2,cleaved-caspase-3/caspase-3,p-AKT/AKT,p-GSK3β/GSK3β proteins were detected by Western blot.Results qRT-PCR and Western blot showed that the expression of TRPV4 was markedly increased in BASMCs of SHR compared to (WKY).Cell viability decreased after transfected with TRPV4 shRNA in BASMCs of SHR,while cell cycle arrest and apoptosis were induced.Furthermore,the expression of cyclinD1,p-Rb,Bcl-2,p-AKT,p-GSK3β protein were down-regulated and the expression of cleaved-caspase-3 protein was up-regulated.Conclusion Block of TRPV4 in BASMCs of SHR could inhibit cell proliferation andpromote cell apoptosis.The mechanism may be related to the inhibition of AKT/GSK3 β pathway.So the new calcium ion channel TRPV4 provided a new target for diagnosis and therapy of hypertensive encephalopathy.
TRPV4; Basilar arterial smooth muscle cells; Cell proliferation and apoptosis; AKT/GSK3β pathway
2017-04-12;
2017-05-30
河南卫计委项目(201602154)资助
(新乡医学院第一附属医院神经内五科,河南 新乡 453100)
冯 辉,E-mail:xyfenghui@126.com
1003-2754(2017)08-0721-04
R773.3
A

