无醛固定液与醛类固定液对细胞核DNA及细胞质着色的影响
黄荣祥,余岚岚,朱晨雁,马 亮,聂 琨,何文波
(福建省厦门麦克奥迪医学检验所 361006)
无醛固定液与醛类固定液对细胞核DNA及细胞质着色的影响
黄荣祥,余岚岚,朱晨雁,马 亮,聂 琨,何文波
(福建省厦门麦克奥迪医学检验所 361006)
目的 旨在探究无醛固定液与醛类固定液对细胞核DNA及细胞质着色的影响。方法 通过运用DNA定量分析系统(ICM)对分别经过8种不同固定液固定的细胞核DNA含量(IOD)、离散系数(CV)、DNA指数(DI)、细胞核面积进行测量,联合细胞学染色,分析不同固定液对核DNA及细胞质染色的影响。结果 醛类固定液优于无醛固定液,固定液中的甲醛对Feulgen-eosin联合染色有重要影响。结论 采用醛类固定液进行后固定,硫堇对细胞核DNA染色,与细胞学染色相结合,获得了良好的染色效果,为后续的多技术联合诊断提供依据。
病理学;定量;图像细胞测定;细胞,固定化;DNA
自从1924年Feulgen和Rossenbeck等建立了DNA-Feulgen染色法以来,Feulgen染色法仍然是DNA定量测定金标准[1]。DNA定量测定既能反映细胞生长、分化及癌前病变,又能判断肿瘤性质、预后等情况[2-4]。因此,国内外很多医院、实验室已经广泛开展[5-7]。这就决定了Feulgen反应的每个环节有着非常苛刻的要求。液基标本一放入细胞保存液就会被固定,大部分固定效果都由这一步实现,称之为标本的前固定。本实验对Feulgen反应后固定环节进行探讨,选用病理学中最常用的10%甲醛生理盐水、甲醛-乙酸-乙醇混合固定液(AAF)、乙酸、乙醇、甲醇、丙酮、15%聚乙二醇及玻姆-施普伦格(Bohm-Sprenger)固定液作为后固定,通过Feulgen染色后,在全自动细胞图像分析系统中对细胞核DNA含量(IOD)、离散系数(CV)进行测量计算,并对细胞质进行伊红染色,比较不同固定液对染色的影响,遴选出适合细胞核DNA及细胞质染色的固定液,为Feulgen联合细胞学染色提供技术参考。
1 材料与方法
1.1 材料与试剂
1.1.1 标本来源 选用厦门麦克奥迪医学检验所病理细胞室2015年8月至2016年1月,符合实验要求的妇科宫颈新鲜标本。
1.1.2 主要试剂 10%甲醛生理盐水(10 mL甲醛+90 mL生理盐水);AAF固定液(10 mL甲醛+5 mL乙酸+85 mL 75%乙醇);乙酸(AR级)、乙醇(AR级)、甲醇(AR级)、丙酮(AR级)、15%聚乙二醇(15 g 聚乙二醇+100 mL蒸馏水)、Bohm-Sprenger固定液(80 mL甲醇+15 mL甲醛+5 mL乙酸);其余试剂由厦门麦克奥迪医疗诊断系统有限公司提供;
1.1.3 仪器设备 MotiCytometer细胞DNA定量分析系统(ICM),由厦门麦克奥迪医疗诊断系统有限公司提供。
1.2 方法
1.2.1 制片 采用自然沉降法制片。将细胞保存瓶在震荡器上震荡混匀;往离心管中加入8 mL标本;800×g离心5 min,弃上清;加入2 mL PBS缓冲液稀释细胞沉淀,震荡混匀;转移0.5~1.0 mL细胞混悬液至沉降仓中,沉降10 min;吸弃沉降仓中残液。
1.2.2 后固定 室温条件下,将8组来自同一宫颈刷取物的液基细胞片分别放入无醛固定液组(乙酸、乙醇、甲醇、丙酮、15%聚乙二醇)和醛类固定液组(10%甲醛生理盐水、AAF、Bohm-Sprenger固定液)固定50 min。未进行后固定处理作空白对照。
1.2.3 染色 (1)Feulgen染色:上述固定后的液基细胞片依次进行后续的酸解、染色、漂洗、脱水、透明,步骤见表1。(2)Feulgen-eosin联合染色:按表1进行Feulgen染色,脱水至95%乙醇后,置eosin染色数分钟,无水乙醇脱水,二甲苯透明,封片。
1.2.4 评价 使用MotiCytometer细胞DNA定量分析系统对染色后的细胞DNA片进行扫描。该系统通过显微镜上的高精度CCD摄像头采集细胞核图像,并借助图像定量分析软件对细胞核图像进行数字化转换,同时对多个细胞参数进行分析计算,自动对细胞进行识别分类。评价指标,IOD:表示细胞核DNA的积分光密度值,即细胞核DNA含量;DNA指数(DNA index,DI ),DI=(被测细胞DNA-IOD值)/(正常2c细胞DNA-IOD平均值),当DI=1,代表该细胞为正常2倍体(2c);CV:表示同一细胞片各细胞DNA含量测定时的差别,CV=标准差/均值×100%。

表1 Feulgen染色流程
染色后的玻片保存于阴凉处;RT为室温
2 结 果
2.1 固定液比较 从图1结果显示,室温下8种固定液50 min内的固定效果差异显著,醛类固定液组的IOD值均高于无醛固定液组及空白对照组。固定液对细胞核染色后的CV有不同程度的影响,各处理组的细胞群CV差异见图2,醛类固定液组的细胞群较为集中分布,所测CV值均小于无醛固定液组。综合IOD和细胞核CV值,无醛固定液组与空白对照组无差异,提示醛对细胞核DNA染色起至关重要的作用。
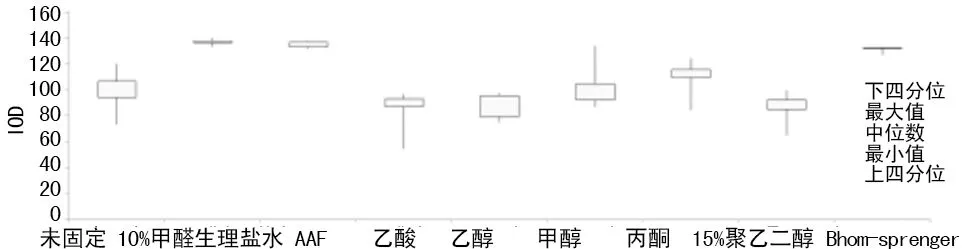
图1 8种固定液对细胞核IOD的影响
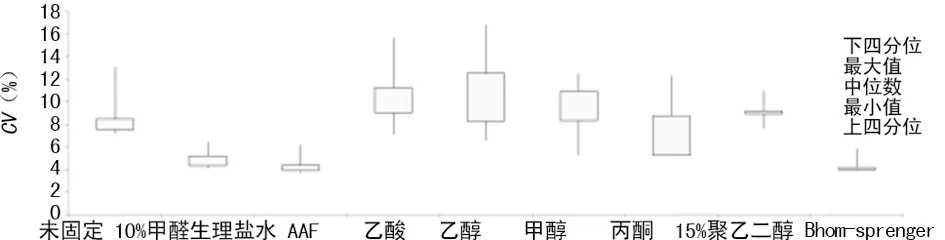
图2 8种固定液对细胞核CV值的影响
2.2 DI-细胞核面积散点图绘制 室温条件下,采用8种固定液对宫颈刷取物中的宫颈细胞进行相同时间的固定。无醛固定液固定的标本,峰型较粗(图3A~F),无论细胞核面积大小,均有较多的细胞DI值偏离1,提示DNA染色效果差,染色不均,DNA丢失或非特异性着色增强;经醛类固定液固定的标本,峰型较细(图3G~I),较为集中,DNA染色效果较好。结果表明,醛类能有效固定DNA,明显提高染色的特异性。
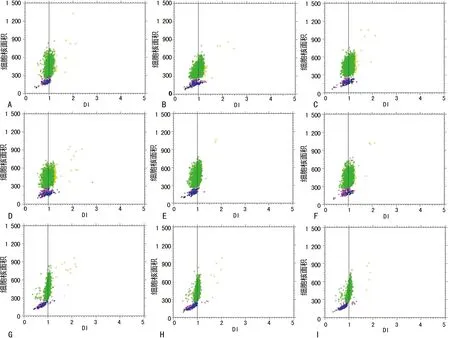
A:未固定组;B:乙酸组;C:乙醇组;D:甲醇组;E:丙酮组;F:15%聚乙二醇组;G:10%甲醛生理盐水组;H:AAF组;I:BS组
图3 各固定液组DI-细胞核面积散定图
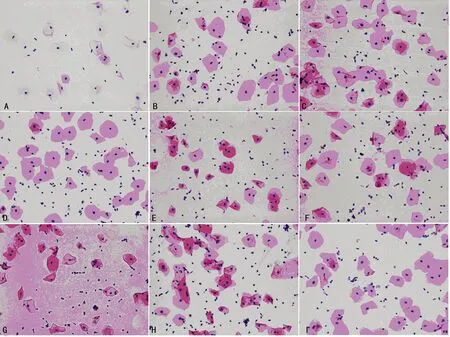
A:未固定组;B:10%甲醛生理盐水组;C:AAF组;D:Bohm-Sprengr组;E:乙酸组;F:乙醇组;G:甲醇组;H:丙酮组;I:15%聚乙二醇组
图4 各固定液组细胞形态(×200)
2.3 固定后的细胞形态 采用Feulgen染色法对细胞核染色,伊红对细细胞质进行染色。醛类固定液组Feulgen-eosin联合染色核浆对比清晰,核浆形态正常,与未固定组区别明显(表2,图4A~D)。无醛固定液组细胞核着色整体略淡,细胞质着色正常,染色对比度清晰,乙酸、乙醇、15%聚乙二醇固定组细胞核肿胀,除15%聚乙二醇外,其余细胞质形态正常(表2,图4E~I)。
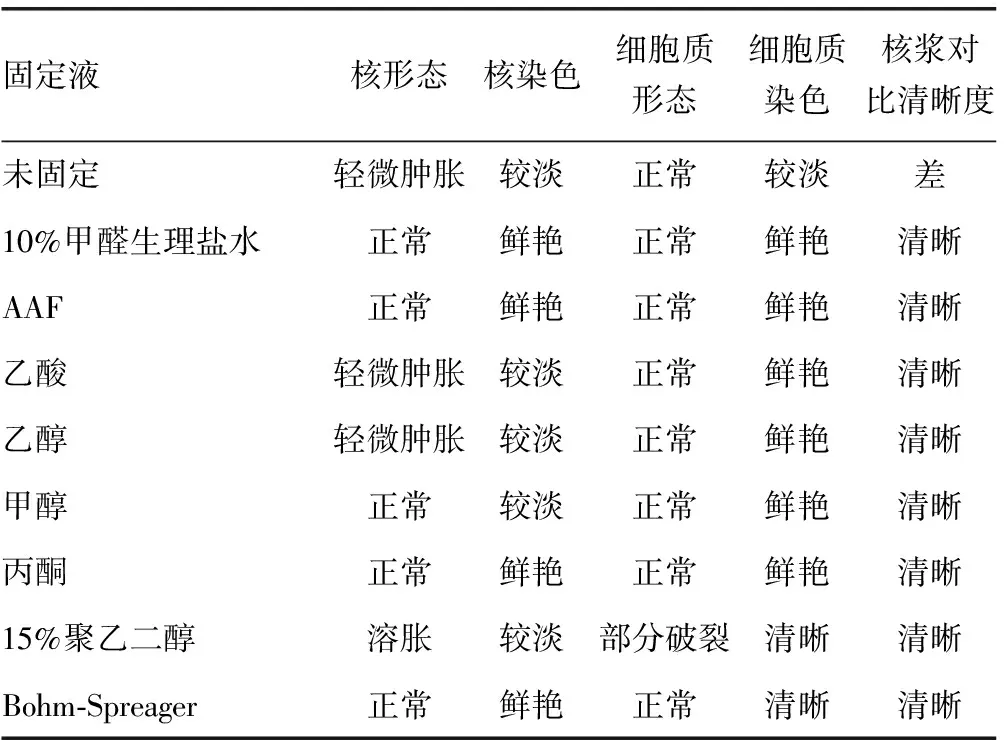
表2 8种固定液对宫颈细胞核、浆染色效果比较
3 讨 论
目前,病理上使用的固定液种类繁杂多样,大多通过苏木素-伊红(HE)或者巴氏染色的评价来选择适宜固定、保存病理标本的固定液[8-13]。病理医师往往根据这些评价结果,来选择Feulgen反应固定液,对固定液没有进行特异性的严格、科学的筛选,进而影响Feulgen反应效能,间接影响病理诊断结果的准确性。好的固定液既能在不破坏细胞原有形态的情况下,以最快的速度达到最理想的固定效果。甲醛渗透性较强,固定均匀,组织收缩轻微,与蛋白质分子交联,形成不溶性产物,使DNA更好地固定在蛋白质上;乙醇用于糖原、纤维蛋白及弹性纤维的固定,渗透力较甲醛弱,组织收缩力较强,能凝固清蛋白,球蛋白和核蛋白,使DNA对盐酸保持高敏感性;乙酸渗透性强,组织膨胀较明显,能沉淀核蛋白,因此染色质固定很快,可较好地保持染色体结构,是染色质良好的固定液。甲醇渗透性强,组织收缩力较乙醇小,固定细胞质效果好,与乙酸结合,能使细胞形态不变[12,14]。丙酮对组织穿透性强,细胞收缩力强,使蛋白质发生凝结。因此,本文选用10%甲醛生理盐水、AAF、乙酸、乙醇、甲醇、丙酮、15%聚乙二醇及Bohm-Sprenger固定液作为评价对象,DNA定量分析系统对观测结果进行定量的评价。固定后的细胞核DNA可在酸性条件下水解,嘌呤碱基与脱氧核糖之间的糖苷键断开,使DNA链暴露出醛基,此时特异性染料与游离醛基一对一地结合,形成具有特定颜色的反应产物,DNA定量分析系统根据颜色深浅将反应产物含量数字化,数字化后的平均IOD值即为细胞片上所有细胞核DNA含量的平均值。平均IOD值越高, DNA含量越高,提示固定的效果越好。CV越小,散点图分布越窄,提示着色特异性越强。
实验结果表明,单一固定液要使细胞固定后达到Feulgen染色要求是比较困难的。因此,在提高细胞核DNA测定含量上,混合固定液表现较好。结合细胞质染色,Feulgen-eosin联合染色首选醛类固定液10%甲醛生理盐水、AAF、Bohm-Sprenger固定液中的一种。
后固定对Feulgen染色是有作用的,可以影响细胞核大小,以及DNA对酸和染料的接触。散点图上的“J”形细胞分布是由不完全染色引起的。大的细胞核被完全染色,小的细胞核只有部分被染色,过小的细胞核不利于细胞核DNA含量的测定[15-16]。醛类固定液中的甲醛对染色有影响。甲醛的含量会影响染色深浅和细胞核大小。但是,甲醛会与硫堇结合,破坏硫堇染色,使染出的颜色偏黄绿色,并产生沉淀。因此,细胞片进入染液之前,要把固定液彻底冲洗干净,避免固定液污染硫堇染液。
综上,根据细胞核的结构特点,采用醛类固定液进行后固定,硫堇对细胞核DNA染色,与细胞学染色相结合,获得了良好的染色效果,为后续的多技术联合诊断提供依据。此外,DNA定量分析系统(DNA-ICM)能测定多种细胞核形态参数,如球形度、偏心率、核致密度等。这些大数据有待科学工作者进一步挖掘,以广泛、深入了解不同固定液的作用机制。
[1]Biesterfeld S,Beckers S,Del Carmen Villa Cadenas M,et al.Feulgen staining remains the Gold standard for precise DNA image cytometry[J].Anticancer Res,2011,31(1):53-58.
[2]Barlogie B,Drewinko B,Schumann J,et al.Cellular DNA content as a marker of neoplasia in man[J].Am J Med,1980,69(2):195-203.
[3]Bremmer JF,Brakenhoff RH,Broeckaert MA,et al.Prognostic value of DNA ploidy status in patients with oral leukoplakia[J].Oral Oncol,2011,47(10):956-960.
[4]Collin F,Salmon I,Rahier I,et al.Quantitative nuclear cell image analyses of thyroid tumors from archival material[J].Hum Pathol,1991,22(2):191-196.
[5]韩永良,涂露霞,王洁.常规细胞学与DNA定量分析联合诊断在宫颈CINⅢ及以上级别病变中的应用[J].诊断病理学杂志,2015,22(10):631-633,650.
[6]王春兰,仲玉英,耿建祥,等.967例女性宫颈细胞DNA定量检测的临床研究[J].中国妇幼保健,2015,30(29):4959-4962.
[7]苏杰,陶伟,张培,等.细胞DNA定量分析技术在尿路上皮癌诊断中的应用价值[J].实用医学杂志,2016,32(5):750-753.
[8]孙海梅,尚宏伟,张立新,等.不同固定液对大鼠脾石蜡切片HE染色标本的影响[J].中国医学装备,2011,8(10):48-50.
[9]李晶晶,朱鸿,施彩虹.三种方法对大鼠视网膜固定效果的比较研究[J].上海交通大学学报(医学版),2011,31(8):1105-1107.
[10]杨群,胥维勇,何娟,等.不同固定液冷冻切片HE染色质量的对比观察[J].实用医院临床杂志,2010,7(3):69-70.
[11]万鸿飞,周全,张盛忠,等.固定时间对不同组织染色的影响[J].诊断病理学杂志,2011,18(6):476.
[12]刘成龙,余琦,周会芹,等.7种固定液对冷冻组织切片固定效果的比较[J].诊断病理学杂志,2010,17(2):138.
[13]黄宏森,张超,郭晓珍,等.不同固定液及固定时间对小鼠肝组织结构的影响[J].广州医学院学报,2007,35(2):65-68.
[14]郭志杰.病理制片中固定液的选择[J].中国医药导报,2009,6(6):146,149.
[15]魏清柱,夏潮涌,黄中新,等.光衍射现象对细胞核DNA含量检测的影响[J].中国体视学与图像分析,2001,6(2):78-82.
[16]魏清柱,夏潮涌,刘江欢.染色质浓缩对细胞核DNA含量检测的影响[J].中国体视学与图像分析,2007,12(2):123-125.
Effects of aldehyde-free fixation solution and aldehyde fixation solution on the nucleus DNA and cytoplasm staining
HuangRongxiang,YuLanlan,ZhuChenyan,MaLiang,NieKun,HeWenbo
(XiamenMoticMedicalLaboratory,Xiamen,Fujian361006,China)
Objective To investigate the effect of aldehyde-free fixation solution and aldehyde fixation solution on DNA and cytoplasm of nucleus.Methods The DNA quantification (IOD),discrete coefficient (CV),DNA index (DI) and nucleus area (area) were measured by DNA quantification system (ICM) in 8 different fixation solution;combined with cytological staining,the effects of different fixative solution on nuclear DNA and cytoplasmic staining were analyzed.Results Aldehyde fixation solution was better than aldehyde free fixation solution,the formaldehyde in fixtion solution has important influence on Feulgen-eosin staining.Conclusion Aldehyde fixation solution combined with cytological staining can obtained good dyeing effect,which provides the basis for the subsequent multi-technique joint diagnosis.
pathology;quantitative;image cytometry;cells,immobilized;DNA
黄荣祥(1986-),本科,主要从事病理细胞学研究。
10.3969/j.issn.1671-8348.2017.23.023
R361+.3
A
1671-8348(2017)23-3241-04
2016-01-10
2017-03-10)
·技术与方法·

