Notch信号通路在大鼠骨髓间充质干细胞移植后促进脑缺血区血管新生过程中的作用
刘 琦 魏璐珊 王 颖 杨玉生 鲁雅琴
(兰州大学第一医院康复科,甘肃 兰州 730000)
Notch信号通路在大鼠骨髓间充质干细胞移植后促进脑缺血区血管新生过程中的作用
刘 琦 魏璐珊 王 颖1杨玉生 鲁雅琴1
(兰州大学第一医院康复科,甘肃 兰州 730000)
目的探讨Notch1信号通路在骨髓间充质干细胞(MSCs)移植后促进脑缺血区血管新生过程中的作用。方法分离、培养SD大鼠MSCs,制作大鼠大脑中动脉栓塞(MCAO)模型,将试验分为正常组、脑缺血后MSCs移植组、脑缺血后MSCs移植+rhNF-κB组、脑缺血对照组。脑组织冰冻切片行Ⅷ因子免疫组织荧光染色检测各试验组MSCs移植1、4、7、14 d后缺血皮质区微血管数量。Western印迹检测各试验组MSCs移植1、4、7、14 d后缺血皮质区血管内皮生长因子(VEGF)165、Notch1、Hes1蛋白表达。结果缺血对照组、MSCs移植组和MSCs移植+rhNF-κB组在各时间点微血管数量及VEGF165、Notch1、Hes1蛋白表达均显著高于正常组,从第14天起开始下降,3组的微血管数量及VEGF165、Notch1、Hes1蛋白表达依次上升,差异显著(P<0.01)。结论MSCs移植可促进缺血区新生血管的形成,并可通过激活Notch信号通路促进缺血皮质区VEGF165的表达,从而促进缺血区的血管新生。
Notch1信号通路;骨髓间充质干细胞;移植;脑缺血;血管新生
骨髓间充质干细胞(MSCs)是存在于骨髓间质中的非造血干细胞,具有很强的增殖能力和多向分化潜能〔1〕。此外,MSCs还能分泌血管内皮生长因子(VEGF)、碱性成纤维细胞生长因子(FGF)-2等多种细胞因子和生长因子,对周围组织和细胞起支持作用〔2〕。研究显示,将MSCs移植到缺血损伤大鼠体内,缺血区新生血管的数量增多,并能促进脑缺血损伤神经功能的恢复〔3〕,MSCs对脑缺血具有重要影响。Notch信号通路对血管新生的作用已受到广泛关注〔4〕,但如何影响MSCs从而使脑缺血区血管新生的作用尚不清楚。本研究建立大脑中动脉栓塞(MCAO)模型,研究Notch信号通路在MSCs移植后促进脑缺血区血管新生过程中的作用。
1 材料与方法
1.1实验动物、试剂和仪器 SPF级SD雌性大鼠40只,体重240~280 g,用于脑缺血模型的制作;雄性SD大鼠10只,体重90~140 g,用于MSCs的分离培养试验。由兰州大学实验动物中心提供。胎牛血清、DMEM培养基、胰酶、青链霉素均购自美国Gibco公司;兔抗鼠Ⅷ因子多克隆抗体购自福州迈新生物技术开发有限公司;小鼠抗大鼠Notch1抗体购自美国Chemicon公司;兔抗大鼠VEGF抗体购自上海长嘉生物科技有限公司;兔抗大鼠Hes1抗体购自武汉武士得生物技术有限公司;辣根过氧化物标记的羊抗鼠IgG购自美国Abcam公司;组织蛋白提取试剂盒购自北京普利莱基因技术有限公司;二喹啉甲酸(BCA)蛋白分析试剂盒购自美国Pierce公司;CO2细胞培养箱购自美国Thermo公司;倒置荧光显微镜购自日本Olympus公司。
1.2MSCs细胞的分离培养 取出用于MSCs分离培养的SD大鼠,分离两侧的股骨,充分暴露出骨髓腔,用DMEM培养基反复冲洗骨髓腔,将骨髓悬液过滤并离心后,弃掉上清,重悬细胞后移至培养瓶中,置于37℃、95%相对湿度、5% CO2细胞培养箱中培养。培养24 h后去掉未贴壁细胞,更换培养液,之后每3天换液1次,细胞生长融合度达到80%~90%时进行传代培养。取第4代 MSCs用于实验研究。
1.3MCAO模型的建立 参照改良的Zea Longa制作MCAO模型。简要步骤:抓取用于制作模型的大鼠,置于天平上称重,按照1 ml/100 g腹腔注射4%的水合氯醛麻醉,于固定板上固定头和四肢,充分暴露头部,剪掉颈部毛发,取颈部正中切口,显微镜下分离暴露出颈前部肌群,在右侧胸锁乳突肌和颈前部肌群间分离暴露出右侧颈总动脉、颈内动脉和颈外动脉。将颈外动脉远心端与颈总动脉近心端结扎,动脉夹夹闭颈内动脉。在颈外动脉近心端剪一“V”形切口,将一特制的4~0线栓经颈总动脉顺利进入颈内动脉,插入长度约距离颈总动脉18 mm处。固定线栓,用00号线缝合皮下组织,进行简单的包扎。1 h后拔线,缝合颈部切口。术后喂四环素水,预防感染。
1.4MCAO瘫痪程度评分 动物麻醉清醒后,参照经典的Zea Longa法(5级4分法)进行神经功能缺损评分。0分:无神经缺损症状;1分:不能伸展对侧前爪;2分:行走时向左转圈;3分:行走时向左侧跌倒;4分:不能自发行走或意识丧失。1~3分者为研究对象。神经损伤太重或太轻的老鼠舍去。
1.5试验分组 (1)正常组;(2)脑缺血后MSCs移植组:模型制作24 h后,将培养至第4代 MSCs细胞通过股静脉匀速注入。MSCs移植组又分为移植1、4、7、14 d;(3)脑缺血后MSCs移植组+rhNF-κB组:细胞生长至80%~90%时,向细胞中加入1 μg/ml rhNF-κB,再按(2)的方法移植;(4)脑缺血对照组。按MSCs移植组操作方法注入0.01 mol/L磷酸盐缓冲液(PBS)。
1.6微血管密度(MVD)检测 随机选择各实验组各时间点每只脑组织冰冻切片5张,用免疫组织荧光染色法行Ⅷ因子检测。MVD计数按照每单个内皮细胞或内皮簇为一个血管计数,每个标本取2~3张切片,每张切片在低倍显微镜下选择同一皮质缺血区的5个血管内皮细胞染色密集区,在200倍显微镜下对微血管进行计数,取均值作为微血管密度。
1.7Western印迹检测VEGF165、Notch1、Hes1蛋白表达 按照组织蛋白提取试剂盒提取大鼠缺血区脑组织中的总蛋白,按照BCA试剂盒说明测定提取的蛋白浓度。将各组蛋白样品与上样缓冲液按照1∶1的比例充分混匀,十二烷基硫酸钠-聚丙烯酰胺凝胶SDS-PAGE电泳分离,4℃转膜过夜。取出聚偏氟丙稀(PVDF)膜用5 %脱脂奶粉封闭1 h后,以VEGF165、Notch1、Hes1抗体作为一抗(1∶500稀释),4℃孵育过夜,Tris盐酸缓冲液(TBST)清洗后加入辣根过氧化物酶标记的二抗(1∶1 000稀释),37℃孵育2 h,TBST清洗后加入增强化学发光法(ECL)发光剂显影,自动凝胶成像系统采集图像。以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参,分析蛋白表达水平。
1.8统计学方法 应用SPSS22.0软件进行t检验、方差分析。
2 结 果
2.1各组不同时间点大鼠缺血皮质区微血管计数 缺血对照组、MSCs移植组和MSCs移植+rhNF-κB组在1、4、7、14 d微血管数均显著高于正常组,从第14天起3个组微血管数开始下降,且在各个时间点依次上升,差异显著(P<0.01)。见表1。
2.2MSCs移植及Notch1信号通路对缺血皮质区VEGF165、Notch1、Hes1蛋白表达的影响 缺血对照组、MSCs移植组和MSCs移植+rhNF-κB组在各时间点VEGF165、Notch1、Hes1蛋白表达均显著高于正常组,从第14天起开始下降,3组在各个时间点依次上升,差异显著(P<0.01)。见图1,表2~表4。
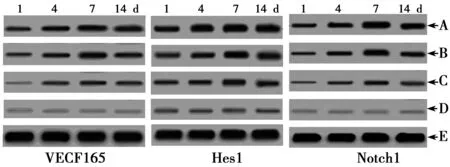
A:MSCs移植+rhNF-κB组;B:MSCs移植组;C:缺血对照组;D:正常对照组;E:GAPDH图1 MSCs移植及Notch1信号通路对缺血皮质区VEGF165、Notch1、Hes1蛋白表达的影响

组别1d4d7d14d正常组2 45±0 182 46±0 202 49±0 262 52±0 25缺血对照组3 48±0 621)4 84±0 411)5 42±0 691)4 78±0 471)MSCs移植组4 63±0 641)2)5 56±0 681)2)8 48±0 841)2)6 87±0 561)2)MSCs移植+rhNF⁃κB组6 26±0 721)2)3)7 43±0 761)2)3)11 84±0 751)2)3)7 83±0 611)2)3)
与正常组比较:1)P<0.05;与缺血对照组比较:2)P<0.05;与MSCs移植组比较:3)P<0.05;下表同
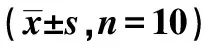
表2 各组不同时间点VEGF165蛋白表达
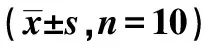
表3 各组不同时间点Notch1蛋白表达
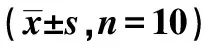
表4 各组不同时间点Hes1蛋白表达
3 讨 论
MSCs移植后促进脑缺血新生血管生成的作用机制尚不清楚。Notch信号通路的激活对胚胎、成体肿瘤等组织的血管新生有调控作用〔5〕。MSCs移植后是否激活了Notch信号通路从而影响脑缺血血管新生的作用还有待进一步探讨。
血管新生是血管内皮细胞通过分裂增殖形成血管的过程,是主要的形成血管的方式。目前发现的促血管生成因子有VEGF家族、FGF家族、血管新生素等。研究显示,慢性心肌缺血后VEGF的表达水平明显上调,从而促进缺血区新生血管的形成〔6〕。将MSCs移植到脑缺血大鼠体内后,可发现VEGF的表达水平明显高于对照组,且微血管的数量及血液灌输量明显增多〔6〕。VEGF对血管新生具有重要调控作用,其中的VEGF165作用最为明显〔7〕。本研究结果这说明移植MSCs能通过上调VEGF165表达促进新生血管的形成。随着对血管新生有关的信号通路研究的不断深入,研究者发现Notch、JAK/STAT、WNT等信号通路均能调控血管新生,其中Notch信号通路的调控作用最明显〔8〕。Notch信号通路是一个高度保守的信号调节系统,对细胞的增殖、分化和成熟有重要作用,该信号系统由Notch配体、Notch和CSL等组成。Notch的配体包括Jagged-1、Jagged-2、Deltalike-1、Deltalike-2、Deltalike-3、Deltalike-4。Notch受体与Jagged-1配体结合后,Notch蛋白被γ-分泌酶切割,释放出胞内的活性片段NICD,NICD进入细胞核后可与Maml家族的激活因子及DNA结合蛋白CSL结合从而形成起始转录复合物,启动Hes、Hey基因家族靶基因的转录,作为下游基因Math-1等的阻遏子发挥作用〔9,10〕。在小鼠缺血模型中过表达Notch1,发现缺血区微血管数量及血液灌输量明显高于单纯性损伤组〔11~13〕。这说明调控Notch信号通路可促进缺血区微血管增加。本研究结果说明移植MSCs能通过上调Notch1和Hes1蛋白表达促进血管新生,同时移植MSCs和rhNF- κB作用更明显。
1Zhao Q,Gregory CA,Lee RH,etal.MSCs derived from iPSCs with a modified protocol are tumor-tropic but have much less potential to promote tumors than bone marrow MSCs〔J〕.Proc Nat Acad Sci,2015;112(2):530-5.
2Bhoj M,Zhang C,Green DW.A first step in de novo synthesis of a living pulp tissue replacement using dental pulp MSCs and tissue growth factors,encapsulated within a bioinspired alginate hydrogel〔J〕.J Endod,2015;41(7):1100-7.
3Chang HK,Kim PH,Cho HM,etal.Inducible HGF-secreting human umbilical cord blood-derived MSCs produced via TALEN-mediated genome editing promoted angiogenesis〔J〕.Mol Ther,2016;24(9):1644-54.
4Kerr G,Sheldon H,Chaikuad A,etal.A small molecule targeting ALK1 prevents Notch cooperativity and inhibits functional angiogenesis〔J〕.Angiogenesis,2015,18(2):209-17.
5Nedvetsky PI,Zhao X,Mathivet T,etal.cAMP-dependent protein kinase A(PKA)regulates angiogenesis by modulating tip cell behavior in a Notch-independent manner〔J〕.Development,2016;143(19):3582-90.
6Yu K,Wu S,Li H.A chitosan-graft-PEI-eprosartan conjugate for cardiomyocyte-targeted VEGF plasmid delivery in myocardial ischemia gene therapy〔J〕.J Exp Nanosci,2016;11(2):81-96.
7Yang J,Gao F,Zhang Y,etal.Buyang huanwu decoction(BYHWD)enhances angiogenic effect of mesenchymal stem cell by upregulating VEGF expression after focal cerebral ischemia〔J〕.J Mol Neurosci,2015;56(4):898-906.
8Tsai JL,Lee YM,Pan CY,etal.The Novel VEGF121-VEGF165 fusion attenuates angiogenesis and drug resistance via targeting VEGFR2-HIF-1α-VEGF165/Lon signaling through PI3K-AKT-mTOR pathway〔J〕.Curr Cancer Drug Targ,2016;16(3):275-86.
9Ambasta RK.Molecular signalling saga in tumour biology〔J〕.J Tumor,2015;3(2):309-13.
10马建赢,唐燕华.Notch1 在心血管疾病中的研究现状〔J〕.中国老年学杂志,2015;35(18):5324-7.
11Kong JH,Yang L,Dessaud E,etal.Notch activity modulates the responsiveness of neural progenitors to sonic hedgehog signaling〔J〕.Developmental cell,2015;33(4):373-87.
12Takebe N,Miele L,Harris PJ,etal.Targeting notch,hedgehog,and wnt pathways in cancer stem cells:clinical update〔J〕.Nat Revi Clin Oncol,2015;12(8):445-64.
13Cui D,Dai J,Keller JM,etal.Notch pathway inhibition using PF-03084014,a γ-secretase inhibitor(GSI),enhances the antitumor effect of docetaxel in prostate cancer〔J〕.Clin Cancer Res,2015;21(20):4619-29.
〔2017-01-05修回〕
(编辑 袁左鸣/滕欣航)
甘肃省卫生行业科研项目(No.GSWST2012-3)
鲁雅琴(1972-),女,副教授,主任医师,主要从事急性脑血管病及康复治疗研究。
刘 琦(1982-),男,硕士,主治医师,主要从事卒中后康复治疗研究。
R318.06
A
1005-9202(2017)17-4185-03;doi:10.3969/j.issn.1005-9202.2017.17.007
1 兰州大学第一医院神经内科

