园养大袋鼠“粗颌病”的病原分离与鉴定
李照伟,刘 霞,费荣梅,陈 蓉,王素春
(1. 贵州省动物疫病预防控制中心,贵州贵阳 550008;2. 南京农业大学,江苏南京 210095;3. 南京市红山森林动物园,江苏南京 210028;4. 中国动物卫生与流行病学中心,山东青岛 266032)
园养大袋鼠“粗颌病”的病原分离与鉴定
李照伟1,刘 霞1,费荣梅2,陈 蓉3,王素春4
(1. 贵州省动物疫病预防控制中心,贵州贵阳 550008;2. 南京农业大学,江苏南京 210095;3. 南京市红山森林动物园,江苏南京 210028;4. 中国动物卫生与流行病学中心,山东青岛 266032)
园养大袋鼠“粗颌病”是一种由齿槽感染引发顽固性牙周炎,导致出现牙龈溃烂并形成溃疡、窦道,严重时颌面部肿胀、坏死,上下颌骨不可逆性变形等一系列临床症状为特征的口炎综合征。本研究对江苏省南京市红山森林动物园发生“粗颌病”的两种园养大袋鼠进行病原分离与鉴定,从发病大袋鼠的病变部位分离出3株细菌。依据形态特征和培养特性观察,以及生化试验和耐药性检测,初步判定其中1株为粪肠球菌(Enterococcus faecalis),另2株为肺炎克雷伯菌(Klebsiella pnenmoniae)。通过全自动药敏分析和小鼠致病性试验,对分离菌株进一步鉴定,结果发现与初判结果一致。小鼠口腔感染试验可以模拟复制出发病袋鼠下颌肿胀的病变特征,只是一般注射剂量不能致死小鼠。
袋鼠;粗颌病;病原分离与鉴定;粪肠球菌;肺炎克雷伯菌
大袋鼠属哺乳动物纲有袋目(Marsupialia)袋鼠科(Macropididae)[1],原产于澳大利亚大陆和巴布亚新几内亚的部分地区。大袋鼠多群居,主要以灌木嫩树枝、青草和柔软植物为食[2]。由于其具有较高的观赏价值,通常在动物园内作为观赏动物饲养[3]。大袋鼠在园养过程中广泛流行一种口炎综合征,以齿槽感染引发顽固性牙周炎,出现牙龈溃烂并形成溃疡、窦道,严重时颌面部肿胀、坏死,上下颌骨不可逆性变形等为主要临床特征[4],被Fowler等[5]命名为“粗颌病”(Lumpy Jaw)。“粗颌病”的致病菌并非单一菌株,常为多种细菌,因而难以有效控制[6-8]。发病袋鼠不分性别、品种和年龄,均有较高的发病率、复发率及病死率,因此严重影响袋鼠的正常展出与观赏,并可因预后不良导致死亡,造成巨大的经济损失。对发病大袋鼠进行病原菌的分离与鉴定,可为该病的治疗及预防提供理论依据。
1 材料与方法
1.1 材料
发病袋鼠包括赤大袋鼠(Macropus rufus)和灰大袋鼠(Macropus giganteus)。
1.1.1 被检材料。从发病袋鼠的口腔、牙龈、下颚,剪下痂皮、结节,或无菌采集病变部的脓汁、坏死组织。
1.1.2 培养基。营养肉汤(NB)、营养琼脂(NA)平板、麦康凯琼脂(MAC)平板、亚硫酸铋琼脂(BS)平板、三糖铁琼脂(TSI)斜面,血琼脂(BA)平板(无菌脱纤羊血购自杭州微生物试剂有限公司),按使用说明书配制。
1.1.3 试剂及试纸。草酸铵结晶紫溶液、革兰碘溶液、95%乙醇、沙黄溶液、香柏油、二甲苯溶液,硝酸盐还原检测试剂、VP检测液、甲基红检测试剂、苯丙氨酸检测试剂,3% H2O2、生理盐水、氧化酶反应试剂及试纸、药敏试纸、葡萄糖氧化/发酵管、微量生化鉴定管,均购自杭州微生物试剂有限公司。
1.1.4 实验仪器。SPX-150B-Z型生化培养箱、DK-8D数显恒温水浴箱、GY-31光学显微镜、SYQ-DSX-280B手提式压力蒸汽灭菌器、THZ-C台式恒温振荡器、Pico17离心机、Smart SpecTM3000紫外分光光度计、Biomerieux微生物药敏分析鉴定系统等。
1.1.5 实验动物。清洁级小鼠12只,雌性,体重均为20 g左右,购自扬州大学比较医学中心。
1.2 细菌学检查
1.2.1 细菌分离培养及形态学观察。无菌采集发病袋鼠下颌感染部位脓汁[9],接种于NB中,分别置37 ℃烛缸和37 ℃生化培养箱内进行厌氧培养和有氧培养,24~48 h后将其涂片染色镜检;待菌液浑浊度足够时,将增菌液分三区划线接种于BA平板后,置37 ℃烛缸和37 ℃生化培养箱内增菌24~48 h,挑取单个可疑菌落,对其涂片染色镜检。1.2.2 细菌纯培养。将染色镜检后的单个可疑菌落分别进行BA平板接种、NB纯培养,将培养物置37 ℃烛缸和37 ℃生化培养箱内24 h后涂片染色镜检,观察是否出现杂菌。如已达到纯培养目的,则继续观察细菌的形态以及在需氧环境和厌氧环境中的生长情况[10]。
1.2.3 细菌鉴别培养。挑取单个可疑菌落,将其分三区划线接种于MAC平板、BS平板和TSI斜面,置37 ℃生化培养箱,24 h后观察。
1.3 生化试验
取纯培养物,对其进行触酶、氧化酶、葡萄糖氧化/发酵等试验;参考细菌编码鉴定系统,接种微量生化鉴定管,置37℃生化培养箱,24 h后鉴定生化特性[11]。
1.4 耐药性检测及全自动药敏分析鉴定
根据抗生素敏感度判定标准[12],采用K-B纸片扩散法进行耐药性检测。置37℃生化培养箱,24 h后测量抑菌圈直径,判断细菌对14种药物的敏感性。将3株纯培养物送检江苏省中西医结合医院进行全自动药敏分析鉴定。
1.5 动物试验
取纯培养物,将其接种于NB中,37 ℃,180 r/min振摇12~14 h,至细菌的生长对数期;以灭菌磷酸盐缓冲液(PBS)洗涤3次,测定OD600nm值;将菌液浓度稀释至1.0×108CFU/mL,进行小鼠口腔感染试验。将小鼠随机分为4组,每组3只,设空白对照组。除对照组外,其余各组分别注射不同细菌。用无菌注射器吸取稀释菌液0.1~0.2 mL/只,进行小鼠口腔注射[10](空白对照组不注射),观察小鼠1周内的发病情况。
2 结果与分析
2.1 细菌学鉴定
2.1.1 细菌形态。经分离、纯化后得到3株不同的菌株。其中:第1株为革兰阳性球菌,多呈双球形态,染色均匀,无鞭毛、芽孢和荚膜;第2株和第3株均为革兰阴性短杆菌,染色均匀,两端钝圆呈棒状,无规则散在,无鞭毛和芽孢,有荚膜。
2.1.2 细菌培养特征。3株细菌均为需氧菌:第1株菌液浑浊度较低,管低见少量沉淀,振摇后沉淀呈螺旋上升;第2株和第3株菌液浑浊度较高,呈均匀浑浊。细菌分离培养后,接种第1株菌的BA平板上可见白色不透明针尖状菌落。菌落直径0.5 mm左右,表面光滑,边缘整齐;初分离时有狭窄溶血,传代后溶血现象不明显。接种第2株和第3株菌的BA平板上可见乳白色圆形小菌落。菌落直径1~2 mm,表面光滑、湿润,边缘整齐,不溶血。细菌纯培养后,接种第2株和第3株菌的MAC平板上出现呈玫红色圆形菌落。菌落直径1 mm左右,表面湿润、光滑,边缘整齐,生长良好,个别呈同心圆状。接种第2株和第3株菌的BS平板上出现黑色圆形或椭圆形菌落。菌落直径0.5~1 mm,表面湿润、光滑,边缘整齐,生长良好;接种第2株菌和第3株菌的TSI斜面出现产酸、产气,整个斜面呈黄色,穿刺线无变化,菌株无动力。
2.2 生化试验
将3株纯培养物分别进行葡萄糖氧化/发酵(O/ F)试验、氧化酶试验和触酶试验,并将菌落接种于微量生化鉴定管中,置37 ℃生化培养箱内培养24 h。结果显示,菌株1(O/F)试验氧化型,触酶试验、尿素、蔗糖、精氨酸水解、木糖、木糖醇、密二糖、葡磷胨水均为阴性,乳糖、甘露糖、麦芽糖、覃糖、甘露醇、N-乙酰葡胺、果糖、山梨醇、硝酸盐还原均为阳性;菌株2和3(O/F)试验发酵型,氧化酶试验、硫化氢、苯丙氨酸、蛋白胨水、葡磷胨水、枸橼酸盐、动力、山梨醇、鸟氨酸、氨基酸对照均为阴性,葡萄糖酸盐、尿素、产气、赖氨酸、棉子糖、侧金盏花醇、木糖均为阳性。根据生化试验结果,结合其形态及染色特性、分离培养特性、菌落特征等,初步鉴定分离菌株为1株粪肠球菌(Enterococcus faecalis)和2株肺炎克雷伯菌(Klebsiella pnenmoniae)。
2.3 耐药性检测及全自动药敏分析鉴定
通过K-B纸片扩散法,结合抑菌圈直径判定标准,对分离菌进行耐药性检测(表1)。结果显示:菌株1对复方新诺明、先锋霉素IV、头孢吡肟、氨苄西林、头孢西丁、新霉素、青霉素G耐药,对庆大霉素、红霉素、氯霉素、诺氟沙星、阿米卡星、四环素、阿莫西林敏感;菌株2和菌株3对氨苄西林、庆大霉素、青霉素G、四环素、复方新诺明、阿莫西林、先锋霉素IV耐药,对新霉素、红霉素处于中介敏感,对诺氟沙星、阿米卡星、头孢吡肟、头孢西丁、氯霉素敏感。
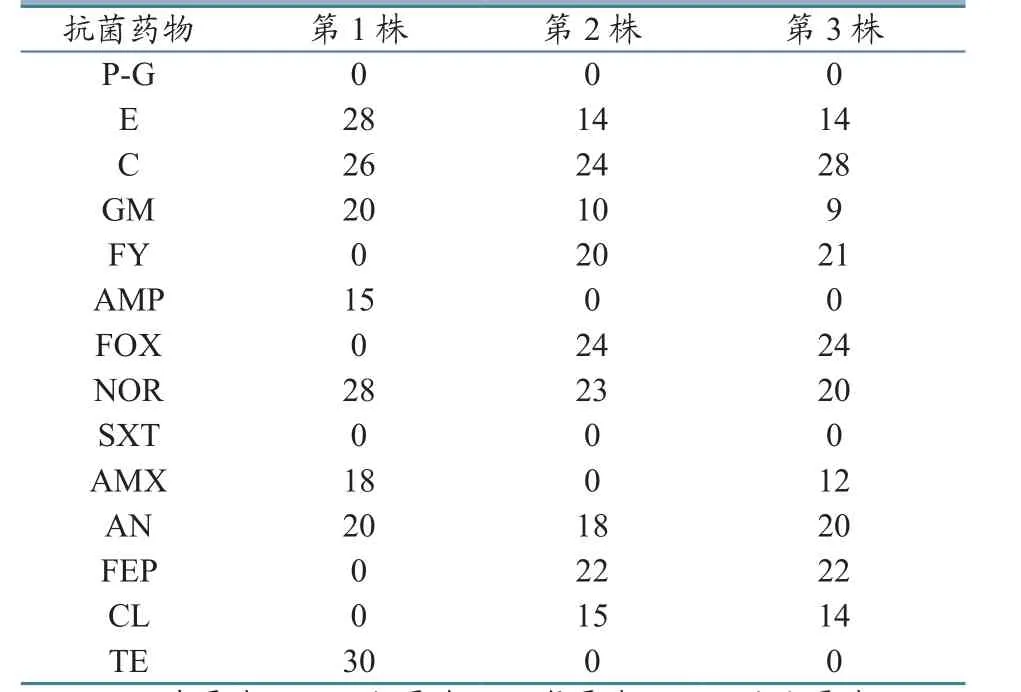
表1 耐药性检测结果(抑菌圈直径) (单位:mm)
将3株纯培养物进行全自动药敏分析鉴定,结果发现与耐药性检测结果一致(表2);进一步鉴定分离菌株,确定1株为粪肠球菌,另2株为肺炎克雷伯菌。

表2 微生物药敏分析鉴定结果
2.4 动物试验
将3株菌接种于NB振摇12 h后,用紫外分光光度计分别测定OD600nm值(3株菌液浓度分别2.6×108、5.6×108、6.7×108CFU/mL)。将菌液浓度均稀释至1.0×108CFU/mL,以0.1~0.2 mL/只对小鼠进行口腔注射,对照组不注射,观察1周。小鼠感染试验显示:感染24 h后,感染组小鼠精神状态较好,饮食、饮欲正常,除颌部有非常轻微肿胀外,与对照组小鼠体况基本相似;感染48 h后,小鼠食欲开始减弱,颌部肿胀开始显现,并轻微发红;感染72 h后,小鼠精神逐渐沉郁,食欲骤降,甚至不食,不愿意活动,常打堆抱团不动,饮水量减少,其颌部肿胀明显,常以前爪搔抓颌部,有疼痛表现(触摸肿胀部小鼠回避闪躲)。
3株菌均可引起小鼠的临床反应,复制出颌部肿胀的病变特征,但该剂量菌液不能致死小鼠,因此判定菌株致病力不强。第8天全部处死小鼠,进行剖检,可见下颌部有明显的局部脓肿,个别严重者牙髓腔较对照组小鼠增大,有明显的空洞,小鼠肝脏、脾脏肿大,呈淡粉色,个别感染小鼠心脏有淤血。分别取各组小鼠病变肝脏、脾脏以及颌部脓汁接种于BA平板,然后将其置37 ℃生化培养箱,24 h后可观察到与之前纯培养相似的菌落;挑取单个可疑菌落,对其进行革兰染色镜检,可见细菌形态与分离菌株形态相同,证明在本试验病例分离出的菌株为粪肠球菌和肺炎克雷伯菌。
3 讨论
根据本次试验结果,可以初步确诊感染袋鼠的病原为粪肠球菌和肺炎克雷伯菌。其中,粪肠球菌是条件致病菌,一般栖居于各种温血和冷血动物的腔肠,对环境耐受性极强,存活力持久[13];肺炎克雷伯菌是动物呼吸道和肠道内的寄生性条件致病菌,只在特殊条件下(免疫力低下、长期使用抗菌药等)才会引起化脓性感染[14]。本园袋鼠由于存在近亲交配、长期携带贾第虫、病毒侵害等问题,个体免疫力较差,易被这些条件致病菌引起发病。
“粗颌病”多因牙周炎、口腔黏膜损伤等引发颌部骨髓炎,因此定期口腔检查和局部清创消炎是防治的关键[8]。“粗颌病”致病菌并非单一。国内多家动物园已分离到多种细菌,且均为条件致病菌[4,7-8],其主要通过发病袋鼠眼部、鼻腔及口腔的脓性分泌物传播,因此应避免同群袋鼠通过相互接触而感染。相较于野生袋鼠以柔软植物为食,圈养袋鼠饲料偏于粗硬,易造成口腔损伤,且红薯、土豆等高淀粉饲料易在口腔内发酵,这为致病菌生长繁殖提供了有利条件和环境[15]。因此,应改善园养袋鼠饮食,减轻饲料纤维硬度,避免龋齿形成(饲料糖分过高)和牙齿松动脱落(摄入钙量不足)[16]。此外,袋鼠天性胆小谨慎,因此饲养场地应尽可能开阔、安静,以减少应激,增强袋鼠免疫力。只要坚持“养防重于治疗”的原则,就可有效控制此病发生。
[1] 郑智民,姜志宽,陈安国. 啮齿动物学[M]. 上海:上海交通大学出版社,2008:365-398.
[2] 耿毅,汪开毓,熊焰. 袋鼠口腔炎综合征的病理学观察[J].中国兽医杂志,2004,40(10):31-32.
[3] 李伟. 复方新诺明和甲硝哒唑联用防治红颈袋鼠面颊肿胀[J]. 动物医学进展,2005,26(2):115.
[4] 程家球,邓长林,陈楠,等. 袋鼠粗颌病及临床继发病的探讨[C]//程家球,邓长林,陈楠,等. 华东地区动物园论文集. 上海:中国动物园协会华东地区组委会,2012:268-270.
[5] FOWLER M E. 动物园与野生动物医学(下册)[M]. 台湾:淑馨出版社,1998:65-66.
[6] TAYLOR M R H,WILSON P,KEANE C T,et al. Laboratory investigations in the “Lumpy Jaw” of macropods[J]. Veternary research Communications,1987,2(1):131-136.
[7] 黄勉,陈洪汉,蔡勤辉,等. 袋鼠口腔炎综合征的病原分离与鉴定[J]. 中国兽医杂志,2001,37(1):25-26.
[8] 魏迎涛,马强. 袋鼠“粗颌病”诊治的探讨[J]. 上海畜牧兽医通,2001(3):41.
[9] 郑明球,沈正达,王锡祯,等. 家畜传染病学实验指导[M].北京:中国农业出版社2011:19.
[10] 姚火春,方定一,杜念兴,等. 兽医微生物学实验指导[M]. 2版. 北京:中国农业出版社,2009:23-24,124-126.
[11] 东秀珠,蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社,2001:117-119.
[12] Performance Standards for Antimicrobial Susceptibility Testing(Twenty-Third Informational Supplement)[S]. Wayne:Clinical and Laboratory Standards Institute(CLSI),2013.
[13] 唐晓丹. 肠球菌感染研究现状[J]. 中国感染与化疗杂志,2007,7(3):221-223.
[14] 陆承平. 兽医微生物学[M]. 4版.北京:中国农业出版社,2007:117-118.
[15] SAMUEL J L. Jaw disease in macropod marsupials:Bacterial flora isolated from lesions and form the mouths of affected animals Original Research Article[J]. Veterinary microbiology,1983,8(4):373-387.
[16] 邵俊峰. 袋鼠口腔疾病的诊治[J]. 动物医学进展,2008,29(S1):83-84.
(责任编辑:朱迪国)
Pathogen Isolation and Identifcation for“Lumpy Jaw”of Kangaroos in Zoos
Li Zhaowei1,Liu Xia1,Fei Rongmei2,Cheng Rong3,Wang Suchun4
(1. Guizhou Provincial Animal Disease Prevention and Control Center,Guiyang,Guizhou 550008;2. Nanjing Agricultural University,Nanjing,Jiangsu 210095;3. Hongshan Forest Zoo,Nanjing,Jiangsu 210028;4. China Animal Health and Epidemiology Center,Qingdao,Shandong 266032)
“Lumpy Jaw”of kangaroos in zoos is an oral inflammation syndrome caused by alveolus infection,which was characterized by refractory periodontitis,ulcerated gums resulting in ulcer and sinus,swelling and necrosis in maxillofacial region and irreversible malposition of maxillary and mandible seriously. In this study,the pathogens of“Lumpy Jaw” in park kangaroos from Nanjing Hongshan Forest Zoo were isolated and identified. Three strains of bacteria were isolated and were identified as Enterococcus faecalis and Klebsiella pnenmoniae,respectively,by their morphology,cultural characteristics,biochemical characteristics and drug sensitivity. By full-automatic analysis of drug sensitivity and pathogenicity in mice experiment,further identification of the isolated strains were carried out,and the results were consistent with the former. The oral infection of mice experiment showed that the symptoms of“Lumpy Jaw” in the mice could be simulated,but general dozes could not contribute to death of mice.
kangaroo;Lumpy Jaw;pathogen isolation and identification;Enterococcus faecalis;Klebsiella pnenmoniae
S851.3
A
1005-944X(2017)09-0107-05
10.3969/j.issn.1005-944X.2017.09.028
科技部科技基础性专项(SQ2012FY3260033)