土壤中多环芳烃微生物降解能力模拟
程晓暄, 刘 昱, 张枝焕*, 蔡 婷, 王 珂, 丁 玥
1.中国石油大学(北京)地球科学学院, 北京 102249 2.油气资源与探测国家重点实验室, 北京 102249
土壤中多环芳烃微生物降解能力模拟
程晓暄1,2, 刘 昱1,2, 张枝焕1,2*, 蔡 婷1,2, 王 珂1,2, 丁 玥1,2
1.中国石油大学(北京)地球科学学院, 北京 102249 2.油气资源与探测国家重点实验室, 北京 102249
为了揭示微生物菌种(组合)对土壤中PAHs(多环芳烃)降解率的影响以及不同类型PAHs抗微生物降解能力的差异,分析了北京市6个不同环境功能区土壤中微生物种类及其分布特征,从中筛选出部分微生物菌种对典型PAHs和原油进行降解模拟试验,对比分析微生物对不同PAHs降解能力的差异. 结果表明:①不同菌种组合对PAHs的降解能力存在明显差异,与假单胞菌属、无色杆菌、短稳杆菌混合菌相比,假单胞菌属、无色杆菌、短稳杆菌和微杆菌混合菌对PAHs的降解率高0.6%~4.5%;②在相同降解条件下,不同PAHs的降解率存在明显差异,在单体培养基中,LMW PAHs(低环数PAHs)的降解率在25.3%以上,而HMW PAHs(高环数PAHs)的降解率都小于20.1%;③在单体培养基与混合培养基中PAHs的降解能力也存在一定差别,单体培养基中PAHs的降解率较混合培养基中高4.2%~26.6%;④无论在单体培养基中,还是混合培养基中这些化合物的降解率均存在随着降解时间的增加而增大的现象;⑤在原油培养基中不同PAHs的降解率更为复杂,并且出现了中低分子量PAHs降解率随降解时间增加反而降低的假象,这可能是由于随着时间增加,微生物对PAHs的降解能力加强,原油中含烷基的PAHs基团降解或HMW PAHs被微生物降解产生LMW PAHs中间产物造成. 研究显示,假单胞菌属、无色杆菌、短稳杆菌和微杆菌对HMW PAHs 和LMW PAHs 均有明显的降解效果,但不同PAHs的降解率存在明显的差异,即使是同一单体化合物,在单体培养基、混合培养基和原油培养基三种不同的降解条件下,其降解率也具有不同程度的差别.
土壤; 多环芳烃; 混合菌群; 微生物降解; 模拟试验
PAHs(多环芳烃)是土壤中主要有机污染物之一. Wild等[1]认为,在英国,环境中90%的PAHs主要存在于土壤中. 有机污染物进入土壤后会经历复杂的地球化学变化,但大部分会残留在土壤中或向土壤更深部迁移,导致土壤、地下水污染,尤其是一些难降解的有机污染物可能在土壤中长期积累,表现出明显的生态效应和环境效应,这将会危及土壤生态系统的正常结构、功能与平衡[2]. 土壤中PAHs有较高的稳定性,而PAHs的稳定性又受到苯环排列方式的影响,非线性排列比线性排列更稳定[3]. 除此之外,土壤中PAHs的降解速度还取决于PAHs的结构、物化特性以及土壤组成与结构,分子结构中苯环数目越多越不易降解[4- 5],高分子量的PAHs主要是通过共代谢作用去除的[6]. 有研究表明,在含有14种PAHs处于饱和状态的土壤中,挥发作用对土壤PAHs的影响可忽略不计,而且非生物作用只对4环及4环以下的PAHs有影响[7- 8],所以,土壤中PAHs去除的主要机制是生物降解. 据文献报道,目前在土壤中发现了70多属、200余种能够降解烃类的微生物[9],其中在环境中发挥着主要贡献的是细菌[10]. 即使是同种菌属,对不同的PAHs降解率也不同,对于同种PAHs,用不同的菌降解,其降解率也不同[11],这可能是受环境因素对微生物代谢的影响,如底物以及底物浓度不同[12]、其他PAHs或降解产物的毒性作用[13- 14]、底物之间的竞争、PAHs浓度低以至于不能诱导产生裂解酶等[15].
目前对于生物降解PAHs的研究主要集中在单体PAHs的生物降解方面,然而受污染土壤中PAHs的组合和比例的多样性使得不同PAHs之间的相互影响以及生物降解PAHs的差异性研究至关紧要[16],并且PAHs抗生物降解的差异性很有可能会导致土壤中PAHs源解析参数的变化,这对于提高土壤中PAHs降解率和选择有效的PAHs源解析参数都具有重要意义. 因此,该试验主要在已有研究基础上,通过微生物降解模拟试验,对比分析不同菌种组合对PAHs的降解率,以及不同PAHs单体之间抗微生物降解能力的差异,以期为进一步探讨微生物降解对土壤中PAHs分子标志物源解析参数有效性的影响、合理开展土壤中PAHs污染源研究提供参考,同时为PAHs污染土壤的微生物修复提供参考.
1 材料与方法
1.1样品采集
微生物降解污染物往往需要一定的适应时间[17]. WANG等[18]研究表明,未被污染的土壤中微生物降解PAHs的能力远不如受PAHs污染的土壤强. 所以,该试验根据北京地区土壤污染状况及土壤中w(PAHs)的高低[19- 20],在w(PAHs)较高的地区选取5个采样点,用梅花采样法采集5~10 cm的表层土样,各子样质量为300 g左右,将20 g左右放在锡箔纸里用来筛菌. 采样点位置及土壤基本特征如表1所示.
1.2菌种的筛选
1.2.1培养基的选择及制备
无机盐培养基:1 L蒸馏水中加入NaNO31.5 g,CaCl2(无水)0.002 g,NaCl 5 g,(NH4)2SO41.5 g,K2HPO41 g,FeSO40.01 g,KCl 0.5 g,MgSO40.5 g. 原油培养基:无机盐培养基中加入0.5 g原油. 降解培养基的制备:无机盐培养基中加入待降解的PAHs.
1.2.2菌种的驯化
菌种的驯化过程采用定时碳源浓度逐步提高的方法:①分别称取6个不同采样点的土壤样品5 g,放入盛有45 mL无菌水并带有玻璃珠的锥形瓶中,振荡20 min,使土样与水充分混合,②取出10%的土壤混合液放入盛有0.5 g原油的驯化培养基中,培养1周后再取出10%的培养液加入盛有1 g原油的驯化培养基中,如此循环,驯化培养3周. 驯化培养基浓度设计见表2. 摇床转速为170 r/min,培养温度为28 ℃,最后一周取出驯化培养液用于菌种的筛选.
1.2.3菌种的筛选及鉴定方法
用涂布平板法和平板划线法分离和纯化优势菌[21]. 通过革兰氏染色确定细菌的阴阳性,对其分别进行DNA分离、提取,提取的DNA送至上海生物工程股份有限公司进行检测,鉴定菌种. 通过表3中第7组、第8组、第9组试验结果来筛选高效降解混合菌,再用所确定的高效混合菌进行降解试验.
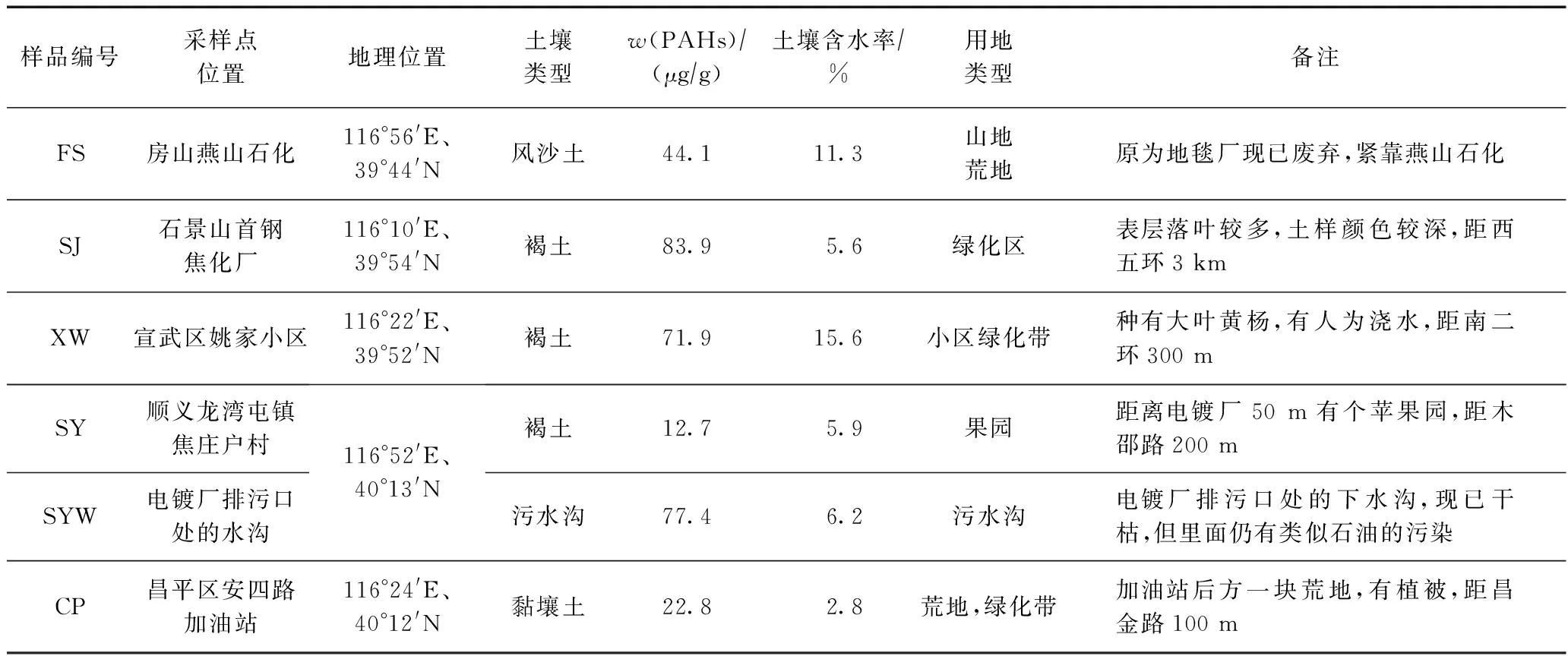
表1 采样点地理位置及周围环境特征

表2 驯化培养基中原油质量分布
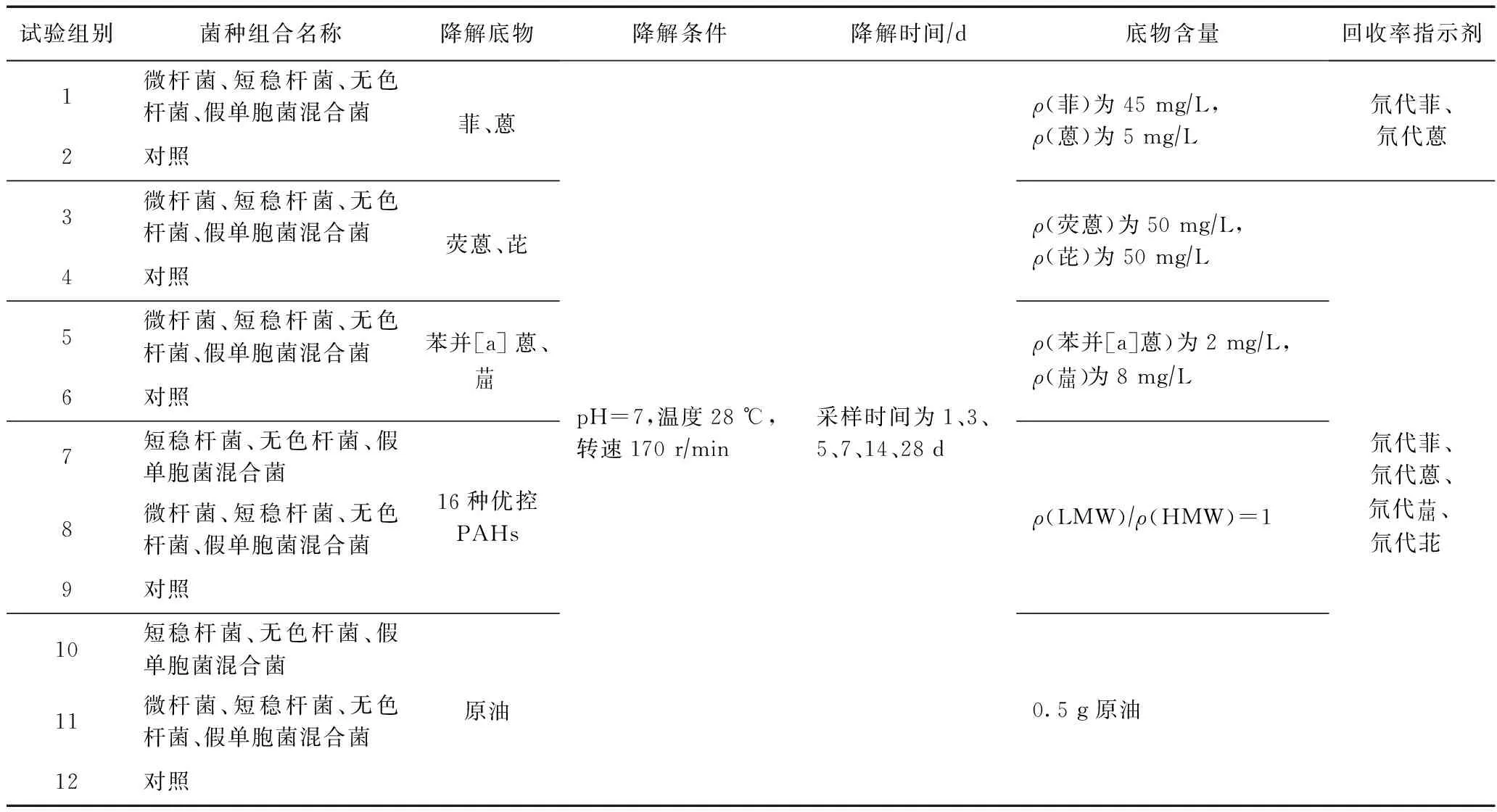
表3 微生物降解模拟试验设计
1.3微生物降解试验方案
该试验主要通过微生物降解PAHs来测定降解前后ρ(PAHs)是否发生变化,从而判断在不同模拟试验条件下微生物是否能够有效降解PAHs. 降解试验方案见表3,每一组降解试验都设置了对照,主要是为了去除非微生物降解的误差,如吸附、光解、挥发等[22- 23].
1.4样品分析及质量保证
1.4.1样品前处理
1.4.1.1培养基中降解产物的液-液萃取
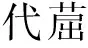
1.4.1.2降解后原油中可溶有机质的分离
降解原油萃取后,称取0.02~0.05 g到50 mL具塞锥形瓶中,加入5 mL石油醚稀释,经3次超声波萃取后,静置12 h,沉淀沥青质. 将短颈漏斗用镊子塞上脱脂棉过滤沥青质,用恒重瓶承接滤液,以石油醚3次冲洗漏斗及脱脂棉,待沥青“A”冲洗干净后,用二氯甲烷冲洗脱脂棉多次至无色,同时更换称量瓶,以承接沥青质. 沥青“A”为饱和烃、芳烃和非烃组分的混合液,待层析柱分离. 分离前先用正己烷沉淀沥青质,再分别采用石油醚、V(二氯甲烷)∶V(石油醚)=2∶1的混合溶剂及甲醇依次通过硅胶/氧化铝层析柱洗脱饱和烃、芳烃和非烃. 芳烃淋出液在旋转蒸发仪上浓缩至1 mL,加入10 mL二氯甲烷,再次浓缩至1~2 mL以转换溶剂,用二氯甲烷定量转移至5 mL 样品瓶中,在高纯氮气流中吹蒸定容至200 μL后待测.
1.4.2降解试验产物分析
用GC-MS(气相色谱-质谱)对PAHs进行定量定性分析,用含菌种的培养基中的降解率减去对照样品的降解率得到微生物降解率.
GC-MS分析采用Agilent 6890/5975气相色谱-质谱联用仪. 化合物检测条件:①色谱条件,HP- 5 MS弹性石英毛细柱(60 m×0.25 mm×0.25 μm)作为色谱柱,99.999%氦气作为载气,流速调至1 mL/min,进样口温度为300 ℃,采用不分流进样;升温程序,初温设为80 ℃,保持1 min后,以3 ℃/min的速度升至310 ℃,保持16 min,至样品完全流出色谱柱. ②质谱条件,EI电流源70 eV,倍增器电压2 400 V,离子源温度230 ℃,四极杆温度为150 ℃,气相与质谱的传输线温度为280 ℃,采用全扫描和选择离子同时采集数据方式.
1.4.3定量方法与回收率控制
采用内外标结合法对土壤中PAHs进行定量. 把16种PAHs标准物质和四种回收率指示剂配制成五种不同的质量浓度,再分别加入定量内标进行GC-MS 分析. GC-MS分析得到的部分标准物质在五个不同质量浓度下的回归曲线呈线性关系,各标准物质的回归系数(R)的分布范围为 0.912 1~0.999 7,平均值为 0.987 1,表明以此标准所求的数据可信度较高.
根据GC-MS测得四种回收率指示剂的峰面积及氘代三联苯的峰面积和质量,代入回归方程,计算得到回收率指示剂的质量. 所得质量与样品预处理之前的质量之比即为回收率. 该试验对每个样品中均加入回收率指示剂来反映每组样品不同的回收率. 每个样品除以对应的回收率,便可得到较为准确的质量.
2 结果与讨论
2.1高效降解菌的确定
根据测序菌株在GeneBank中比对结果,选取每个采样点不同菌属(见表4),共有15个菌种,包括假单胞菌属、无色杆菌和微杆菌三种,其中假单胞菌属在昌平采样点的样品中被筛选出,无色杆菌在房山、宣武区样品中均被筛选出,微杆菌在宣武区、顺义区、电镀厂的样品中也均被筛选出,这些菌的筛选具有随机性,说明其在土壤中具有普遍性. 短稳杆菌通过中国科技自然共享网购自新疆农业科学院微生物应用研究所,菌种的分离基物为泥土.
由表5可知,较短稳杆菌、无色杆菌及假单胞菌混合菌对16种PAHs的降解效果优于假单胞菌单菌属,故选用这三种菌混合菌用于降解试验. 但微杆菌单菌属降解萘、菲、蒽和芘混合液的降解率高于微杆菌、纤维化纤维菌、螯球菌属和鞘脂菌属混合菌. 可见,不同的菌属混合在一起对降解效果可能有促进作用,也可能有抑制作用. 所以,对短稳杆菌、无色杆菌、假单胞菌和微杆菌四种菌混合后的降解情况需要进一步确定.

表4 采样点所筛选菌种名称

表5 高效菌的降解情况

2.216种PAHs在不同条件下的降解率
2.2.1单体培养基中部分中低分子量PAHs微生物降解作用下随时间的变化特征
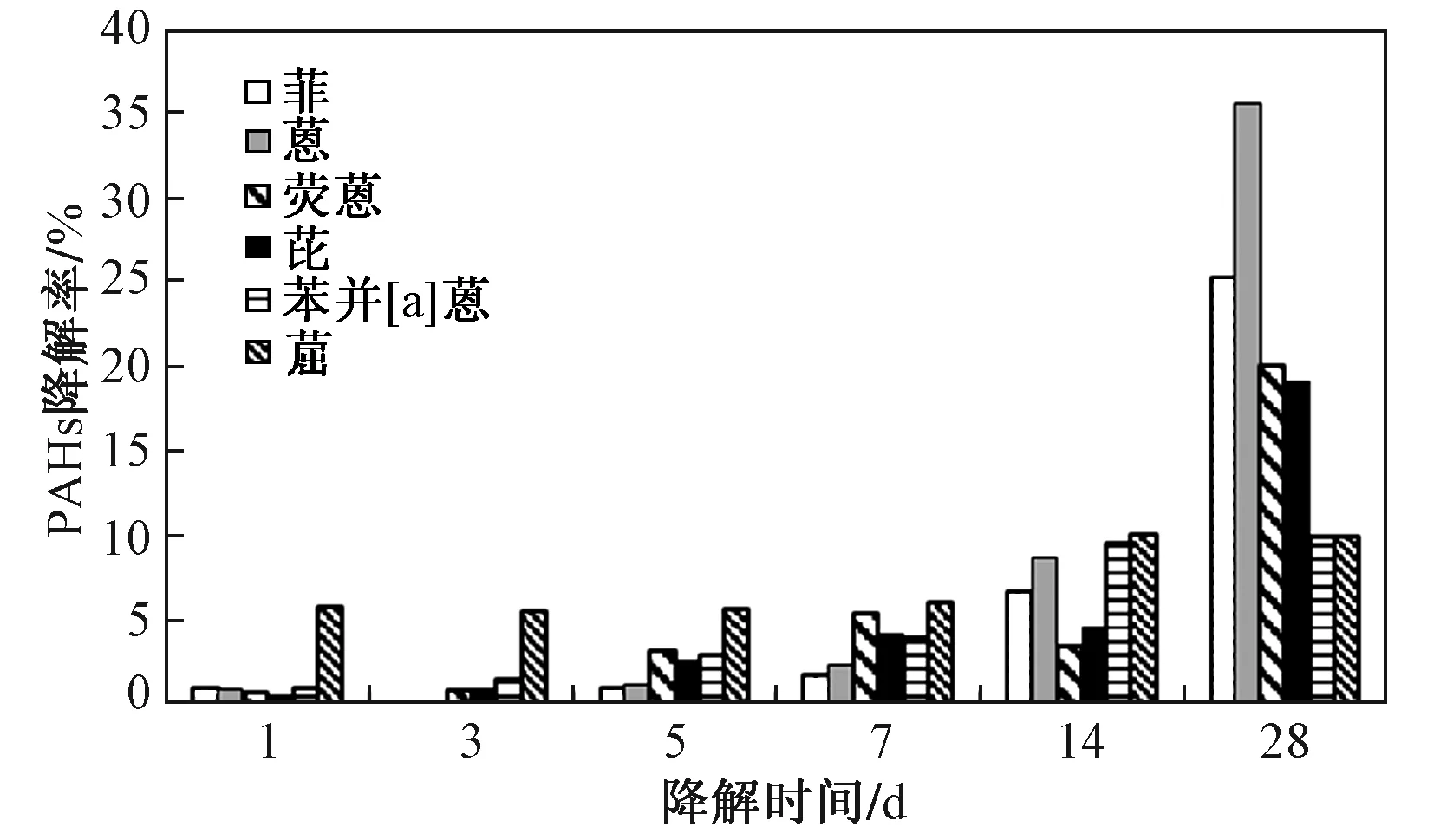
图1 单体培养基中PAHs降解率随降解时间的变化特征Fig.1 Degradation characteristics of PAHs in single medium with time
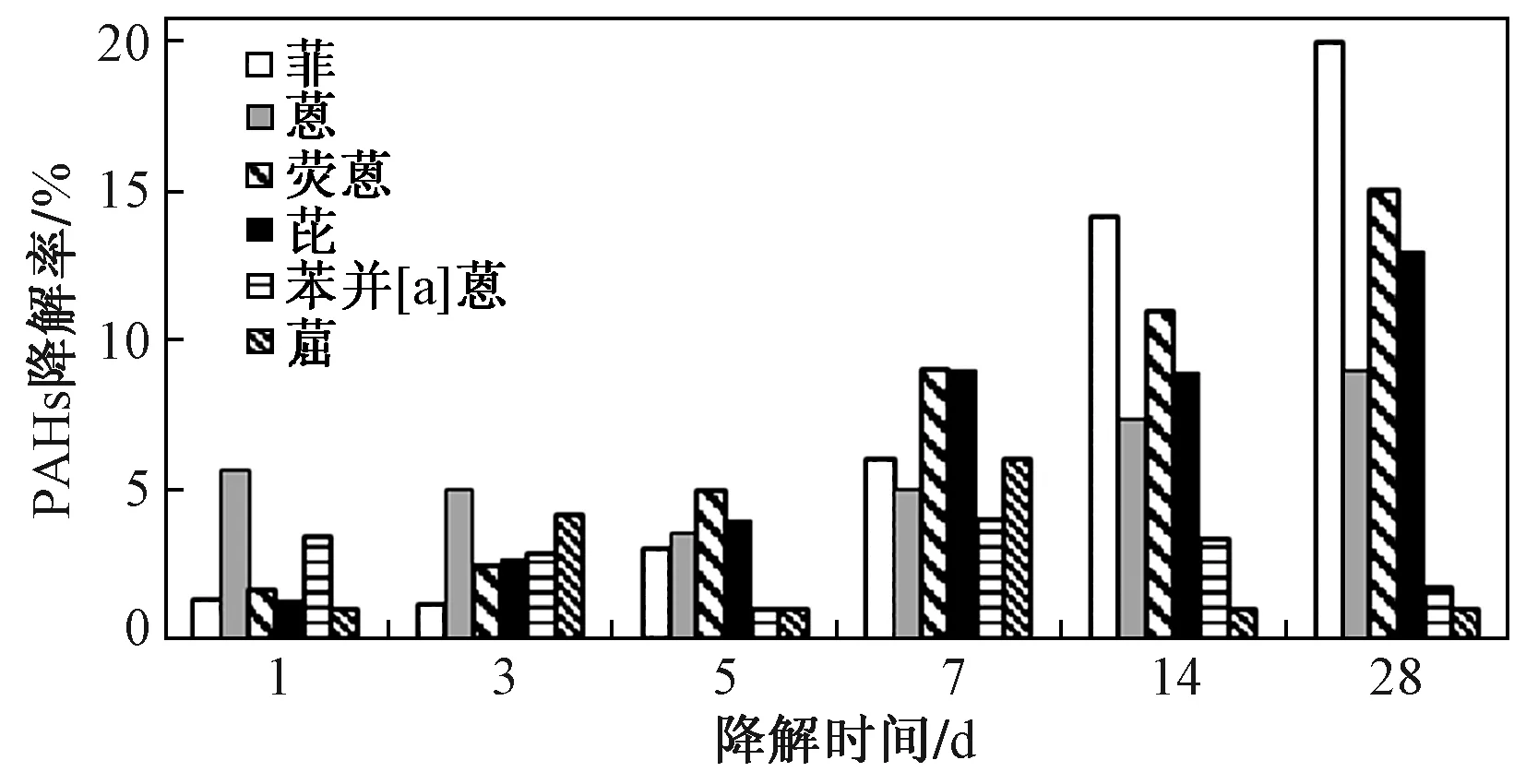
图2 混合培养基中PAHs降解率随降解时间的变化特征Fig.2 Degradation characteristics of PAHs in combined medium with time
2.2.2混合培养基中部分中低分子量PAHs在微生物降解作用下随时间的变化特征
采用四种混合菌对含16种PAHs为碳源和能源的培养基进行降解试验,结果如图2所示. 由图2可见,菲、荧蒽、芘的降解率随时间的增加逐渐增大,降解时间为28 d时,这三种化合物的微生物降解率分别为20%、15%和13%,而蒽的降解率先降低后升高,降解时间为28 d时生物降解率为9%,这可能是由于荧蒽和芘或其他更高环数的PAHs降解的中间产物通过一系列的反应生成了蒽,使得在降解时间为1~5 d时培养液中蒽的浓度有所升高. 并且,HMW PAHs具有较高的生物毒性,对微生物活性有抑制作用,使得微生物对蒽的降解能力降低了,而低分子量的蒽溶解度高更易诱导微生物产生PAHs降解酶,也可作为碳源和能源促进HMW PAHs的降解,所以在此降解时间内荧蒽和芘的降解率反而比蒽更高[31].
2.2.3原油培养基中部分中低分子量PAHs在微生物降解作用下随时间的变化特征

图3 原油培养基中PAHs的降解率随降解时间的变化特征Fig.3 Degradation characteristics of PAHs in oil medium with time

2.2.4其余PAHs在微生物降解作用下随时间的变化特征
2.2.4.1混合培养基
采用四种混合菌对以16种PAHs底物为碳源的培养基进行降解试验. 通过28 d降解试验结果表明,2环的萘和3环的苊烯、苊的自然降解率(加入混合菌后的降解率)和对照降解率都接近100%(见图4),所以由自然降解率扣除对照之后的微生物降解率几乎都为零. 这可能主要是由于萃取过程中这些PAHs的挥发造成的(LMW PAHs挥发性较大)[33],因此检测结果不能很好地反映真实情况. 苯并[b]荧蒽、苯并[k]荧蒽、苯并[a]芘、二苯并[a,h]蒽、茚并[1,2,3-cd]芘、苯并[g,h,i]苝等高环数化合物,在混合培养基中的最大降解率分别为7.41%、6.92%、8.16%、9.72%、4.04%、5.67%.
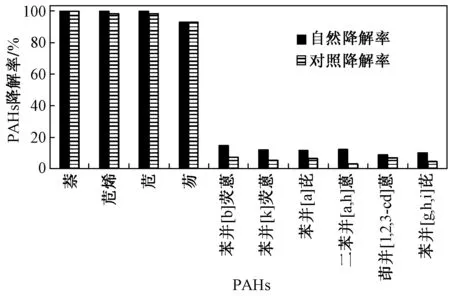
图4 混合培养基中PAHs的自然降解率和对照降解率对比Fig.4 Comparation of PAHs′ degradation rate between natural group and blank group in combined medium
2.2.4.2原油培养基
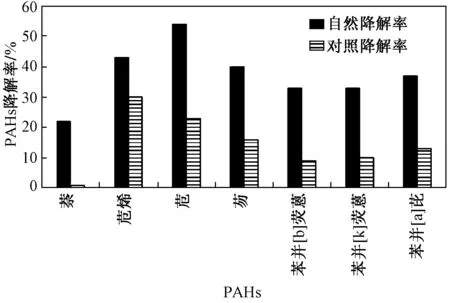
图5 原油培养基中PAHs的自然降解率和对照降解率对比Fig.5 Comparation of d PAHs′ egradation rate between natural group and blank group in oil medium
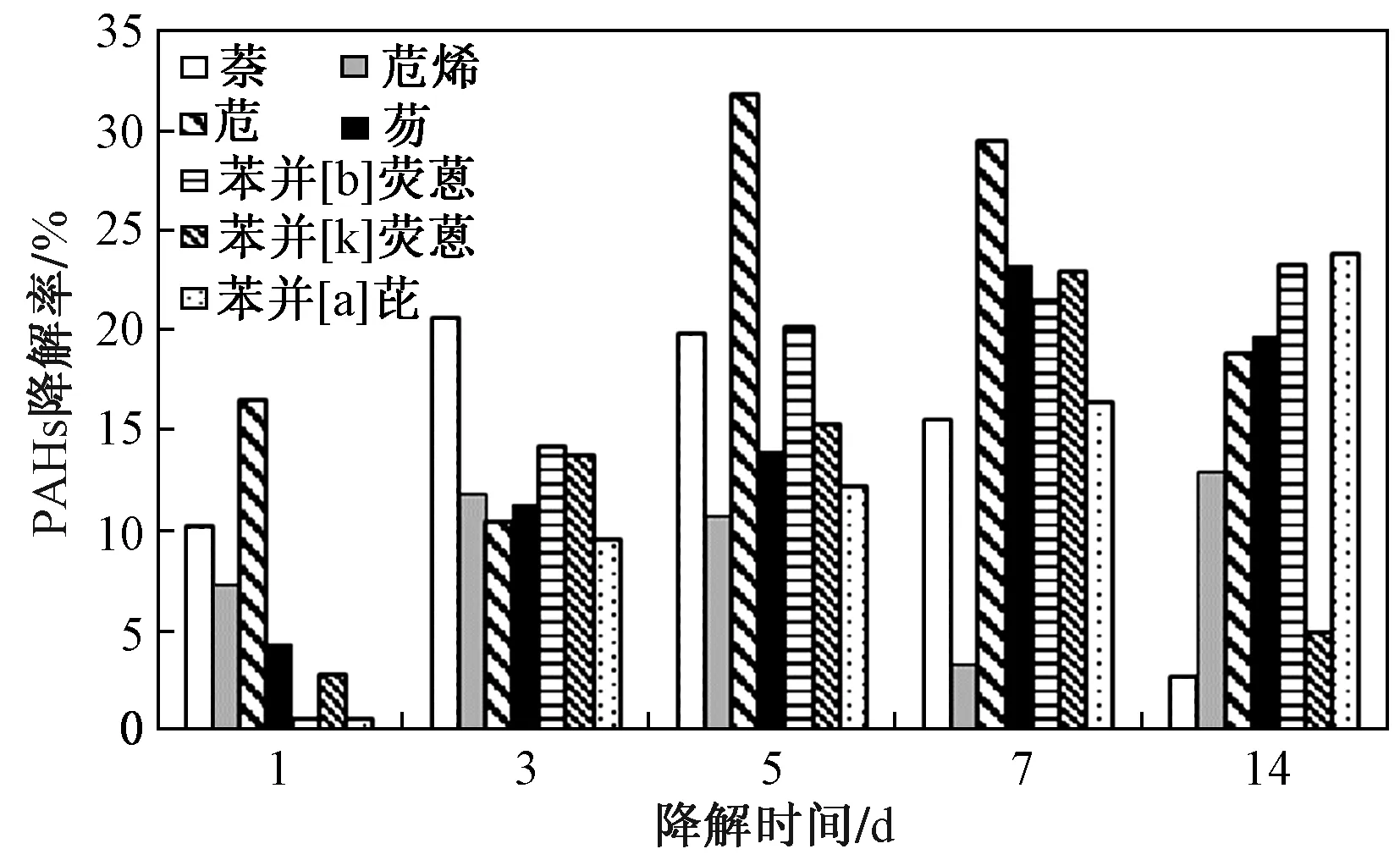
图6 原油培养基中PAHs的降解率随降解时间的变化特征Fig.6 Degradation characteristics of PAHs in oil medium with time
采用四种混合菌对以原油为底物和碳源的培养基进行降解试验. 结果表明,原油中检测到的萘、苊烯、苊、芴、苯并[b]荧蒽、苯并[k]荧蒽、苯并[a]芘的最大微生物降解率分别是20.6%、13.0%、31.7%、23.2%、23.2%、22.9%、23.8%(见图5). 原油培养基中PAHs的降解率随降解时间的变化特征如图6所示,苯并[b]荧蒽、苯并[k]荧蒽、苯并[a]芘等高环的PAHs的降解率呈现出随降解时间的增加上升的趋势,但低环的PAHs,如萘、苊烯、苊、芴的微生物降解率随降解时间的增加降解率都呈现上下波动的变化趋势,在降解时间为1~3 d时,PAHs的降解率都随降解时间的增加而不断上升,这说明在降解初期,降解菌能有效利用这几种PAHs,而降解3 d后低环的PAHs降解率呈现上下波动的变化趋势,其原因除了对照试验对低环数的PAHs的影响较大之外,也进一步说明了在降解过程中高环数的PAHs可能会降解生成了低环数的PAHs,而在降解7 d之后,苯并[k]荧蒽的降解率出现了降低的趋势,这可能是原油中其他高环数的芳烃化合物及PAHs的烷基取代物降解生成苯并[k]荧蒽导致的.
3 结论
a) 土壤稀释液培养的混合菌属经多次划线分离后菌种鉴定,得到15种不同细菌,不同的微生物菌群对PAHs的降解能力存在明显差别,其中假单胞菌属、无色杆菌、短稳杆菌和微杆菌4种菌属对土壤中不同组成的PAHs均有较高的降解率.

c) 在原油培养基与PAHs培养基中PAHs化合物的降解能力存在比较明显的差别. 在原油培养基中,不同PAHs的降解特征比较复杂,且存在随降解时间增长,中低分子量PAHs降解率降低的现象. 这可能是由于在降解过程中,微生物对高环数PAHs的降解能力增强,以及原油中的烷基PAHs的降解或高环数PAHs被微生物降解所产生的复杂的降解中间产物所致.
d) 28 d的降解试验结果表明,在混合培养基中,苯并[b]荧蒽、苯并[k]荧蒽、苯并[a]芘、二苯并[a,h]蒽、茚并[1,2,3-cd]芘、苯并[g,h,i]苝等HMW-PAHs的最大降解率分别是7.41%、6.92%、8.16%、9.72%、4.04%、5.67%,其降解规律不明显. 在原油培养基中,苯并[b]荧蒽、苯并[k]荧蒽、苯并[a]芘的降解率呈现出随降解时间的增加不断上升的趋势.
[1] WILD S R,JONES K C.Polynuclear aromatic hydrocarbons in the United Kingdom environment:a preliminary source inventory and budget[J].Environmental Pollution,1995,88(1):91- 108.
[2] 温志良,莫大伦.土壤污染研究现状与趋势[J].土壤污染与防治,2000,22(3):56- 58. WEN Zhiliang,MO Dalun.Present situation and trend of study on soil pollution[J].Soil Pollution and Prevention,2000,22(3):56- 58.
[3] 杨占文.土壤中多环芳烃菲和芘降解的研究进展[J].山东化工,2008,37(1):30- 33. YANG Zhanwen.Advances of the degradation of PAHs in soil[J].Shandong Chemical Industry,2008,37(1):30- 33.
[4] WILCKE W,MLLER S,KANCHANAKOOL N,etal.Polycyclic aromatic hydrocarbons in hydromorphic soils of the tropical metropolis Bangkok[J].Geoderma,1999,91:297- 309.
[5] 刘瑞民,王学军,郑一,等.天津市土壤多环芳烃含量与国外若干城市的比较[J].农业环境科学学报,2004,23(4):827- 830. LIU Ruimin,WANG Xuejun,ZHENG Yi,etal.Comparisons on polynuclear aromatic hydrocarbons contents in the topsoil of Tianjin City with those of some foreign cities[J].Agricultural Journal of Environmental Science,2004,23(4):827- 830.
[6] HARITASH A K,KAUSHIK C P.Biodegradation aspects of polycyclic aromatic hydrocarbons(PAHs):a review[J].Journal of Hazardous Materials,2009,169(1/2/3):1- 15.
[7] 丁克强,骆永明.多环芳烃污染土壤的生物修复[J].土壤,2001,33(4):169- 178.
[8] 李春玉.多环芳烃的土壤降解特性及其影响因子研究[D].南京:南京农业大学,2008:12- 16.
[9] WEISSENFELS W D,KLEWER H J,LANGHOFF J.Adsorption of polycyclic aromatic hydrocarbons(PAHs)by soil particles:influence on biodegradability and biotoxicity[J].Applied Microbiology and Biotechnology,1992,36(5):689- 696.
[10] 史兵方,杨秀培,张有会,等.土壤中多环芳烃污染的研究进展[J].安徽农业科学,2007,35(6):1735- 1737. SHI Bingfang,YANG Xiupei,ZHANG Youhui,etal.Research advance in the pollution of polycyclic aromatic hydrocarbons in soil[J].Journal of Anhui Agricultural Science,2007,35(6):1735- 1737.
[11] JUHASZ A L,NAIDU R.Bioremediation of high molecular weight polycyclic aromatic hydrocarbons:a review of the microbial degradation of benzo[a]pyrene[J].International Biodeterioration & Biodegradation,2000,45(1/2):57- 88.
[12] HEITKAMP M A,CERNIGLIA C E.Mineralization of polycyclic aromatic hydrocarbons by a bacterium isolated from sediment below an oil field[J].Applied and Environmental Microbiology,1988,54(6):1612- 1614.
[13] MUELLER J G,CHAPMAN P J,PRITCHARD P H.Action of a fluoranthene-utilizing bacterial community on polycyclic aromatic hydrocarbon components of creosote[J].Applied and Environmental Microbiology,1989,55(12):3085- 3090.
[14] WEISSENFELS W D,BEYER M,KLEINl J,etal.Microbial metabolism of fluoranthene:isolation and identification of ring fission products[J].Applied Microbiology and Biotechnology,1991,34(4):528- 535.
[15] BOUCHEZ M,BLANCHET D,VANDECASTEETE J P.Degradation of polycyclic aromatic hydrocarbon pure strains and by defined strain association:inhibition phenomena and cometabolism[J].Applied Microbiology and Biotechnology,1995,43(1):368- 377.
[16] MADRID F,RUBIO-BELLIDO M,VILLAVERDE J,etal.Natural attenuation of fluorene and pyrene in contaminated soils and assisted with hydroxypropyl-β-cyclodextrin.effect of co-contamination[J].Science of the Total Environment,2016,571:42- 49.
[17] SAMANTA S K,SING O V,JAIN R K.Polycyclic aromatic hydrocarbons:environmental pollution and bioremediation.[J].Trends in Biotechnology,2002,20(6):243.
[18] WANG X P,YU X B,BARTHA R,etal.Effect of bioremediation on polycyclic aromatic hydrocarbon residues in soil[J].Environmental Science & Technology,1990,24(7):1086- 1089.
[19] 张枝焕,卢另,贺光秀,等.北京地区表层土壤中多环芳烃的分布特征及污染源分析[J].生态环境学报,2011,20(4):668- 675. ZHANG Zhihuan,LU Ling,HE Guangxiu,etal.Distribution and sources of polycyclic aromatic hydrocarbon in surface soil of Beijing,China[J].Ecology and Environmental Science,2011,20(4):668- 675.
[20] 贺光秀,张枝焕,彭旭阳,等.北京地区表层土壤中含氧、含硫杂环芳烃化合物的分布特征及污染源分析[J].环境科学,2011,(11):3284- 3293. HE Guangxiu,ZHANG Zhihuan,PENG Xuyang,etal.Distribution and sources of oxygen and sulfur heterocyclic aromatic compounds in surface soil of Beijing,China[J].Environmental Science,2011,(11):3284- 3293.
[21] 马放,任南琪,杨基先.污染控制微生物学试验[M].哈尔滨:哈尔滨工业大学出版社,2002.
[22] PARK K S,SIMS R C,DUPONT R R,etal.Fate of PAH compounds in two soil types:influence of volatilization,abiotic loss and bioloical activity[J].Environmental Toxicology and Chemistry,1990,9(2):187- 195.
[23] GHOSAL D,GHOSH S,DUTTA T K,etal.Current state of knowledge in microbial degradation of polycyclic aromatic hydrocarbons(PAHs):a review[J].Frontiers in Microbiology,2016,7(386):1369- 1395.
[24] 马静.多环芳烃降解菌的筛选、降解机理及降解性能研究[D].大连:大连理工大学,2013:36- 40.
[25] 王春明.多环芳烃降解菌分离,降解特性及在稠油微生物采油中的应用研究[D].成都:四川大学,2007:30- 36.
[26] KASTNER M,MAHRO B.Microbial degradation of polycyclic aromatic hydrocarbons in soils affected by the organic matrix of compost[J].Applied Microbiology and Biotechnology,1996,44(5):668- 675.
[27] BANERJEE D K,FEDORAK P M,HASHIMOTO A.Monitoring the biological treatment of anthracene-contaminated soil in a rotating-drum bioreactor[J].Applied Microbiology and Biotechnology,1995,43(3):521- 528.
[28] CERNIGLIA C E.Biodegradation of polycyclic aromatic hydrocarbons[J].Biodegradation,1992,3(2/3):351- 368.
[29] WANG P,LUO L,KE L,etal.Combined toxicity of polycyclic aromatic hydrocarbons and heavy metals to biochemical and antioxidant responses of free and immobilizedSelenastrumcapricornutum[J].Environmental Toxicology and Chemistry,2013,32(3):673- 683.
[30] 刘芳,梁金松,孙英.高分子量多环芳烃降解菌LD29的筛选及降解特性研究[J].环境科学,2011,32(6):799- 1804. LIU Fang,LIANG Jinsong,SUN Ying.Isolation and degradation characteristics of a HMW PAHs-degrading strain LD29[J].Environmental Science,2011,32(6):1799- 1804.
[31] MARCOUX J,DÉZIEL E,VILLEMUR R,etal.Optimization of high-molecular-weight polycyclic aromatic hydrocarbons′ degradation in a two-liquid-phase bioreactor[J].Journal of Applied Microbiology,2000,88(4):655- 662.
[32] CHEN J,ZHANG H,HUANG H,etal.Impact of anaerobic biodegradation on alkylphenanthrenes in crude oil[J].Organic Geochemistry,2013,61(6):6- 14.
[33] 卢晓霞,吴淑可,侯珍,等.焦化厂污染土壤中多环芳烃降解菌的分离及降解特性[J].应用与环境生物学报,2011,17(5):722- 726. LU Xiaoxia,WU Shuke,HOU Zhen,etal.Isolation and degrading properties of PAHs-degrading bacteria from the contaminated soil of a coking plant[J].Chinese Journal Applied and Environmental Biology,2011,17(5):722- 726.
Laboratory Simulation of Microbial Degradation Ability for Polycyclic Aromatic Hydrocarbons in Soil
CHENG Xiaoxuan1,2, LIU Yu1,2, ZHANG Zhihuan1,2*, CAI Ting1,2, WANG Ke1,2, DING Yue1,2
1.College of Geosciences, China University of Petroleum (Beijing), Beijing 102249, China 2.State Key Laboratory of Petroleum Resource and Prospecting, Beijing 102249, China
In order to reveal and understand microbial degradation efficiency for polycyclic aromatic hydrocarbons (PAHs) in soil, microbial species and distribution characteristics were evaluated for six different environmental functional soils in Beijing. Several microbial strains were screened to simulate PAHs and crude oil degradation experiments and discuss the difference in microbial degredation ability for PAHs. The results showed that there were obvious differences in the ability of microbial degradation between different combinations of microbial strains. Bacteria consortium ofPseudomonassp.,Achromobactersp.,Empedobactersp. andMicrobacteriumshowed a higher efficiency in degradation for PAHs than bacteria consortium ofPseudomonassp.,Achromobactersp. andEmpedobactersp.. Under the same degradation conditions, the degradation efficiency for different PAHs monomer compounds were obviously different; in the single medium, the degradation rate for low-molecular weight (LMW) PAHs was bigger than 25.3%, but the degradation rate for high-molecular weight (HMW) PAHs was less than 20.1%. Degradation ability differences between single medium and mixed medium were also observed; the degradation rate of PAHs in the single medium was 4.2%- 26.6% higher than that in the mixed medium. It is a common phenomenon that the degradation rate increases with degradation time in the single and mixed medium. Significant differences in degradation ability between crude oil medium and PAHs medium could be obtained for PAHs monomer compounds in the oil medium, indicating the degradation efficiency is much more complicated, including because of the longer degradation time and the lower degradation ratio of middle and low molecular weight PAHs. The degradation ability of HMW PAHs increased with the degradation time, and the LMW PAHs formed as an intermediate produced by the PAHs with alkyl groups or HMW PAHs. The results revealed that LMW PAHs and HMW PAHs can be effectively degraded byPeudomonassp.,Achromobactersp.,Empedobactersp. andMicrobacteriumwith different degradation efficiency. Even for the same PAHs monomer compound in the single medium, mixed medium or the crude oil medium, the degradation efficiency differs.
soil; polycyclic aromatic hydrocarbons(PAHs); bacteria consortium; microbial degradation; simulated experiment
2017-01-17
:2017-05-27
国家自然科学基金面上项目(41373126)
程晓暄(1992-),女,安徽安庆人,jychengxiaoxuan@163.com.
*责任作者,张枝焕(1962-),男,福建屏南人,教授,博士,博导,主要从事环境地球化学与油藏地球化学研究,zhangzh3996@vip.163.com
X5
:1001- 6929(2017)09- 1373- 09
ADOI:10.13198/j.issn.1001- 6929.2017.02.82
程晓暄,刘昱,张枝焕,等.土壤中多环芳烃微生物降解能力模拟[J].环境科学研究,2017,30(9):1373- 1381.
CHENG Xiaoxuan,LIU Yu,ZHANG Zhihuan,etal.Laboratory simulation of microbial degradation ability for polycyclic aromatic hydrocarbons in soil[J].Research of Environmental Sciences,2017,30(9):1373- 1381.

