3D打印聚乳酸/纳米级β-磷酸钙可吸收山羊颈椎融合器的生物相容性及生物力学评价
杨接来, 徐 俊, 谷辉杰, 殷潇凡
复旦大学附属中山医院闵行医院(闵行区中心医院)骨科,上海 201100
·论著·
3D打印聚乳酸/纳米级β-磷酸钙可吸收山羊颈椎融合器的生物相容性及生物力学评价
杨接来, 徐 俊, 谷辉杰, 殷潇凡*
复旦大学附属中山医院闵行医院(闵行区中心医院)骨科,上海 201100
目的: 探讨3D打印聚乳酸(polylactic acid,PLA)/纳米级β-磷酸钙(β-TCP)可吸收颈椎融合器的生物相容性及生物力学性能。方法: 通过计算机辅助设计(computer-assisted design,CAD)系统和3D打印仪制备个性化山羊颈椎融合器,分析评价其终板匹配性;通过体外细胞实验检测3D打印融合器的生物相容性;将3D打印融合器植入山羊颈椎,分析其生物力学稳定性。结果: 3D打印融合器的终板匹配性能明显高于自体髂骨、美敦力威高融合器和史赛克Solis融合器,差异有统计学意义(P<0.05)。纯PLA材料与3D打印复合材料对细胞活力的影响差异无统计学意义。3D打印复合材料融合器左右侧屈和旋转活动度均小于自体髂骨、美敦力威高融合器和史赛克融合器,差异有统计学意义(P<0.05)。3D打印复合材料前屈活动度小于自体髂骨(P<0.05),但与美敦力威高融合器、史赛克融合器差异无统计学意义;3D打印复合材料后伸活动度与对照组差异无统计学意义。结论: 3D打印PLA/纳米级β-TCP可吸收颈椎融合器具有较好的生物相容性和力学稳定性,具有良好的应用前景。
3D打印;颈椎融合器;生物降解;聚乳酸;β-磷酸钙
前路颈椎椎间盘切除植骨融合术已在颈椎外科领域得到广泛应用,取得不错疗效,但存在供区疼痛、髂骨部感觉异常等缺点[1]。为代替或部分代替自体骨移植,早期常采用金属椎间融合器,但其弹性模量与骨组织差异大、应力遮挡,因而促进了其他材质融合器的研究[2]。碳纤维和聚醚醚酮(polyetheretherketone,PEEK)融合器的弹性模量与人体接近,克服了部分金属融合器的缺点[3]。然而,无论是金属融合器,还是碳纤维或PEEK融合器均不可降解。融合器一般被置于手术难进入的地方,因此翻修和取出比较困难。因此,寻找弹性模量接近于人体骨、固定稳定性强且能逐步降解的脊柱融合器成为目前研究的热点。
最常用于脊柱融合器的可降解生物材料是聚乳酸(polylactic acid,PLA),其降解速率缓慢,与新骨生长速率基本同步。但PLA缺乏骨传导性,而且PLA在降解过程中产生的降解产物易破坏成骨环境[4]。为了充分利用PLA的可降解特性和其初始稳定性、可加工性,又克服其降解产物的不良反应,可添加一定比例的β-磷酸钙(β-TCP)。β-TCP有良好的降解性能、优良的骨传导性,与自体骨相比具有类似的钙/磷比,已被用于骨修复和脊柱融合术中[5]。在PLA基质中加入一定比例的β-TCP,不仅可调节PLA的降解性能,并且可缓冲PLA产生的酸性产物,也将其优良的骨传导性带入复合物中[6]。本研究采用PLA与纳米β-TCP复合可降解材料制作融合器,并使用3D打印技术实现个性化定制,初步探讨其生物相容性,并对其生物力学特性进行初步测定,为后续研究奠定基础。
1 材料与方法
1.1 细胞培养 选用C57BL6乳鼠源性细胞系(MC3T3-E1)进行研究。MC3T3-E1细胞购于中国科学院细胞库。细胞置于新鲜的α-MEM培养液,在37℃、5%CO2浓度培养箱中传代培养。
1.2 PLA/纳米β-TCP复合材料的制备 参照文献[7],选用含20%纳米级β-TCP的方案,先将PLA溶于二氯甲烷中,放置于磁力搅拌器上,持续溶解24 h以上以达到充分溶解。然后加入β-TCP颗粒,再经过超声振荡和机械搅拌24 h以上,达到充分混和均匀后,置于蒸发皿中,浇筑成薄膜。将PLA纳米β-TCP薄膜裁剪成小颗粒,置于拉丝机中,在加热套筒的辅助加热下,将复合材料薄膜在160℃、120 MPa下熔融压拉制成直径1.8 mm的线材,供3D打印机使用。
1.3 山羊颈椎标本制备 选取30个雌性绵羊颈椎C2~C5段标本,绵羊平均体质量(66.3±5.1) kg。所有颈椎标本均在使用前经X线检查以排除异常标本。颈椎标本C3~C4为测试节段,仔细清除肌肉和筋膜组织,保留韧带、椎间盘和关节囊等。所有标本-80℃深低温冰箱保存,使用前室温下解冻。选取颈椎C3/4间隙,用尖刀切开前纵韧带和纤维环,髓核钳咬除髓核和纤维环,刮勺清除椎间盘组织直达后纵韧带,终板刮刀刮除相邻椎体的椎板直至暴露骨质。在椎间隙水平方向两侧减压达钩椎关节,前后达前、后纵韧带,上下达相邻椎骨。
1.4 3D打印复合材料融合器的制备 获取山羊颈椎标本的全颈椎CT(Siemens 64排螺旋CT)连续扫描Dicom格式原始图像(层厚0.6 mm)。将所得CT数据导入Mimics 18.0(Materialise,Leuven,Belgium),以180~3 071为阈值,用Thresholding工具将骨组织分离出来,使用Region growing工具进行区域性增长,并保存为蒙板;使用Edit Masks工具对蒙板图像进行操作,将C1~C6节颈椎节段完整分离,并使用不同颜色标注区分(图1A),利用Calculate 3D工具对C3和C4进行三维重建;使用Morphology operations工具对细小空洞进行填补并平滑骨性结构表面(图1B)。选择并导出C3、C4椎体为STL格式保存。
利用已经建立的C3和C4的数字模型获得颈椎间隙的结构,通过使用Rhino 5.0(Robert McNeel & Assoc.)可将该间隙实体化并利用该实体通过3D打印制成完全匹配该间隙的个性化解剖型颈椎间融合器。将15 mm×15 mm×10 mm的椎间盘导板模型和颈椎模型导入Rhino 5.0,模拟手术调整至合适位置(图1C),使用布尔运算中的差集运算命令,在C3和C4模型中将融合器导板多余的部分减去(图1D),从而使融合器导板的上下曲面完全匹配颈椎间隙,将Cage导板连同椎体做矢状面四等份分割观察截面以验证其匹配度(图1E)。将上下曲面已修剪完成的融合器(图1F)移出椎体,使用柱状模块对融合器进行布尔差集运算来制作植骨孔(图1G)。将融合器数字模型导出并保存为STL格式,打印3D融合器(图1H)。
1.5 终板匹配评价 对山羊颈椎标本进行颈椎前路椎间盘切除减压植骨融合术(ACDF),按分组方案植入融合器,在C3/4间隙注入造影剂,相同条件下再次CT薄层扫描。根据造影剂显影而融合器不显影的特点,通过计算机软件减影处理,观察融合器周缘与椎体相邻终板间造影剂的高度体积等数据,评估融合器与终板的匹配程度(图2)。实验分4组:采用自体骨组,史赛克颈椎融合器组,威高颈椎融合器组,3D打印PLA/β-TCP复合材料融合器(自行设计)组。分别将不同融合器植入C3/4椎体间隙,按上述方法进行CT扫描,评估终板匹配程度(图2)。
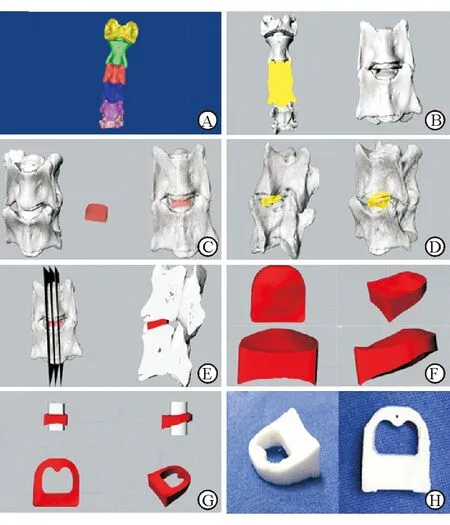
图1 3D打印融合器的设计和制作过程
A:将C1~C6分离,用不同颜色标注;B:填补细小空洞,使椎体表面平滑;C:导入椎间盘导板模型和颈椎模型;D:减去融合器导板多余的部分;E:将Cage导板同锥体做矢状面四等份分割,观察匹配度;F:修剪融合器上下曲面;G:制作植骨孔;H:3D融合器
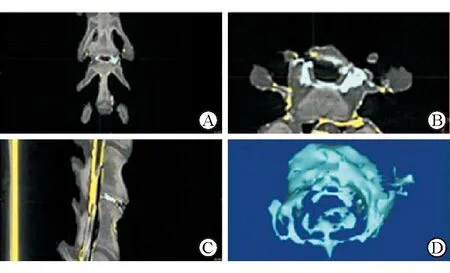
图2 用造影剂显像评估融合器与终板的匹配情况
植入融合器后,将造影剂注入C3/4间隙,CT显影. A:冠状面;B:横状面;C:矢状面;D:去除无效造影剂
1.6 生物相容性测试 3D打印PLA/β-TCP复合材料生物相容性测试采用CCK-8法检测。将所制备的PLA/β-TCP复合材料及纯的PLA料使用3D打印机打印成膜片状,再用剪刀剪成与24孔板相似大小。为保证所有材料上接种的细胞数一样,材料均剪成为1 cm×1 cm正方形小块。每孔种植1×105个细胞,溶解在30 μL的培养液中,滴加在材料上形成滴状,防止培养基外溢,从而保证所有细胞均在材料上,与纯塑料底的培养皿中的细胞数一样。到培养的时间点时,将培养液吸弃,加入含有500 μL的含有10%(V/V)CCK-8的新鲜α-MEM,继续培养2 h。再将24孔板的反应液取100 μL加入到1个新的96孔板中,利用酶标仪在450 nm的波长条件下进行光密度(D)读数。每个样品取6个平行样(n=6;图3)。
1.7 生物力学实验 具体实验步骤参照文献[8],对山羊颈椎标本行C3/4椎间盘切除术处理,使用高速电磨钻处理上下椎体,调整椎间隙高度为5~6 mm,植入内植物后椎间隙高度增加1~2 mm。30具羊颈椎标本按植入物不同分为5组:完整山羊颈椎组;自体三面皮质髂骨组(自体骨组);美敦力威高融合器组;史塞克Solis 融合器组;3D打印融合器组。为确保生物力学实验的可比性,所有融合器均选用大小、宽度、高度相似的型号(图4)。
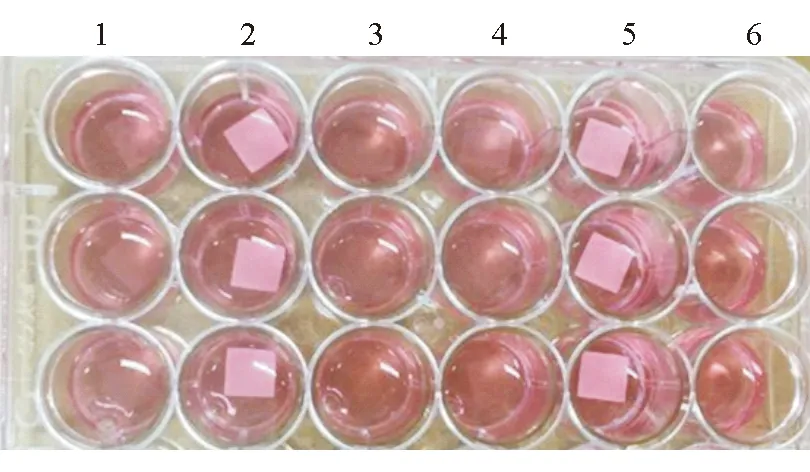
图3 CCK-8实验检测MC3T3-E1细胞活性
1:纯PLA材料;2:PLA/β-TCP复合材料;3:阳性对照;4:纯PLA材料;5:PLA/β-TCP复合材料;6:阳性对照
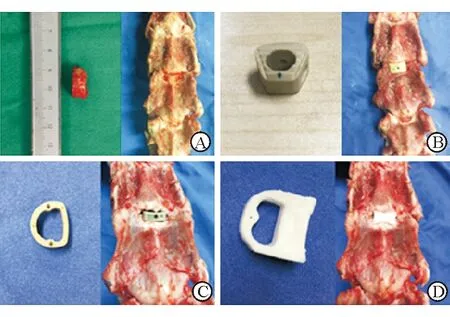
图4 各类融合器及植入后大体观
A:自体骨; B:威高融合器; C:Solis融合器;D:3D打印融合器
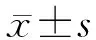
2 结 果
2.1 终板匹配评估 自体骨组平均体积为(21.30±1.21) mm3,威高融合器组体积(29.21±1.03) mm3,Solis融合器组平均体积(28.47±1.41) mm3,3D打印融合器组平均体积为(17.34±0.86) mm3。自体骨组优于威高融合器组和Solis融合器组,差异有统计学意义(P<0.01);3D打印融合器组优于自体骨组,差异有统计学意义(P<0.05);3D打印融合器组明显优于威高融合器组和Solis融合器组(P<0.01);威高融合器组和Solis融合器组间差异无统计学意义(图5)。
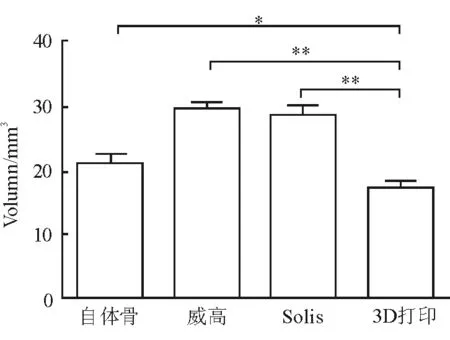
图5 各种材料融合器终板匹配结果
2.2 3D打印PLA/β-TCP复合材料的生物相容性 结果(图6)表明:培养7 d内,所有样品的细胞活性都提高。培养第1天,所有样品没有明显区别;第4天,样品PLA/β-TCP上细胞的活性与另外两组相似,无明显差别;第7天,培养皿底的细胞活性明显高于另外两组,但是纯PLA和PLA/β-TCP复合材料的细胞活性无明显差别。结果提示,适量的β-TCP 加入对成骨细胞没有明显影响,与纯PLA结果相似;3D打印对于上述材料的生物相容性没有明显影响。
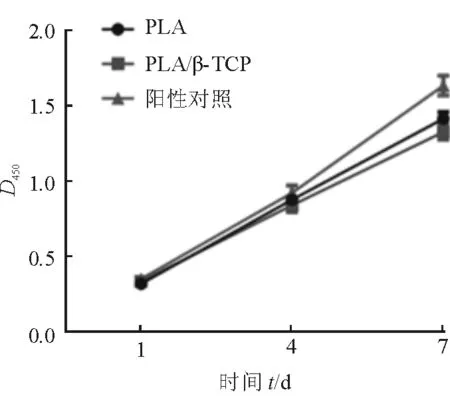
图6 细胞活性
2.3 生物力学检测 结果(图7)表明:在前屈活动度方面,3D打印融合器较自体骨明显减少(P<0.05),但与威高融合器、Solis 融合器差异均无统计学意义;后伸活动度方面,3D打印融合器与自体骨、其他融合器差异均无统计学意义;左侧弯活动度方面,3D打印融合器较自体骨、威高融合器、Solis 融合器均明显减少(P<0.05);右侧弯活动度方面,3D打印融合器较自体骨、威高融合器、Solis融合器均明显减少(P<0.05);左旋活动度方面,3D打印融合器较自体骨、威高融合器、Solis 融合器均明显减少(P<0.05);右旋活动度方面,3D打印融合器较自体骨、威高融合器、Solis 融合器均明显减少(P<0.05)。
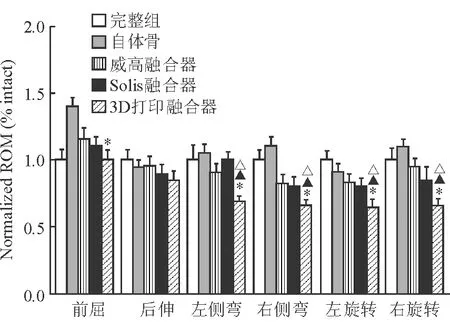
图7 各类融合器的生物力学测试结果
*P<0.05与自体骨相比;△P<0.05与威高融合器相比;▲P<0.05与Solis 融合器相比
3 讨 论
目前,颈椎病的发病率越来越高,主要原因包括异常应力、骨质增生、椎间盘突出、韧带增厚等,结果导致颈椎脊髓、神经根或椎动脉受压,从而出现一系列功能障碍[9]。为了解决中重度颈椎病的脊髓、神经根受压问题,必要的局部减压和融合器选择尤为重要。在脊柱融合术中,最主要的融合方式是使用椎间融合器[10]。
传统融合器在给临床治疗带来益处的同时,其固有的缺陷也促使研究人员对其提出了更高的要求。理想的融合器:刚度与骨接近;可透视观察骨愈合情况;随时间推移及新生骨生长而吸收,最后完全被自体骨替代[11]。这一理念促进了对可吸收融合器的研究。但是,可吸收材料有自身的缺点和不足:首先,其强度通常低于金属和非吸收高分子聚合物融合器;其次,降解后产生的碎屑也会造成炎症反应甚至骨溶解[12]。对于任何可降解物而言,降解产物的局部浓度取决于其产生速率和吸收速率。相对缓慢的降解速率可以使融合器在新骨生长期间保持必要的机械强度直至最终融合,但同时产生刺激组织反应的降解产物。此外,可吸收植入物周围良好的血管化也很重要,可提高降解产物的吸收速率,从而减少降解产物在局部组织中的残留[13]。
虽然生物可吸收聚合物用于整形外科已有30余年,可最近才开始应用于脊柱外科[14]。PLA作为颈椎融合器材料的优势在于:其可以在维持一定范围的理化特性内被加工生产,从而根据不同需要生产出相应的产品。但PLA的降解产物乳酸可使局部组织pH值降低,进而影响细胞正常的活性和功能,导致细胞形态改变甚至死亡[15]。有研究表明,pH值7.2对成骨细胞生长适宜[16]。加入一定量的β-TCP既能提高PLA的骨传导特性,又减轻了其降解产物导致的酸性环境。但是,两种不同材料的加工融合过程以及3D打印过程,包括加热、设计植入及应用环境,都会影响其最终特性。即使是相同组成和相对分子质量的聚合物也会有不同的特征。
有研究[17]发现,含50% β-TCP的复合材料与纯β-TCP材料的骨传导性无明显差异,表明当β-TCP含量达到一定比例时,可与纯β-TCP具有基本相同的骨传导特性。该实验仅制得微米级β-TCP且其复合材料孔隙率较低。另有研究[7]表明,纳米级β-TCP的骨传导性明显优于微米级β-TCP,并且β-TCP含量的多少也会影响支架的骨传导性,而含有20%~30%和50%纳米级β-TCP支架的骨传导性差异无统计学意义。本研究通过反复试制不同比例材料的打印精度,以及结合体外实验结果,选用含20%纳米级β-TCP的PLA复合材料为打印材料,获得了良好的加工测试结果。
椎间融合器的形状和大小对脊椎融合效率、手术时间都有重要的影响。不合适的融合器会明显延长外科手术时间及增加手术难度,而融合器过大或过小都会影响脊柱椎间融合的稳定性,从而增加相应的并发症[18]。终板匹配分析结果显示:相对于自体骨、威高融合器和Solis融合器,3D打印融合器匹配程度最佳。体外生物力学实验进一步验证了3D打印融合器的稳定性明显优于传统融合器。一种新的生物材料要应用于人体,其生物相容性须先经过生物学的评价,体外细胞毒性实验是生物相容性评价的重要部分[19]。本研究通过CCK-8法检测,结果显示,PLA/β-TCP复合材料具有良好的细胞相容性。
尽管3D打印技术目前在生物医学领域被广泛应用,但在脊柱方面却鲜有报道[20]。Serra等[21]第1次将3D打印技术应用于腰椎椎间融合器的研究中,为制定个性化脊椎融合器提供了新的思路。本研究利用3D技术研制可吸收性颈椎融合器,在该领域目前还尚未见报道,具有一定的创新性。但本研究只是初步探讨,对于3D打印融合器长期稳定性缺乏动物实验。因此,3D打印融合器的空间结构和外形对其生物相容性的影响需要进一步研究。
综上所述,3D打印PLA/纳米级β-TCP可吸收颈椎融合器具有较好的生物兼容性和机械稳定性,为研制新型颈椎融合器提供了新的选择,具有良好的临床应用前景。
[ 1 ] LIED B, ROENNING P A, SUNDSETH J, et al. Anterior cervical discectomy with fusion in patients with cervical disc degeneration: a prospective outcome study of 258 patients (181 fused with autologous bone graft and 77 fused with a PEEK cage)[J]. BMC Surg, 2010,10: 10.
[ 2 ] KEPLER C K, RAWLINS B A. Mesh cage reconstruction with autologous cancellous graft in anterior cervical discectomy and fusion[J]. J Spinal Disord Tech, 2010,23(5): 328-332.
[ 3 ] HELLBUSCH L C, SPANGLER W J, BOWDER A. Radiographic PEEK double-lucency finding after anterior cervical discectomy and fusion with local autograft and PEEK spacer: a preliminary study[J]. J Neurosurg Spine, 2012,16(3): 248-250.
[ 4 ] CROUZIER T, SAILHAN F, BECQUART P, et al. The performance of BMP-2 loaded TCP/HAP porous ceramics with a polyelectrolyte multilayer film coating[J]. Biomaterials, 2011,32(30): 7543-7554.
[ 5 ] WANG J, QU L, MENG X, et al. Preparation and biological properties of PLLA/beta-TCP composites reinforced by chitosan fibers[J]. Biomed Mater, 2008,3(2): 025004.
[ 6 ] SONG K J, CHOI B Y. Current concepts of anterior cervical discectomy and fusion: a review of literature[J]. Asian Spine J, 2014,8(4): 531-539.
[ 7 ] CAO L, DUAN P G, WANG H R, et al. Degradation and osteogenic potential of a novel poly(lactic acid)/nano-sized beta-tricalcium phosphate scaffold[J]. Int J Nanomedicine, 2012,7:5881-5888.
[ 8 ] CAO L, DUAN P G, LI X L, et al. Biomechanical stability of a bioabsorbable self-retaining polylactic acid/nano-sized beta-tricalcium phosphate cervical spine interbody fusion device in single-level anterior cervical discectomy and fusion sheep models[J]. Int J Nanomedicine, 2012,7:5875-5880.
[ 9 ] ANDERSON D G, ALBERT T J. Bone grafting, implants, and plating options for anterior cervical fusions[J]. Orthop Clin North Am, 2002,33(2):317-328.
[10] HEIDA K JR, EBRAHEIM M, SIDDIQUI S, et al. Effects on clinical outcomes of grafts and spacers used in transforaminal lumbar interbody fusion: a critical review[J]. Orthop Surg, 2013,5(1): 13-17.
[11] JELONEK K, LI S, WU X, et al. Self-assembled filomicelles prepared from polylactide/poly(ethylene glycol) block copolymers for anticancer drug delivery[J]. Int J Pharm, 2015, 485(1-2): 357-364.
[12] KIM T K, JEONG T W, LEE D H. Foreign body reaction after PLC reconstruction caused by a broken PLLA screw[J]. Orthopedics, 2014, 37(12): e1129-e1132.
[13] CHEN X, YANG X, PAN J, et al. Degradation behaviors of bioabsorbable P3/4HB monofilament sutureinvitroandinvivo[J]. J Biomed Mater Res B Appl Biomater, 2010,92(2): 447-455.
[14] VACCARO A R, SINGH K, HAID R, et al. The use of bioabsorbable implants in the spine[J]. Spine J, 2003, 3(3): 227-237.
[15] KANG Y, YAO Y, YIN G, et al. A study on the in vitro degradation properties of poly(L-lactic acid)/beta-tricalcuim phosphate (PLLA/beta-TCP) scaffold under dynamic loading[J]. Med Eng Phys, 2009,31(5): 589-594.
[16] KAYSINGER K K, RAMP W K. Extracellular pH modulates the activity of cultured human osteoblasts[J]. J Cell Biochem, 1998,68(1): 83-89.
[17] AUNOBLE S, CLEMENT D, FRAYSSINET P, et al. Biological performance of a new beta-TCP/PLLA composite material for applications in spine surgery:invitroandinvivostudies[J]. J Biomed Mater Res A, 2006,78(2):416-422.
[18] PALISSERY V, MULHOLLAND R C, MCNALLY D S. The implications of stress patterns in the vertebral body under axial support of an artificial implant[J]. Med Eng Phys, 2009,31(7):833-837.
[19] SIQUEIRA L, PASSADOR F R, COSTA M M, et al. Influence of the addition of beta-TCP on the morphology, thermal properties and cell viability of poly (lactic acid) fibers obtained by electrospinning[J]. Mater Sci Eng C Mater Biol Appl, 2015,52: 135-143.
[20] TANG D, TARE R S, YANG L Y, et al. Biofabrication of bone tissue: approaches, challenges and translation for bone regeneration[J]. Biomaterials, 2016,83:363-382.
[21] SERRA T, CAPELLI C, TOUMPANIARI R, et al. Design and fabrication of 3D-printed anatomically shaped lumbar cage for intervertebral disc (IVD) degeneration treatment[J]. Biofabrication, 2016, 8(3):035001.
[本文编辑] 姬静芳, 贾泽军
Biocompatibility and biomechanics study on novel 3D printed polylactic acid/nano-scale β-TCP degradable cervical fusion cage
YANG Jie-lai, XU Jun, GU Hui-jie, YIN Xiao-fan*
Department of Orthopedics Surgery, Minhang Hospital, Zhongshan Hospital, Fudan university, Shanghai 201100, China
Objective: To discuss the biocompatibility and biomechanics properties of novel 3D printed polylactic acid (PLA)/nano-scale β-TCP degradable cervical fusion cage.Methods: The computer-assisted design (CAD) system and 3D printer were used to design and fabricate the personalized goat cervical fusion device and the endplate matching was evaluated and analyzed. The biocompatibility of 3D printed fusion device was tested by cell experiment. The biomechanical stability of 3D printed cage was analyzed after being implanted into the goat cervical spine.Results: The matching degree of 3D printed cage was significantly higher than that of autologous bone, Wego cage, and Solis cage (P<0.05). The differences were statistically significant (P<0.05). There was no significant difference in cell viability between pure PLA materials and 3D-printed PLA/nano-β-TCP composites. On the left and right sides of the flexion and rotation of the ROM, 3D printed composite fusion device were less than the autologous iliac, Wego cage, and Solis cage, the differences were statistically significant (P<0.05). In the flexion ROM, although the 3D printed fusion device was less than the autogenous iliac bone (P<0.05), but there was no significant difference with the Wego cage, and Solis cage. In the posterior ROM, there was no significantly difference between 3D printed fusion device and autologous iliac, Wego cage, or Solis cage.Conclusions: The 3D printed PLA/nano-scale β-TCP degradable cervical fusion device showed good biocompatibility and mechanical stability, which indicating a promising clinical application prospect.
3D printing; cervical cage; biodegradation; polylactic acid; β-TCP
R 681.5
A
2017-08-07 [接受日期] 2017-08-20
杨接来,硕士,住院医师. E-mail: jielai1990@163.com
*通信作者(Corresponding author). Tel: 021-64923400-6170, E-mail: 18918169029@189.cn
10.12025/j.issn.1008-6358.2017.20170675

