两种流式细胞术分析软件用于检测小鼠骨髓造血干祖细胞的方法比较*
付伟超 梁昊岳 王 楠 于文颖 程雪莲 任怡然 杨晚竹 陈 婷 白 杨 董 芳*
两种流式细胞术分析软件用于检测小鼠骨髓造血干祖细胞的方法比较*
付伟超①梁昊岳①王 楠①于文颖①程雪莲①任怡然①杨晚竹①陈 婷①白 杨①董 芳①*
目的:探讨流式细胞术中两种不同分析软件在小鼠造血干细胞(HSC)分析中的特点和差异。方法:使用小鼠骨髓细胞悬液作为实验材料,采用BD Aria Ⅲ流式细胞仪检测小鼠造血干祖细胞(HSPCs),分别应用BD FACSDiva Software v6.1.3和FlowJo 7.6.1软件对检测数据进行分析,并对比分析其数据结果。结果:FACSDiva与FlowJo软件在数据导入、数据显示、圈门、补偿调节、数据导出和特色分析等存在细微差异,各项检测指标均可实现多色流式细胞分析功能。结论:FACSDiva和FlowJo软件分析同一样本所得结果具有较高的一致性。
流式细胞术;造血干祖细胞;FACSDiva软件;FlowJo软件
造血干细胞(hematopoietic stem cell,HSC)存在于哺乳动物不同阶段造血器官,如胎肝、脐血和骨髓中,被特定的造血微环境包围[1]。HSC可以具体分为长周期造血干细胞(long term-haematopoietic stem cell,LT-HSC)和短周期造血干细胞(short term-hematopoietic cell,ST-HSC),在造血系统发生过程及造血稳态的维持中发挥着十分重要的作用。小鼠HSC常用的表面标记有系列抗原Lin、Sca-l和c-Kit等,其余表面标记如Flk2、CD34和CD61常与LSK联合使用[2-4]。LT-HSC是Flk2阴性,而Flk2+HSC主要是拥有短期造血重建功能的STHSC[5]。应用流式细胞技术分析小鼠骨髓造血干祖细胞(hematopoietic stem and progenitor cells,HSPCs),是进行骨髓移植重建等科研实验工作的基础,具有重要的科学意义。
近年来,随着流式细胞术的不断发展,流式分析软件的功能也在不断优化,以满足流式细胞术使用者在细胞周期、凋亡和表型等多方面的应用需求。FACSDiva软件和FlowJo软件是目前科学研究中最常用的两款流式分析软件,但目前对上述两款软件的使用分析方法的对比研究尚无报道。为此,本研究对不同流式分析软件的使用方法进行对比分析,并对应用不同软件检测小鼠骨髓HSPCs的分析结果进行比较,旨在能够为流式分析软件的使用者提供借鉴。
1 材料与方法
1.1 仪器与材料
BD Aria Ⅲ型流式细胞仪(美国Becton Dickinson公司),Rainbow Beads。APC-Cy7标记的抗小鼠Lineage抗体、APC标记的抗小鼠c-kit抗体、FITC标记的抗小鼠CD34抗体、PE-Cy7标记的抗小鼠Sca-1抗体和PE标记的抗小鼠CD16/32抗体(美国eBioscience公司);1×磷酸盐缓冲液(phosphatebuffer solution,PBS)鞘液(无锡傲锐东源生物科技有限公司)。
1.2 方法
1.2.1 样品制备
将Rainbow Beads用无菌鞘液稀释备用,取小鼠骨髓细胞,使用流式抗体染色,避光30 min后用2 ml磷酸缓冲液洗涤细胞,离心后重悬于PBS溶液,溶液中细胞浓度水平在107个细胞/ml以下,2 h内上机进行流式分析。
1.2.2 样品检测
开启BD Aria Ⅲ型流式细胞仪,用Rainbow Beads检测仪器各通道,应用FACSDiva检测软件。在前向角散射光(forward scatter,FSC)和侧向角散射光(side scatter,SSC)散点图中显示细胞群,调节荧光电压等参数,记录总细胞数≥200 000个,保存实验数据(.FCS格式)。
1.2.3 小鼠骨髓HSC流式分析
分别应用BD FACSDiva Software v6.1.3和FlowJo 7.6.1分析软件,对小鼠骨髓HSC进行流式分析,圈选表型为Lin-CD34-c-kit+sca-1+的小鼠骨髓HSC,分析细胞群比例。
2 结果
2.1 FACSDiva和FlowJo软件总观
FACSDiva分析软件总观主要由文件导入、数据列表、流式图显示、补偿调节及数据保存等模块组成,如图1所示。
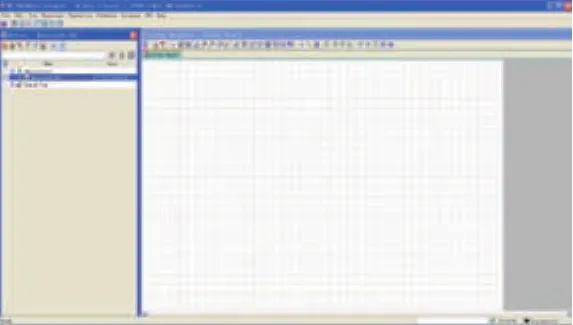
图1 FACSDiva软件总观界面图
FlowJo软件总观主要由文件导入、数据列表、流式图显示、补偿调节及数据保存等模块组成,如图2所示。

图2 FlowJo软件总观界面图
两款软件都可以完成多色的流式分析并确定细胞群比例,二者在总观方面有如下区别:①FACSDiva软件为界面式操作软件,可全屏显示于两个电脑显示器,操作较为方便,显示空间较大,各模块显示可不重叠,而FlowJo软件为窗口式操作软件,每使用一个模块的功能需要打开一个新的对话框,各模块显示具有重叠性,但节省成本和空间;②FACSDiva软件具备流式分析结果图显示界面,可以将所有流式图完整地展现在一个界面内,而FlowJo软件未设计显示界面,需将流式图逐级打开。
2.2 FACSDiva和FlowJo软件数据导入比较
FACSDiva和FlowJo两款软件均可导入FCS格式的流式检测数据并显示流式结果图,二者主要区别如下。
(1)FACSDiva通过先建立experiment,然后点击File界面下的Import选项导入实验数据(FCS文件),而FlowJo通过拖拽式文件导入模式,可直接将完整的数据文件夹一次性拖拽进入软件内,完成流式数据的导入,如图3、图4所示。

图3 FACSDiva软件数据导入界面图
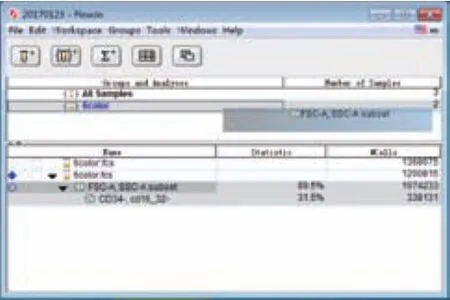
图4 FlowJo软件数据导入界面图
(2)在数据导入方面,FlowJo软件操作更加简易便捷。向FlowJo中导入数据时,储存实验数据(FCS文件)的各层文件夹要求不能有中文字符,否则会导致流式图无法正常显示,而向FACSDiva中导入数据时则无此要求。
2.3 FACSDiva和FlowJo软件数据显示比较
FACSDiva和FlowJo两款软件均可显示流式单参数直方图、双参数散点图、密度图和等高线图等常见流式结果图,显示图形结果具有一致性,如图5、图6所示。

图5 FACSDiva软件数据显示界面图

图6 FlowJo软件数据显示界面图
FACSDiva和FlowJo两款软件差别为:①FACSDiva软件改变横纵坐标表示方式(线性或对数)需要在Inspector对话框中调节,而FlowJo软件可以直接通过坐标旁边的按钮调节;②FACSDiva软件需新建“Show Population Hierarchy”对话框来显示不同等级的细胞群比例,而FlowJo软件会自动随着圈门步骤的进行,在各窗口中直接显示细胞群比例;③FACSDiva软件可以通过选择“Create Statistic View”选项,显示包括Max、Min、Mean、Median、SD、rSD、%CV和%rCV等在内的多项参数。
FACSDiva和FlowJo软件变换荧光通道显示界面主要区别在于,FlowJo软件可以直接显示各荧光通道是否已经调节荧光补偿,调过补偿后各通道标识前面会加入“Comp-”标记,同时在主界面流式管左侧加图标,给予使用者提示和方便,FACSDiva软件没有这一显示,如图7、图8所示。2.4 FACSDiva和FlowJo软件圈门比较

图7 FACSDiva软件变换荧光通道显示界面图

图8 FlowJo软件变换荧光通道显示界面图
FACSDiva和FlowJo两款软件都可以运用不同的设门工具对流式数据结果中目的细胞群进行圈门操作并显示下一级流式门内的细胞群比例,如图9、图10所示。

图9 FACSDiva软件圈门界面图

图10 FlowJo软件圈门界面图
通过FACSDiva和FlowJo软件显示下一级流式门界面显示,二者主要区别为:FACSDiva软件通过先建立流式图,然后右键选择“Show Populations”来选择所要显示的目的细胞群,这一操作也可以在“Inspector”中的“Population”选项中完成,而FlowJo软件可以通过直接单击上一级流式门内区域,软件自动弹出此流式门内图形的方式来完成下一级流式图的显示,如图11、图12所示。

图11 FACSDiva软件显示下一级流式图界面图

图12 FlowJo软件显示下一级流式图界面图
2.5 FACSDiva和FlowJo软件荧光补偿调节比较
由于在流式细胞检测中,荧光素的发射光谱存在重叠现象,单个荧光通道中的信号会部分渗漏到其他通道中,造成信号误差,所以通过流式分析软件进行补偿调节对数据分析具有重要的意义。两款流式分析软件都具有将其他通道渗漏到当前通道的信号扣除的功能,保证流式细胞分析的准确性和细胞群比例的可靠性,FACSDiva和FlowJo软件荧光补偿调节界面如图13、图14所示。
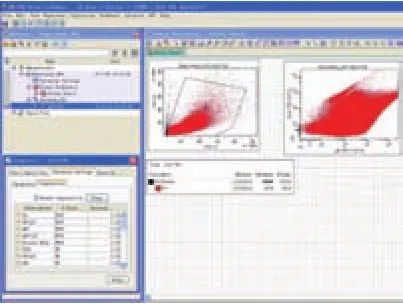
图13 FACSDiva软件荧光补偿调节界面图

图14 FlowJo软件荧光补偿调节界面图
FACSDiva和FlowJo软件主要区别为:①FACSDiva软件在“Cytometer Settings”界面下的“Compensation”对话框中调节补偿,而FlowJo软件在“Windows”界面下的“Open Compensation Editor”对话框中调节补偿,FACSDiva软件以列表方式显示补偿参数,而FlowJo软件以矩阵方式显示补偿参数;②FACSDiva软件在完成补偿调节后,可通过单击“Enable Compensation”使补偿结果应用于流式数据,而FlowJo软件则通过“Compensation”界面下的“Add To Group”选项应用补偿值于数据组,如图15所示。

图15 FlowJo软件荧光补偿应用于数据组界面图
FACSDiva和FlowJo软件荧光补偿调节完成后,流式散点图符合“横平竖直”原则,补偿调节结果理想,如图16、图17所示。

图16 FACSDiva软件荧光补偿调节后流式界面图

图17 FlowJo软件荧光补偿调节后流式界面图
2.6 FACSDiva和FlowJo软件分析小鼠骨髓HSC造血干祖细胞比例比较
分别使用FACSDiva和FlowJo软件分析小鼠骨髓HSPCs造血干祖细胞流式比例数据,P7门内为小鼠骨髓LT-HSC,其表型为Lin-c-kit+sca-1+CD34-CD16/32;P5门内为小鼠骨髓ST-HSC,其表型为Lin-c-kit+sca-1+CD34+CD16/32-;P6门内为小鼠骨髓多能祖细胞(multiple potential pro-genitor,MPP),其表型为Lin-c-kit+sca-1+CD34+CD16/32+。FACSDiva和FlowJo软件分析小鼠骨髓HSPCs群比例结果:LT-HSC为6.7%和6.09%,ST-HSC为32.6%和32.2%,MPP为57.4%和58.4%,分析结果具有较高的一致性(如图18、图19所示)。

图18 FACSDiva分析小鼠骨髓HSPCs造血干祖细胞比例
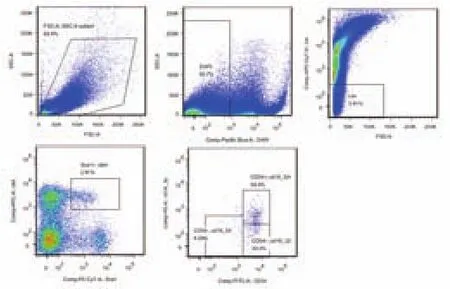
图19 FlowJo软件分析小鼠骨髓HSPCs造血干祖细胞比例
2.7 FACSDiva和FlowJo软件分析结果导出比较
FACSDiva和FlowJo两款软件均可将流式图通过“Copy”或“Copy Picture”的方式导出到画图软件中,完成图片格式的保存,两款软件分析流式图导出界面如图20、图21所示。
值得注意的是,FACSDiva软件可以将完整的流式结果保存为.pdf文件,也可以将多个流式分析结果通过“Batch Analysis”的方式一键保存;而FlowJo软件可以将流式分析得到的不同门内的细胞数和细胞群比例导出为Excel格式的数据,方便后续的统计分析。两款软件在数据保存方面各有优势,各具特色,其数据导出界面如图22、图23所示。

图20 FACSDiva软件分析流式图导出界面图

图21 FlowJo软件分析流式图导出界面图

图22 FACSDiva软件分析数据导出界面图

图23 FlowJo软件分析数据导出界面图
2.8 FlowJo软件特色分析功能
(1)在常规流式分析中,一般采用直方图和散点图显示流式数据结果,分别显示一维和二维的数据信息,而FlowJo软件完成了对流式数据的三维分析,即在一幅流式图中显示三个流式参数,实现了数据呈现方式的多样化,促进了流式软件分析功能的进步和发展。同时,FlowJo软件还设计了细胞周期、增殖和细胞动力学等分析功能,拓展了流式分析软件的综合分析功能,FlowJo软件分析三维显示功能和高级分析功能如图24、图25所示。

图24 FlowJo软件分析三维显示功能界面图

图25 FlowJo软件高级分析功能界面图
(2)对于细胞周期分析,实现了与Modfit软件向媲美的分析功能,可以通过函数模拟,实现对检测样本G0/G1、S、G2/M各期的细胞群比例分析,集合软件自动分析和人工手动分析两种方式,最大程度的保证了分析的准确性和实验结果的一致性。两种流式分析软件主要功能比较见表1。
3 讨论
近年来,流式细胞术获得了突飞猛进的发展,在血液学等领域有着更为广泛的应用[6-10]。流式细胞仪的发展趋势是向多激光多色、小型化和高速分析分选方面发展。此外,流式细胞仪聚焦原理多样化和与其他生物学技术密切结合也是流式细胞仪发展的一大特色。在传统的应用流体力学聚焦原理的流式细胞仪基础上,发展出了应用声波聚焦原理的流式细胞仪、微毛细管技术为核心的流式细胞仪、将流式细胞检测与荧光显微成像相结合的显微成像流式细胞仪和采用金属元素标记物识别细胞信号分子的质谱流式细胞仪等[11-13]。然而,目前部分流式细胞仪仍存在操作复杂、软件友好程度低的情况,因此,不断开发流式分析软件功能、优化软件设计、使软件使用更加便捷具有重要的意义。

表1 两种流式分析软件主要功能比较
FACSDiva软件是美国BD公司开发的一款集操作和分析于一体的流式软件,广泛应用于包括BD LSRⅡ、BD LSRFortessa、BD CantoⅡ和BD Aria系列在内的流式细胞仪中。FlowJo软件是由美国斯坦福大学设计研发的一款功能强大的流式数据分析软件,可以分析任何流式细胞仪收集的流式数据,是流式领域最受推荐的一款专业分析软件之一。FACSDiva软件和FlowJo软件在分析细胞周期、凋亡和表型等方面具有高度的可信性,两种流式分析软件的主要功能比较见表1,二者在数据导入、数据显示及补偿调节等方面略具差异[14-15]。同时,FlowJo软件具备部分独特的高级分析功能,如三维显示、周期分析等,极大扩展了该软件的应用范围。
4 结语
通过分析和比较了两款常用的流式细胞分析软件和小鼠骨髓HSPCs流式结果,为流式分析软件的使用提供了借鉴。流式分析软件是解读流式数据不可或缺的工具,未来在FACSDiva和FlowJo软件的帮助下,流式细胞仪在临床和科研领域的应用范围会更加广阔、更为深入,不断为人类认识疾病、治疗疾病提供科学依据。
[1]Qing Y,Lin Y,Gerson SL.An intrinsic BM hematopoietic niche occupancy defect of HSC in scid mice facilitates exogenous HSC engraftment[J].Blood,2012,119(7):1768-1771.
[2]Yokota T,Oritani K,Butz S,et al.The endothelial antigen ESAM marks primitive hematopoietic progenitors throughout life in mice[J].Blood,2009,113(13):2914-2923.
[3]Buzavidas N,Cheng M,Duarte S,et al.FLT3 receptor and ligand are dispensable for maintenance and posttransplantation expansion of mouse hematopoietic stem cells[J].Blood,2009,113(15):3453.
[4]Chen J,Ellison FM,Keyvanfar K,et al.Enrichment of hematopoietic stem cells with SLAM and LSK markers for the detection of hematopoietic stem cell function in normal and Trp53 null mice[J]. Exp Hematol,2008,36(10):1236-1243.
[5]田晨.流式细胞术在小鼠造血干细胞分析分选中的应用[J].国际输血及血液学杂志,2012,35(4):370-372.
[6]张学艳,王军.流式细胞仪在血液学检验中的应用[J].中国医学装备,2008,5(5):8-11.
[7]刘涛,张巍,王凤阳,等.流式细胞仪在免疫学研究中的应用[J].动物医学进展,2008,29(3):102-105.
[8]张琰,温浩,张朝霞.流式细胞仪在医学中的应用[J].新疆医科大学学报,2005,28(1):92-93.
[9]李娟,王静.流式细胞仪在医学检验中的应用[J].中国实用医药,2010,5(36):101-102.
[10]王爱贞,王光,郑兰华,等.胸腔镜肺癌根治术与开胸肺癌根治术患者围术期免疫指标及应急激素对比[J].中国医学装备,2016,13(12):92-95.
[11]Grimwade L,Gudgin E,Bloxham D,et al.PML protein analysis using imaging flow cytometry[J]. J Clin Pathol,2011,64(5):447-450.
[12]Zuba-Surma EK,Kucia M,Abdel-Latif A,et al. The ImageStream System:a key step to a new era in imaging[J].Folia Histochem Cytobiol,2007,45(4):279-290.
[13]Sitton G,Srienc F.Single-cell tracking with a reversing flow cytometer[J].Cytometry Part A,2011,79(1):66-76.
[14]刘飒,崔巍,王晓波,等.流式细胞术检测细胞周期分析软件的比较[J].新乡医学院学报,2012,29(11):870-873.
[15]崔巍,牛福玲.流式细胞术检测细胞凋亡的分析软件比较[J].北京中医药大学学报,2001,24(6):45-47.
Comparison of two analysis softwares of flow cytometry for the detected results of mice bone marrow hematopoietic stem and progenitor cells/
FU Wei-chao, LIANG Hao-yue, WANG Nan, et al//
China Medical Equipment,2017,14(9):161-166.
Objective: To explore the characteristics and differences of two analysis softwares used in flow cytometric analysis of mice bone marrow hematopoietic stem and progenitor cell. Methods: Mice bone marrow cells were used as experimental materials, and BD Aria III flow cytometer was used to detect HSPCs, and FACSDiva Software v6.1.3 and Flow Jo 7.6.1 software were used to analyze the detected data, respectively, and then these data were compared and further analyzed. Results: There were slightly differences between FACS Diva and FlowJo in data import, data display, gating, compensation regulation, data export and special analysis and so on. Besides, both of the two softwares could achieve the function of multicolor flow analysis in these indicators. Conclusion: Results of the same sample analyzed, respectively, by FACS Diva and Flow Jo are highly consistent.
Flow cytometry; Hematopoietic stem and progenitor cell; FACSDiva software; FlowJo software
State Key Laboratory of Experimental Hematology, Institute of Hematology & Blood Disease Hospital, Chinese Academy of Medical Sciences & Peking Union Medical College, Tianjin 300020, China.
1672-8270(2017)09-0161-06
R-331
A
10.3969/J.ISSN.1672-8270.2017.09.046

2017-03-24
国家自然科学基金青年项目(81500085)“p18在造血干细胞向B细胞分化中的作用及机制研究”;北京协和医学院协和青年基金(332015125)“Puma基因缺陷对造血干细胞扩增的影响及其机制研究”
①中国医学科学院北京协和医学院血液病医院(血液学研究所) 实验血液学国家重点实验室 天津 300020
*通讯作者:dongfang@ihcams.ac.cn
付伟超,男,(1992- ),本科学历,技师。中国医学科学院北京协和医学院血液病医院(血液学研究所)从事流式细胞测试工作。

