草木樨中华根瘤菌CHW10B溶磷特性及其对南方红豆杉的促生作用
李云玲,侯沁文,刘瑞祥,任嘉红,张 易
(1.长治学院生物科学与技术系,山西 长治 046011; 2.太行山生态与环境研究所,山西 长治 046011)
草木樨中华根瘤菌CHW10B溶磷特性及其对南方红豆杉的促生作用
李云玲1, 2,侯沁文1, 2,刘瑞祥1, 2,任嘉红1, 2*,张 易1
(1.长治学院生物科学与技术系,山西 长治 046011; 2.太行山生态与环境研究所,山西 长治 046011)
目的探讨南方红豆杉根际微生物草木樨中华根瘤菌(Sinorhizobiummeliloti)CHW10B的溶磷特性及促生作用。方法利用液体发酵试验比较不同时间、碳源、氮源、碳氮比、培养温度等条件下CHW10B菌株的溶磷量,采用温室盆栽法研究该菌株对南方红豆杉生长的影响,并分析该菌株产嗜铁素、精氨酸脱羧酶、ACC脱氨酶及有机酸等成分的能力。结果该菌株分别在培养时间4 d、磷酸钙5.00 g·L-1、初始pH值 7.0、装液量1/2、NaCl为0.0 g·L-1、温度30℃、碳源为葡萄糖、氮源为硫酸铵、碳氮比100∶1时溶磷能力最强。将该菌株接种于1年生南方红豆杉实生苗360 d后,苗木的地径、苗高、生物量比对照分别增长了19.53%、20.14%、25.39%。该菌株能够产嗜铁素、精氨酸脱羧酶、ACC脱氨酶(0.922 U·mg-1)和IAA(8.908 mg·mL-1),并可分泌大量有机酸—葡萄糖酸(5 704.92 μg·L-1)。结论草木樨中华根瘤菌CHW10B溶磷能力强,对南方红豆杉促生作用显著,适用于多种不同酸碱性土壤,可高效应用于南方红豆杉的人工栽培,具有被开发为生物肥料的潜力。
草木樨中华根瘤菌;南方红豆杉;溶磷;促生作用
Abstract:[Objective] A phosphate-solubilizing bacterium,SinorhizobiummelilotiCHW10B, was selected fromTaxuschinensisvar.mairei. Its phosphate-solubilizing characteristics and growth-promoting effect onT.chinensisvar.maireiwere studied. [Method] The effects of culture time, Ca3(PO4)2concentration, carbon sources, nitrogen sources, initial pH, liquid filling volume, salt ions and other environment factors on phosphate solubilizing ability of strain CHW10B were studied by liquid fermentation experiment. Pot experiment was conducted to evaluate the role of strain CHW10B in promoting the growth ofT.chinensisvar.mairei. Some growth-promoting mechanism such as producing ACC deaminase, siderophore, indoleacetic acid, arginine decarboxylase and organic acid were determined. [Result]The results showed that CHW10B strain displayed the highest phosphate-dissolving capacity when the cultivation period was 4 days, the amount of calcium phosphate was 5.00 g·L-1, the initial pH reached 7.0,the volume of liquid was 1/2, the NaCl concentration was 0.0 g·L-1and the temperature was 30℃. The phosphate solubilizing capacity of the strain got the highest when using glucose as carbon source and ammonium sulfate as nitrogen source. Moreover, the ratio of carbon to nitrogen (100∶1) is optimum for strain CHW10B. After being inoculated with strain CHW10B, the ground diameter, seedling height and biomass of 1-year-oldT.chinensisvar.maireiseedlings increased by 19.53%, 20.14% and 25.39% in 360 days’ post-inoculation, respectively. The strain could produce siderophore, arginine decarboxylase, ACC deaminase (0.922 U·mg-1) and IAA (8.908 mg·mL-1), and secrete a large amount of gluconic acid (5 704.92 μg·L-1). [Conclusion]S.melilotiCHW10B has strong phosphorus-solubilizing capability, and plays a significant promoting role in the growth ofT.chinensisvar.mairei. The strain can be applied to a variety of soils of different acidity-alkalinity. The result would be an important reference for further exploring of the CHW10B strain in production of bio-fertilizer and high efficient cultivation onT.chinensisvar.mairei, etc.
Keywords:Sinorhizobiummeliloti;Taxuschinensisvar.mairei; phosphate-solubilization; growth-promoting effect

南方红豆杉(Taxuschinensis(Pilger) Rehd. var.mairei(Lemee et Levl.) Cheng et L. K. Fu)是我国一级保护野生濒危药用植物,采取人工栽培措施,在一定程度上能够克服南方红豆杉天然林生长缓慢、资源紧缺的问题[9]。本课题组前期从南方红豆杉根际分离筛选到1株高效溶无机磷细菌——草木樨中华根瘤菌(Sinorhizobiummeliloti)CHW10B,经初步研究发现,该菌株对南方红豆杉60 d实生苗幼苗期生长有明显的促生作用[8],并能稳定地定殖于南方红豆杉根际和根部[10]。本研究在前期工作的基础上,进一步探讨该菌株产IAA、ACC脱氨酶、嗜铁素及精氨酸脱羧酶等促生长特性,分析比较其溶磷特性及对1年生南方红豆杉的促生效果,旨在完善该菌株的系统研究,为高效利用该菌株以更好提高南方红豆杉人工栽培效率、丰富生物肥料菌种资源奠定基础。
1 材料
1.1供试菌株
高效溶磷草木樨中华根瘤菌CHW10B,由本课题组前期从南方红豆杉根际分离筛选得到。
1.2供试植物
南方红豆杉1年生盆栽实生苗,栽培于长治市林业局苗圃。
1.3供试培养基

2 研究方法
2.1CHW10B菌株溶磷动态

2.2磷酸钙浓度对CHW10B菌株溶磷能力的影响
向灭菌的NBRIP培养基中分别加入终浓度为0.63、1.25、2.50、5.00、10.00g·L-1的磷酸钙,按1%接种量接入CHW10B种子液。各处理均设3个重复和1个空白对照,在30℃、180r·min-1培养最适天数(4d)后,取适量发酵液测定可溶性磷含量,方法同2.1。
2.3碳源、氮源、碳氮比对CHW10B菌株溶磷能力的影响
将葡萄糖、果糖、蔗糖、甘露醇、麦芽糖和可溶性淀粉分别按1%比例加入到NBRIP液体培养基中作为唯一碳源;将(NH4)2SO4、NH4NO3、KNO3、牛肉膏、酵母膏、蛋白胨分别按0.1‰的比例加入NBRIP液体培养基中作为唯一氮源;以最适的碳源和氮源,将NBRIP培养基的C/N调到150/1、125/1、100/1、75/1、50/1和25/1。每处理设3个重复和1个空白对照,按1%接种量进行接种,在30℃、180r·min-1培养最适天数(4d)后,测定可溶性磷含量,方法同2.1。
2.4温度、pH值、装液量、NaCl浓度对CHW10B菌株溶磷能力的影响
按1%的接种量将CHW10B种子液接入到NBRIP液体培养基中,设置培养温度分别为20、25、30、35、40℃;将NBRIP液体培养基pH值分别调至4、5、6、7、8、9、10;分别将20、40、50、60、80mLNBRIP培养基加入到100mL三角瓶中,使其体积比分别为1/5、2/5、1/2、3/5、4/5;调节NBRIP培养基的NaCl浓度为0.0、2.5、5.0、10.0、15.0、20.0g·L-1。各处理设3个重复和1个空白对照,30℃、180r·min-1培养最适天数(4d)后,测定可溶性磷含量,方法同2.1。
2.5CHW10B菌株产有机酸、ACC脱氨酶、IAA、ADC、嗜铁素能力测定

参考Saleh等[11,13]的研究方法进行CHW10B菌株ACC脱氨酶活性测定,IAA含量测定采用Salkowski比色法[14],产精氨酸脱羧酶(ADC)能力测定参照Sun等[15]的方法,产嗜铁素参照Yu等[16]的方法采用CAS平板进行定性检测。
2.6CHW10B菌株对1年生南方红豆杉的促生作用

3 结果与分析
3.1CHW10B菌株溶磷量动态变化
从图1可看出:前4dCHW10B菌株培养液的可溶磷含量逐渐增加,到第4天时达到峰值(757.752mg·L-1),此时溶磷能力最强;4d后该菌的溶磷能力明显降低,但到第7天却有所回升,回升原因可能是培养后期营养耗尽,菌体细胞大量死亡裂解导致可溶性磷释放。以上结果说明,该菌株溶磷的最佳培养时间为4d。
3.2磷酸钙浓度对CHW10B菌株溶磷能力的影响

3.3碳源、氮源、碳氮比对CHW10B菌株溶磷能力的影响
3.3.1碳源对CHW10B菌株溶磷能力的影响 图3表明:不同碳源明显影响CHW10B菌株溶解磷酸钙的能力;以葡萄糖为唯一碳源时,该菌株溶磷能力最强,溶磷量达740.310mg·L-1;其次为果糖(79.457mg·L-1);以麦芽糖、甘露醇、蔗糖和可溶性淀粉为碳源时,溶磷量大幅降低,尤其以可溶性淀粉为碳源时,溶磷量最小(2.907mg·L-1)。由此可知,葡萄糖为CHW10B菌株充分发挥其溶磷功能的最适碳源。因此,在CHW10B菌株的实践应用中,应考虑与可以降解土壤中多糖的菌株结合使用。
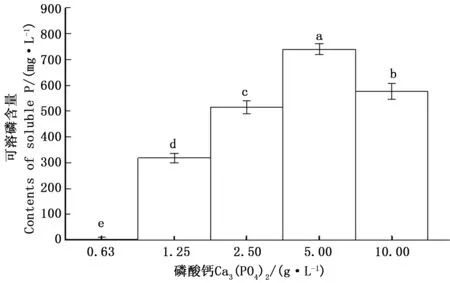
图2 不同磷酸钙浓度下CHW10B菌株培养液可溶磷含量的变化Fig.2 Changes of soluble phosphate content in culture liquid of strain CHW10B cultivated under different calcium phosphate contents

图3 不同碳源下CHW10B菌株培养液可溶磷含量的变化Fig.3 Changes of soluble phosphate content in culture liquid of strain CHW10B cultivated under different carbon sources

图4 不同氮源下CHW10B菌株培养液可溶磷含量的变化Fig.4 Changes of soluble phosphate content in culture liquid of strain CHW10B cultivated under different nitrogen sources
3.3.2氮源对CHW10B菌株溶磷能力的影响 图4表明:不同氮源条件下,CHW10B菌株溶磷能力差异显著;以(NH4)2SO4为氮源时,CHW10B菌株的溶磷能力最强,溶磷量为738.372mg·L-1;以NH4NO3为氮源时,该菌株的溶磷能力比以(NH4)2SO4为氮源时略低(溶磷量为720.504mg·L-1),但二者差异不显著。以牛肉膏、酵母膏和蛋白胨为氮源时,该菌株的溶磷能力明显下降,而以KNO3为氮源时,该菌株的溶磷能力最弱(溶磷量为179.201mg·L-1)。说明该菌株以NH4+为氮源时的溶磷能力明显比以NO3-为氮源时的强,NH4+适合该菌株溶磷能力的充分发挥。因此,CHW10B菌株溶磷作用最适氮源为(NH4)2SO4,在实践应用中与(NH4)2SO4没有显著差异的NH4NO3也可以考虑。
3.3.3碳氮比对CHW10B菌株溶磷能力的影响 以最适碳源(葡萄糖)和最适氮源(硫酸铵)分别作为碳源和氮源,比较不同C/N对CHW10B菌株溶磷能力的影响。图5表明:不同C/N对CHW10B菌株的溶磷能力影响显著;C/N≤100/1时,C/N越大,CHW10B菌株的溶磷能力越强;C/N>100/1,随着C/N升高,该菌株的溶磷能力反而减弱。C/N为25/1时,该菌株的溶磷量最低(318.542mg·L-1),C/N为100/1时,该菌株的溶磷量最高(684.108mg·L-1),此时溶磷能力最强。
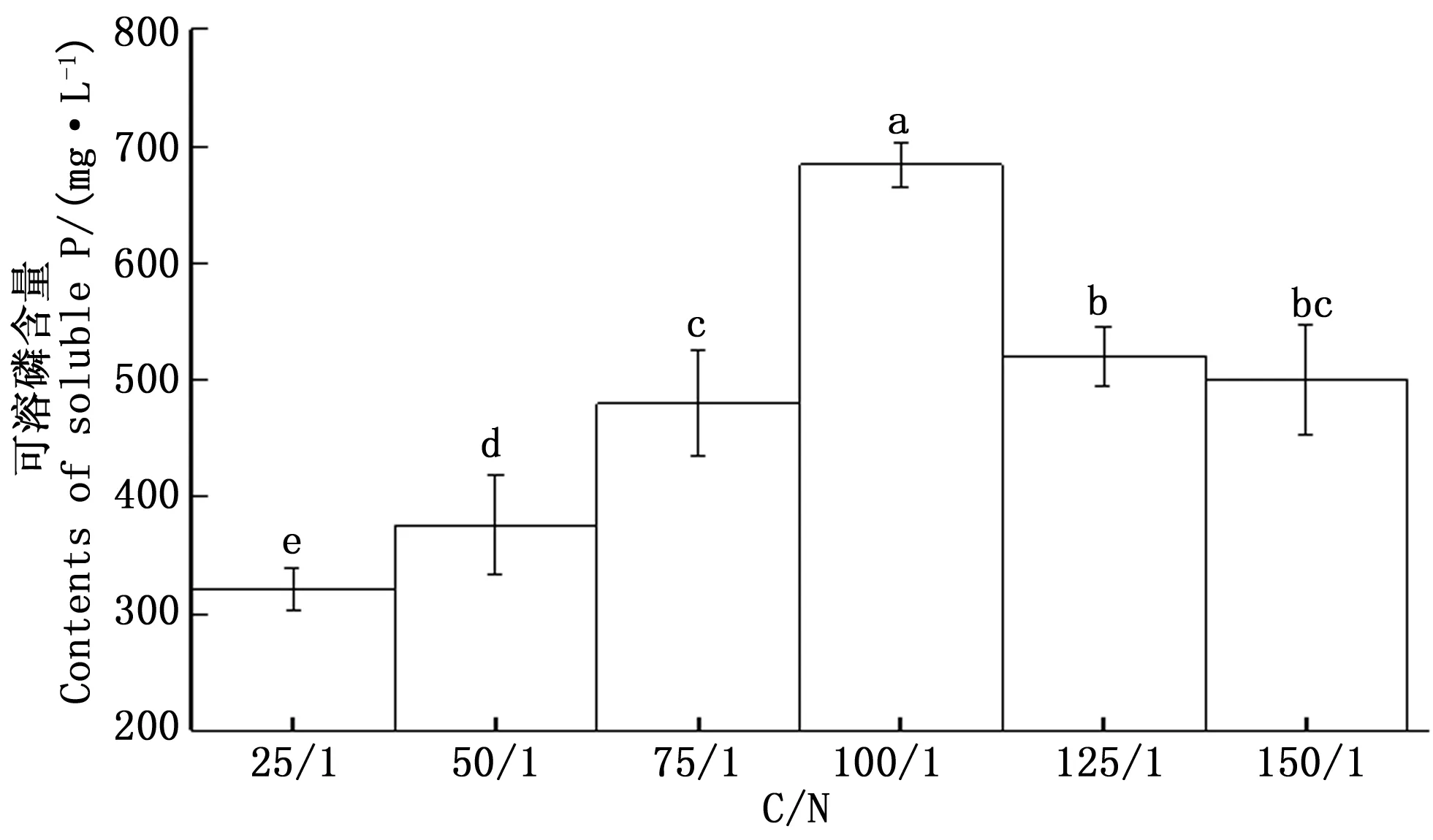
图5 不同C/N下CHW10B菌株培养液可溶磷含量的变化Fig.5 Changes of soluble phosphate content in culture liquid of strain CHW10B cultivated under different C/N
3.4环境条件对CHW10B菌株溶磷能力的影响
3.4.1初始pH值对CHW10B菌株溶磷能力的影响 图6表明:随着pH值的升高,CHW10B菌株的溶磷能力表现为先增长后降低;当初始pH值为10时,该菌株的溶磷能力最差,但可溶性磷含量仍达521.318mg·L-1;初始pH值为7时,该菌株的溶磷能力最强(727.713mg·L-1)。以上结果表明,CHW10B菌株对不同的pH值具有较强的适应能力,但中性条件最利于其溶磷功能的发挥,这也暗示了该菌株可以应用于多种不同酸碱性土壤中。
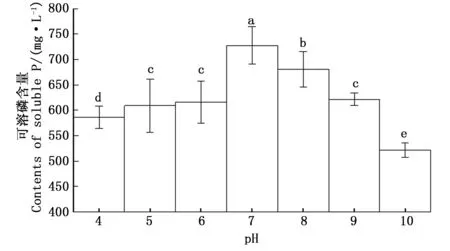
图6 不同初始pH值下CHW10B菌株培养液可溶磷含量的变化.6 Changes of soluble phosphate content in culture liquid of strain CHW10B cultivated under different initial pH
3.4.2装液量对CHW10B菌株溶磷能力的影响 溶氧量对微生物的生长有重要作用,不同微生物对溶解氧需求也不同。装液量是影响溶氧量的一个重要因素,装液量越少,溶氧系数越大,溶氧量越多。图7表明:CHW10B菌株在不同装液量下均有一定的溶磷能力,但溶磷能力的强弱不同:装液量400mL·L-1(2/5)和800mL·L-1(4/5)时,CHW10B菌株的溶磷能力差异不显著;装液量600mL·L-1(3/5)时,CHW10B菌株的溶磷能力最差;装液量500mL·L-1(1/2)时,CHW10B菌株的溶磷能力最强,溶磷量高达750.001mg·L-1。由此可知,装液量500mL·L-1(1/2)为本研究条件下CHW10B菌株溶磷的最适装液量。
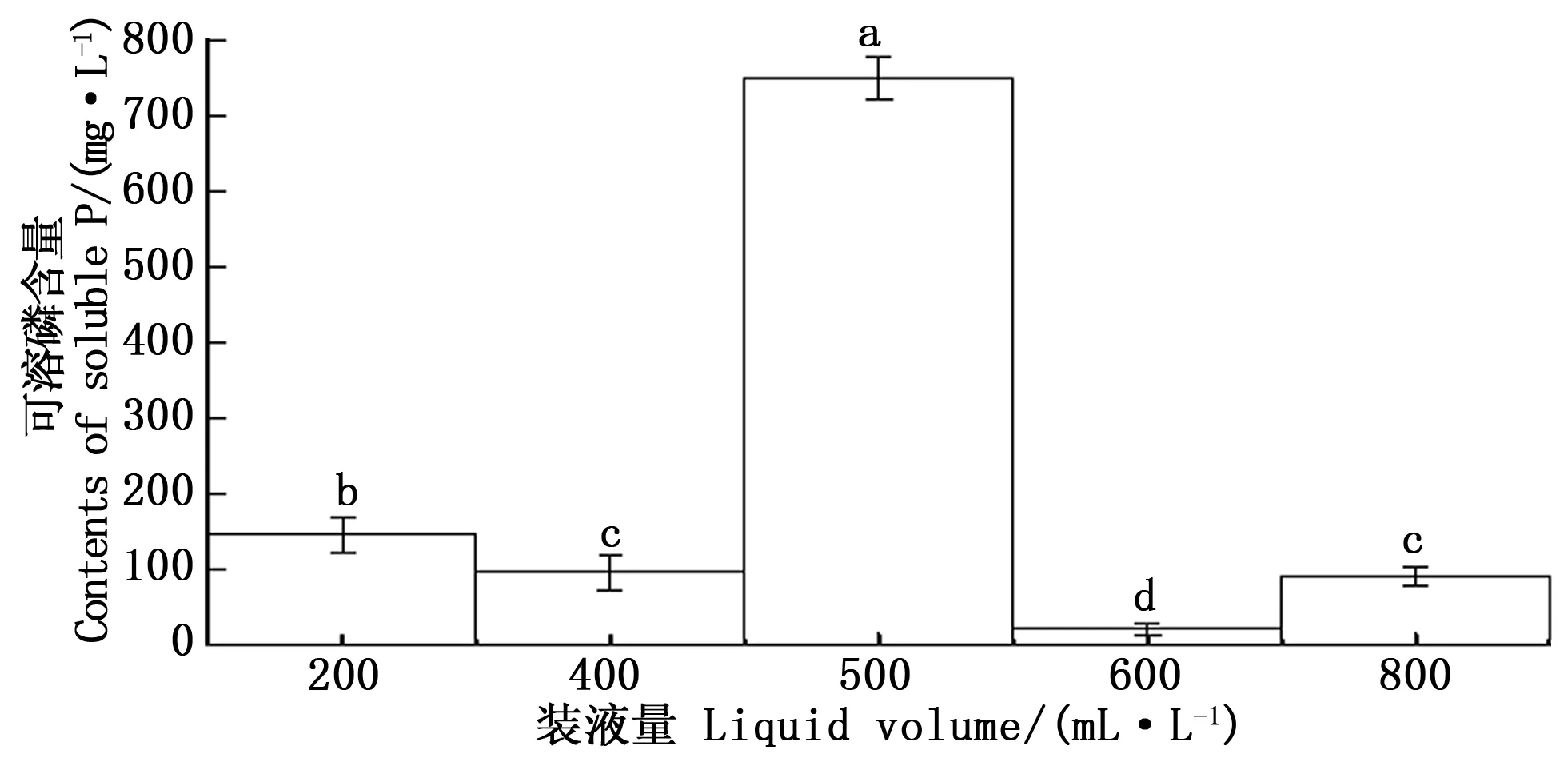
图7 不同装液量下CHW10B菌株培养液可溶磷含量的变化Fig.7 Changes of soluble phosphate content in culture liquid of strain CHW10B cultivated under different liquid volume in flask

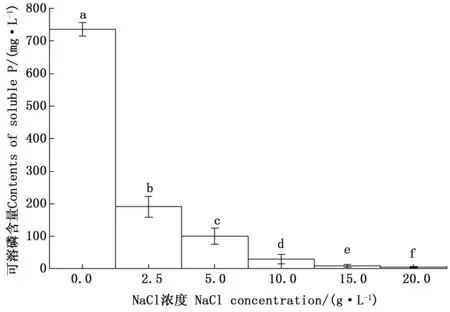
图8 不同NaCl浓度下CHW10B菌株培养液可溶磷含量的变化Fig.8 Changes of soluble phosphate content in culture liquid of strain CHW10B cultivated under different concentration of Nacl


图9 不同温度下CHW10B菌株培养液可溶磷含量的变化Fig.9 Changes of soluble phosphate content in culture liquid of strain CHW10B cultivated under different temperature
3.5CHW10B菌株产有机酸能力
表1表明:CHW10B菌株发酵液产生有机酸,且有机酸总量为5710.82μg·L-1,比对照组的665.05μg·L-1高758.70%。CHW10B菌株分泌的有机酸为草酸和葡萄糖酸,与对照相比,虽然少了甲酸和柠檬酸,但其葡萄糖酸的产生量远大于对照,分泌草酸的量与CK的相差不大。葡萄糖酸一方面能降低pH值从而溶解难溶性磷,另一方面还能与Al3+等螯合释放磷酸根[17]。由此可见,CHW10B菌株发酵液良好的分泌葡萄糖酸的能力促进了其高效溶磷作用。
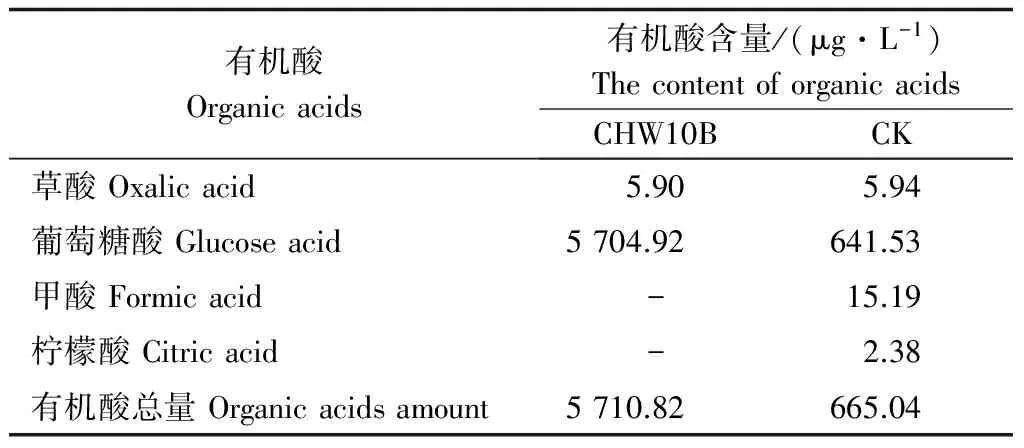
表1 CHW10B菌株分泌的有机酸种类和含量
注:“-”代表未检测到。Note:“-” represents not detected.
3.6CHW10B菌株产ACC脱氨酶、IAA、嗜铁素及精氨酸脱羧酶能力
经测定,CHW10B菌株可以产生吲哚乙酸(IAA)和ACC脱氨酶,产IAA量为8.908mg·mL-1,其ACC脱氨酶比活力为0.922U·mg-1。采用CAS平板对CHW10B菌株进行产铁载体定性测定,结果表明:CHW10B菌株能产生铁载体(图10)。图11表明:该菌株还具有产精氨酸脱羧酶的能力。以上结果说明,CHW10B菌株具有多种植物促生特性。
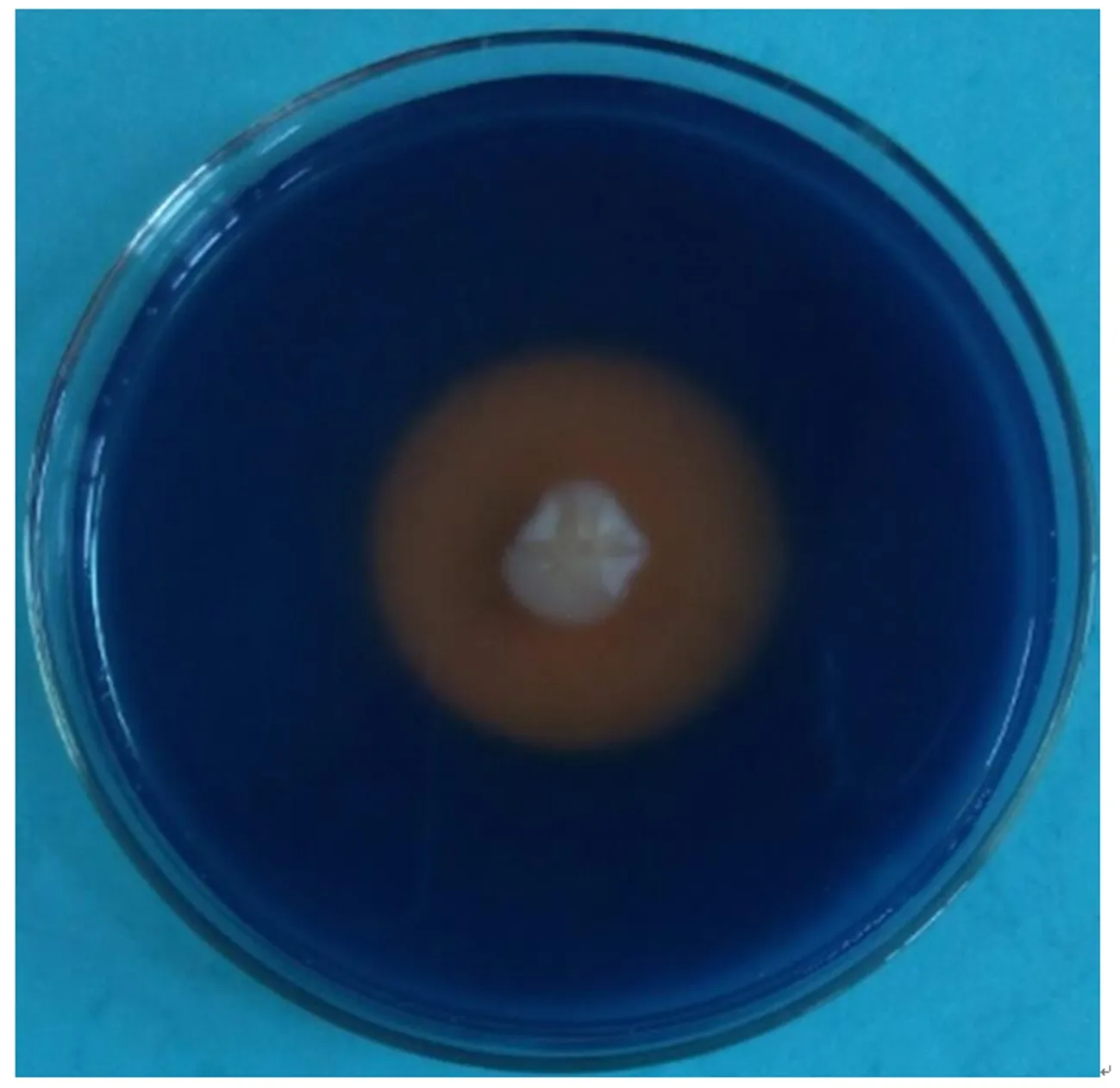

图10 CHW10B菌株的CAS平板检测Fig.10 Siderophore production of strain CHW10B on CAS agar plates
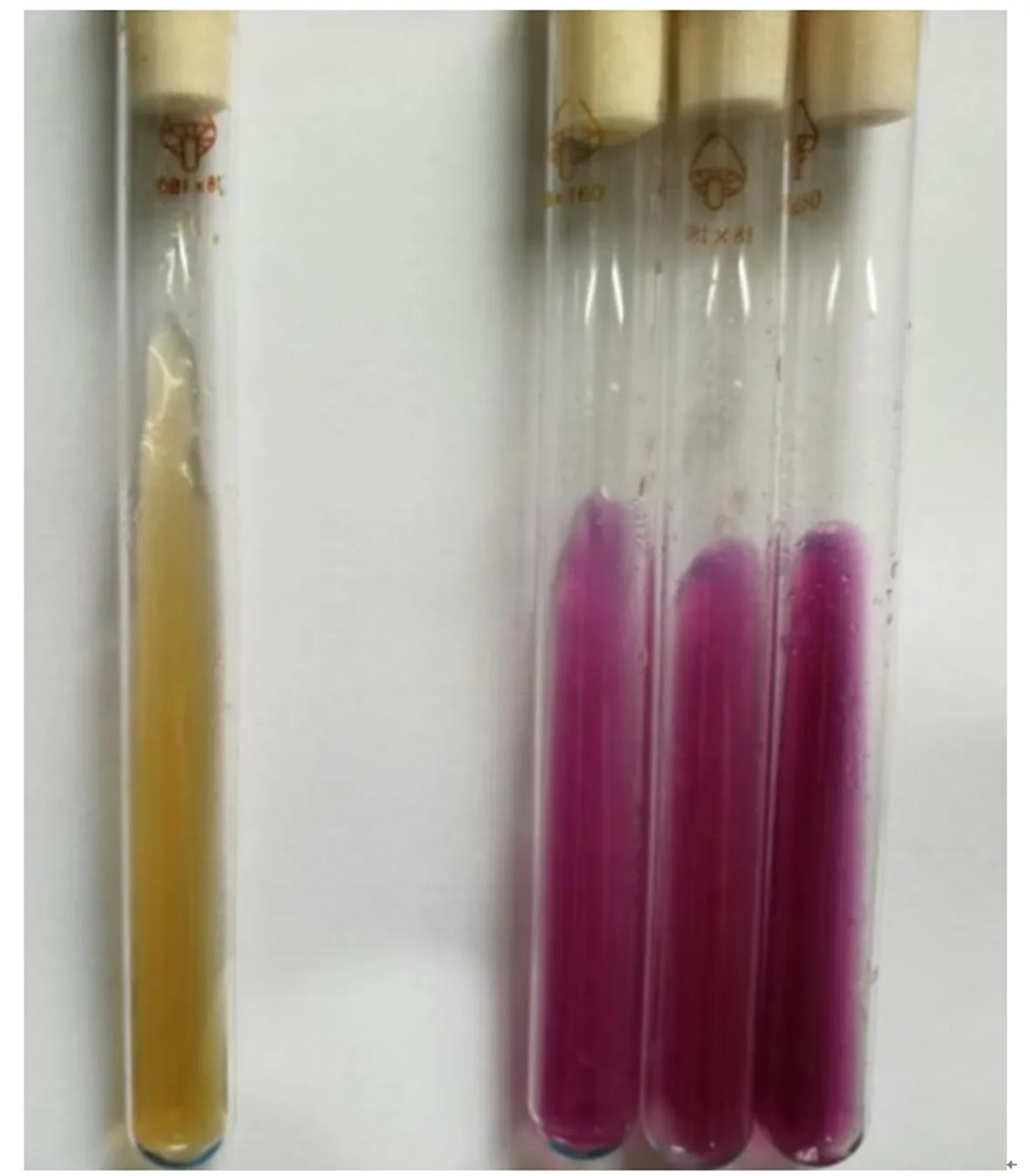

图11 CHW10B菌株产精氨酸脱羧酶定性测定结果Fig.11 Qualitative determination results of strain CHW10B on producing Arginine decarboxylase
3.7CHW10B菌株对南方红豆杉的促生作用
南方红豆杉1年生实生苗接种CHW10B菌株后360d的生长情况(表2)表明:接种CHW10B菌剂对南方红豆杉生长具促进作用,与对照相比,南方红豆杉实生苗地径、苗高和生物量的增长率分别为19.53%、20.14%和25.39%。CHW10B菌株对南方红豆杉实生苗生物量和苗高的促生作用达极显著(P<0.01),而对地径的促生作用达显著(P<0.05)。
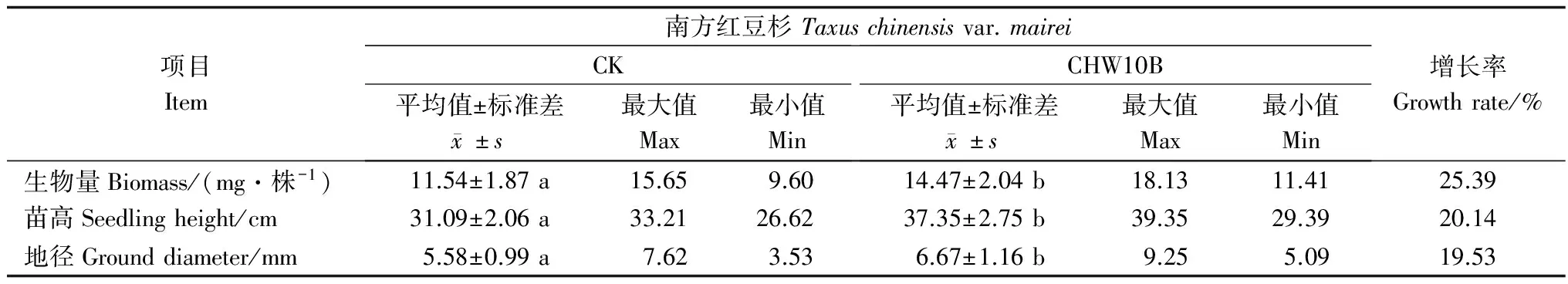
表2 CHW10B菌株对南方红豆杉生长的影响
注:同行不同小写字母表示差异显著,P<0.05。
Note:The different small letters in the samerow mean the significant difference atP<0.05.
4 讨论

溶磷微生物的溶磷作用并非一成不变,随着外界环境或营养物质的变化,其溶磷效果也发生改变[19]。许多研究表明,碳是影响溶磷菌生长繁殖和生理生化代谢包括溶磷作用等的最主要因素,不同溶磷菌株的最佳碳源及利用碳源的广泛性存在明显区别,如节杆菌1TCRi7只有以葡萄糖为碳源时才具有溶磷能力[20];而洋葱伯克霍尔德氏菌C5-A[17]、耳假单胞菌WB38[7]、泛菌属溶磷菌D2[18]、荧光假单胞菌JW-JS1[21]和本研究中的草木樨中华根瘤菌CHW10B溶磷碳源较广,以葡萄糖、麦芽糖、蔗糖等分别作为碳源时皆具有溶磷能力;在后4株菌中,除洋葱伯克霍尔德氏菌C5-A以麦芽糖为碳源时溶磷作用最强外,其余均以葡萄糖为碳源时溶磷能力最强。草木樨中华根瘤菌CHW10B溶磷最佳碳源为葡萄糖也可能与其溶磷过程中产生大量的葡萄糖酸有关[19,22]。
不同溶磷微生物对不同氮源利用效率也不尽相同。本研究中,草木樨中华根瘤菌CHW10B以NH4+为氮源时的溶磷能力明显比以NO3-为氮源时的强,以硫酸铵为氮源时溶磷能力最强,以硝酸铵为氮源时溶磷能力次之,而以硝酸钾为氮源时的溶磷能力明显降低,这与耳假单胞菌WB38[7]溶磷氮源情况相似,不同的是后者以硝酸铵为氮源时溶磷能力最强,硫酸铵次之。本研究结果与赵小蓉等[20]和范丙全等[23]发现的溶磷菌通常以NO3-为氮源时的溶磷量高于以NH4+为氮源时的溶磷量相反。另外,范丙全等[23]认为,使用铵态氮时主要分泌苹果酸、柠檬酸、乙酸、琥珀酸、丙酸,而硝态氮条件下几乎不产生这些有机酸。本研究中,CHW10B菌株以(NH4)2SO4为氮源时产生大量的葡萄糖酸,并没有产生其他有机酸,其具体原因有待进一步研究。
有研究表明,适当调整C/N值,溶磷微生物可能会释放更多磷[21],不同菌株对培养基中C/N值反应差异显著。本研究发现,当C/N<100/1时,随培养基的C/N值升高,草木樨中华根瘤菌CHW10B的溶磷能力逐渐增强;当C/N=100/1时,草木樨中华根瘤菌CHW10B菌株溶磷能力最强,这与刘辉等[21]关于荧光假单胞菌JW-JS1菌株和赵小蓉等[20]关于欧文氏杆菌的研究结果相同;当C/N>100/1时,CHW10B菌株的溶磷能力逐渐减弱,与青霉和肠杆菌的结果[20]不一致,可能是因为不同菌株自身所适宜的C/N有所不同。
本研究中的草木樨中华根瘤菌CHW10B是分离自南方红豆杉根际的高效溶磷菌株,具有在南方红豆杉根际发展成优势种群的前提,该菌株除产生葡萄糖酸具有较强溶磷能力外,还可产ACC脱氨酶、IAA、铁载体和精氨酸脱羧酶,具有多种植物促生特性。将该菌株制成菌剂作用于1年生南方红豆杉实生苗后,具有良好的促生效应。在本课题组的前期研究中,CHW10B对60 d南方红豆杉幼苗生长也表现出明显的促生作用。可以看出,该菌株有望被制成生物肥料,应用于南方红豆杉等的人工栽培,具有较高的应用潜力。若将该菌株更好应用于农林业生产中,还需进一步结合实践中土壤和周围环境的实际情况,进行深入验证。
5 结论
碳源、氮源、碳氮比和温度等环境条件均对CHW10B菌株的溶磷能力有一定的影响,以葡萄糖为碳源,硫酸铵为氮源,且碳氮比为100/1时,该菌株的溶磷能力最强。该菌株溶磷能力最强的其他环境条件分别为培养时间4 d、磷酸钙5.00 g·L-1、初始pH值7.0、装液量1/2、NaCl为0.0 g·L-1、温度30℃。将该菌株接种于1年生南方红豆杉根部360 d后,发现其对南方红豆杉有明显的促生作用。经检测,该菌株除产生大量葡萄糖酸外,还产生可促进植物生长的IAA、ACC脱氨酶、嗜铁素和精氨酸脱羧酶。鉴于该菌株对南方红豆杉良好的促生作用,结合其溶磷特性,可将该菌株应用于南方红豆杉的种植。
[1] 张希涛, 康丽华, 马海宾, 等. 具有解磷能力的相思根瘤菌的筛选[J]. 林业科学研究, 2008, 21(5): 619-624.
[2] 张玉兰, 王俊宇, 马星竹, 等. 提高磷肥有效性的活化技术研究进展[J]. 土壤通报, 2009, 40(1): 194-202.
[3] 王 舒, 张林平, 郝菲菲, 等. 油茶根际高效溶磷细菌的筛选、鉴定及其安全性测试[J]. 林业科学研究, 2015, 28(2): 166-172.
[4] Babita K J, Monhandass G P,etal. Simultaneous phosphate solubilization potential land antifungal activity of new fluorescent pseudomonad strains,Pseudomonasaeruginosa,P.plecoglossicidaandP.mosselii[J]. World J Microbiol Biotechnol, 2009, 25: 573-581.
[5] 梅新兰, 闪安琪, 蒋 益, 等. 适应玉米的溶磷细菌筛选及其对玉米生长的影响[J]. 土壤学报, 2016, 53(2): 502-509.
[6] 史发超, 殷中伟, 江红梅, 等. 一株溶磷真菌筛选鉴定及其溶磷促生效果[J]. 微生物学报, 2014, 54(11): 1333-1343.
[7] 王 舒, 张林平, 张 扬, 等. 红壤区油茶根际解磷细菌的筛选、鉴定及其解磷能力[J]. 林业科学研究, 2015, 28(3): 409-416.
[8] 任嘉红, 刘 辉, 吴晓蕙, 等. 南方红豆杉根际溶无机磷细菌的筛选、鉴定及其促生效果[J]. 微生物学报, 2012, 52(3): 295-303.
[9] 肖 遥, 楚秀丽, 徐肇友, 等. 南方红豆杉2年生容器苗多点试验的生长节律家系变异[J]. 林业科学研究, 2016, 29(2): 238-244.
[10] 任嘉红, 刘 辉, 姜 楠, 等. GFP标记溶磷草木樨中华根瘤菌CHW10B及其定殖[J]. 林业科学, 2015, 51(1): 74-79.
[11] Penrose D M, Glick. Methods for Isolating and Characterizing ACC Deaminase-Containing Plant Growth-Promoting Rhizobacteria[J]. Physiologia Plantarum, 2003, 118(1): 10-15.
[12] 鲁如坤. 土壤农业化学分析方法(第一版)[M]. 北京: 中国农业科技出版社, 2000.
[13] Saleh S S, Glick B R. Involvement of gacS and rpoS in enhancement of the plant growth-promoting capabilities of Enterobacter cloacae CAL2 and UW4[J]. Canadian Journal of Microbiology, 2001, 47(8): 698-705.
[14] Johan H, Leveaul J, Lindow S E. Utilization of the plant hormone indole-3-Acetic acid for growth byPseudomonasputidastrain 1290[J]. Applied Environment Microbiology, 2005, 71(5): 2365-2371.
[15] Sun L N, Zhang Y F, He L Y,etal. Genetic diversity and characterization of heavy metal-resistant-endophytic bacteria from two copper-tolerant plant species on copper mine wasteland[J]. Bioresource Technology, 2010, 101(2): 501-509.
[16] Yu X, Chen M, Jiang Z,etal. The two-component regulators GacS and GacA positively regulate a nonfluorescent siderophore through the Gac/Rsm signaling cascade in high-siderophore-yieldingPseudomonassp. strain HYS[J]. Journal of Bacteriology, 2014, 196(18): 3259-3270.
[17] 刘文干, 何园球, 张 坤, 等. 一株红壤溶磷菌的分离、鉴定及溶磷特性[J]. 微生物学报, 2012, 52(3): 326-333.
[18] 王俊娟, 阎爱华, 王 薇, 等. 铁尾矿区油松根际溶磷泛菌D2的筛选鉴定及溶磷特性[J]. 应用生态学报, 2016, 27(11): 3705-3711.
[19] Yi Y M, Huang W Y, Ge Y. Exopolysaccharide: a novel important factor in the microbial dissolution of tric alcium phosphate[J].World J. Microbiol. Biotechnol, 2008, 24: 1059-1065.
[20] 赵小蓉, 林启美, 李保国. C、N源及C/N比对微生物溶磷的影响[J]. 植物营养与肥料学报, 2002, 8(2): 197-204.
[21] 刘 辉, 吴小芹, 任嘉红, 等. 一株荧光假单胞菌的溶磷特性及其对杨树的促生效果[J]. 林业科学, 2013, 49(9): 112-118.
[22] Patel D K, Archana G, Kumar G N. Variation in the nature of organic acid secretion and mineral phosphate solubilization byCitrobactersp. DHRSS in the presence of different sugars[J]. Current Microbiology, 2008, 56(2): 168-174.
[23] 范丙全, 金继运, 葛 诚. 溶磷草酸青霉菌筛选及其溶磷效果的初步研究[J]. 中国农业科学, 2002, 35(5): 525-530.
(责任编辑:徐玉秀)
Phosphate-solubilizingCharacteristicsandGrowth-promotingEffectofSinorhizobiummelilotiCHW10BonTaxuschinensisvar.mairei
LIYun-ling1, 2,HOUQin-wen1, 2,LIURui-xiang1, 2,RENJia-hong1, 2,ZHANGYi1
(1.Department of Biological Science and Technology, Changzhi University, Changzhi 046011, Shanxi, China;2.Ecological and Environmental Research Institute of Taihangshan Mountains, Changzhi 046011, Shanxi, China)
S718.8
A
1001-1498(2017)05-0751-08
10.13275/j.cnki.lykxyj.2017.05.007
2017-02-15
国家自然科学基金项目(31100471);山西省重点学科建设经费资助
李云玲(1976—),女,硕士,讲师.主要研究方向:环境微生物.电话: 13509755820. E-mail: lyl_0315@163.com
* 通讯作者:任嘉红,博士,教授.主要研究方向:森林微生物.E-mail : renjiahong@163.com

