大豆皂苷I与II及苷元B对黄曲霉毒素B1和苯并芘突变效应的拮抗
光翠娥, 干建平, 杨红飞, 李志刚
(1.黄冈师范学院 经济林木种质改良与资源综合利用湖北省重点实验室/大别山特色资源开发湖北省协同创新中心,湖北 黄冈 438000;2.食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122)
大豆皂苷I与II及苷元B对黄曲霉毒素B1和苯并芘突变效应的拮抗
光翠娥1,2, 干建平1, 杨红飞2, 李志刚2
(1.黄冈师范学院 经济林木种质改良与资源综合利用湖北省重点实验室/大别山特色资源开发湖北省协同创新中心,湖北 黄冈 438000;2.食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122)
本研究确认了大豆皂苷I与II及苷元B对黄曲霉毒素B1和苯并芘的抗突变作用。Ames试验中,除了最小剂量时大豆皂苷I与II未能显著抑制移码突变外,3个受试物均明显抑制黄曲霉毒素B1和苯并芘诱发的TA98和TA100回复突变。而且,除了最小剂量时大豆皂苷I与II未能显著抑制苯并芘与DNA的结合外,3个受试物均明显抑制人肝癌 (HepG2)及支气管上皮(BEAS-2B)细胞中突变剂与DNA加合物的形成。大体上,苷元B比大豆皂苷I与II更有效地抑制移码与碱基置换突变和加合物的形成。因此,3个食源活性成分不仅抑制基因突变同时也拮抗突变剂诱导的DNA损害。
大豆皂苷;黄曲霉毒素;苯并芘;Ames试验;DNA加合物
以苷元B为配基的大豆皂苷I与II是天然的齐墩果酸型五环三萜苷,其含量随大豆品种、种植年份、地理位置及成熟度而变化[1],大豆皂苷I更多存在于胚芽中而大豆皂苷II则主要分布在子叶中[2]。两皂苷分子具有两亲性,由极性可溶的糖链连接到非极性不可溶的苷元B C-3位上[3],分子式分别为3-O-[α-L-吡喃鼠李糖基(1→2)-β-D-吡喃半乳糖基 (1→2)-β-D-吡喃葡萄糖醛酸基-苷元B和3-O-[α-L-吡喃鼠李糖基(1→2)-α-L-吡喃阿拉伯糖基(1→2)-β-D-吡喃葡萄糖醛酸基-苷元 B。作为单糖链 B 族和 DDMP (2,3-二氢-2,5-二羟-6-甲基-4-氢-吡喃-4-酮)族皂苷的糖苷配基,苷元B(齐墩果酸型-12-烯-3β,22β,24-三醇) 由大豆皂苷酸碱水解生成,因而可存在于大豆制品中[4]。B族大豆皂苷经人体代谢成苷元B[5],其中大豆皂苷I由人体粪便微生物代谢成中间体大豆皂苷III(或者大豆皂苷III与苷元 B-3-β-D-葡糖苷酸)[6],而大豆皂苷 II的代谢中间体为大豆皂苷IV[7]。
大豆皂苷I有抗炎、抗癌、抗微生物、抗氧化、佐剂、肝脏、肾脏及心血管保护等功能,大豆皂苷II有抗病毒、佐剂、肝脏及心血管保护等功能,苷元B也能抗炎、抗癌、抗病毒及保护肝脏[8]。大豆皂苷粗提物显著抑制黄曲霉毒素B1诱发的碱基置换突变并通过抑制DNA加合物的生成而阻止癌变的启动[9],苷元B则能拮抗2-乙酰氧基乙酰氨基芴诱导的DNA损害[10]。本研究通过细菌回复突变和DNA加合物形成实验确定大豆皂苷I与II及苷元B对黄曲霉毒素B1和苯并芘的抗突变作用。
1 材料与方法
1.1 材料与设备
大豆皂苷 I,II,苷元 B:美国 ChromaDex 公司;TA98,TA100,S9: 美国 Molecular Toxicology 公司产品;黄曲霉毒素B1,苯并芘,辅酶II,6-磷酸葡萄糖,L-组氨酸,D-生物素,核糖核酸酶:Sigma-Aldrich公司产品;[3H]黄曲霉毒素B1,[3H]苯并芘:美国Radiolabeled Chemicals公司产品;HepG2和BEAS-2B 细 胞 :AmericanType Culture Collection;RPMI-1640和LHC-8培养基,胎牛血清,蛋白酶K:Gibco公司产品;LS 6500液体闪烁计数器:Beckman-Coulter公司产品。
1.2 实验方法
1.2.1 移码和碱基突变拮抗实验 Ames实验中,鼠伤寒沙门氏菌TA98和TA100分别用于指示移码突变和碱基置换突变。菌株接种于营养肉汤培养基,37℃振荡培养12 h。代谢活化体系包括(体积分数 ):S9,4% ;0.4 mol/L MgCl2,1%;1.65 mol/L KCl,1%;1 mol/L 6-磷酸葡萄糖,0.5%;0.1 mol/L 辅酶 II,4%;0.2 mol/L磷酸盐缓冲液,50%;无菌蒸馏水,39.5%。实验时,0.05 mL受试物、0.05 mL突变剂(20 μg/mL)、0.1 mL 菌株液以及 0.5 mL S9 混合液在37℃预孵30 min,加入含0.5 mmol/L组氨酸/生物素溶液的顶层琼脂培养基2 mL,充分混匀,倾入底层葡萄糖琼脂平板上,待冷凝固化后,倒置于37℃培养箱中孵育48 h。记数每皿回变菌落数[11]。
1.2.2 DNA加合物形成拮抗实验 HepG2培养在含体积分数10%胎牛血清、100 U/mL青霉素及100μg/mL链霉素的RPMI-1640培养基中,BEAS-2B则培养在LHC-8中,培养箱条件为37℃、体积分数5%CO2及90%相对湿度。培养基每隔一天更新,直至汇合达80%~90%。通过0.25 g/dL胰酶及0.02 g/dL EDTA传代后,以细胞浓度6×105个/mL接种,24 h孵育后,由含受试物的培养基取代。在1 h预孵后,加入[3H]黄曲霉毒素 B1或[3H]苯并芘(30 nmol/L),24 h后,所得细胞用冷PBS冲洗2次,然后用含10 mmol/L Tris·HCl、0.1 mol/L EDTA、0.1 mg/mL 蛋白酶K及0.5 g/dL十二烷基硫酸钠的溶液在50℃水浴中抽提 3 h。 用苯酚∶氯仿∶异戊醇(25∶24∶1)及氯仿∶异戊醇(24∶1)清洗后,分离出的 DNA 使用 1/5 体积的5 mol/L NaCl和2体积体积分数99%的乙醇在-80℃沉降1 h,离心后,所获沉淀用体积分数70%乙醇清洗,并使用核糖核酸酶在37℃重新溶解2 h。DNA量由在260 nm UV吸收方法决定,辐射量由液体闪烁计数器测量[9,12]。
2 结果与讨论
从表1可知,高剂量大豆皂苷I与II显著抑制2突变剂诱导的移码突变,而苷元B在所有受试浓度都起作用(P<0.01)见表 1。
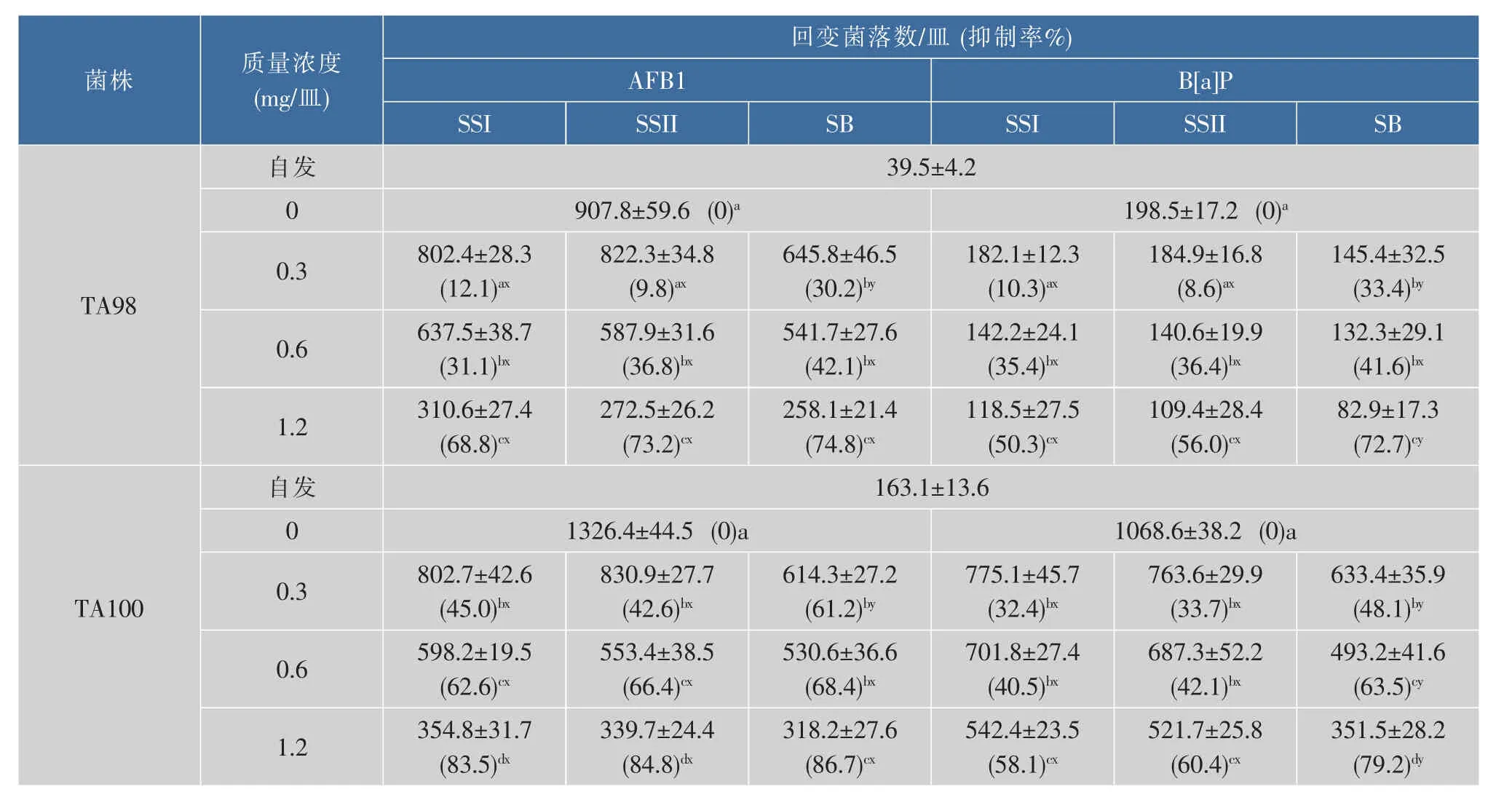
表1 大豆皂苷 I(SSI)与 II(SSII)及苷元 B(SB)对黄曲霉毒素 B1(AFB1)和苯并芘(B[a]P)诱导的基因突变的拮抗Table 1 Protective effects of soyasaponin I (SSI),II (SSII) and soyasapogenol B (SB) against aflatoxin B1 (AFB1)-and benzo[a]pyrene(B[a]P)-induced mutations(1 μg/plate) in Salmonella typhimurium TA98/TA100*
在最低剂量0.3 mg/皿,苷元B的抑制能力明显强于大豆皂苷I与II,在最高剂量1.2 mg/皿,苷元B抑制苯并芘诱导的移码突变的能力也显著强于2个皂苷。对于两突变剂诱导的碱基置换突变,3个活性物在3个受试浓度都实施了显著抑制;对于黄曲霉毒素B1诱发的突变,3个剂量皂苷彼此抑制能力显著不同,对于苯并芘诱发的突变,不同剂量苷元B抑制能力也有显著差异;苷元B在最低剂量0.3 mg/皿时抑制黄曲霉毒素B1诱导的碱基置换突变能力显著强于2个皂苷,而对于苯并芘诱发的突变,苷元B在3个受试浓度均显示了比皂苷明显更强的拮抗能力。在剂量0.6 mg/皿,大豆皂苷I抑制了31.1%的黄曲霉毒素B1诱导的移码突变和62.6%的碱基置换突变,大豆皂苷II分别抑制了36.8%和66.4%,苷元B则分别抑制了42.1%和68.4%;对于苯并芘诱导的移码和碱基置换突变,大豆皂苷I分别抑制了35.4%和40.5%,大豆皂苷II分别抑制了36.4%和42.1%,苷元B则分别抑制了41.6%和63.5%。大体上,苷元B比大豆皂苷I与II更有效抑制突变,3个活性物拮抗碱基置换突变比拮抗移码突变更有效。3个活性物对基因突变的拮抗可能缘于它们对亲电突变剂的清除能力以及对基因毒物代谢的影响[9]。
图1总结了3个活性物对HepG2中黄曲霉毒素B1-DNA和BEAS-2B中苯并芘-DNA加合物形成的拮抗。黄曲霉毒素B1与苯并芘分别产生1.14 pmol/mg和1.57 pmol/mg的加合物,除了在最低计量(5 mg/mL)大豆皂苷I与II未能显著抑制苯并芘与DNA的结合外,3个受试物均能有效拮抗加合物生成(P<0.01);同一活性物在不同浓度的抑制能力没有显著差异;大豆皂苷II在质量浓度30 μg/mL与50 μg/mL对黄曲霉毒素B1-DNA形成的拮抗能力明显小于苷元B,2个皂苷在质量浓度5 μg/mL对苯并芘-DNA形成的抑制能力也显著弱于苷元B。在质量浓度 10~50 μg/mL 和 5~15 μg/mL 下,3 个受试物分别抑制了30%~50%与17%~45%2种加合物形成。类似地,同一质量浓度下苷元B比大豆皂苷I与II更有效抑制加合物生成。3个活性物对DNA加合物形成的拮抗可能缘于它们对细胞膜渗透性的改变[9]。
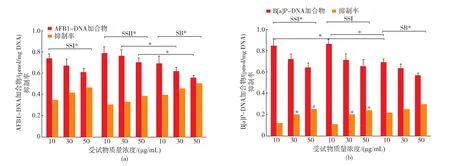
图1 大豆皂苷 I(SSI)、II(SSII)及苷元 B(SB)对黄曲霉毒素 B1(AFB1)-DNA 和苯并芘(B[a]P)-DNA 的拮抗(邓肯氏多范围检验确定显著性差异)Fig.1 Protective effects of soyasaponin I (SSI),II (SSII) and soyasapogenol B (SB) against the formation of aflatoxin B1(AFB1)-DNA(a) and benzo[a]pyrene(B[a]P)-DNA(b) adducts.Significance(P<0.01) was determined by Duncan’s multiple range test
3 结语
作为粗提物中的组成成分,大豆皂苷I与II及苷元B均贡献于对黄曲霉毒素B1诱导的碱基置换突变以及HepG2中黄曲霉毒素B1-DNA形成的抑制,它们也能拮抗黄曲霉毒素B1诱导的移码突变、苯并芘诱导的移码与碱基置换突变以及BEAS-2B中苯并芘-DNA的生成。因此,3个食源活性成分能有效阻止基因突变并通过抑制DNA加合物形成而延缓癌变的启动。
[1]HU J,LEE S,HENDRICH S,et al.Quantification of the group B soyasaponins by high-performance liquid chromatography[J].Journal of Agricultural and Food Chemistry,2002,50(9):2587-2594.
[2]BERHOW M A,KONG S,VERMILLION K E,et al.Complete quantification of group A and group B soyasaponins in soybeans[J].Journal of Agricultural and Food Chemistry,2006,54(6):2035-2044.
[3]ZHANG W,POPOVICH D G.Chemical and biological characterization of oleanane triterpenoids from soy[J].Molecules,2009,14(8):2959-2975.
[4]KANG J,BADGER T M,RONIS M J J,et al.Non-isoflavone phytochemicals in soy and their health effects[J].Journal of Agricultural and Food Chemistry,2010,58(14):8119-8133.
[5]HU J,REDDY M B,HENDRICH S,et al.Soyasaponin I and sapongenol B have limited absorption by Caco-2 intestinal cells and limited bioavailability in women[J].Journal of Nutrition,2004,134(8):1867-1873.
[6]CHANG S,HAN M,HAN S,et al.Metabolism of soyasaponin I by human intestinal microflora and its estrogenic and cytotoxic effects[J].Biomolecules&Therapeutics,2009,17(4):430-437.
[7]SANG Shangyuan,GUANG Cuie,JIANG Bo.In vitro metabolism of soyasaponin II by human intestinal microflora[J].Journal of Food Science and Biotechnology,2015,34(5):470-474.(in Chinese)
[8]GUANG C E,CHEN J,SANG S Y,et al.Biological functionality of soyasaponins and soyasapogenols[J].Journal of Agricultural and Food Chemistry,2014,62(33):8247-8255.
[9]JUN H,KIM S,SUNG M.Protective effect of soybean saponins and major antioxidants against aflatoxin B1-induced mutagenicity and DNA-adduct formation[J].Journal of Medical Food,2002,5(4):235-240.
[10]BERHOW M A,WAGER E D,VAUGHN S F,et al.Characterization and antimutagenic activity of soybean saponins[J].Mutation Research,2000,448(1):11-12.
[11]MARON D M,AMES B N.Revised methods for the Salmonella mutagenicity test[J].Mutation Research,1983,113(3-4):173-215.
[12]SHARMA S,STUTZMAN J D,KELLOFF G J,et al.Screening of potential chemopreventive agents using biochemical markers of carcinogenesis[J].Cancer Research,1994,54(22):5848-5855.
会议名称(中文):中国微生物学会酿造分会2017年学术年会
所属学科:生物物理学、生物化学及分子生物学,生物技术与生物工程
开始日期:2017-10-31
结束日期:2017-11-03
所在城市:北京市 东城区
主办单位:中国微生物学会酿造分会
联系人:高洁 鲁绯
联系电话:010-66237217
E-MAIL:gaojie@ninh.chinacdc.cn
会议网站:http://csm.im.ac.cn/templates/team/introduction.aspx?nodeid=9&page=ContentPage&contentid=4847
会议背景介绍:我国政府于2016年颁布“健康中国2030规划纲要”,强调要将健康工作结合到所有政府工作当中,把健康作为我国社会发展的目标。利用微生物发酵而成的酿造食品是我国膳食结构中的重要组成部分,发酵过程不仅能够提高原产品的经济价值,还能产生丰富的代谢产物及微生态菌群,增加酿造食品的营养和保健价值,与我国居民的营养健康密切相关。我国微生态和益生菌资源丰富,是酿造科学应用大国,近年来,产业界依靠科技与学术界共同致力于菌种资源基础研究以及自有核心技术创新,推动符合健康需求的产品不断涌现。为了及时掌握国内外酿造科学与产业信息的最新进展,促进科技界与产业界的交流与融合,中国微生物学会酿造分会将于2017年10月31-11月3日(31日报道,1-2日会议,3日离会)在北京举办以“酿造科学与健康”为主题的酿造分会学术年会。本次会议将就酿造领域相关的科学理论和技术展开报告及研讨,并适时组织参观相关生产企业。
Protective Activities of Soyasaponin I,II and Soyasapogenol B Against Aflatoxin B1 and Benzo[a]Pyrene-Induced Mutagenicity
GUANG Cuie1,2, GAN Jianping1, YANG Hongfei2, LI Zhigang2
(1.Hubei Key Laboratory of Economic Forest Germplasm Improvement and Resources Comprehensive Utilization,Hubei Collaborative Innovation Center for the Characteristic Resources Exploitation of Dabie Mountains,Huanggang Normal University,Huanggang 438000,China;2.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
Inhibitory activities of soyasaponin I,II and their aglycone for aflatoxin B1 (AFB1) and benzo[a]pyrene(B[a]P)-induced mutagenicity were investigated.In the Ames assay,Salmonella typhimurium strains TA98 and TA100 were selected for frameshift and base substitution mutations,respectively.Three compounds showed remarkable protection against AFB1 and B[a]P-induced mutations,with the exception that at the low concentration of 0.3 mg/plate soyasaponins I and II did not significantly inhibit the frameshift mutation.Three compounds also effectively protected againstthe formation of AFB1-DNA adduct in HepG2 cells and B[a]P-DNA adduct in BEAS-2B cells,with the exception that at the low concentration of 5 g/ml soyasaponins I and II showed no significant inhibition for the binding of B[a]P to DNA.Generally,soyasapogenol B more effectively suppressed AFB1 and B[a]P-induced frameshift and base substitution mutations and showed stronger inhibitory activities in the formation of adducts than soyasaponins I and II.These results indicate that three bioactives not only inhibit gene mutations but also protect against mutagen-induced DNA damage.
soyasaponins,aflatoxin B1,benzo[a]pyrene,Ames test,DNA adduct
R 992
A
1673—1689(2017)08—0814—05
10.3969/j.issn. 1673-1689.2017.08.005
2015-07-05
国家自然科学基金项目(31201289);经济林木种质改良与资源综合利用湖北省重点实验室&大别山特色资源开发湖北省协同创新中心联合开放基金项目(2017AW01)。
光翠娥(1976—),女,湖北仙桃人,工学博士,副教授,硕士研究生导师,主要从事食品营养与功能因子研究。E-mail:guang1226@hotmail.com
光翠娥,干建平,杨红飞,等.大豆皂苷I与II及苷元B对黄曲霉毒素B1和苯并芘突变效应的拮抗[J].食品与生物技术学报,2017,36(08):814-818.

