树蝴蝶多糖LKY-I的结构和抗氧化、抗肿瘤活性评价
申超群,陈 健*
(1.广东省食品检验所(广东省酒类检测中心),广东 广州 510165;2.华南理工大学食品科学与工程学院,广东 广州 510641)
树蝴蝶多糖LKY-I的结构和抗氧化、抗肿瘤活性评价
申超群1,陈 健2,*
(1.广东省食品检验所(广东省酒类检测中心),广东 广州 510165;2.华南理工大学食品科学与工程学院,广东 广州 510641)
采用超声波辅助水提、乙醇沉淀、DEAE-52阴离子交换层析法从树蝴蝶(Lobaria koorkauae Yoshim)中分离纯化得到多糖LKY-I。采用凝胶渗透色谱法(gel permeation chromatography,GPC)结合葡聚糖凝胶Sephadex G-100分离,测定其分子质量分布及纯度;利用傅里叶变换红外光谱、气相色谱和核磁共振对其结构进行解析;通过体外清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、2’-联氨-双-3-乙基苯并噻唑啉-6-磺酸自由基(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) free radical,ABTS+·)以及对铁离子还原力(ferric-reducing antioxidant power,FRAP)测定结果,评价LKY-I的抗氧化能力;采用3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT)测定LKY-I对肿瘤细胞HepG-2、HCC827、MCF-7增殖的抑制作用。结果显示:LKY-I的总糖含量为88.91%,重均分子质量为61 598 D,是组分均一的多糖,由鼠李糖、木糖、甘露糖、葡萄糖、半乳糖组成,其物质的量比为1.1∶2.0∶46.5∶28.5∶20.5。傅里叶变换红外光谱分析结果显示,LKY-I具有一般多糖类物质的特征吸收峰,单糖残基以吡喃环的形式存在。高碘酸氧化、Smith降解以及核磁共振分析表明,LKY-I是含有甘露糖的D-吡喃糖环,包括α和β两种构型,由24.68%的(1→6)或(1→)连接的糖苷键组成。在250~10 000 μg/mL的质量浓度范围内,随着多糖质量浓度的升高,LKY-I对DPPH自由基、ABTS+·的清除率逐渐增大,当质量浓度为10 000 μg/mL时,清除率分别达44.12%、24.74%,FRAP值可达0.071 17 mmol/L,与100 μg/mL VC(0.072 31 mmol/L)相当。在125~2 000 μg/mL范围内,随着多糖质量浓度的增加,LKY-I对癌细胞的增殖抑制率逐渐增大。当质量浓度为2 000 μg/mL时,LKY-I对肿瘤细胞HepG-2、HCC827、MCF-7增殖的抑制率达到半抑制浓度,说明树蝴蝶水洗多糖LKY-I具有一定的抗肿瘤活性。
树蝴蝶;多糖;结构;抗氧化;抗肿瘤
多糖类化合物是一种天然生物大分子,广泛存在于动物、植物、微生物和真菌中,具有提高机体免疫力、抗氧化、抗病毒、抗衰老等生物活性[1-4]。树蝴蝶(Lobaria koorkauae Yoshim)为子囊地衣类(Ascolichenes)茶渍目(Lecanorales)牛皮叶科(Stictaceae)肺衣属(Lobaria)植物光肺衣、裂芽肺衣和网肺衣的干燥叶状地衣体,味淡、微苦,性平,归胃、肝、脾、肾经,又名石龙皮、石龙衣、老龙七、兜衣、肺衣、癞肚皮、蛇皮苔、石花(陕西)、树蝴蝶(云南)等[5]。树蝴蝶以叶状体入药,常生长在树干或林下岩石上,具有健脾利水、祛风止痒等功效[6]。研究表明,地衣多糖具有较强的抗癌活性,能增强机体的免疫能力[7]。靳菊情等[8]研究了树蝴蝶多糖的初级结构,结果表明多糖主要由甘露糖、葡萄糖、半乳糖及少量鼠李糖、阿拉伯糖、木糖组成的杂多糖,通过α(1→4)、α(1→6)糖苷键连接。王晓梅等[9]研究了树蝴蝶粗多糖的抗氧化活性,结果表明树蝴蝶粗多糖对O2-·和·OH的最大清除率分别为56%、55%,说明树蝴蝶多糖具有一定的抗氧化作用。目前有关于树蝴蝶多糖的研究较少,且多集中在粗多糖的体外抗氧化实验,关于树蝴蝶多糖的分离纯化、结构鉴定及纯化多糖的抗氧化和抗肿瘤活性等还鲜见报道。为开发利用树蝴蝶药用资源,本课题对树蝴蝶粗多糖进行纯化,得到树蝴蝶纯化多糖LKY-I。
本实验采用傅里叶变换红外光谱法、气相色谱分析法、高碘酸氧化法、Smith降解法、13C核磁共振(nuclear magnetic resonance,NMR)和1H NMR分析研究LKY-I的结构,通过体外抗氧化实验研究LKY-I对自由基的清除作用及铁离子还原力。3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT)法研究了LKY-I对癌细胞的增殖抑制作用。以期为树蝴蝶多糖生物活性作用机制与分子结构间的关系和树蝴蝶多糖的应用提供有用信息和数据支持。
1 材料与方法
1.1 材料与试剂
树蝴蝶购买于广州市清平药材市场,由广东药科大学药科学院王定勇教授鉴定。
葡萄糖、甘露糖、半乳糖等单糖标品、牛血清白蛋白、考马斯亮蓝G-250、半乳糖醛酸、葡聚糖标准品 美国Sigma公司;DEAE-52 北京慧德易科技有限公司;Sephadex G-100 瑞典Pharmacia公司;磷酸盐缓冲溶液(phosphate buffered saline,PBS)、高糖DMEM培养基、胎牛血清、胰酶、MTT、双抗、二甲基亚砜(dimethyl sulfoxide,DMSO)、5-氟尿嘧啶 美国Gibco公司;其他试剂均为国产分析纯。
1.2 仪器与设备
可见光分光光度计 上海元析仪器有限公司;超声波清洗机 昆山市超声仪器有限公司;傅里叶变换红外光谱仪 德国Bruck公司;气相色谱仪 美国Agilent公司;酶标仪 瑞士Tecan公司;倒置显微镜 日本Olympus公司。
1.3 方法
1.3.1 树蝴蝶多糖的制备与纯化流程
树蝴蝶原料→粉碎过60 目筛→超声辅助热水浸提→抽滤→减压浓缩→D354FD树脂脱色→醇沉→离心(4 000 r/min,10 min)→Sevag法脱蛋白→醇沉→离心→50 ℃烘干→样品溶解→DEAE-52阴离子交换柱层析→蒸馏水洗脱→收集组分→减压浓缩→透析→冷冻干燥→得到LKY-I样品。
1.3.2 LKY-I分子质量的测定和纯度鉴定
凝胶渗透色谱法(gel permeation ghromatography,GPC)测定LKY-I的分子质量[10],以葡聚糖(5 200、11 600、23 800、48 600、148 000、273 000、410 000、668 000 D)为标准品。色谱条件为:TSK G-5000 PWXL柱(7.8 mm×300 mm,7 μm)、TSK G-3000 PWXL柱(7.8 mm×300 mm,7 μm)串联,流动相为0.02 mol/L的KH2PO4缓冲溶液,流速为0.6 mL/min,2414示差检测器,柱温35 ℃。
1.3.3 LKY-I理化性质的测定
用苯酚-硫酸法测定LKY-I中的总糖含量;采用3,5-二硝基水杨酸法(3,5-dinitrosalicylic acid,DNS)测定LKY-I中的还原糖含量;采用考马斯亮蓝G-250法测定LKY-I中的蛋白质含量[11]。
1.3.4 LKY-I单糖组成分析
LKY-I的水解及标准品的衍生化方法参照文献[12],最后生成具有挥发性的糖腈乙酸酯衍生物,气相色谱(gas chromatograph,GC)法测样品中单糖组成。GC条件:采用6890N GC仪、DB-1701毛细管柱(30 m×0.25 m ,0.25 μm)及氢火焰离子化检测器;高纯氮作载气,流速为1mL/min。程序升温:柱初始温度为180 ℃,以2 ℃/min升至220 ℃,保持1 min,以5 ℃/min升至250 ℃,保持2 min;进样口温度为250 ℃,汽化室温度为250 ℃,检测器温度为300 ℃,吹扫流速为4.0 mL/min。
1.3.5 LKY-I傅里叶变换红外光谱分析
LKY-I 2mg与KBr混合研细后,在4 000~500 cm-1波数范围内进行傅里叶变换红外光谱扫描[13]。
1.3.6 高碘酸氧化和Smith降解
高碘酸氧化和Smith降解方法参考文献[14],将降解后溶液水解、衍生化后进行GC分析。
1.3.7 NMR分析
取约60 mg的LKY-I,用1.0 mL重水溶解后置于核磁管中,测定多糖LKY-I的氢谱和碳谱。
1.3.8 多糖LKY-I抗氧化活性的测定
1.3.8.1 对1,1-二苯基-2-三硝基苯肼自由基的清除作用
[15]的方法,于96 孔板依次加20 μL不同质量浓度(0.25、0.50、1.00、2.00、4.00、6.00、8.00、10.00 mg/mL)的LKY-I溶液及180 μL的150 μmol/L 1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)工作液,空白对照用蒸馏水代替LKY-I样品,阳性对照用VC代替LKY-I样品,振荡,517 nm波长处测定吸光度。DPPH自由基清除率按式(1)计算。
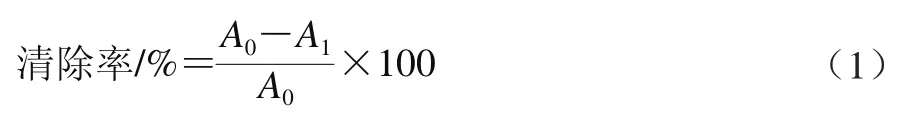
式中:A0为空白对照孔的吸光度;A1为样品孔的吸光度。
1.3.8.2 对2’-联氨-双-3-乙基苯并噻唑啉-6-磺酸自由基的清除作用
先配制7 mmol/L的2’-联氨-双-3-乙基苯并噻唑啉-6-磺酸(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)水溶液及4.9 mmol/L的过硫酸钾水溶液,将二者等体积混合,得ABTS母液,将ABTS母液用无水乙醇稀释至0.262 6 mmol/L备用。于96 孔板中依次加入不同质量浓度的LKY-I样品(0.25、0.50、1.00、2.00、4.00、6.00、8.00、10.00 mg/mL)20 μL,再加入180 μL的0.262 6 mmol/L ABTS工作液,37 ℃避光振荡反应6 min后在734 nm波长处测定吸光度。空白对照组及阳性对照组分别用蒸馏水及VC代替多糖样品。ABTS+·清除率按式(1)计算。
1.3.8.3 铁离子还原法
2,4,6-三吡啶基-1,3,5-三嗪(2,4,6-tri(2-pyridy)-1,3,5-triazine,TPTZ)工作液配制:首先分别配制10 mmol/L TPTZ溶液、20 mmol/L FeCl3溶液、0.3 mol/L醋酸钠缓冲液,再将三者按体积比1∶1∶10混合,配制成TPTZ终浓度为0.83 mmol/L的工作液。
FeSO4标准曲线绘制:于96 孔板中加依次加入不同浓度的FeSO4标准溶液(0.0、0.1、0.2、0.4、0.6、0.8、1.0 mmol/L)20 μL,再分别加入180 μL TPTZ工作液,37 ℃避光振荡反应10 min后在595 nm波长处测定吸光度,以FeSO4的物质的量为横坐标,吸光度为纵坐标,建立标准曲线。于96 孔板中加不同质量浓度的多糖溶液(0.25、0.50、1.00、2.00、4.00、6.00、8.00、10.00 mg/mL)20 μL,再依次加入180 μL TPTZ工作液,37 ℃避光振荡反应10 min后在595 nm波长处测定吸光度。空白对照组及阳性对照组分别用蒸馏水及VC代替多糖样品。
1.3.9 对肿瘤细胞HepG-2、MCF-7、HCC827增殖的抑制作用
肿瘤细胞以5×104个/mL的浓度接种到96 孔板,37 ℃、5% CO2、高糖DMEM完全培养基培养24 h后,分别加入质量浓度为125、250、500、1 000、2 000 μg/mL的LKY-I溶液,继续培养24 h,每孔加入20 μL MTT溶液(5 mg/mL),培养箱反应4 h。培养结束后,除去上清液,加入150 μL DMSO溶液,避光振荡反应10 min。采用酶标仪于490 nm波长处检测吸光度,按公式(2)计算细胞抑制率。

式中:A0为空白对照孔的吸光度;A1为样品孔的吸光度。
1.4 数据统计分析
采用SPSS 16.0软件对实验数据进行处理分析,数据表示为 ±s。
2 结果与分析
2.1 LKY-I的分子质量测定和纯度鉴定
树蝴蝶粗多糖经DEAE-52分离,蒸馏水洗脱得到纯化多糖LKY-I。LKY-I经Sephadex G-100检验得到对称的洗脱曲线(图1),与GPC(图2)相互验证,表明LKY-I为纯度较好的单一组分的多糖。LKY-I重均分子质量(Mw)为61 598 D,黏均分子质量为29 125 D,峰位分子质量为26 397 D。
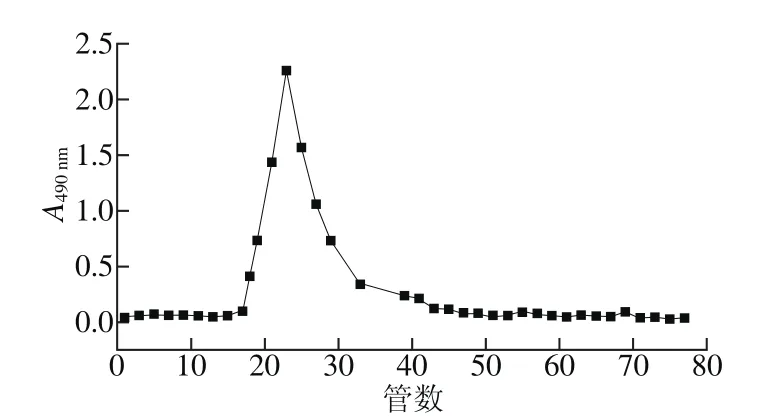
图1 LKY-I的 Sephadex G-100洗脱曲线Fig. 1 Elution curve of LKY-I by Sephadex G-100 column chromatography
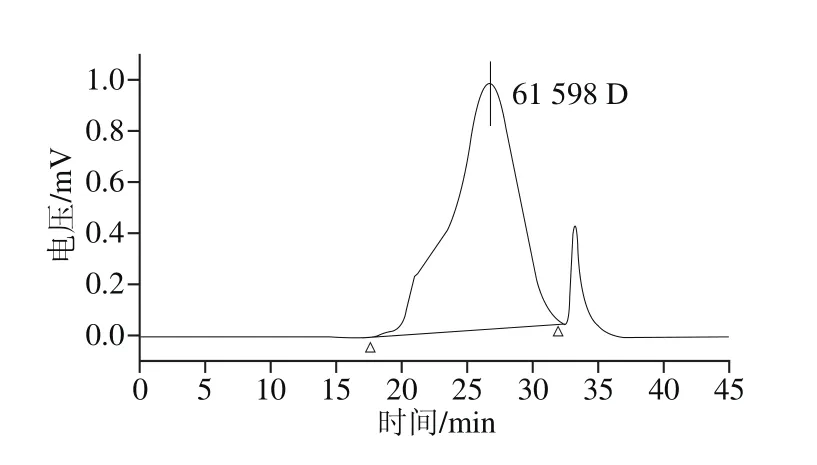
图2 LKY-I的 GPC 图谱Fig. 2 GPC chromatogram of LKY-I
2.2 LKY-I理化性质分析
苯酚-硫酸法葡萄糖标准曲线为y=8.207 3x-0.016 1,R2=0.999 3,测得LKY-I的总糖含量为88.91%。DNS法测得葡萄糖标准曲线为y =9.154 2x-0.003 4,R2=0.998 4,测得结果显示LKY-I中不含还原糖。考马斯亮蓝G-250标准曲线方程为y=8.837 1+0.009 6,R2=0.996 3,测得LKY-I中蛋白质含量为0.13%。
2.3 LKY-I的单糖组成
通过对多糖水解及衍生化产物的测定,可以得出单糖组成和物质的量比。多糖经水解、衍生化,GC测定,与标准品的出峰时间相互对照,即可得到样品中的单糖成分和物质的量比。图3单糖标准品经衍生化后生成糖腈乙酸酯衍生物,用GC分析得到的图谱。图4为LKY-I样品经水解和衍生化后得到的GC图,与标准品色谱图对比可知,LKY-I主要由鼠李糖、木糖、甘露糖、葡萄糖、半乳糖组成,5 种单糖的物质的量比为1.1∶2.0∶46.5∶28.5∶20.5,甘露糖、葡萄糖和半乳糖的含量之和在90%以上,其中甘露糖的含量最高。
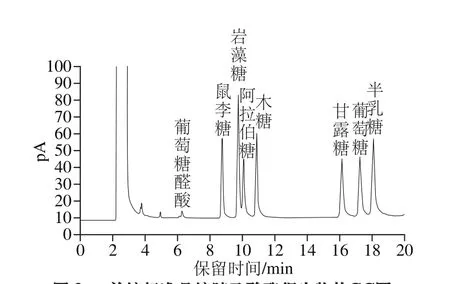
图3 单糖标准品糖腈乙酸酯衍生物的GC图Fig. 3 GC chromatogram of aldononitrile acetate derivatized monosaccharide standards
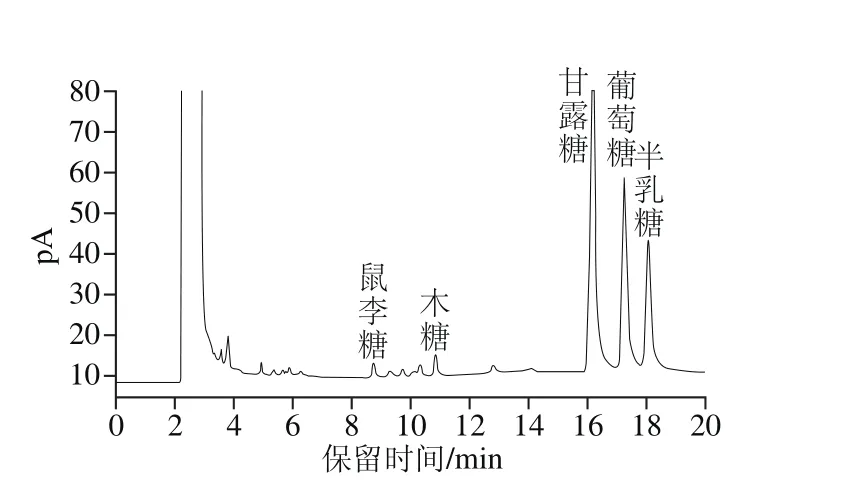
图4 LKY-I的GC图Fig. 4 GC chromatogram of LKY-I
2.4 LKY-I的傅里叶变换红外光谱分析
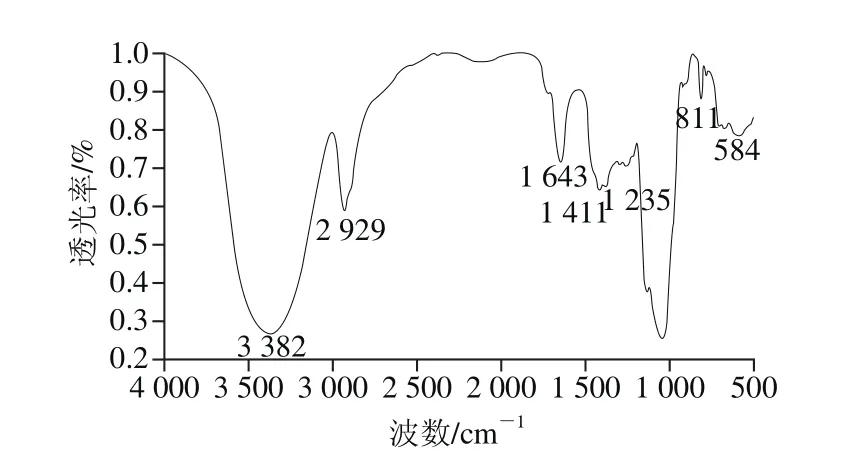
图5 LKY-I的傅里叶变换红外光谱图Fig. 5 FT-IR spectrum of LKY-I
傅里叶变换红外光谱是研究糖类化合物结构不可或缺的技术,可用于检测醛糖和酮糖的糖环构象、糖苷键的构型等[16]。LKY-I的傅里叶变换红外光谱分析结果如图5所示,3 382 cm-1处是多糖中O—H伸缩振动的吸收峰,形宽而钝,可知不是游离的羟基,而是在分子间发生了缔合作用;2929 cm-1处的吸收峰是C—H伸缩振动的吸收峰;1 400~1 200 cm-1处的吸收峰是C—H的变角振动吸收峰;由以上3 组吸收峰可初步判断该物质为糖类化合物[17]。1 643 cm-1处的吸收峰是多糖中乙酰氨基(—NHCOCH3)的C=O伸缩振动产生的,说明LKY-I是一种含氨基的糖缀合物[18];1 200~1 000 cm-1这个区域比较大的吸收峰是由2 种C—O伸缩振动引起的,其中1 种属于C—O—H,另一种则属于糖环的C—O—C;LKY-I在811 cm-1处的吸收峰表明LKY-I中含有α-D-甘露糖,这与GC结果一致[19]。
2.5 LKY-I的高碘酸氧化和Smith降解
LKY-I经高碘酸氧化108 h后达到稳定,吸光度为0.374,通过标准曲线Y=8.165X+0.049 24(R2=0.992 6)计算,可知消耗高碘酸的量为0.126 mmol;用0.009 45 mol/L NaOH溶液滴定,得到甲酸的生成量为0.038 mmol。LKY-I经高碘酸氧化后生成甲酸,说明有(1→)或(1→6)糖苷键,高碘酸的消耗量大于甲酸生成量的2 倍,表明可能含有只消耗高碘酸而不产生甲酸的糖苷键,如(1→2)、(1→4)、(1→2,4)、(1→4,6)糖苷键及不消耗高碘酸也不产生甲酸的(1→3)糖苷键。根据甲酸消耗量推测(1→6)或(1→)连接的糖苷键约占多糖连接键的24.68%,约占可氧化糖苷键的43.18%[20-22]。
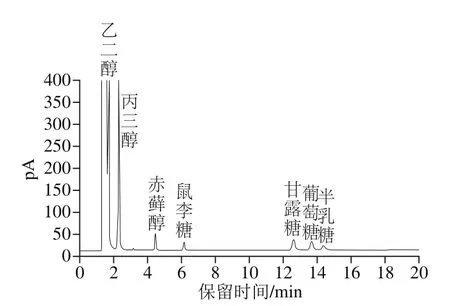
图6 混合标准品的糖腈乙酸酯衍生物GC图Fig. 6 GC chromatogram of acetyl derivatives of monosaccharide standard mixture
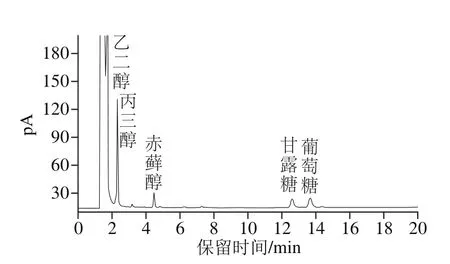
图7 LKY-I Smith降解产物GC图Fig. 7 GC chromatogram of Smith degradation products of LKY-I
图7为LKY-I经Smith后的降解产物经过衍生化后的GC图。将其与混合标准品的糖腈乙酸酯衍生物的GC图(图6)对比可知,LKY-I经Smith降解后的产物中有乙二醇、丙三醇、赤藓醇、甘露糖及葡萄糖5 种产物。表明糖链中含有(1→4)、(1→4,6)、(1→)、(1→6)、(1→2)、(1→2,6)糖苷键,降解产物中不含有鼠李糖、半乳糖,表明鼠李糖和半乳糖中不含(1→3)糖苷键;甘露糖和葡萄糖的存在,说明甘露糖和葡萄糖都含有(1→3)糖苷键。降解产物中乙二醇、丙三醇、赤藓醇、甘露糖、葡萄糖的物质的量比为7.74∶6.50∶1.05∶1.00∶1.11。
2.6 LKY-I的核磁共振结果分析
NMR是分析有机物结构的有力手段,但由于糖类的结构单体(糖残基)相似,且分子质量大,因此对其进行NMR分析有一定的难度。通常,测定糖类样品的一维1H NMR和13C NMR谱可得到其整体结构信息,如糖的化学组成、糖苷键构型及键合位置、糖环构象、糖残基排列顺序等。NMR是进行复杂的多糖结构解析的有效技术,对多糖的结构鉴定起到决定性作用[23-24]。
树蝴蝶纯化多糖LKY-I的1H NMR图(图8)显示,在δ 4.3~5.9区域内有5 个质子信号峰,表示LKY-I主要有有5 种单糖种类[25],这与单糖组成鉴定结果一致;在δ 4.8~5.3范围内有共振峰,表明LKY-I中含有β型吡喃糖;化学位移小于δ 3.5有系列小峰,说明该糖中可能有烷基或蛋白质中支链氨基酸残基的存在,说明LKY-I是一种糖蛋白缀合物[26-27]。高场区δ 1.27处的共振信号为C6脱氧糖的甲基质子信号峰[28]。δ 2.14为O-乙酰基(—COOCH3)的甲基质子信号[29]。综上所述,根据NMR图的结果,进一步确定了树蝴蝶纯化多糖LKY-I是含有蛋白质的糖缀合物。
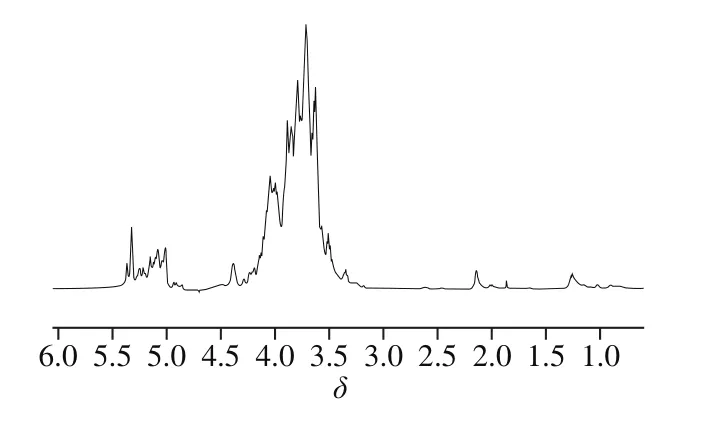
图8 LKY-I的1H NMR图Fig. 8 1H-NMR spectrum of LKY-I
13C NMR是研究糖类化合物结构的重要方法之一。多糖的13C NMR的化学位移范围较1H NMR广,达δ 300,具有较好的分辨率。树蝴蝶纯化多糖LKY-I的13C NMR图显示(图9),异头碳的共振峰集中在δ 97.92~103.00范围内,清楚呈现4 个共振信号(甘露糖不以此判断),说明该多糖主要有4 种不同的单糖残基组成,为杂多糖;化学位移在δ 103.00处的共振峰,表明多糖的单糖以吡喃环存在[28,30];其中δ 106.14、104.88、103.40处对应的是β构型的吡喃糖残基的信号峰[31];在δ 70~75间的化学位移说明该多糖存在吡喃型糖残基末端被取代的C2、C3、C4化学位移;小于δ 80有信号吸收峰,表明有吡喃糖环结构存在;δ 69.41、65.48处化学位移存在较强的信号,表明该多糖中C6键上的—OH中H被取代,多糖链中有(1→6)糖苷键[32]。
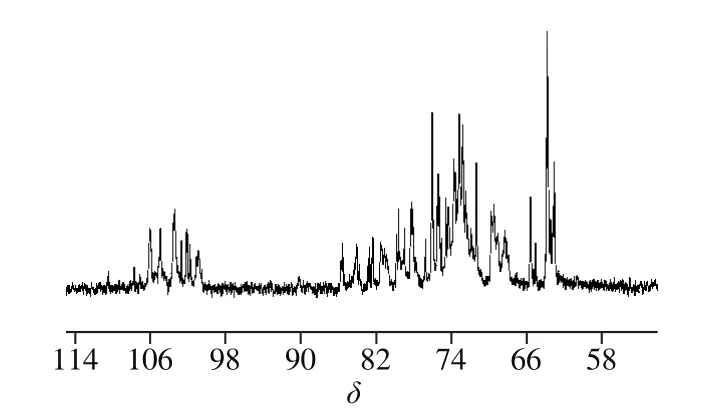
图9 LKY-I的13C NMR图Fig. 9 13C-NMR spectrum of LKY-I
2.7 LKY-I的抗氧化活性
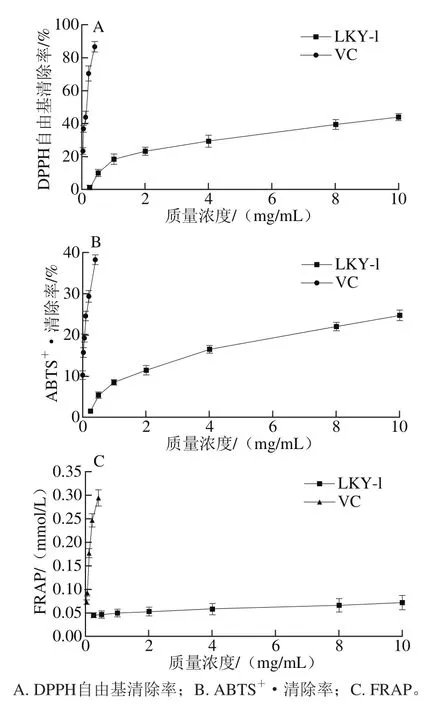
图10 LKY-I的抗氧化能力Fig. 10 Antioxidant activity of LKY-I
DPPH自由基是稳定的自由基化合物,其溶液在517 nm波长处有强吸收峰,它被广泛地应用于评估抗氧化剂清除自由基的能力,DPPH自由基清除率高说明抗氧化活性好。在此基础上,LKY-I对DPPH自由基的清除能力进行测定,结果如图10A所示。在0.25~10.00 mg/mL范围内LKY-I对DPPH自由基清除能力随着质量浓度的增大而增大,呈线性关系。表明LKY-I可以提供清除DPPH自由基的氢供体。与低质量浓度的VC比较,10 mg/mL LKY-I的清除能力与100 μg/mL的VC相当。当样品质量浓度达10 mg/mL时,DPPH自由基清除率达到最大值44.12%,说明LKY-I样品均可提供清除DPPH自由基的氢供体,具有一定的抗氧化能力。
如图10B所示,在0.25~10.00 mg/mL范围内,LKY-I对ABTS+·的清除能力随着质量浓度的增大而增大,当样品质量浓度为10 mg/mL时,ABTS+·清除率达到最大值24.74%,稍高于100 μg/mL的VC(24.56%),说明LKY-I有一定清除ABTS+·的能力。
铁离子还原力(ferric-reducing antioxidant power,FRAP)法测定多糖的抗氧化能力的原理是当具有还原性的物质存在时,TPTZ溶剂中的Fe3+被还原为Fe2+,显示蓝色,通过测定其吸光度即可判定还原性物质抗氧化能力大小。FeSO4标准曲线为Y=0.966X+0.023(R2=0.996 0),其中X为FeSO4的浓度/(mmol/L),Y为对应的吸光度。
如图10C所示,在0.25~10.00 mg/mL范围内,LKY-I的FRAP随着质量浓度的增大而增大,当样品质量浓度为10 mg/mL时,LKY-I的FRAP值达到0.071 17 mmol/L与100 μg/mL VC(0.072 31 mmol/L)相当,说明LKY-I具有还原Fe3+的能力。
2.8 LKY-I对癌细胞HepG-2、HCC827、MCF-7增殖的抑制作用
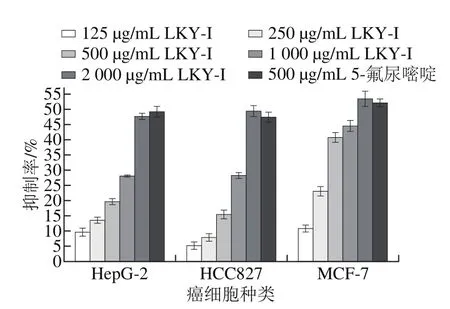
图11 LKY-I质量浓度对癌细胞的影响Fig. 11 Inhibitory effect of LKY-I on tumor cells
MTT法检测不同质量浓度LKY-I对不同癌细胞增殖的影响,结果表明,树蝴蝶纯化多糖LKY-I具有抗肿瘤活性。如图11所示,在125~2 000 μg/mL范围内LKY-I对癌细胞HepG-2、MCF-7、HCC827的抑制率随质量浓度的增大而增大,呈正相关性,且有一定的剂量依赖性。当多糖质量浓度为2 000 μg/mL时,LKY-I对HepG-2细胞增殖的抑制率达47.65%,稍低于500 μg/mL的5-氟尿嘧啶(49.21%);对HCC827细胞增殖的抑制率达49.41%,稍高于500 μg/mL的5-氟尿嘧啶(47.42%);对MCF-7的抑制率达53.44%,稍高于500 μg/mL的5-氟尿嘧啶(52.12%)。综上可知,树蝴蝶纯化多糖LKY-I具有抗肿瘤活性,推测可能是因为LKY-I中含有α(1→6)糖苷键,且对不同癌细胞呈现出不同的抑制能力。
3 结 论
本实验通过超声波辅助热水浸提法制备树蝴蝶粗多糖,通过DEAE-52阴离子交换柱对粗多糖进行分离纯化得到组分均一的树蝴蝶纯化多糖——LKY-I。LKY-I的重均分子质量为61 598 D,主要由鼠李糖、木糖、甘露糖、葡萄糖、半乳糖组成,5 种单糖的物质的量比为1.1∶2.0∶46.5∶28.5∶20.5,并且甘露糖、葡萄糖和半乳糖三者之和的含量在90%以上。结构表征LKY-I是含有甘露糖苷的D-吡喃糖环,包括α构型和β构型,由24.68%的(1→6)或(1→)连接的糖苷键组成。LKY-I具有一定的清除DPPH自由基、ABTS+·和还原Fe3+能力,其活性都随质量浓度的增加而增加,即都呈一定的剂量-效应关系。当LKY-I的质量浓度达到10 mg/mL时,清除DPPH自由基的能力与微克级别的VC相当,因为多糖化合物中含有多羟基基团,使DPPH自由基还原为DPPH-H,从而表现出较强的抗氧化能力。在清除ABTS+·的反应中,LKY-I能够抑制ABTS+·的产生,LKY-I的质量浓度达到10 mg/mL时,ABTS+·的清除率达24.74%。随着LKY-I质量浓度的增加,FRAP值也随之增加。FRAP是表示抗氧化物质提供电子能力的重要指标,提供可阻断Fe2+向Fe3+的转变的电子;多糖的分子链中活性羟基提供电子或氢原子,与自由基充分作用,表现出抗氧化活性。2 000 μg/mL的LKY-I对癌细胞HepG-2、HCC827、MCF-7增殖的抑制率可达到半抑制浓度,说明LKY-I具有一定的抗肿瘤活性,可能与LKY-I中含有β(1→3)糖苷键,以及中等分子质量和其良好的水溶性密切相关,可用于临床抗肿瘤活性药物进行深入研究。本实验对组分均一LKY-I的研究,为树蝴蝶多糖生物活性作用机制与分子结构间的关系和树蝴蝶多糖的活性研究奠定了基础。而要完整阐述树蝴蝶多糖分子结构与功能的关系,则需要进一步研究多糖的结构。多糖的结构,特别是高级结构的研究对揭示多糖的生理功能及构效关系十分重要。
参考文献:
[1] 林俊, 李萍, 陈靠山. 近5 年多糖抗肿瘤活性研究进展[J]. 中国中药杂志, 2013, 38(8): 1116-1125. DOI:10.4268/cjcmm20130802.
[2] SARANGI I, GHOSH D, BHUTIA S K, et al. Anti-tumor and immunomodulating effects of Pleurotus ostreatus mycelia-derived proteoglycans[J]. International Immunopharmacology, 2006, 6(8):1287-1297. DOI:10.1016/j.intimp.2006.04.002.
[3] SCHEPETKIN I A, QUINN M T. Botanical polysaccharides:macrophage immunomodulation and therapeutic potential[J].International Immunopharmacology, 2006, 6(3): 317-333.DOI:10.1016/j.intimp.2005.10.005.
[4] LI Y Q, FANG L, ZHANG K C. Structure and bioactivities of a galactose rich extracellular polysaccharide from submergedly cultured Ganoderma lucidum[J]. Carbohydrate Polymers, 2007, 68(2): 323-328. DOI:10.1016/j.carbpol.2006.12.001.
[5] 杜远东. 老龙皮的药效物质及质量标准研究[D]. 咸阳: 陕西中医学院, 2012: 1-10. DOI:10.7666/d.y2109752.
[6] 房敏峰, 王启林, 胡正海. 地衣化学成分和药理作用研究进展[J]. 中草药, 2011, 42(12): 2571-2576.
[7] 张璞, 樊守金. 地衣抗生素和地衣多糖类物质的研究进展[J]. 山东科学, 2007, 20(2): 41-44.
[8] 靳菊情, 丁东宁, 边晓丽, 等. 老龙皮多糖的研究[J]. 中药材, 1997,20(7): 355-357. DOI:10.13863/j.issn1001-4454.1997.07.015.
[9] 王晓梅, 李健, 李宗孝, 等. 老龙皮提取物的体外抗氧化活性研究[J]. 现代中医药, 2010, 30(5): 79-80. DOI:10.13424/j.cnki.mtcm.2010.05.036.
[10] HAN X F, SHEN S Q, LIU T A, et al. Characterization and antioxidant activities of the polysaccharides from Radix Cyathulae officinalis Kuan[J]. International Journal of Biological Macromolecules, 2015,72(6): 544-552. DOI:10.1016/j.ijbiomac.2014.09.007.
[11] 高呈琳, 张小爽, 陈健. 梭柄松苞菇多糖CVP-Ⅱ2的理化性质及其结构研究[J]. 食品工业科技, 2015, 36(3): 133-136. DOI:10.13386/j.issn1002-0306.2015.03.019.
[12] WANG L J, YAO Y, SANG W, et al. Structural features and immunostimulating effects of three acidic polysaccharides isolated from Panax quinquefolius[J]. International Journal of Biological Macromolecules, 2015, 80: 77-86. DOI:10.1016/j.ijbiomac.2015.06.007.
[13] ZHANG L J, ZHANG W, WANG Q, et al. Purification, antioxidant and immunological activities of polysaccharides from Actinidia Chinensis roots[J]. International Journal of Biological Macromolecules, 2015,72: 975-983. DOI:10.1016/j.ijbiomac.2014.09.056.
[14] 陈健, 向莹. 滑子菇多糖的结构分析[J]. 现代食品科技, 2013, 29(7):1544-1550. DOI:10.13982/j.mfst.1673-9078.2013.07.05.
[15] HAO L M, SHENG Z C, LU J K, et al. Characterization and antioxidant activities of extracellular and intracellular polysaccharides from Fomitopsis pinicola[J]. Carbohydrate Polymers, 2015, 141(6): 54-59.
[16] GE Q, MAO J W, GUO X Q, et al. Composition and antioxidant activities of four polysaccharides extracted from Herba Lophatheri[J].International Journal of Biological Macromolecules, 2013, 60(6): 437-441. DOI:10.1016/j.ijbiomac.2013.06.011.
[17] 尹艳. 两种水溶性大豆多糖的红外光谱分析[J]. 食品研究与开发,2013, 34(8): 67-68. DOI:10.3969/j.issn.1005-6521.2013.08.018.
[18] 何钢, 刘嵬, 李会萍, 等. 银杏叶多糖分离纯化、结构鉴定及抗氧化活性研究[J]. 食品工业科技, 2015, 36(22): 81-86. DOI:10.13386/j.issn1002-0306.2015.22.008.
[19] 夏朝红, 戴奇, 房韦, 等. 几种多糖的红外光谱研究[J]. 武汉理工大学学报, 2007, 29(1): 45-47. DOI:10.3321/j.issn:1671-4431.2007.01.012.
[20] 张化朋, 张静, 南征, 等. 杏鲍菇多糖WPP2的结构表征及抗肿瘤活性[J]. 高等学校化学学报, 2013, 34(10): 2327-2333. DOI:10.7503/cjcu20130081.
[21] JIN F, JIA L Y, TU Y Y. Structural analysis of an acidic polysaccharide isolated from white tea[J]. Food Science and Technology, 2015, 24(5): 1623-1628.
[22] 裴丽娟, 袁雷, 马姣妮, 等. 松木层孔菌多糖PEP的结构及活性研究[J]. 分子科学学报, 2010, 26(2): 103-107. DOI:10.3969/j.issn.1000-9035.2010.02.006.
[23] 田媛, 张尊建. 糖类结构的核磁共振波谱及质谱分析[J]. 药学进展,2003, 27(2): 78-80. DOI:10.3969/j.issn.1001-5094.2003.02.004.
[24] 谢明勇, 聂少平. 天然产物活性多糖结构与功能研究进展[J]. 中国食品学报, 2010, 10(2): 1-11
[25] 杜秀菊, 张劲松, 潘迎捷. 核磁共振技术在食用菌多糖结构分析中的作用[J]. 中国食用菌, 2010, 29(1): 3-6; 19. DOI:10.3969/j.issn.1003-8310.2010.01.001.
[26] SUN Y X, LIU J C, YANG X D, et al. Purification, structural analysis and hydroxyl radical-scavenging capacity of a polysaccharide from the fruiting bodies of Russula virescens[J]. Process Biochemistry, 2010,45(6): 874-879. DOI:10.1016/j.procbio.2010.02.007.
[27] 杜秀菊, 张劲松, 潘迎捷. 核磁共振技术在食用菌多糖结构分析中的作用[J]. 中国食用菌, 2010, 29(1): 3-6; 19.
[28] 刘小如, 张丽美, 胡蒋宁, 等. 油茶粕多糖的分级纯化及结构研究[J]. 食品科学, 2013, 34(23): 96-102. DOI:10.7506/spkx1002-6630-201323021.
[29] 刘玉红, 王凤山. 核磁共振波谱法在多糖结构分析中的应用[J]. 食品与药品, 2007, 9(8): 39-43. DOI:10.3969/j.issn.1672-979X.2007.08.014.
[30] SERRATO R V, SASSAKI G L, GORIN P A J, et al. Structural characterization of an acidic exohetero polysaccharide produced by the nitrogen-fixing bacterium Burkholderia tropica[J]. Carbohydrate Polymers, 2008, 73(4): 564-572.
[31] 罗祖友, 陈根洪, 郑小江, 等. 藤茶多糖AGP-3的分离纯化与结构的初步鉴定[J]. 时珍国医国药, 2009, 20(7): 1707-1709. DOI:10.3969/j.issn.1008-0805.2009.07.072.
[32] 孙元琳, 陕方, 崔武卫, 等. 当归多糖ASP3及其水解产物的NMR光谱分析[J]. 高等学校化学学报, 2009, 30(9): 1739-1743.DOI:10.3321/j.issn:0251-0790.2009.09.011.
Structural Analysis and Antioxidant and Antitumor Activity of Polysaccharide LKY-I from Lobaria koorkauae Yoshim
SHEN Chaoqun1, CHEN Jian2,*
(1. Guangdong Provincial Institute of Food Inspection (Guangdong Provincial Liquor Testing Center), Guangzhou 510165, China;2. School of Food Science and Engineering, South China University of Technology, Guangzhou 510641, China)
A novel water-soluble polysaccharide (LKY-I) was isolated from Lobaria koorkauae Yoshim sequentially through ultrasonic-assisted water extraction, ethanol precipitation, DEAE-52 ion-exchange chromatography and gel permeation chromatography. Its molecular weight distribution and purity were determined by gel permeation chromatographic (GPC) separation with dextran-based Sephadex G-100. The chemical structure of LKY-I was studied by Fourier transform-infrared (FT-IR) spectroscopy, gas chromatography (GC), periodate oxidation, Smith degradation, and nuclear magnetic resonance (NMR). The antioxidant activity was evaluated by measuring reducing power and radical scavenging capacities against 1,1-diphenyl-2-picrylhydrazyl (DPPH) free radical and 2,2’-azinobis(3-ethylbenzothiazoline-6-sulfonic acid) free radicals (ABTS+·) in vitro. The growth inhibitory effect of LKY-I on tumor cell HepG-2, HCC827 and MCF-7 was evaluated using 3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide (MTT) assay. The results revealed that the weight-average molecular mass (Mw) of LKY-I was 61 598 D, and its polysaccharide content was 88.91%. GC results showed that LKY-I contained five monosaccharides, including rhamnose(Rha), xylose (Xyl), mannose (Man), glucose (Glu), and galactose (Gal), with a molar ratio of 1.1:2.0:46.5:28.5:20.5. FT-IR analysis showed that LKY-I had characteristic absorption peaks and its monosaccharide residues existed in the form of pyranring. Periodate oxidation, Smith degradation and NMR revealed that there were 24.68% (1→6) and (1→) glycosides bonds in LKY-I; meanwhile, LKY-I had a D-glucopyranose ring containing mannose residue, including α and β configurations.The scavenging activity of LKY-I against DPPH free radicals and ABTS+· increased with increasing its concentration from 250 to 10 000 μg/mL, with the highest inhibition percentages of 44.12% and 24.74%, respectively at a concentration of 10 000 μg/mL. At 10 000 μg/mL, the FRAP value was 0.071 17 mmol/L, which was equivalent to 100 μg/mL of VC(0.072 31 mmol/L). The inhibitory effect of LKY-I on the proliferation of cancer cells was gradually increased with increasing its concentration from 125 to 2 000 μg/mL. When the concentration was 2 000 μg/mL, the percentage inhibition of tumor cell HepG-2, HCC827 and MCF-7 proliferation was nearly 50%, indicating that LKY-I has potent antitumor activity.
Lobaria koorkauae Yoshim; polysaccharides; structure; antioxidant; antitumor
2016-07-12
广东省自然科学基金项目(2014A030313242)
申超群(1992—),女,硕士研究生,研究方向为多糖的结构表征及生物活性。E-mail:1481630722@qq.com
*通信作者:陈健(1967—),男,副教授,博士,研究方向为天然产物化学。E-mail:fejchen@scut.edu.cn
10.7506/spkx1002-6630-201721019
TS241
A
1002-6630(2017)21-0119-07
申超群, 陈健. 树蝴蝶多糖LKY-I的结构和抗氧化、抗肿瘤活性评价[J]. 食品科学, 2017, 38(21): 119-125.
10.7506/spkx1002-6630-201721019. http://www.spkx.net.cn
SHEN Chaoqun, CHEN Jian. Structural analysis and antioxidant and antitumor activity of polysaccharide LKY-I from Lobaria koorkauae Yoshim[J]. Food Science, 2017, 38(21): 119-125. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201721019. http://www.spkx.net.cn

