抗菌治疗对兔颊VX-2鳞癌感染性微环境中树突状细胞的影响
陈志红 易杰 黄桂林 张霓霓 姚礼 张立刚
抗菌治疗对兔颊VX-2鳞癌感染性微环境中树突状细胞的影响
陈志红 易杰 黄桂林 张霓霓 姚礼 张立刚
目的探索抗菌治疗对兔颊VX-2鳞癌感染性微环境中树突状细胞(dendritic cells,DCs)成熟及功能的影响。方法瘤粒植入形成兔颊VX-2鳞癌后,附加机械创伤及高糖饮食获得该鳞癌的炎症模型,再分为3 组(n=6),A组:颊癌炎症模型使用抗生素治疗3 d;B组:颊癌炎症模型以生理盐水代替抗生素对照;C组:单纯颊癌不做处理。3 d后收集各组肿瘤标本,制成匀浆,取上清液与正常兔外周血单核细胞共培养,流式细胞仪检测DCs表面分子HLA-DR、CD83、CD86的表达,混合淋巴细胞反应检测DCs刺激T细胞增殖的能力。结果HLA-DR、CD83、CD86阳性率及刺激指数(stimulate index,SI)由高到低均分别为:C组>A组>B组(P<0.05)。结论抗菌治疗有助于感染兔颊VX-2鳞癌微环境中树突状细胞的成熟及功能恢复。
抗菌治疗; 炎症; VX-2鳞癌; 树突状细胞
自1990 年以来,全球范围内口腔癌的发病率及其在全身各系统中发生肿瘤所占比例逐年上升[1]。口腔中适宜的温度及湿度、大量的食物残渣及细菌,以及口腔癌患者在语言或进食时牙齿、食物等对肿瘤造成创伤等原因,导致口腔癌患者肿瘤局部常常伴有感染,出现疼痛、出血等症状。近年的研究证实了炎症与肿瘤的发生有着明显的因果关系[2],但口腔癌继发局部感染后是否会导致肿瘤微环境中与免疫相关的细胞发生功能改变,抗菌治疗能否对患者的局部免疫功能产生影响,在我们检索的文献中还未见相关报道。本研究拟通过建立兔颊VX-2鳞癌感染性微环境模型,探索抗菌治疗能否影响DCs表面分子HLA-DR、CD83、CD86的表达及DCs的功能。
1 材料与方法
1.1 实验动物
种植于新西兰兔后腿的VX-2荷瘤兔1 只,购自中山大学。2~4 月新西兰兔25 只,体重约1.5~2 kg,购自重庆滕鑫生物技术有限公司。
1.2 实验试剂
注射用普鲁卡因青霉素(上海公谊兽药厂);替硝唑片(重庆科瑞制药集团有限公司);兔外周血淋巴细胞分离液 (天津灏洋生物制品科技有限公司);APC-CD83、PE-CD86、FITC-HLA-DR、APC-IgG1、PE-IgG1、FITC-IgG2a抗体(BD公司,美国);尼龙毛(郑州派和泰德医药科技有限公司);活细胞计数试剂盒(同仁化学研究所,日本)。
1.3 实验方法
1.3.1 兔颊VX-2鳞癌模型的建立及干预 参照张林等[3]建模方法,取荷瘤兔大腿肿瘤制备成大小1 mm3的瘤粒,在无菌操作下植入到实验兔颊肌内,约6~7 d肿瘤形成。实验第14天,在肿瘤部位切除体积1 cm×1 cm×0.3 cm的黏膜块,形成局部创伤,术后全部实验兔予以高糖黏性牛奶饮用。实验第17天,肿瘤表面黏膜破溃红肿,建模成功。根据不同的干预措施分成3 组,每组6 只,共18 只。A组:肿瘤伴炎症,150 mg/kg替硝唑片灌胃,22 000 U/kg注射用普鲁卡因青霉素肌肉注射;B组:肿瘤伴炎症,20 ml生理盐水灌胃,1 ml生理盐水肌注;C组:单纯接种的肿瘤,20 ml生理盐水灌胃,1 ml生理盐水肌注。1 次/d,连续3 d。实验第20天,完整切取所有肿瘤,部分标本行HE染色,光镜观察。其余标本以200 g/L与RPMI 1640培养基混合后制成匀浆, 3 000 r/min离心20 min×2 次,取上清液,存于-20 ℃冰箱内。
1.3.2 兔外周血源树突状细胞的培养 取1 只正常新西兰兔,经皮穿刺心脏采血约15 ml,参照说明书分离外周血单个核细胞,将细胞浓度调整至2×106/ml,再以1 ml/孔加入到6 孔板内,37 ℃、5%CO2培养箱中静置3 h,吸弃上清液,剩余细胞即为单核细胞。将1.3.1中所得上清液以0.22 μm过滤器过滤3 遍后与上述单核细胞一起培养。A组上清液1 ml+10%胎牛血清RPMI 1640培养基2 ml;B组上清液1 ml+10%胎牛血清RPMI 1640培养基2 ml;C组上清液1 ml+10%胎牛血清RPMI 1640培养基2 ml。每组隔日半量换液,在培养第6天,收集各组细胞,相差显微镜和扫描电镜(SEM)下观察细胞形态。
1.3.3 流式细胞仪(BD公司,美国)检测HLA-DR、CD83、CD86的表达 制备单细胞悬液,调整浓度至1×106/ml,检测活细胞率>95%。3 组分别取6 个样本,每个样本设实验管(100 μl细胞悬液,加入HLA-DR-FITC、CD83-APC、CD86-PE各10 μl)和对照管(100 μl细胞悬液,加入IgG2a-FITC、IgG1-APC、IgG1-PE各10 μl),室温避光孵育20 min,然后1 500 r/min离心10 min,弃上清,PBS清洗2 次,以0.5 ml PBS缓冲液混匀,再加0.5 ml 1%多聚甲醛固定,4 ℃冰箱避光保存,流式细胞仪检测HLA-DR、CD83、CD86的表达。
1.3.4 同种异源混合淋巴细胞反应 分离外周血单个核细胞,静置3 h后取悬浮细胞。参照考尼龙毛柱法,分离悬浮细胞中的T细胞,调整细胞浓度至5×106/ml。3 组DCs中分别加入25 mg/L丝裂霉素C,培养箱中孵育30 min ,PBS清洗3次,悬于10%胎牛血清RPMI 1640培养基中,调整细胞浓度至1×106/ml。以3 组DCs为刺激细胞,T细胞为效应细胞,另设单纯培养液对照组和阴性对照组(只添加T细胞)。将DCs和T细胞以 1∶5、1∶10、1∶20 的比例,每组3 复孔,混于96 孔板中,终体积200 μl。孵育72 h,然后每孔加入活细胞计数盒试剂20 μl,孵育3 h。酶标仪(Labsystems Multiskan MS,芬兰)于450 nm处检测各组A值并计算刺激指数(stimulate index,SI),SI=(待测样品孔A值-培养液对照组A值)/(阴性对照组A值-培养液对照组A值)。
1.4 统计学分析
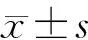
2 结 果
2.1 兔颊VX-2鳞癌炎症模型的病理学改变
制备炎症模型后第3天,肉眼下见A组颊部黏膜破溃,肿瘤外露,稍红肿,无明显渗血;B组颊部黏膜破溃,肿瘤外露,肿瘤组织红肿、渗血;C组兔颊部黏膜完整,未见明显破溃。镜下见各组肿瘤组织内大量形态、大小不一的癌细胞,异型性明显,其中A组鳞癌组织内见少量炎性细胞浸润;B组炎性细胞浸润较A组多;C组则炎性细胞少见(图 1)。
2.2 镜下DCs形态
细胞培养第6天,相差显微镜下见部分细胞呈悬浮或半悬浮状态生长,并且聚集成团(图 2A)。扫描电镜下见DCs表面有大量褶皱及长短、粗细不等的突起(图 2B)。
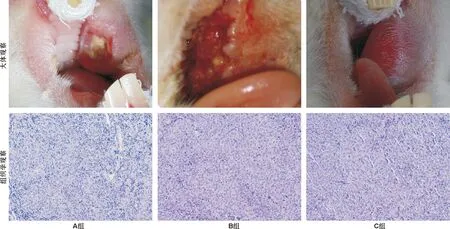
图 1 各组VX-2鳞癌病理学观察(HE, ×100)
Fig 1 Pathological observation of rabbit buccal VX-2 squamous cell carcinoma in the 3 groups(HE, ×100)

图 2 第6天DCs的形态(A: 相差显微镜, ×400; B: 扫描电镜, ×5 000)
Fig 2 Morphology of DCs on the 6th day of cell culture(A: Phase microscope, ×400; B: SEM, ×5 000)
2.3 3 组DCs表型的流式细胞仪检测
3 组HLA-DR、CD83、CD86阳性率F值分别为18.444、30.033、40.664,P<0.01,具有统计学意义,说明3 组中至少有2 组HLA-DR、CD83、CD86阳性率不相等,进一步使用LSD-t检验两两比较,P<0.05,具有统计学意义(表 1)。
2.4 同种异源混合淋巴细胞反应
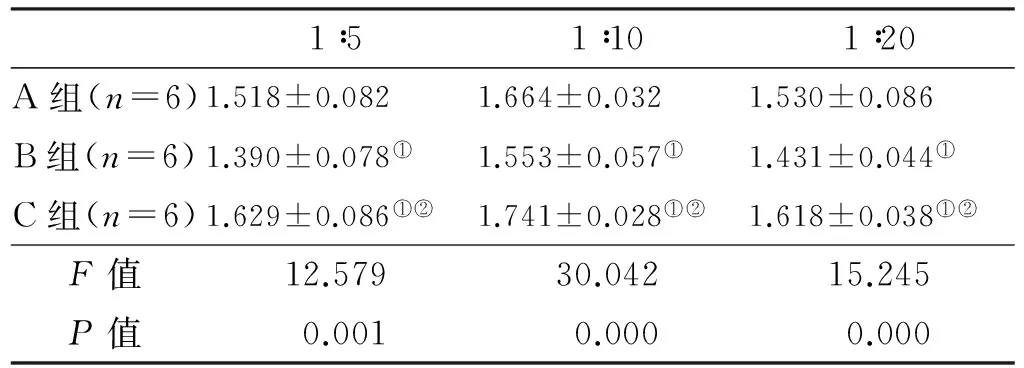
3 组SI相比较的F值分别为12.579、30.042和15.245,P<0.05,具有统计学意义,说明3 组中至少有2 组SI不相等,进一步行LSD-t检验两两比较,结果P值均小于0.05,具有统计学意义(表 2)。
表 1 3 组细胞表型的流式学分析
Tab 1 Flow cytometry analysis of the cell phenotype in the 3 groups

CD83CD86HLA-DRA组(n=6)2.13±0.3021.17±2.302.03±0.26B组(n=6)1.57±0.38①13.95±2.05①1.47±0.16①C组(n=6)2.60±0.18①②25.07±1.84①②2.63±0.33①②F值18.44440.66430.033P值0.0000.0000.000
注: ①与A组比较,P<0.01; ②与B组比较,P<0.01
表 2 3 组混合淋巴细胞反应刺激指数
Tab 2 Stimulate index of mixed lymphocyte reaction in the 3 groups
1∶51∶101∶20A组(n=6)1.518±0.0821.664±0.0321.530±0.086B组(n=6)1.390±0.078①1.553±0.057①1.431±0.044①C组(n=6)1.629±0.086①②1.741±0.028①②1.618±0.038①②F值12.57930.04215.245P值0.0010.0000.000
注: ①与A组比较,P<0.05; ②与B组比较,P<0.05
3 讨 论
所谓肿瘤炎性微环境,就是指肿瘤发生发展过程中所处的炎性内环境,主要包括肿瘤细胞、炎性细胞及炎性因子、细胞外基质成分、血管及淋巴管网络等。由于大量炎性细胞及因子的存在,进一步促进了肿瘤增殖、转移及血管生成,使肿瘤微环境更加复杂多变[4]。
DCs是迄今为止体内功能最强大的抗原提呈细胞。在肿瘤微环境中浸润着大量的DCs,可通过各种途径发挥抗肿瘤免疫[5]。由于各种抑制因子的作用,使DCs加工及提呈抗原能力减弱[6-7]。在肿瘤炎性微环境中,大量的炎性细胞和炎性因子如肿瘤相关巨噬细胞(tumor-associated macrophages,TAM)、髓源性抑制细胞(myeloid derived suppressor cell,MDSC)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、白细胞介素(interleukin,IL)-6、 IL-10等,可进一步抑制DCs成熟及功能,导致免疫逃逸的发生。如:炎症相关细胞MDSC可直接或通过产生大量Arg-1和iNOS间接抑制DCs的功能[8]。炎性因子IL-6可通过激活JAK2-STAT3信号通路诱导DCs功能障碍,削弱机体的免疫监视[9]。IL-10不仅可通过下调DCs表面标记分子MHC及B7的表达,使其无法提呈抗原至T细胞[10],还可诱导初始T细胞转化为调节T细胞(regulatory T cell, Treg),Treg通过以下途径进一步阻止imDC的成熟[11]:(1)Treg较初始T细胞更易更快聚集在DCs周围,阻断DCs激活初始T细胞;(2)Treg抑制DCs表面CD80、CD86分子,使其无法提呈抗原至T细胞。另外,在肿瘤炎性微环境中VEGF也可通过各种途径抑制DCs分化、成熟及功能[12]。
本实验首先建立兔颊VX-2鳞癌及其炎症模型,连续3 d使用抗生素进行抗感染治疗,然后通过肉眼观察到A组肿瘤表面红肿、溃烂情况较B组明显改善,镜下见A组肿瘤组织内炎性细胞浸润较B组少。应用VX-2鳞癌上清液体外模拟肿瘤微环境,并与兔外周血单核细胞共培养,检测DCs表面分子HLA-DR、CD83、CD86表达情况及其刺激T细胞增殖能力。3 组结果显示:HLA-DR、CD83、CD86分子表达情况及SI均为C组>A组>B组(P<0.05)。由此可见炎症对DCs细胞成熟及功能的影响,A组、B组DCs的成熟及功能受到不同程度的抑制,尤其是B组,HLA-DR、CD83、CD86分子表达及SI同A组相比,均明显降低。由此笔者推测:通过抗菌药物抗感染治疗后,兔颊VX-2鳞癌局部环境中感染性炎症得到控制,炎性细胞及炎性因子的释放减少,对DCs分化成熟及功能的抑制作用也随之减弱。也就说明了在兔颊VX-2鳞癌中,感染性炎症能抑制DCs分化成熟及功能发挥。这提示临床医生应该及时处理口腔癌患者的局部感染,如避免过硬及刺激性食物,摘除肿瘤旁的不良修复体、拔除残根残冠等,保持局部清洁,必要时可适当进行全身抗感染,避免肿瘤进一步恶化,及早手术。这都有利于患者体内DCs的分化成熟及功能发挥,提高免疫力。
感染性炎症抑制DCs成熟及功能的中间环节仍不清楚,需进一步研究炎症对DCs影响的机制,从而有效阻断其信号通路,促进DCs成熟及功能发挥。
[1] Global Burden of Disease Cancer Collaboration, Fitzmaurice C, Dicker D, et al. The global burden of cancer 2013[J]. JAMA Oncol, 2015, 1(4): 505-527.
[2] Hussain SP, Harris CC. Inflammation and cancer: An ancient link with novel potentials[J]. Int J Cancer, 2007, 121(11): 2373-2380.
[3] 张林, 张霓霓, 黄桂林, 等. 抗感染对伴炎症兔颊VX2鳞状细胞癌组织中树突状细胞表面分子HLA-DR和CD86表达的影响[J]. 华西口腔医学杂志, 2015, 33(2): 141-144.
[4] 沈政洁, 程海波, 沈卫星, 等. 肿瘤炎性微环境与“癌毒”病机相关性探讨[J]. 北京中医药大学学报, 2015, 38(1): 14-17.
[5] 罗颖蓝, 鲍依稀. 树突状细胞疫苗在肝癌免疫治疗中的研究进展[J]. 国际检验医学杂志, 2010, 31(9): 971-973.
[6] Ostrand-Rosenberg S, Sinha P. Myeloid-derived suppressor cells: Linking inflammation and cancer[J]. J Immunol, 2009, 182(8): 4499-4506.
[7] Palucka K, Ueno H, Roberts L, et al. Dendritic cell subsets as vectors and targets for improved cancer therapy[J]. Curr Top Microbiol Immunol, 2011, 344: 173-192.
[8] Ma Y, Shurin GV, Peiyuan Z, et al. Dendritic cells in the cancer microenvironment [J]. J Cancer, 2013, 4(1): 36-44.
[9] Lin A, Schildknecht A, Nguyen LT, et al. Dendritic cells integrate signals from the tumor microenvironment to modulate immunity and tumor growth[J]. Immunol Lett, 2010, 127(2): 77-84.
[10]孙桂芝, 周同, 张玉梅, 等. 白细胞介素-10对人树突状细胞表型及致炎细胞因子分泌的影响[J]. 上海第二医科大学学报, 2004, 24(7): 510-513.
[11]何浩, 宋文刚. 调节性DC与调节性T细胞的相互作用[J]. 免疫学杂志, 2010, 26(6): 551-554.
[12]Gottfried E, Kreutz M, Mackensen A. Tumor-induced modulation of dendritic cell function[J]. Cytokine Growth Factor Rev, 2008, 19(1): 65-77.
TheeffectsofantimicrobialtherapyondendriticcellsintheinfectedmicroenvironmentofrabbitbuccalVX-2squamouscellcarcinoma
CHENZhihong1,YIJie2,HUANGGuilin2,ZHANGNini2,YAOLi2,ZHANGLigang2.
1. 550002Guiyang,DepartmentofStomatology,People'sHospitalofGuizhouProvince,China; 2.DepartmentofOralandMaxillofacialSurgery,StomatologicalHospital,ZunyiMedicalCollege
Objective: To study the effects of antimicrobial therapy on the maturation and function of dendritic cells(DCs) in the infected microenvironment of rabbit buccal VX-2 squamous cell carcinoma.MethodsThe inflammatory models were obtained by mechanical trauma and high sugar diet on the basis of rabbit buccal VX-2 squamous cell carcinoma models which were established by particle implantation of the tumor tissue. The model rabbits were divided into 3 groups(n=6). In group A the rabbits with buccal VX-2 squamous cell carcinoma and local inflammation were given antibiotics by gavage and intramuscular injection for 3 consecutive days; the rabbits in group B with buccal VX-2 squamous cell carcinoma and local inflammation were given normal saline by gavage and intramuscular injection; the rabbits in group C with tumor and without inflammation were given normal saline by gavage and intramuscular injection.The tumor specimens were collected 3 days after treatment, and made into tissue homogenate, supernatant was collected after centrifugation.Normal rabbit peripheral blood mononuclear cells were separated and co-cultured with the supernatant obtained from the 3 groups respectively. Expressions of DCs surface markers HLA-DR,CD83 and CD86 were detected by flow cytometry. the function of DCs was tested by mixed lymphocyte reaction.ResultsThe positive rate of HLA-DR,CD83,CD86 and stimulate index were group C>group A>group B(P<0.05).ConclusionAntimicrobial therapy can promote the maturation and function of DCs in the infected microenvironment of rabbit buccal VX-2 squamous cell carcinoma.
Antimicrobialtherapy;Inflammation;VX-2squamouscellcarcinoma;Dendriticcells
贵州省科学技术基金(编号: 黔科合J字LKZ[2013]36号,黔科合J字LKZ[2011]23号); 遵义市红花岗区科学技术局项目(编号: 遵红科合社字[2015]09号); 贵州省研究生工作站项目(编号: 黔教研合YJSZ字[2013]08)
550002 贵阳, 贵州省人民医院口腔科(陈志红); 遵义医学院附属口腔医院口腔颌面外科(易杰 黄桂林 张霓霓 姚礼 张立刚)
黄桂林 E-mail: chaojiehuanghgl@163.com
R739.8
A
10.3969/j.issn.1001-3733.2017.05.005
(收稿: 2016-11-28 修回: 2017-04-25)

