OPG、RANKL在2型糖尿病伴牙周炎大鼠牙槽骨中的表达
钟雯怡 杨琨 高丽 杨孟雪 向文安 刘琪
OPG、RANKL在2型糖尿病伴牙周炎大鼠牙槽骨中的表达
钟雯怡 杨琨 高丽 杨孟雪 向文安 刘琪
目的探讨骨保护素(OPG)和核因子κB受体活化因子(RANKL)在2型糖尿病伴牙周炎大鼠模型中的表达水平。方法46 只Wistar雄性大鼠,随机分为健康组10 只;单纯牙周炎组12 只;2型糖尿病组12 只;2型糖尿病牙周炎组12 只;分别建模,免疫组织化学方法检测牙槽骨OPG、RANKL蛋白表达。结果与健康组相比, OPG在2型糖尿病组、单纯牙周炎组、2型糖尿病伴牙周炎组表达水平依次降低,RANKL的表达水平依次增强;OPG及RANKL的表达除2型糖尿病牙周炎组与单纯牙周炎组间比较无差异外,其余组间比较有统计学意义(P<0.05)。结论炎症可能导致破骨细胞及免疫细胞中RANKL的上调和成骨细胞中OPG的下调。
牙周炎; 2型糖尿病; 2型糖尿病伴牙周炎大鼠; κB 受体活化子; 骨保护素
牙周病和糖尿病都是慢性疾病,牙槽骨丢失是牙周炎的主要症状,与糖尿病关联的重要并发症是骨代谢的改变。糖尿病又是牙周疾病主要的危险因素[1]。牙周病原菌的炎性反应可造成牙槽骨吸收,全身性疾病可影响宿主反应,比如1、2型糖尿病,能加重牙周疾病的严重性和加速骨吸收[2]。实验证实在糖尿病鼠模型,上调的TNF-α、巨噬细胞集落刺激因子、RANKL、血管内皮细胞生长因子A会促进破骨细胞分化和活化[3-4];糖尿病也会以不同方式影响牙周组织的破骨细胞和成骨细胞,如增加炎性介质的表达和上调RANKL/OPG及增加AGEs和ROS[5]。破骨细胞表面的RANKL 和受体RANK的相互作用能有效的诱导破骨细胞的形成和活性。OPG与RANK的结合抑制了破骨细胞形成阻止了RANKL的活性[6]。本研究基于OPG/RANKL/RANK轴对骨质形成调控的生物学基础,检测了OPG、RANKL在不同模型组动物牙槽骨中的表达情况,为牙槽骨再生及重塑奠定理论基础。
1 材料与方法
1.1 主要仪器与试剂
主要仪器:超纯水仪(MILLIPAK,法国),离心机(KDC-20447低速冷冻,科大中佳分公司),倒置显微镜及照相系统(TMS-1015型,Olypus,日本)。
主要试剂:链脲佐菌素(STZ)及免疫组化SP试剂盒(Sigma 公司,美国),SABC 兔IgG KIT (北京索莱宝科技有限公司)。
1.2 实验方法
1.2.1 分组 46 只6 周龄Wistar雄性大鼠,平均体重196.5 g,来源于第三军医大学动物实验中心。随机分为10 只健康组、12 只单纯牙周炎组、12 只2型糖尿病组、12 只2型糖尿病牙周炎组。本实验通过遵义医学院伦理委员会许可。
1.2.2 建模 ①健康组以普通饲料喂养;②12 只牙周炎组用0.25 mm结扎丝结扎其上颌第二磨牙牙颈部, 术后高糖喂养8 周;③12 只2型糖尿病组以高糖高脂饲料喂养6 周后禁食12 h,腹腔低剂量链脲佐菌素(STZ)35 mg/kg注射,4 d后采尾部血测空腹血糖值>11.8 mmol/L,随机血糖>16.8 mmol/L,葡萄糖耐量实验均高于正常血糖值为建模成功;④12 只2型糖尿病伴有牙周炎大鼠组用0.25 mm结扎丝结扎在上颌第二磨牙牙颈部,术后高糖高脂饲料喂养6 周后禁食12 h,注射腹腔低剂量STZ 1 次,4 d后采尾部血,大鼠空腹血糖值>11.8 mmol/L的继续喂养2周,测空腹血糖稳定在11.8 mmol/L以上,随机血糖>16 mmol/L,葡萄糖耐量实验均高于正常血糖浓度值做为模型成功标准。
1.2.3 制作标本 取大鼠上颌牙槽骨4%甲醛固定,10%EDTA脱钙,常规乙醇梯度脱水,石蜡包埋,切片备用。
采用HE染色观察各组大鼠牙槽骨的变化。
1.2.4 免疫组化法检测 PBS代替一抗作为阴性对照。按试剂盒操作说明检测牙槽骨OPG、RANKL的蛋白表达。全自动彩色图像分析系统(IPWIN60型,MEDIA CYBERNETICS公司,美国)进行图像分析。每个标本随机选取2 张切片,每张切片于第二磨牙牙槽骨近远中区随机取4 个视野分析(×400),每个视野内截取区域测量阳性信号的强度然后计算平均光密度值。
平均光密度=积分光密度/测量面积
1.3 统计学分析
2 结 果
2.1 建模情况
健康组(N):大鼠牙周情况很好。牙周炎组(P):牙龈出现不同程度炎症反应,牙龈红肿、探诊出血、探及牙周袋,牙齿松动>2度、可探及上颌第二磨牙根分叉。2型糖尿病组(D):探诊出血,未探及牙周袋和附着丧失,牙周状况良好。 2型糖尿病伴牙周炎组(PD):与单纯牙周炎组相比牙龈炎症较重,牙齿松动度>2度,表现为重度牙周炎。
2.2 2型糖尿病组
6 周高脂高糖饲料喂养糖尿病组大鼠体重明显增加,出现三多一少症状,与非糖尿病大鼠比较差异有统计学意义。糖尿病组STZ注射2 周后,进食量增多而体重明显减轻,差异有显著性(表 1)。

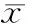
Tab 1 The body weight of the rats in the 2 groups(±s,n=10)
注: ①P<0.01

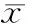
Tab 2 FPG and RBG of the rats in the 2 groups(±s,n=10)
注: ①P<0.01
注射2 周链脲佐菌素后,糖尿病组大鼠随机及空腹血糖显著高于非糖尿病组大鼠并且血糖能较稳定的维持在较高浓度水平。2 组差异有统计学意义(表 2)。
2.3 牙槽骨吸收情况观察
2型糖尿病大鼠牙槽骨边缘见到活跃的破骨细胞性骨吸收陷窝。牙周炎大鼠牙槽骨吸收至根尖1/3处,牙周袋形成,附着丧失很明显(图 1)。
2.4 各组大鼠牙槽骨中OPG、RANKL的蛋白表达
健康大鼠OPG阳性表达集中在大鼠牙槽骨骨细胞中,胞膜、胞质及核膜都被染色呈棕黄色颗粒状,表达细胞量最多且染色最深。其余3组较健康大鼠均有不同程度的减弱,而2型糖尿病伴牙周炎组大鼠表达细胞量最少且染色程度最弱(图 2)。

图 1 4 组大鼠牙槽骨组织学变化(HE, A,C: ×400; B,D: ×200)
Fig 1 The histological changes of rat alveolar bone in the 4 experimental groups(HE, A,C: ×400; B,D: ×200)
图 2 OPG在4 组大鼠牙槽骨中的表达(IHC, A~D: ×200; E~H: ×400)
Fig 2 The expression of OPG in alveolar bone of rats in the 4 groups(IHC, A-D: ×200; E-H: ×400)
RANKL的阳性表达集中在大鼠牙槽骨骨髓基质细胞中,胞膜、胞质及核膜都被染色,呈棕黄色颗粒状。与健康组大鼠RANKL表达呈弱阳性相比,糖尿病合并牙周炎与单纯牙周炎组RANKL表达细胞量最多且染色程度最深(图 3)。各组间OPG、RANKL平均光密度值的单因素方差分析,N与P、D、PD相比差异有统计学意义;P与D、D与PD差异有统计学意义(P<0.01);P与PD差异无统计学意义(P>0.05)(表 3)。

图 3 RANKL在4 组大鼠牙槽骨中的表达(IHC, A~D: ×200; E~H: ×400)
Fig 3 The expression of RANKL in alveolar bone of rats in the 4 groups(IHC, A-D: ×200; E-H: ×400)
表 3 4 组大鼠牙槽骨中OPG、RANKL平均吸光度值(n=10)

Tab 3 A of OPG and RANKL expression in the alveolar bone in the 4 groups (n=10)
3 讨 论
RANKL-OPG双分子系统是一个在生理和病理条件下调节破骨细胞生成和骨吸收的关键[7]。破骨细胞活化引起的骨破坏以RANKL、RANK、OPG为信号,RANKL和RANK结合,破骨细胞和破骨细胞前体细胞表面受体刺激细胞的增殖和分化形成破骨细胞表型[8]。破骨细胞及很多细胞产生的OPG,通过抑制RANKL/RANK的结合改变了RANKL的效果[9]。骨丢失作为RANKL/OPG升高的结果,RANKL/OPG升高是因为RANK升高或OPG降低,或两者都有。
牙槽骨破坏是牙周炎最主要的诊断特征,宿主反应在牙周炎的发病机制里被证实,免疫应答在牙槽骨破坏中起了非常重要的作用证明了免疫系统和骨代谢的紧密关系。研究证实与慢性牙周炎个体相比,OPG在健康个体龈沟液、唾液和牙龈组织中的含量显著增高[10-11],与课题组前期研究一致[12]。本实验证实了与健康组相比,3 组大鼠的OPG、RANKL蛋白表达有显著差异,单纯糖尿病与牙周炎和糖尿病性牙周炎相比差异也有显著性,而牙周炎与糖尿病性牙周炎相比差异没有显著性。说明炎症环境,免疫应答对RANKL-OPG系统的作用会影响骨的吸收。吸烟被认为是牙周炎的危险因素之一,研究证实无论吸烟是否通过RANKL-OPG系统影响骨的吸收,慢性牙周炎的RANKL/OPG率高于健康对照组[13]与本实验结果一致。在炎性环境中,活化淋巴细胞成为RANKL的来源[14],RANKL在炎性环境中增多,OPG的减少导致RANKL/OPG率增高,增高的RANKL/OPG率与骨吸收和动脉粥样硬化相关[15]。重组人骨保护素能调节牙周炎大鼠牙槽骨RANKL/OPG的表达,外源性的注入为牙槽骨的修复提供思路[17]。
糖尿病是一组全身多发紊乱伴随着高血糖的疾病,2型糖尿病提高了线粒体活性氧的水平促进RANKL调解的破骨细胞分化和功能,提高对M-CSF 和RANKL应答的破骨细胞的形成[16-18]。体外实验中高血糖会促进破骨细胞形成,AGEs增加破骨细胞活性[19]。
控制糖尿病和炎症利于牙槽骨的形成及牙周组织的健康。
[1] 刘道洲, 吴万红, 姜慧, 等. 慢性牙周炎伴2型糖尿病患者龈沟液中脂联素水平的检测及意义[J]. 实用口腔医学杂志, 2016, 32(4): 565-568.
[2] Kajiya M, Giro G, Taubman MA, et al. Role of periodontal pathogenic bacteria in RANKL-mediated bone destruction in periodontal disease[J]. J Oral Microbiol, 2010, Nov 8. doi:10.3402/jom.v2i0.5532.
[3] Kayal RA, Tsatsas D, Bauer MA et al. Diminished bone formation during diabetic fracture healing is related to the premature resorption of cartilage associated with increased osteoclast activity[J]. J Bone Miner Res, 2007, 22(4): 560-568.
[4] Jeffcoate WJ, Game F, Cavanagh PR. The role of proinflammatory cytokines in the cause of neuropathic osteoarthropathy (acute Charcot foot) in diabetes[J]. Lancet, 2005, 366(9502): 2058-2061.
[5] Wu YY, Xiao E, Graves DT. Diabetes mellitus related bone metabolism and periodontal disease[J]. Int J Oral Sci, 2015, 7(2): 63-72.
[6] Pacios S, Kang J, Galicia J, et al. Diabetes aggravates periodontitis by limiting repair through enhanced inflammation[J]. FASEB J, 2012, 26(4): 1423-1430.
[7] Belibasakis GN, Bostanci N. The RANKL-OPG system in clinical periodontology[J]. J Clin Periodontal, 2012, 39(3): 239-248.
[8] 李秀兰, 侯志明, 艾红军,等. 牙髓卟啉单胞菌诱导成骨细胞表达RANKL mRNA 的研究[J]. 实用口腔医学杂志, 2005, 21(5): 583-586.
[9] Buduneli N, Kinane DF. Host-derived diagnostic markers related to soft tissue destruction and bone degradation in periodontitis[J]. J Clin Periodontol, 2011, 38(Suppl 1): 85-105.
[10]Hassan SH, El-Refai MI, Ghallab NA, et al. Effect of periodontal surgery on osteoprotegerin levels in gingival crevicular fluid, saliva, and gingival tissues of chronic periodontitis patients[J]. Dis Markers, 2015, 2015: 341259.
[11]Sarlati F, Sattari M, Razzaghi S, et al. Receptor activator of nuclear factor kappa B ligand and osteoprotegerin levels in gingival crevicular fluid[J]. Dent Res J(Isfanan), 2012, 9(6): 752-757.
[12]刘国霞, 武岐山, 钱毅, 等. OPG RANKL在2型糖尿病大鼠血清龈沟液中的表达[J]. 长治医学院学报, 2012, 26(1): 6-9.

[14]Leibbrandt A, Penninger JM. TNF conference 2009: Beyond bones-RANKL/RANK in the immune system[J]. Adv Exp Med Biol, 2011, 691: 5-22.
[15]Kelesidis T, Currier JS, Yang OO, et al. Role of RANKL-RANK/osteoprotegerin pathway in cardiovascular and bone disease associated with HIV infection[J]. AIDS Rev, 2014, 16(3): 123-133
[16]钟雯怡, 武岐山, 高丽, 等. 重组人骨保护素对牙周炎大鼠牙槽骨RANKL、OPG蛋白表达的影响[J]. 重庆医学, 2015, 14(44): 1879-1881.
[17]Kayal RA, Tsatsas D, Bauer MA, et al. Diminished bone formation during diabetic fracture healing is related to the premature resorption of cartilage associated with increased osteoclast activity[J]. J Bone Miner Res, 2007, 22(4): 560-568.
[18]Drosatos-Tampakaki Z, Drosatos K, Siegelin Y, et al. Palmitic acid and DGAT1 deficiency enhance osteoclastogenesis, while oleic acid-induced triglyceride formation prevents it[J]. J Bone Miner Res, 2014, 29(5): 1183-1195.
[19]Catalfamo DL, Britten TM, Storch DL, et al. Hyperglycemia induced and intrinsic alterations in type 2 diabetes-derived osteoclast function[J]. Oral Dis, 2013, 19(3): 303-312.
OPGandRANKLexpressioninalveolarboneoftype2diabeticratswithperiodontitis
ZHONGWenyi1,YANGKun1,GAOLi1,YANGMengxue2,XIANGWen’an3,LIUQi2.
1. 563003,DepartmentofPediatricandPreventiveDentistry,HospitalofStomatology,ZunyiMedicalCollege,China; 2.ThefirstAffiliatedHosptialofZunyiMedicalCollege,China; 3.Zheng’anCountyTraditionalChineseMedicineHospital
Objective: To investigate the expression of osteoprotegerin(OPG) and receptor activator of nuclear factor-κB ligand(RANKL) in type 2 diabetic rats with periodontitis.Methods46 male Wistar rats were randomly divided into the healthy group(n=10), the periodontitis group(n=12), the type 2 diabetes mellitus group(n=12) and the type 2 diabetic periodontitis group(n=12). Animal models were prepared respectively. The expression of OPG and RANKL protein in alveolar bone was detected by immunohistochemistry(IHC).ResultsCompared with the healthy group, the expression of OPG in the type 2 diabetes mellitus group, the periodontitis group, the type 2 diabetes mellitus with periodontitis group decreased in turn, however the expression of RANKL increased in turn. The expression of OPG and RANKL had no significant difference between periodontitis group and type 2 diabetes periodontitis group, while there was statistically significant difference among the other groups(P<0.05).ConclusionInflammation may lead to upregulation of RANKL in osteoclasts and immune cells, and downregulation of OPG in osteoblasts.
Periodontitis;Type2diabetesmellitus;Type2diabeticratswithperiodontitis;Receptoractivatorofnuclearfactor-κBligand;Osteoprotegerin
贵州省科学技术基金(编号: 黔科合LH【2014】7596号); 贵州省卫生厅科技项目[编号: 黔卫发(2012)84号]; 遵义市科技局[编号: 遵市科合社字(2013)31号]
563003, 遵义医学院附属口腔医院预防儿童牙科(钟雯怡 杨琨 高丽); 遵义医学院附属医院(杨孟雪 刘琪); 遵义市正安县中医院(向文安)
刘琪 E-mail: Liuqi1964@hotmail.com
R781.4
A
10.3969/j.issn.1001-3733.2017.05.008
(收稿: 2017-03-13 修回: 2017-06-14)

