33份晒烟种质资源SSR标记的指纹图谱构建
刘国祥,邹昆晏,任民,佟英,冯全福,杨爱国,戴培刚,徐宜民,张兴伟
农业部烟草生物学与加工重点实验室,中国农业科学院烟草研究所,青岛 266101
33份晒烟种质资源SSR标记的指纹图谱构建
刘国祥,邹昆晏,任民,佟英,冯全福,杨爱国,戴培刚,徐宜民,张兴伟
农业部烟草生物学与加工重点实验室,中国农业科学院烟草研究所,青岛 266101
为分析我国晒烟种质资源的遗传多样性,并构建晒烟种质资源的指纹图谱,本研究利用25对SSR标记对33份晒烟材料进行分析。结果表明,25对SSR引物共检测到112个等位基因,平均每个标记4.31个,观测杂合度(Ho)平均值为0.0028,预期杂合度(He)平均值为0.6039。Shannon’s信息指数I为1.1389,Nei’s多样性指数(H)为0.5693,33份晒烟种质资源的遗传多样性相对丰富。UPGMA聚类分析表明,在相似性系数0.345处,可将供试烟草资源分为两个类群。同时,利用25对引物构建了33个晒烟品种的指纹图谱,为晒烟品种鉴定体系的研究奠定理论基础。本研究可为我国晒烟种质资源的鉴定与利用、优异基因的挖掘、育种亲本材料的选择等提供科学依据。
晒烟;种质资源;简单序列重复;遗传多样性;指纹图谱
烟草(Nicotiana tabacumL.)是我国重要的经济作物,也是常用的模式植物之一。在长期的烟草育种过程中,研究人员多选用几个国外引进的骨干材料做亲本[1],导致选育的烟草品种遗传基础狭窄[2]。因此,拓宽烟草种质资源的遗传背景是今后培育稳产、优质、抗病烟草新品种工作的关键[3]。
最近几十年,通过分子标记来实现遗传背景分析的技术已经成熟,分子标记能够检测不同个体之间的核苷酸序列差异,并在分子水平上直接反应个体间的遗传多样性[4]。烟草早期常用的第二代分子标记方法包括随机引物多态性标记(RAPD)[5-7]、扩增片段长度多态性标记(AFLP)[8-10]、相关序列扩增多态性(SRAP)[11]、核糖体DNA和简单序列重复(ISSR)[11-12]等。与上述几种分子标记相比,简单重复序列标记(SSR)具有稳定性高、位点特异性强,呈现共显性、高度多态性等诸多优点,广泛应用于分子标记辅助选择、遗传多样性分析、群体遗传分析、遗传图谱构建和基因克隆等工作。2011年,Bindler等公布了基于第一张烟草遗传图谱的高密度SSR遗传图谱,共定位了2317个SSR标记和2363个位点[13]。Fricano等对312份烟草种质资源利用49对SSR标记进行多样性分析,将312份资源分成6大类群,并进行了系统的遗传结构和遗传距离分析[14]。Xia等利用28对SSR标记对我国78份栽培烟草品种进行遗传多样性分析和群体结构预测,共检测到127个等位基因,分成晒烟和烤烟两个亚群,并发现这78个栽培品种遗传基础相对狭窄[15]。张雪廷等对38份国内外晾晒烟资源进行遗传多样性和亲缘关系分析,结果发现晾晒烟遗传多样性丰富,遗传背景差异较大,亲缘关系较远[16]。因此,对晒烟种质资源进行遗传多样性分析能够了解烟草品种选育遗传背景,加快烟草育种工作进程。目前,烟草种质资源依然利用第二代分子标记(SRAP、ISSR、SSR)进行指纹图谱构建工作。任学良等利用16对烟草核心SRAP引物构建了DNA指纹图谱[17]。聂琼等利用8对多态性高的ISSR引物构建了23份烟草种质资源的指纹图谱[18]。本研究利用筛选得到的25对SSR标记对33份湖北省收集到的晒烟资源进行遗传多样性分析,并进行SSR指纹图谱和计算机化指纹图谱的绘制,以期为重要基因挖掘、晒烟种质资源鉴定、烟草品种选育和新品种审定等工作提供理论依据。
1 材料与方法
1.1 试验材料
本研究供试的烟草种质为湖北省种质资源考察收集的材料,均为典型地方晒烟资源,有很长种植历史,保存了晒烟更多的遗传多样性和优异的基因资源。晒烟资源的编号、来源及种质名称(采用地方俗名)见表1。
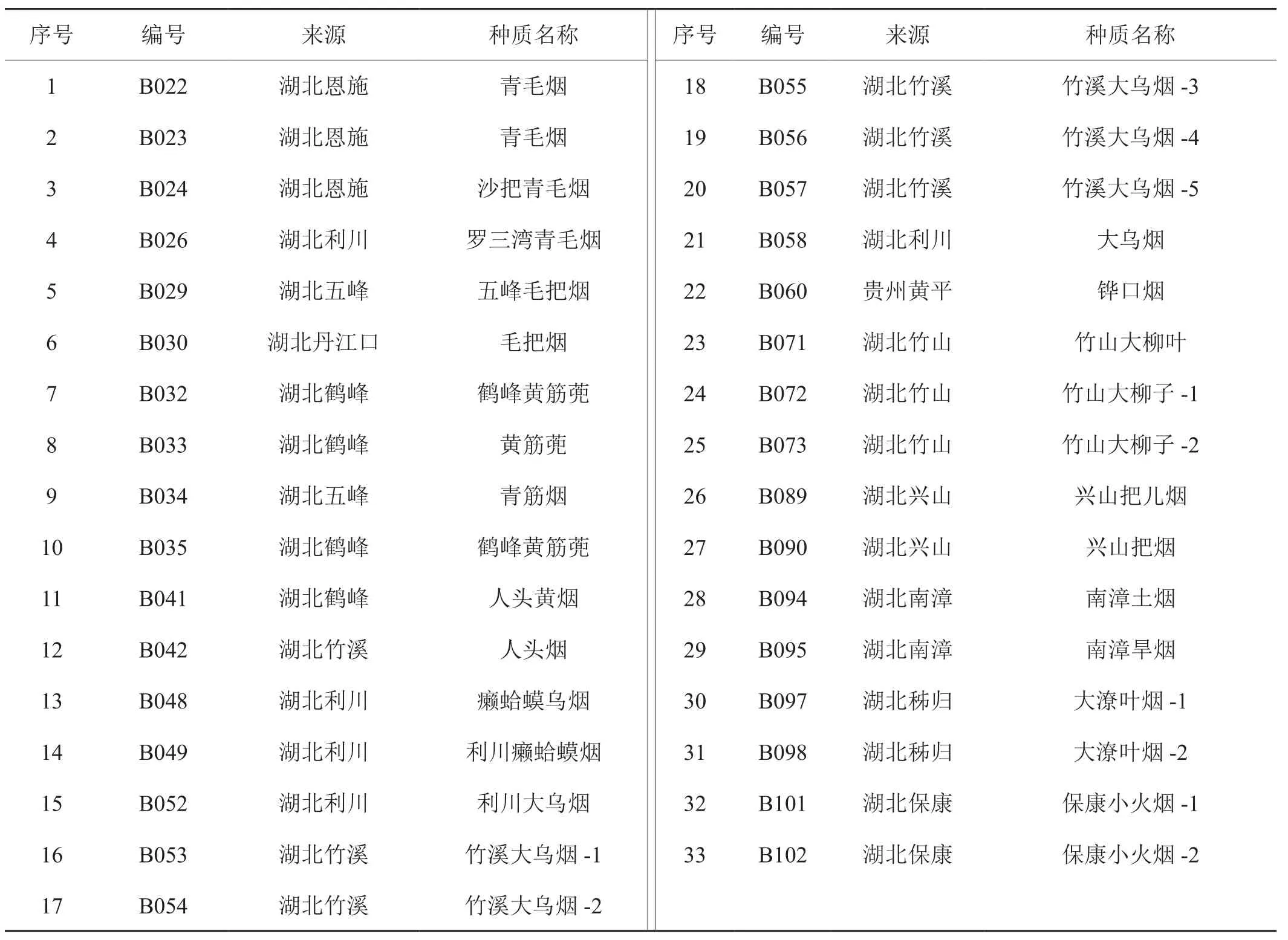
表1 晒烟种质资源Tab.1 Sun-cured tobacco germplasm resources
1.2 试验方法
1.2.1 基因组DNA的提取
从表1中的晒烟种质资源中,每株种质取5片真叶期烟叶。每份材料随机选取10株,混合取样,提取基因组DNA,TE溶解DNA,加入RNA酶水浴30min。经核酸测定仪(NanoProp 2000 Thermo scienti fi c)测定DNA的质量与浓度,将DNA浓度统一稀释到50 ng/μL,在-20℃低温下长期保存。
1.2.2 SSR引物合成
2000对已公布的公共SSR标记引物(从Bindler公布的2317对SSR引物中挑选扩增效果好的2000对SSR引物)[13]由六合华大(北京)基因科技有限公司合成。
1.2.3 SSR引物的PCR扩增
在PCR反应管中依次加入2×Dreamtaq Mix 10µL、模板 DNA1µL、上游引物1µL、下游引物1µL,最后用双蒸水将反应体系补至20 µL。
反应程序为95℃预变性5min;95℃变性45 s,退火温度60℃延伸30 s,72℃延伸45 s,共35个循环;最后72℃延伸10min,10℃恒温冷却。取出PCR反应管,对扩增产物进行非变性聚丙烯酰胺凝胶电泳检测。
1.2.4 数据分析
选择带型清晰的PCR扩增条带进行人工读带,有条带记为“1”,无条带记为“0”,建立“0/1”矩阵,使用DataFormater软件进行矩阵的转换[11]。用Popgene32软件计算:观察等位基因数No(observed number of alleles),有效等位基因Ne(effective number of alleles),Nei’s基因多样性指数H(Nei's gene diversity),Shannon’s多态信息指数I(Shannon’s information index)以及品种间成对Nei’s 遗传距离(Nei’s genetic distance)[19-20]。对不同样品量或引物数处理得到Nei’s遗传距离,使用统计软件NTSYS-PCver 2.1[21]分析33个供试烟草品种间遗传相似系数,采用非加权配对算术平均数法(UPGMA,unweighted pair group method with arithmetic mean)进行聚类分析,绘制聚类分析树状图。并在引物分析结果的基础上构建33份晒烟资源的指纹图谱。
2 结果
2.1 SSR引物的筛选
利用4份主要晾晒烟品种[22](小花青、督叶尖杆软叶子、自来红、白花铁杆子)筛选2000对Bindler公布的SSR标记[13],选取多态性好,条带稳定清晰的引物25对,作为晾晒烟遗传多样性分析的引物,其序列见表2。
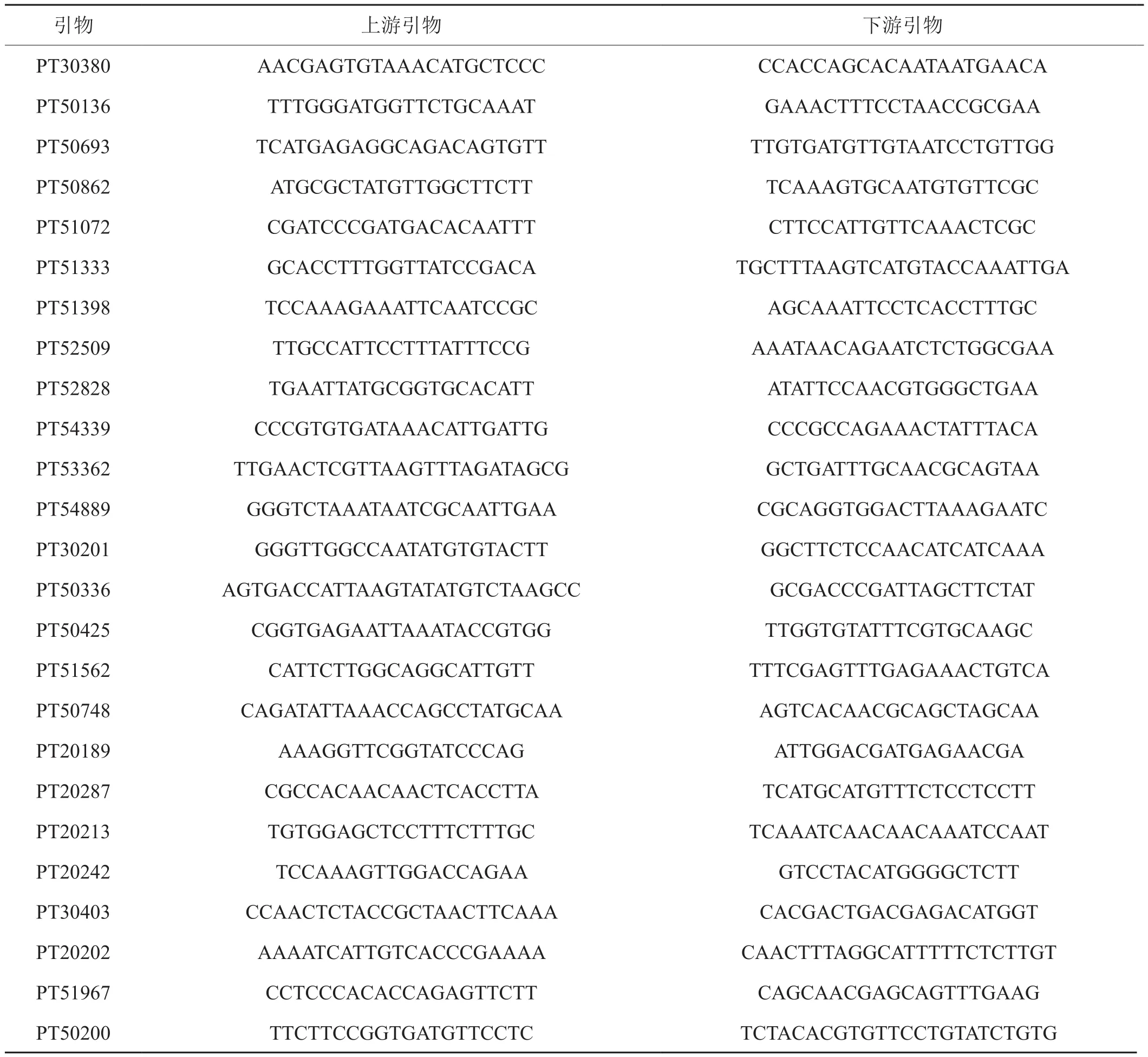
表2 SSR引物序列Tab.2 SSR primer sequences
2.2 SSR标记的遗传多样性分析
数据分析结果(表3)显示观测等位基因数(No)在2~7之间,平均值为4.32,位点PT20213等位基因数最多(7个)。有效等位基因数(Ne)在1.0644~5.5862之间,平均值为2.9250,位点PT20213有效等位基因数最多,为5.5862,位点PT50136有效等位基因最少(1.0644)。观测杂合度(Ho)变化范围为0.0000~0.0370,平均值为0.0028。期望杂合度(He)变化范围为0.0615~0.8365,平均值为0.6039。平均 Nei’s多样性指数(H)为0.5693。Shannon信息指数(I)在0.1391~1.8436之间,平均值为1.1389。不同位点之间遗传参数存在差别,He的平均值大于0.5,表明供试晒烟资源之间遗传多样性较高。
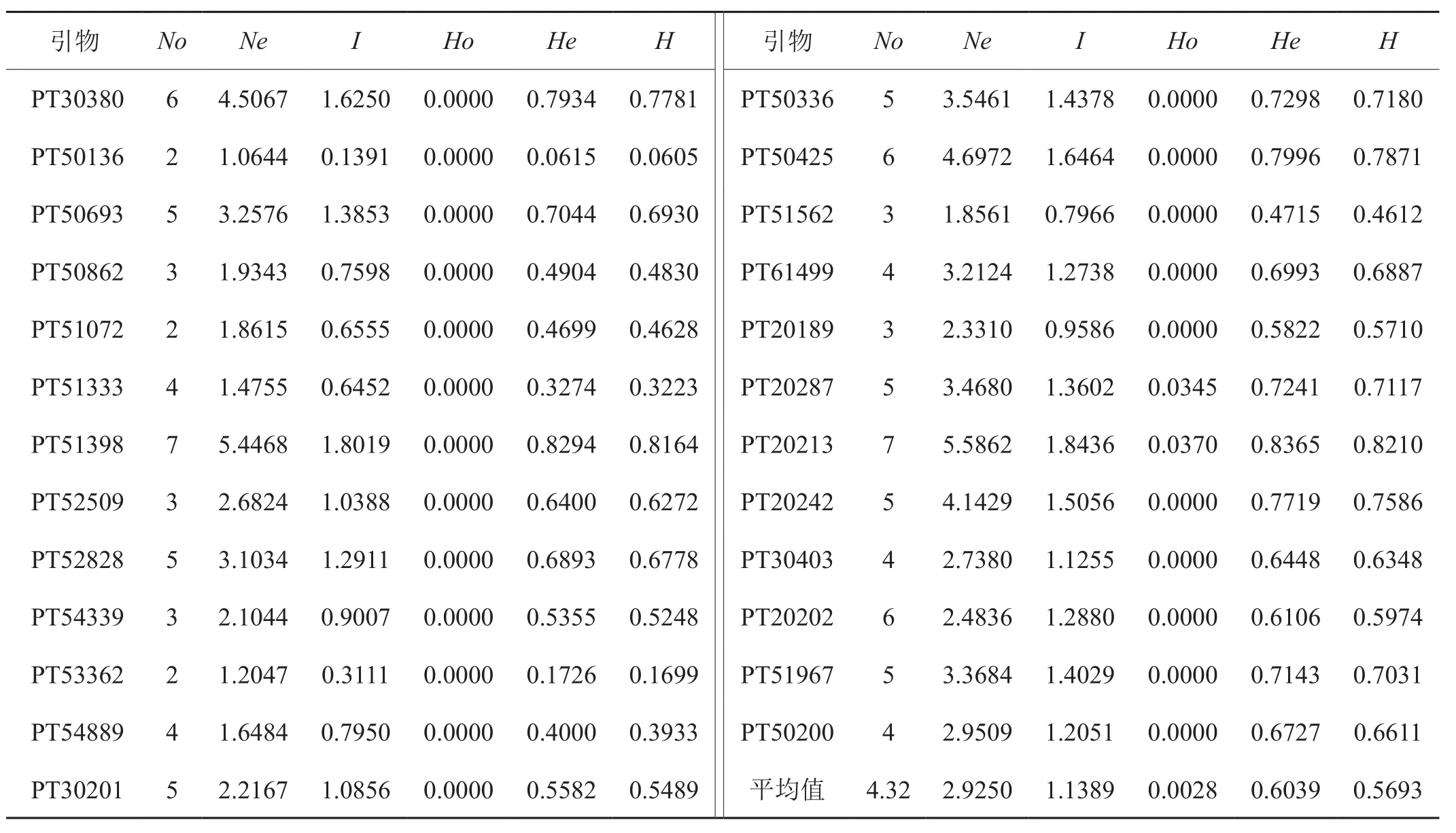
表3 25对SSR在33份材料中的多态性信息Tab.3 Polymorphic information of 25 SSR makers in 33 sun-cured tobacco germplasm resources
2.3 基于SSR标记遗传多样性的聚类分析
利用25对SSR引物对33个供试晒烟资源进行扩增,共扩增出112个等位基因,平均每对引物扩增出4.31个。对扩增结果进行统计分析,绘制0/1二维矩阵,使用NTSYS-pc(2.10e)计算33个供试晒烟资源之间的遗传相似性系数和遗传距离指数。结果表明,晒烟资源间的遗传相似性系数在0.330~0.955之间,在相似性系数0.345处,可将供试晒烟资源分为两个类群(图1)。
从聚类图中还发现,聚类结果与资源的地理来源没有明显的相关性,相似性系数较高地理来源一致的有3组,分别是编号B022、B023和B024,全部来自于湖北恩施;B089和B090,全部来源于湖北兴山;B094和B095,全部来自于湖北南漳。还有些品种来源地一致,但品种间相似性差距较大,如湖北竹溪、湖北利川、湖北竹山、湖北鹤峰、湖北保康、湖北五峰、湖北秭归的晒烟资源。

图1 基于33个晒烟种质资源25个SSR标记的聚类图Fig.1 UPGMA dendrogram for 33 sun-cured tobacco germplasm resources with 25 SSR markers
2.4 33个晒烟种质资源指纹图谱的构建
根据25对SSR引物的扩增结果(以引物PT50425为例,图2),结合参照分子量标记,构建33个供试晒烟资源的指纹图谱(图3)。结合构建的SSR指纹谱图,从25个标记中选取6个标记,共33个多态位点,就可以将33份晒烟种质完全区分开来。这6个SSR标记分别为PT20213(A)、PT51398(B)、PT50425(C)、PT20242(D)、PT50336(E)、PT20189(F)。将33个多态性位点依次排序,把扩增带条的有无分别记为1和0,建立33份晒烟种质资源的计算机化的指纹图谱(表4)。在进行资源鉴定和品种审定时,可以利用25对SSR标记的扩增结果,获得其指纹图谱,与已有的指纹图谱及计算机化的指纹图谱进行比对,即可对资源和品种进行鉴定。

图2 引物PT50425对33个晒烟种质资源PCR扩增结果Fig.2 The ampli fi ed result of 33 sun-cured tobacco germplasm resources by primer PT50425

图3 33个晒烟种质资源的指纹图谱Fig.3 Fingerprints of 33 sun-cured tobacco germplasm resources
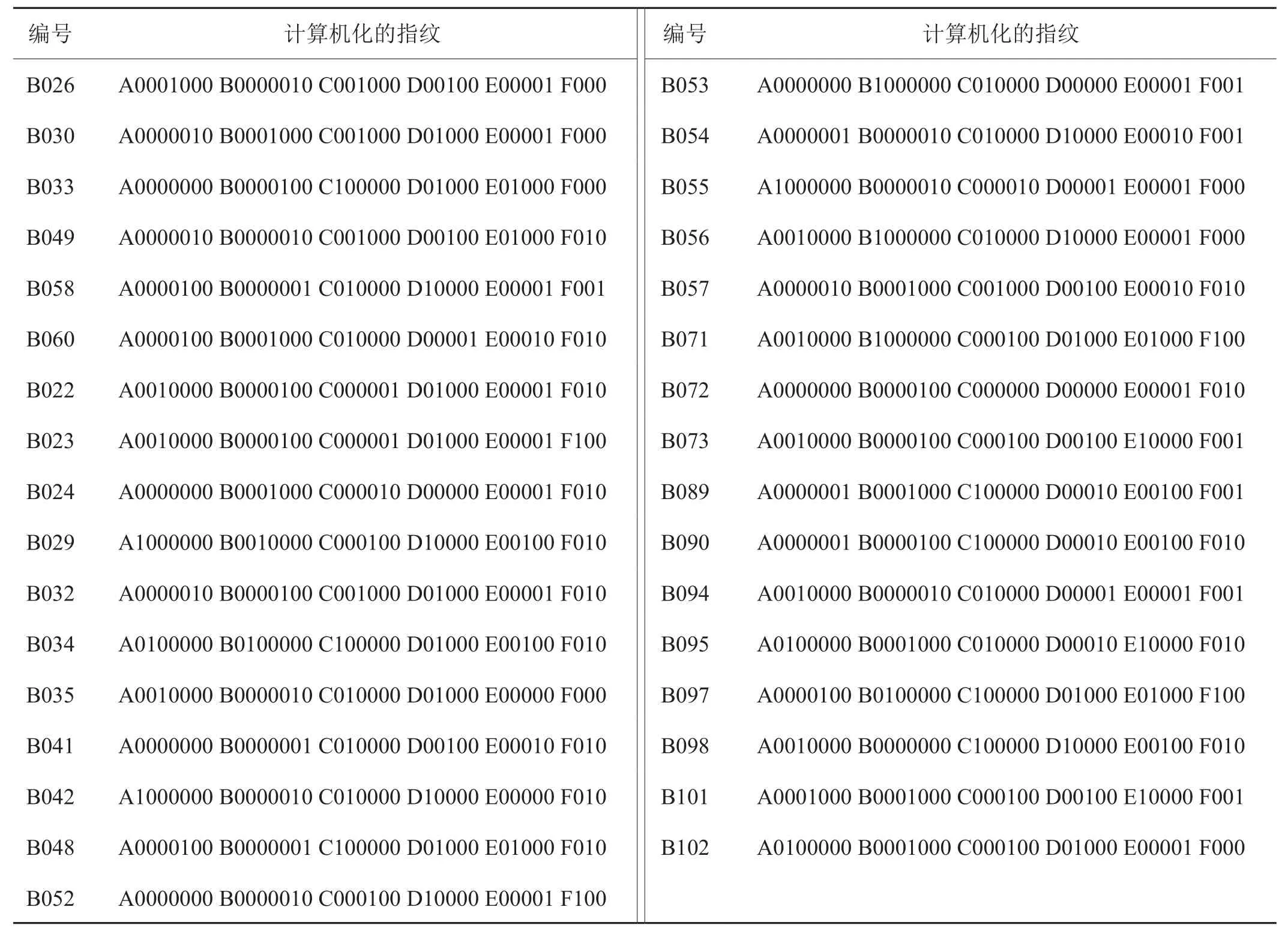
表4 计算机化的指纹图谱Tab.4 A computerized fi ngerprint of 33 sun-cured tobacco germplasm resources
3 讨论和结论
烟草亲本材料的收集鉴定是烟草育种工作的基础,由于遗传基础狭窄导致难以培育出突破性的烟草品种。分析烟草资源的遗传多样性,对于烟草育种工作具有重要的指导意义。利用SSR标记进行烟草遗传多样性的研究国内外已有报导,Moon等利用46对SSR引物分析了烟草属内3种类型54份材料的遗传多样性[1];杨柳等利用14对SSR标记分析了25份烟草种质资源的遗传多样性和品种间的亲缘关系[23]。本研究利用Bindler公布的SSR引物信息[13],筛选出37对适合晒烟遗传多样性分析的SSR标记(选择25对进行多样性分析)。对收集到的33份晒烟资源进行遗传多样性分析发现,平均Nei’s多样性指数(H)为0.5693,Shannon信息指数(I)平均值为1.1389,期望杂合度(He)变化范围为0.0615~0.8365,平均值为0.6039,He的平均值大于0.5,表明供试材料的遗传多样性高。各品种间的遗传相似性系数在0.330~0.955之间。晒烟种质资源聚类分析结果表明,晒烟的亲缘关系与地理来源关系不大,研究结果与张吉顺等的研究结果一致[24]。
新品种权是知识产权的一种重要形式,是推动育种创新、确保遗传资源安全的重要制度保障。烟草品种的真实性和纯度直接影响烟叶质量。烟草有着成熟的育种、栽培、加工销售体系,但在品种保护制度上存在缺失,没有一套完整、有效的种质资源鉴定及品种分子审定制度。指纹图谱可以看作是资源的“身份证”,将资源、引物名称、分子数据等组合在一起,形成每份资源特有的识别代码。基于分子标记进行烟草种质资源指纹图谱的构建工作已有报导。徐军等利用SSR标记构建了烟草核心种质中80份普通烟草种质的指纹图谱,并从中选择8对标记就能完成80份种质资源的鉴定工作[25]。黄莉莎等从62对候选SSR引物中筛选出21对多态性高、稳定好的引物,构建了9份烟草主栽品种的指纹图谱[26]。本研究首次从2000对公共SSR标记[13]中筛选到25对进行晒烟遗传多样性分析及指纹图谱构建的SSR标记,构建了33个晒烟资源的指纹图谱,并利用其中6对SSR标记构建了计算机化的指纹图谱,能够将33个晒烟种质资源完全区分开,证明这33个晒烟种质资源中没有重复收集的资源,此结果为以后晒烟种质资源分子鉴定提供理论依据。本研究首次对大量SSR标记进行筛选,得到25对稳定、遗传多样性高的SSR标记,并针对晒烟种质资源进行系统的指纹图谱构建工作,将其转化为计算机化指纹图谱,为以后晒烟资源鉴定及新品种审定提供理论基础。
国家烟草种质资源中期库中现有晒烟资源2470份,以本研究获得的25对SSR标记为基础,后期可利用标记验证群体进一步获得新的SSR标记,构建所有晒烟资源的指纹图谱,剔除国家烟草种质资源中期库重复收集的晒烟资源。同时,利用SSR标记可开展晒烟种质资源指纹图谱构建工作,探索晒烟种质资源间的亲缘关系,进而从基因组水平上揭示其遗传变异程度,发掘优异育种亲本材料和基因资源,为选育优异基因聚合新种质奠定基础。构建指纹图谱为晒烟种质资源鉴定和分类提供一种解决办法,并为晒烟新品种审定、引进品种及地方品种鉴定奠定良好理论基础。
[1]Moon H S,Nicholson J S,Lewis R S.Use of transferableNicotiana tabacumL.microsatellite markers for investigating genetic diversity in the genusNicotiana[J].Genome,2008,51(8):547-559.
[2]常爱霞,贾兴华,冯全福,等.我国主要烤烟品种的亲源系谱分析及育种工作建议[J].中国烟草科学,2013,34(1):1-6.CHANG Aixia,JIA Xinghua,FENG Quanfu,et al.Parentage analysis of chinese flue-cured tobacco varieties and breeding suggestion[J].Chinese Tobacco Science,2013,34(1):1-6.
[3]马冰,代帅帅,程亚增,等.烤烟种质资源SSR核心引物的筛选及验证[J].中国烟草科学,2016,37(5):1-5,9.MA Bing,DAI Shuaishuai,CHENG Yazeng,et al.Screen and identification of SSR core primers for flue-cured tobacco germplasm[J].Chinese Tobacco Science,2016,37(5):1-5,9.
[4]赵淑清,武维华.DNA分子标记和基因定位[J].生物技术通报,2000,6:1-4.ZHAO Shuqing,WU Weihua.DNA molecular markers and mapping[J].Biotechnology Information,2000,6:1-4.
[5]Del Piano L,Abet M,Sorrentino C,et al.Genetic variability inNicotiana tabacumandNicotianaspecies as revealed by RAPD procedure[J].International Contribution to Tobacco Research,2000,19(1):1-15.
[6]Arslan B,Okumus A.Genetic and Geographic Polymorphism of Cultivated Tobaccos(Nicotiana tabacumL.)in Turkey[J].Russian Journal of Genetics,2006,42(6):667–671.
[7]Bai D,Reeleder R,Brandle J.Identi fi cation of two RAPD markers tightly linked with theNicotiana debneyigene for resistance to black root rot of tobacco[J].Theoretical and Applied Genetics,1995,91(8):1184-1189.
[8]Ren N,Timko M P.AFLP analysis of genetic polymorphism and evolutionary relationships amongcultivated and wildNicotianaspecies[J].Genome,2001,44(4):559-571.
[9]Julio E,Verrier J L,Dorlhac De Borne.Development of SCAR markers linked to three disease resistances based on AFLP withinNicotiana tabacumL[J].Theoretical and Applied Genetics,2006,112(2):335-346.
[10]Siva R K,Madhav M S,Sharma R K,et al.Genetic polymorphism of Indian tobacco types as revealed by ampli fi ed fragment length polymorphism[J].Current Science,2008,94(5):633-639.
[11]祁建民,梁景霞,陈美霞,等.应用ISSR与SRAP分析烟草种质资源遗传多样性及遗传演化关系[J].作物学报,2012,38(8):1425-1434.QI Jianmin,LIANG Jingxia,CHEN Meixia,et al.Genetic diversity and evolutionary analysis of tobacco(Nicotiana tabacumL.)germplasm resources based on ISSR and SRAP markers[J],Acta Agronomica Sinica,2012,38(8):1425-1434.
[12]Jessada D,Sornsuda S,Wilasinee S,et al.Determination of local tobacco cultivars using ISSR molecular marker[J].Chiang Mai Journal of Science,2010,37(2):293-303.
[13]Bindler G,Plieske J,Bakaher N,et al.A high density genetic map of tobacco(Nicotiana tabacumL.)obtained from large scale microsatellite marker development.Theoretical and Applied Genetics,2011,123(2):219-230.
[14]Fricano A,Bakaher N,Piffanelli P,et al.Molecular diversity,population structure,and linkage disequilibrium in a worldwide collection of tobacco(Nicotiana tabacumL.)germplasm.BMC genetics,2012,13(1):18.
[15]Xia Y S,Guo P G,Li R H,et al.Analysis of genetic diversity and population structure using SSR markers in tobacco.Advanced Materials Research,2013,850-851(3):1243-1246.
[16]张雪廷,童治军,焦芳蝉,等.38份晾晒烟种质资源遗传关系的SSR分析[J].植物遗传资源学报,2013,14(4):653-658,678.ZHANG Xueting,TONG Zhijun,JIAO Fangchan,et al.Genetic relationship analysis of thirty-eight sun/Air-cured tobacco germplasms based on simple sequence repeat(SSR)Markers[J].Journal of Plant Genetic Resources,2013,14(4):653-658,678.
[17]任学良.烟草种质资源DNA指纹图谱[M].北京:科学出版社,2010.REN Xueliang.DNA fingerprint of tobacco germplasm resources[M].Beijing:Science Press,2010.
[18]聂琼,刘仁祥.23份烟草种质遗传多样性的SSR和ISSR标记分析[J].西南农业学报,2011,24(1):15-19.NIE Qiong,LIU Renxiang.Genetic diversity of 23 tobacco germplasm resources by SSR and ISSR analysis[J].Southwest China Journal of Agricultural Sciences,2011,24(1):15-19.
[19]Nei M.Genetic distance between populations[J].The American Naturalist,1972,106(949):283-292.
[20]Nei M.Estimation of average heterozy gosity and genetic distance from a small number of individuals[J].Genetics,1978,89(3):583-590.
[21]Rohlf F J.NTSYS-pc:Microcomputer programs for numerical taxonomy and multivariate analysis[J].The American Statistician,1987,41(4):330.
[22]中国农业科学院烟草研究所.烟草栽培技术[M].北京:农业出版社,1980.Institute of tobacco research of CAAS.Tobacco cultivation techniques[M].Beijing:Agricultural Press,1980.
[23]杨柳,汪斌,童治军,等.25份普通烟草种质资源遗传多样性的SSR标记分析[J].福建农林大学学报(自然科学版),2013,42(2):171-175.YANG Liu,WANG Bin,TONG Zhijun,et al.Genetic diversity analysis of 25Nicotiana tabacumL.germplasm resources based on SSR marker[J].Journal of Fujian Agriculture and Forestry University(Natural Science Edition),2013,42(2):171-175.
[24]张吉顺,张孝廉,杨春元,等.地方晒烟种质资源SRAP标记的遗传多样性分析[J].分子植物育种,2016,14(07):1906-1913.ZHANG Jishun,ZHANG Xiaolian,YANG Chunyuan,et al.The genetic diversity analysis of sun-cured tobacco landraces germplasms by SRAP markers[J].Molecular Plant Breeding,2016,14(07):1906-1913.
[25]徐军,刘艳华,任民,等.普通烟草种质资源的SSR标记与指纹图谱分析[J].中国烟草科学,2011,32(2):62-65.XU Jun,LIU Yanhua,REN Min,et al.SSR fi ngerprint map analysis of tobacco germplasms[J].Chinese Tobacco Science,2011,32(2):62-65.
[26]黄莉莎,曹恒春,王毅,等.烟草主栽品种的SSR指纹图谱的构建及其应用[J].山东农业大学学报(自然科学版),2013,44(4):509-515.HUANG Lisha,CAO Hengchun,WANG Yi,et al.Using SSR markers to construct a fingerprint map of major tobacco cultivars[J].Journal of Shandong Agricultural University(Natural Science Edition),2013,44(4):509-515.
Construction of SSR markers’ fi ngerprints of 33 sun-cured tobacco germplasm resources
LIU Guoxiang,ZOU Kunyan,REN Min,TONG Ying,FENG Quanfu,YANG Aiguo,DAI Peigang,XU Yimin,ZHANG Xingwei*
Key Laboratory of Tobacco Biology and Processing,Ministry of Agriculture,Tobacco Research Institute,Chinese Academy of Agricultural Sciences,Qingdao 266101,Shandong,China
In order to analyze genetic diversity and to construct fingerprint of sun-cured tobacco germplasm resources,33 sun-cured tobacco germplasm resources were studied using 25 simple sequence repeat(SSR)markers.Results showed that a total of 112 alleles among these varieties were identi fi ed at all of 25 SSR markers loci,and an average of 4.31 alleles was observed for each primer pair with average heterozygosity(Ho)0.0028,average expected heterozygosity(He)0.6039.Shannon’s index was 1.1389,Nei’s index was 0.5693.Results also showed that genetic diversity of 33 sun-cured tobacco germplasm resources was relatively abundant.These varieties were divided into two groups at genetic similarity coefficient of 0.345 by UPGMA cluster analysis.Meanwhile,25 pairs of primers were used to construct fi ngerprints of 33 sun-cured tobacco,which laid a theoretical foundation for research on identi fi cation system of sun-cured tobacco varieties.The study can provide reference for sun-cured tobacco germplasm resources identi fi cation,utilization and gene discovery.
sun-cured tobacco; germplasm resources; simple sequence repeat(SSR); genetic diversity; fi ngerprint

刘国祥,邹昆晏,任民,等.33份晒烟种质资源SSR标记的指纹图谱构建[J].中国烟草学报,2017,23(5)
国家烟草专卖局专项“中国烟草种质资源平台建设”(国烟办综[2005]501号)、中国烟草总公司海南省公司项目(20164600020007)和中国农业科学院科技创新工程(ASTIP-TRIC01)
刘国祥(1988—),助理研究员,博士,主要研究方向为烟草种质资源,Tel:0532-88702169,Email:liuguoxiang@caas.cn
张兴伟(1978—),副研究员,博士,主要研究方向为烟草种质资源,Tel:0532-88702169,Email:zhangxingwei@caas.cn
2017-05-05;< class="emphasis_bold">网络出版日期:
日期:2017-09-06
:LIU Guoxiang,ZOU Kunyan,REN Min,et al.Construction of SSR markers’ fi ngerprints of 33 sun-cured tobacco germplasm resources[J].Acta Tabacaria Sinica,2017,23(5)
*Corresponding author.Email:zhangxingwei@caas.cn

