发菜固氮酶nifH 基因克隆及其干旱胁迫下的差异表达
吴诗杰,王玲霞,刘 阳,严奉坤,丁苗苗,李晓旭,梁文裕
(宁夏大学 生命科学学院,银川 750021)
发菜固氮酶nifH 基因克隆及其干旱胁迫下的差异表达
吴诗杰,王玲霞,刘 阳,严奉坤,丁苗苗,李晓旭,梁文裕
(宁夏大学 生命科学学院,银川 750021)
通过对发菜固氮酶H亚基基因(nifH)全长进行克隆、原核表达和生物信息学分析,采用qRT-PCR技术,分析不同干旱胁迫下发菜固氮酶基因nifH在转录水平的表达变化。结果表明,根据特异性引物克隆获得长度为894 bp的nifH,GenBank 登陆号为BankIt1901364(KU886163)。将nifH在大肠杆菌中表达,获得约36 ku的外源蛋白。生物信息学分析表明,发菜nifH与已报道的多种蓝藻的nifH及推导的氨基酸序列具有较高的相似性,nifH二级结构和三级结构主要由α螺旋、β-折叠、随机卷曲和β-转角构成。随藻体含水量的逐渐降低,发菜nifH在转录水平上的表达量逐渐增加,固氮酶活性呈现先增加后下降的趋势。研究结果为进一步研究发菜固氮酶基因的分子结构和发菜响应干旱胁迫的固氮机制及氮代谢过程奠定基础。
发菜;固氮酶;基因克隆;生物信息学;差异表达
固氮酶在生物固氮过程中扮演着重要的角色。固氮酶由固氮基因nif编码,不同物种间基因nif有较高的同源性[1-2]。在钼铁固氮酶系统中,nifH基因编码铁蛋白,还参与铁钼辅因子(FeMoco)生物合成并指导铁钼辅因子嵌入钼铁蛋白。nifH基因是所有生物固氮物种相对保守的功能基因,目前,已有较多研究通过nifH基因的遗传多样性来探讨不同生境固氮微生物的群落结构和多样性,并发现在不同植被和地理条件下存在多样的nifH基因[3-5]。而在研究固氮蓝藻生物固氮分子机制及固氮基因遗传多样性等问题方面,固氮酶及其基因信息丰富程度是重要前提。
发菜(NostocflagelliformeBorn. et Flah.)是一种由念珠状细胞包埋在公共胶质鞘内构成丝状藻体的陆生蓝藻,生长在氮素相当缺乏的干旱、半干旱荒漠草原地区,具有较强的固氮能力[6]。发菜在湿润状态下,短时间45 ℃易使固氮酶失去活性;在干燥和高温55 ℃条件下,其固氮活性保持稳定不变[7]。水分对固氮活性有重要的影响,吸水的发菜中固氮酶活性高于干燥的发菜固氮酶[8]。在“干燥-湿润”交替的生态条件下,发菜固氮酶活性逐步提高,抗旱能力明显增强[7]。发菜日生长周期固氮酶活性变化研究发现,在发菜适宜的生长季节,早晨固氮酶活性处于较高水平,中午固氮酶活性急剧下降,傍晚固氮酶活性又逐渐提高[9]。因此,发菜固氮酶活性的变化与其分布区生态环境具有明显的相关性,但目前发菜固氮酶的研究主要集中在环境条件与酶活性变化等方面[7-9],固氮酶各亚基基因及固氮酶分子结构信息相对缺乏,干旱胁迫下固氮酶基因的表达及相应调控机制尚不清楚,制约了对发菜生物固氮分子机理的认识。本研究对发菜固氮酶H亚基基因(nifH)全长进行克隆、表达和生物信息学分析,进而分析干旱条件下发菜nifH的差异表达及固氮酶活性变化,为进一步研究发菜固氮酶基因的分子结构和发菜响应干旱胁迫的固氮机理及氮代谢机制奠定基础。
1 材料与方法
1.1 试验材料与处理
野生发菜采自宁夏贺兰山发菜分布区。在温度25 ℃、持续光照、光照度10 000 lx、无持续风速、相对空气湿度30%的条件下,模拟自然环境在培养床上对发菜进行3种干旱胁迫处理,分别为A处理:发菜充分吸水并保持4 h的样品(含水量800%±15%),B处理:发菜充分吸水后自然失水6 h(含水量200%±8%),C处理:发菜充分吸水后自然失水48 h(含水量15%±3%)(图1)。每个样品3个生物学重复。将样品用灭菌速冻的锡箔纸迅速包好放入液氮中冷冻,于-80 ℃冰箱保藏,备用。含水量计算公式为[(鲜质量-干质量)/干质量]×100%。

图1 干旱胁迫条件下发菜藻体Fig.1 Colonies of N.flagelliforme under different drought stress
1.2 方 法
1.2.1 发菜DNA提取及nifH的克隆 发菜基因组DNA提取参照梁文裕等[10]DNA提取方法。根据发菜同源性较高物种的nifH序列设计特异性引物P1和P2(表1)。按照94 ℃ 8 min;94 ℃ 45 s,50 ℃ 45 s,72 ℃ 90 s,30个循环;最后72 ℃,11 min的程序进行PCR反应。产物用TIANGEN DNA纯化回收试剂盒回收纯化,并和pMD18-T Vector在16 ℃连接12 h,反应结束后,立即转化和测序。测序结果提交NCBI,并应用BLAST程序在GenBank上进行相似性比较。

表1 nifH 扩增、原核表达及qRT-PCR引物序列Table 1 Primer sequences of amplification, prokaryotic expression and qRT-PCR of nifH
1.2.2 发菜nifH的原核表达 根据发菜nifH的测序结果,设计扩增nifH的特异性引物EP1和EP2,并在上、下游游引物5′末端分别添加限制性酶切位点BamHⅠ和XhoⅠ(单下划线所示),两端加保护性碱基CGC和CCG(双下划线所示)(表1)。以含有nifH的阳性菌液为模板,进行PCR扩增(94 ℃ 8 min;94 ℃ 45 s,50 ℃ 45 s,72 ℃ 90 s 30个循环;72 ℃ 11 min)。
37 ℃下将PCR产物和质粒pET28a(+)用BamHⅠ和XhoⅠ双酶切2 h,回收目的片段,16 ℃连接12 h,转化大肠杆菌DH5a,Kan筛选阳性克隆子,37 ℃,180 r/min振荡培养后进行PCR验证。将验证成功的阳性菌液培养12 h提取质粒DNA,使用限制性内切酶BamHⅠ和XhoⅠ分别对pET28a质粒和经PCR扩增得到nifH基因进行双酶切处理。双酶切验证成功的阳性克隆菌液进行测序。IPTG诱导表达和SDS-PAGE电泳检测等参照梁文裕等[10]的方法。
1.2.3nifH诱导表达产物的Western blotting 鉴定 SDS-PAGE后,用半干转移仪将蛋白从凝胶转移到PVDF膜上,20 mL 5 g/L (W/V)脱脂奶粉封闭。一抗为1∶2 000兔抗nifH多克隆抗体,二抗为1∶4 000羊抗兔IgG。用化学显色蛋白免疫印迹法进行Western blotting分析。
1.2.4 生物信息学分析方法 采用生物信息学分析方法对发菜nifH核苷酸序列及推译的氨基酸序列进行分析(表2)。

表2 生物信息学分析方法Table 2 Bioinformatics methods
1.2.5 发菜RNA反转录及荧光定量PCR反应 按照TIANGEN多糖多酚植物总RNA提取试剂盒提取发菜总RNA。cDNA第一链的合成参照TaKaRa Super RT Kit说明书。经检测合格并定量的总RNA逆转录成cDNA。设计qRT-PCR引物RT-PCR-P1和RT-PCR-P2,16S rRNA qRT-PCR引物16S rRNA-P1和16S rRNA-P2为内标引物(表1),在BioRad icycler iQ荧光定量PCR仪进行扩增(95 ℃,10 min;94 ℃ 15 s,57 ℃ 15 s ,72 ℃ 25 s,35个循环)。
1.2.6 干旱胁迫条件下发菜固氮酶活性检测 参照Stewart等[11]的方法对发菜固氮酶活性进行检测。分别取不同干旱胁迫处理的0.2 g 发菜样品置于50 mL玻璃瓶中,密闭后注入氩气保持10~15 min,然后将样品在25 ℃、40 μmol/(m2·s) 10% C2H2条件下孵育3 h,气相色谱(HP-6890)检测C2H4的生成量。固氮酶活性根据C2H4生成量换算。
1.2.7 数据处理 采用Sigmaplot 12.5进行方差分析,检验数据的差异显著性。
2 结果与分析
2.1 发菜nifH 的克隆
以发菜基因组DNA为模板,PCR扩增得到894 bp的目的条带(图2)。阳性单菌落PCR鉴定,扩增产物在894 bp处出现特异性条带(图3),表明外源目的片段已成功克隆。将测序结果提交NCBI,GenBank登录号分别为:BankIt 1901364(KU886163)。

1.nifH ;M.DL2000

1.nifH阳性转化子(DH5a)nifHpositive transformant(DH5a/nifH);2.阴性对照 Negative control; M.DL2000
图3nifH阳性转化子(DH5a)的PCR检测
Fig.3PCRidentifieationofpositivetransformant(DH5a/nifH)
2.2 原核表达与验证
构建的nifH表达载体pET28a-nifH双酶切后,在894 bp处出现一条与预期片段大小一致的特异性条带(图4),说明nifH表达载体构建成功。将pET28a-nifH质粒转化到大肠杆菌BL21(Kan抗性)中,IPTG诱导nifH蛋白表达,SDS-PAGE 电泳检测发现有大量外源蛋白表达,分子质量约为36 ku(图5),经凝胶扫描测定,IPTG诱导5 h后外源蛋白约占细菌蛋白总量的45%。

M.DL15000+DL2 000;1.pET28a-nifH
图4重组表达载体pET28a-nifH的酶切
Fig.4RestrictionanalysisofrecombinantplasmidpET28a-nifH

M. 蛋白分子质量标准 Protein marker;1. IPTG 诱导的空质粒转化子 IPTG induced negative transformant;2. 未诱导的空质粒转化子 IPTG uninduced negative transformant;3. 未诱导的阳性质粒转化子 IPTG uninduced positive transformant with pET28a-nifH;4. IPTG 诱导 1 h 的阳性质粒转化子 IPTG induced positive transformant with pET28a-nifHafter 1 h;5. IPTG 诱导 5 h 的阳性质粒转化子 IPTG induced positive transformant with pET28a-nifHafter 5 h;6. IPTG 诱导 3 h 的阳性质粒转化子 IPTG induced positive transformant with pET28a-nifHafter 3 h;图6同 The same as fig.6
图5nifH蛋白在大肠杆菌中表达的SDS-PAGE电泳图谱
Fig.5SDS-PAGEimageofnifHexpressedinE.coli
应用nifH蛋白多克隆抗体对克隆的nifH大肠杆菌表达产物的进行Western blot检测,转入大肠杆菌的nifH在IPTG诱导后的细菌中有预期大小的显色条带(图6),证明表达的外源蛋白确实为nifH蛋白。

图6 nifH蛋白Western blot 杂交图谱Fig.6 Western blot profile of nifH expressed in E.coli
2.3 发菜nifH 基因生物信息学分析
用NCBI里OFR Finder分析结果表明,nifH具有完整的开放阅读框(ORF),其全长894 bp,编码297个氨基酸,等电点(pI)为4.56,起始氨基酸为甲硫氨酸,终止氨基酸为丝氨酸(图7)。
发菜nifH CDS区包含19种氨基酸,谷氨酸(Glu)数目最多,为30个,占整个氨基酸组成的10.1%;组氨酸(His)和半胱氨酸(Cys)仅为3个,所占比例最低,为1.68%,不含色氨酸(图8)。
对发菜nifH的核苷酸序列进行同源性分析,发现发菜与点形念珠藻(NostocpunctiformePCC 73102)和地木耳(Nostoccommune)的相似性最高,分别为95%和94%,与静水筒藻(CylindrospermumstagnalePCC 7417)为94%,与球形念珠藻(Nostocsp. PCC 7107)、球腥藻(Anabaenasp. L-31)和多变鱼腥藻(AnabaenavariabilisATCC 29413)均为89%,与念珠藻(Nostocsp. PCC 7120)为88%,与池型念珠藻(NostocpiscinaleCENA21)仅为88%(图9)。
将nifH推译的氨基酸序列与其他藻类进行同源性比较,发现发菜和点形念珠藻(NostocpunctiformePCC 73102)的同源性最高,为99%,与地木耳(Nostoccommune)为97%,与静水筒藻(CylindrospermumstagnalePCC 7417)为94%,与球形念珠藻(Nostocsp. PCC 7107)为91%,与池型念珠藻(NostocpiscinaleCENA21)、球腥藻(Anabaenasp. L-31)和多变鱼腥藻(AnabaenavariabilisATCC 29413)均为89%,而与念珠藻(Nostocsp. PCC 7120)仅为87%(图10)。
对nifH磷酸化位点分析表明,Ser有4个磷酸化位点,Thr有3个磷酸化位点,Tyr有2个磷酸化位点(图11)。

图7 发菜nifH 的核苷酸序列(上)和推导氨基酸序列(下)Fig.7 Nucleotide sequence(upper lines) and its deduced amino acid sequence(lower lines) of the nifH from N.flagelliforme

图8 发菜nifH 氨基酸组成预测Fig.8 Putative amino acid composition of nifH from N.flagelliforme

图9 发菜nifH 的核苷酸序列同源树Fig.9 Homologous tree of nucleotide sequences of nifH from N.flagelliforme

图10 发菜nifH 的氨基酸序列同源树Fig.10 The homologous tree of amino acid sequences of nifH from N.flagelliforme

绿色代表丝氨酸 Green represent Serine;蓝色代表苏氨酸 Blue represent Threonine;粉色代表酪氨酸 Pink represent Tyrosine
图11nifH蛋白磷酸化位点在序列中的位置
Fig.11PredictedphosphyorylationsitesinsequenceofnifHfromN.flagelliforme
对发菜nifH的氨基酸序列做疏水性分析,发现多肽链第240位的丙氨酸亲水性最强,第273位的谷氨酸疏水性最强。
发菜nifH蛋白的氨基酸序列跨膜区分析表明,nifH为膜外蛋白(图12)。
对发菜nifH 二级结构进行预测,表明发菜nifH 主要由α-螺旋、β-折叠、随机卷曲和β-转角构成(表3)。运用swissmodel服务器对发菜nifH进行建模分析,并用PyMOL 软件绘制蛋白三级结构图,显示这些α-螺旋、β-折叠、随机卷曲和β-转角构成通过延伸链连接折叠成不对称的三维空间结构(图13)。

图12 nifH 跨膜区分析Fig.12 The TMHMM posterior probabilities for sequence of nifH from N.flagelliforme

表3 发菜nifH 二级结构预测结果Table 3 Secondary structure prediction of nifH from N.flagelliforme
注:# 氨基酸数目;## 占总氨基酸的百分比。
Note:# amount of amino acid; ## amino acid in total percentage.
2.4 发菜nifH qRT-PCR分析
提取的发菜总RNA经检测,OD260/OD280在1.9~2.0。qRT-PCR结果表明,在干旱胁迫条件下,发菜nifH在转录水平上呈现上调表达趋势,B处理和C处理发菜nifH基因的表达量较对照组的nifH均表现为增加,且存在显著差异(Plt;0.05)。其中,C处理的发菜nifH表达量为对照组(A)发菜的1.82倍(图14)。

不同小写字母表示差异显著(Plt;0.05)。图15同。
Different lowercase letters mean significant difference(Plt;0.05).The smae as fig.15.
图14干旱胁迫下nifH相对表达量
Fig.14RelativeexpressionofnifHrelativegeneinN.flagelliformeunderdroughtstress
2.5 干旱胁迫下发菜固氮酶活性的变化
发菜在充分吸水条件下(A),固氮酶活性达7.5 μmol/(g·h),当干燥失水6 h(B)时,固氮酶活性显著高于充分吸水时固氮酶活性(Plt;0.05),而失水干燥48 h时(C),固氮酶活性降低,小于充分吸水和干燥失水6 h(B)时固氮酶活性(Plt;0.05)(图15)。
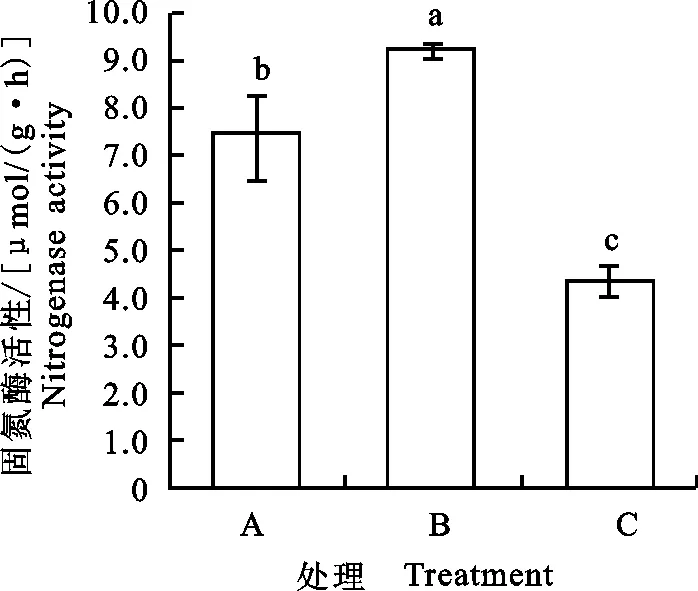
图15 干旱胁迫下发菜固氮酶活性的变化Fig.15 Changes of nitrogenase activities in N.flagelliforme under drought stress
3 讨论与结论
目前,蓝藻固氮酶基因信息尚不丰富,NCBI数据库中具有固氮酶基因信息的蓝藻主要为水生种类,而陆生耐旱蓝藻由于其对分布区具有重要的拓荒固氮的生态作用,基因分子信息的丰富程度对认识其由水生到陆生再到干旱的荒漠草原环境的进化及其生物固氮机制具有重要意义。本研究通过特异性引物克隆获得全长为894 bp的发菜nifH基因信息及原核表达产物,这为认识发菜进化机制及其响应干旱胁迫的固氮机理和氮代谢机理提供信息及试验基础。此外,Gao等[12]对发菜与几种蓝藻的分子水平检测后认为,发菜与点形念珠藻具有很近的亲缘关系。本研究通过核苷酸和氨基酸序列同源比对,表明发菜与已知其他蓝藻一致性都在88%以上,表明发菜nifH和nifH均较保守。系统进化树分析结果表明,发菜nifH和nifH最先与点形念珠藻聚类,其次与地木耳、静水筒藻等物种聚类合并,这也进一步证明了发菜与点形念珠藻亲缘关系较近。
固氮酶是生物固氮的关键酶。一般认为,固氮酶的基因表达水平受到外界复杂的环境因素影响[13]。在海洋环境中,单细胞固氮蓝藻nifH基因的表达水平随昼夜光照和水体盐分含量的变化而变化,但在土壤环境中,土壤中肥料的含量和昼夜光照变化对固氮群落中nifH的表达水平无显著影响[14]。本研究结果表明,发菜nifH基因在转录水平随藻体水分散失程度的加深而增加,说明干旱胁迫可能诱导nifH基因表达水平增加。Liang等[8]研究表明,与充分吸收水分的发菜藻体相比,失水48 h的发菜其nifH蛋白表达量和固氮酶活性均下降,但NH3含量却逐渐增加。本研究表明,随着发菜干旱胁迫程度的增加,固氮酶活性呈现先增加后下降的趋势。分析认为,从基因到蛋白的生物学过程受到转录水平的调控和翻译水平的调控等诸多水平的精确调控和影响,仅仅转录水平的上调还不能直接导致翻译的蛋白表达量增加。同时,理论上固氮酶活性强,促进固氮反应;固氮酶活性下降,固氮反应减弱,然而固氮酶活性受多种因素综合调控[15],尤其nifM是调节固氮酶活性的重要基因,其产物构成固氮酶活性中心的一部分,并调节nifD和nifK的活性,而nifM和nifS产物调节nifH的活性[16-17]。因此,在干旱胁迫条件下发菜nifH表达调控机制以及nifM和nifS是如何调节nifH的表达尚需进一步研究。
综上所述,发菜nifH基因全长为894 bp,与已报道的多种蓝藻的nifH及推导的氨基酸序列具有较高的相似性,nifH二级结构和三级结构主要由α-螺旋、β-折叠、随机卷曲和β-转角构成。干旱胁迫导致发菜nifH差异表达和固氮酶活性的变化。
Reference:
[1] BURGESS B K.Mechanism of molybdenum nitrogenase[J].ChemicalReviews,1996,96(7):983-1012.
[2] FANI R,GALLO R,LI P.Molecular evolution of nitrogen fixation:the evolutionary history of thenifD,nifK,nifE,andnifNgenes[J].JournalofMolecularEvolution,2000,51(1):1-11.
[3] 文都日乐,李 刚,杨殿林,等.呼伦贝尔草原土壤固氮微生物nifH基因多样性与群落结构[J].生态学杂志,2010,30(4):790-797.
WENDU R L,LI G,YANG D L,etal.nifHgene diversity and community structure of soil nitrogen-fixing bacteria in Hulunbeier grassland,Inner Mongolia [J].ChineseJournalofEcology,2010,30(4):790-797(in Chinese with English abstract).
[4] DING Y,WANG J,LIU Y,etal.Isolation and identification of nitrogen fixing bacilli from plant rhizospheres in Beijing region[J].JournalofAppliedMicrobiology,2005,99(5):1271-1281.
[5] DOS S P,DEAN D R.Coordination and finetuning of nitrogen fixation inAzotobactervinelandii[J].MolecularMicrobiology,2011,79(5):1132-1135.
[6] GAO K S.Chinese studies on the edible blue-green alga,Nostocflagelliforme,a review[J].JournalofAppliedPhycology,1998,10(1):37-49.
[7] 钟泽璞,施定基,王发珠,等.温度、含水量和光照对发菜固氮酶活性的影响[J].植物学报,1992,34(3):219-225.
ZHONG Z P,SHI D J,WANG F ZH,etal.Effect of temperature,water content and light intensity on nitrogenase activity ofNostocflagelliforme[J].ActaBotanicaSinica,1992,34(3):219-225(in Chinese with English abstract).
[8] LIANG W Y,ZHOU Y W,WANG L X,etal.Ultrastructural,physiological and proteomic analysis ofNostocflagelliformein response to dehydration and rehydration[J].JournalofProteomics,2012,75(16):5604-5627.
[9] LIANG W Y,WANG L X,ZHANG Y P,etal.Comparative proteomic analysis of diurnal changes inNostocflagelliforme[J].JournalofAppliedPhycology,2013,25(6):1709-1721.
[10] 梁文裕,杨 佳,吴诗杰,等.发菜耐旱相关蛋白NXL-01的基因克隆与表达分析[J].西北植物学报,2015,35(1):44-49.
LIANG W Y,YANG J,WU SH J,etal.Clone and expression of hypothetical protein NXL-01 related to drought-tolerant inNostocflagelliforme[J].ActaBotanicaBoreali-occidentaliaSinica,2015,35(1):44-49(in Chinese with English abstract).
[11] STEWART W D P,FIPZGERALD G P,BURRIS R H.Acetylene reduction by nitrogen fixing blue-green algae[J].ArchivesMicrobiology,1968,62(1),336-348.
[12] GAO X,LIU K,QIU B S.An investigation on the genetic background ofNostocagelliformeby similarity analysis of its partial genomic DNA and phylogenetic comparison of deduced related species[J].ActaPhysiolPlant,2011,33(4):1301-1318.
[13] SVETLANA D,PETER R,WERNER L.nifHandnifDphylogenies:an evolution basis for understanding nitrogen fixation capabilities of methanotrophic bacteria[J].Microbiology,2004,150(23):1301-1313.
[14] CHATTERJEE R,ALLEN R M,LUDDEN P W,etal.In vitro synthesis of the iron-molybdenum cofactor and maturation of the nif-encoded apodinitrogenase.Effect of substitution of VNFH fornifH[J].JournalofBiologicalChemistry,1997,272(34):21604-21608.
[15] WU G.Biosynthesis of poly-hydroxybutyrate (PHB) is controlled by CydR(Fnr) in the obligate aerobe Azotobacter vinelandii[J].FEMSMicrobiologyLetters,2011,13(12):215-220.
[16] KENNEDY C,DEAN D.ThenifU,nifSandnifVgene products are required for activity of all three nitrogenases of Azotobacter vinelandii[J].MolecularandGeneralGenetics,1992,231(3):494-498.
[17] 陈清华,韩云蕾,马 尧,等.生物固氮基因簇结构与进化研究进展[J].中国农业科技导报,2013,15(4):129-138.
CHEN Q H,HAN Y L,MA Y,etal.Research progress on structure and evolution of biological nitrogen-fixation gene cluster[J].JournalofAgriculturalScienceandTechnology,2013,15(4):129-138(in Chinese with English abstract).
CorrespondingauthorLIANG Wenyu,male,Ph.D,professor. Research area:environmental botany and protection and utilization of plant resources.E-mail:liangwy2009@163.com
(责任编辑:史亚歌Responsibleeditor:SHIYage)
CloningofnifHfromN.flagelliformeandItsDifferentialExpressionPatternunderDroughtStress
WU Shijie, WANG Lingxia, LIU Yang, YAN Fengkun, DING Miaomiao, LI Xiaoxu and LIANG Wenyu
(School of Life Sciences, Ningxia University, Yinchuan 750021, China)
N.flagelliformeis a kind of terrestrial nitrogen-fixing cyanobacterium, which is distribute in arid or semiarid steppes and has important ecological value. Full length ofnifHwas cloned by specific primer,nifHwas expressed inE.coli, DNA sequence and its encoded protein was analyzed by bioinformatics methods, differential expression in transcriptional level was also tested by qRT-PCR. The results indicated that full length ofnifHis 894 bp (GenBank access number is BankIt1901364 (KU886163). Heterologous protein (36 ku) was expressed inE.coli.The nucleotide sequence and the encoded amino acid sequence ofnifHwere highly homologous to other cyanobacteria species. The secondary structure and tertiary structure were made up ofα-helix,β-sheet, random coil andβ-turn. In addition, expression level ofnifHgradually increased in transcriptional level with the decrease of water content in colonies ofN.flagelliforme, and changes of nitrogenase activities incresed firstly and then decreased under drought stress. The results laid a foundation for further research on structure of nitrogenase gene and molecular mechanism of nitrogen-fixing forN.flagelliformein response for drought stress.
N.flagelliforme; Nitrogenase; Gene cloning; Bioinformatics; Differential expression
2017-01-11
2017-02-21
Natural Science Grant of Ningxia(No.NZ1608).
WU Shijie, female,master student.Research area:environmental botany.E-mail:398538403@qq.com
日期:2017-11-17
网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20171117.1101.012.html
2017-01-11
2017-02-21
宁夏自然科学基金(NZ1608)。
吴诗杰,女,硕士研究生,研究方向为环境植物学。E-mail:398538403@qq.com
梁文裕,男,博士,教授,研究方向为环境植物学及植物资源保护和利用。E-mail:liangwy2009@163.com
Q78
A
1004-1389(2017)11-1639-09
——固氮微生物

