马铃薯Y病毒对不同马铃薯品种的致病力
白艳菊,韩树鑫,高艳玲,张 威,范国权,邱彩玲,申 宇,张 抒,尚 慧,聂先舟,文景芝
(1.东北农业大学 农学院,哈尔滨 150030;2.黑龙江省农业科学院 植物脱毒苗木研究所,哈尔滨 150086;3.加拿大农业部弗里得里克顿研究中心,新不伦瑞克 弗雷德里克顿 E3B 4Z7)
马铃薯Y病毒对不同马铃薯品种的致病力
白艳菊1,2,韩树鑫1,高艳玲1,2,张 威1,2,范国权2,邱彩玲2,申 宇2,张 抒2,尚 慧1,聂先舟3,文景芝1
(1.东北农业大学 农学院,哈尔滨 150030;2.黑龙江省农业科学院 植物脱毒苗木研究所,哈尔滨 150086;3.加拿大农业部弗里得里克顿研究中心,新不伦瑞克 弗雷德里克顿 E3B 4Z7)
为明确不同马铃薯Y病毒(PVY)株系对马铃薯的影响及危害,采用PVYN:O、PVYN-Wi、PVYNTN-NW(SYRⅠ)和PVYNTN-NW(SYRⅡ)株系分离物人工侵染马铃薯,并通过透射电子显微镜观察经PVY侵染后马铃薯植株细胞的超微结构。结果表明,敏感品种更适用于PVY病毒致病力鉴定,敏感品种‘克新13’和‘克新18’对PVY不同分离物的反应强烈,差异显著,而‘兴加2号’对4个PVY分离株均表现耐病,虽然细胞内均出现叶绿体变形、单层膜小囊泡和典型的风轮状内含体,但症状只表现为不同程度的花叶。同时,发现PVYN-Wi致病力较弱,侵染后,4个马铃薯品种均出现花叶症状,细胞内部产生多膜结构、风轮状内含体,引起敏感品种‘克新13’和‘克新18’细胞变形、叶绿体变形和髓鞘样结构;PVYNTN-NW致病力最强,感病的‘克新13’和‘克新18’植株受害症状明显加重,且植株早衰、细胞破坏严重,有些死亡较快的植株甚至未产生特征性内含体结构;PVYN:O致病力中等,植株受害症状和超微结构变化也介于PVYN-Wi和 PVYNTN-NW之间。不同马铃薯品种对PVY病毒的感病程度有较大差异,‘兴加2号’为耐病品种。
马铃薯Y病毒(PVY);株系;马铃薯品种;超显微结构;症状
马铃薯Y病毒(Potato virus Y,PVY)是马铃薯生产中最常见的一种马铃薯病害,染病马铃薯植株常出现品种退化、产量减少、品质变差等症状。PVY与其他病毒复合侵染后,可致马铃薯最高减产80%,经济损失严重。PVY属于单链正义RNA病毒,其基因组长约9.7 kb。侵染马铃薯的PVY病毒主要可分为PVYO、PVYC、PVYN、PVYZ和PVYE等5个株系[1]。研究发现,PVYO、PVYN以及两者重组衍生的新的株系侵染较为普遍[2],而有关其他株系侵染的报道极少。目前,已报道的PVY重组株系有PVYN:O、PVYN-Wi、PVYNTN-NW,有学者对PVY有规律的重组变化细化归类为A、B和Ⅰ、Ⅱ、Ⅲ几种类型,本研究只选择其中有代表性的PVYN:O、PVYN-Wi、PVYNTN-NW(SYRⅠ)和PVYNTN-NW(SYRⅡ)等株系的分离物进行研究。
自然界中,对PVY免疫的马铃薯品种较少,抗PVY病毒的品种选育和应用则较为普遍。受PVY侵染的马铃薯植株常表现出多种不同症状,如花叶、皱缩、坏死等,侵染严重时可导致植株矮化或早衰,症状的差异是由于病毒对植物细胞功能的破坏产生的。目前,多采用透射电子显微镜技术进行病原鉴定和病原致病力研究。自Kausche和Melcher首次通过电镜观察到烟草花叶病毒(TMV)以来,电镜技术已成为植物病毒研究必不可少的常规手段之一[3],Maramorosch和Franchi在其专著中通过照片的方式为广大研究者提供病毒诊断的参照,从而使越来越多的植物病毒在不同植物中被发现,可以很清楚地观测到病毒的形态和结构。另外,病毒在寄主细胞中的状态、寄主细胞的变化也同样可以被直观发现和记录[4-5]。1996年,胡向武等[6]利用透射电子显微镜对受烟草花叶病毒侵染的烟草细胞进行研究,发现其细胞中叶绿体发生肿胀、空泡化、片层结构疏松、散失甚至外膜破碎等现象。2004年,彭晏辉等[7]利用透射电镜技术对受PVY侵染的马铃薯叶绿体进行研究,并以此分析侵染后对其植物光合作用的影响。
由于PVY为多株系,且分子遗传多样性丰富,PVY在基因水平上的差异与其致病能力有一定相关性,聂碧华[8]鉴定PVYO株系的2个分离株,在核酸和蛋白同源性分别为97.1%和98.5%的情况下,致病力表现出较大差异。本研究通过使用不同遗传背景的PVY对4个品种的马铃薯进行接种,并通过对侵染后的马铃薯细胞进行超薄切片,然后用透射电镜进行分析,拟通过表观症状与超微结构下的表现相对照,找到不同PVY株系症状与超微结构相对应的关系,同时通过病毒对马铃薯细胞的破坏规律找到不同株系PVY致病力差异,为PVY的研究及防治提供理论依据。
1 材料与方法
1.1 试验材料
‘克新13’‘克新18’‘费乌瑞它’和‘兴加2号’4个马铃薯品种原原种均由黑龙江省农业科学植物脱毒苗木研究所提供,种子大小均匀,质量约10 g。接种采用的PVY毒源为遗传背景不同的4个PVY不同株系的分离物:HLJ-BDH-2(PVYN-Wi)、IMN-2013-W-369-12[PVYNTN-NW(SYRⅡ)]、HLJ-30-2(PVYN:O)和HLJ-9-4[PVYNTN-NW(SYRⅠ)],4个分离株的重组位点见图1。
以上材料均由黑龙江省农业科学院植物脱毒苗木研究所保存并提供。

图1 不同株系PVY基因结构差异Fig.1 Genetic structure difference of different strains of PVY
1.2 试验方法
1.2.1 PVY病毒接种 每个品种的马铃薯均种植50株,共计200株,温室保持20~26 ℃,每日光照14 h。当马铃薯植株生长至4~6叶期时,采用摩擦接种的方法将4个PVY分离物分别接种至马铃薯叶片,具体方法:将带有病毒的植物叶片放于磷酸缓冲液(PB)研磨[m(携病毒叶片)∶V(缓冲液)=1∶10],研磨后2 000 r/min离心,上清液即为研究所用的病毒混合液。每株植物均使用约300 μL的病毒混合液,每株分别接种2片叶片,4个马铃薯品种均分别接种不同的PVY株系分离物,每处理3次重复。于接种后第1天即开始,每天观察症状并记录。接种后的第3天、第6天、第9天和第12天分别取植株新生叶片检测,以确定接种是否成功,检测采用DAS-ELSIA的方法。
1.2.2 超薄切片样品的采集及前固定 马铃薯接种24 d后,采集植株自上往下第4片完全展开的叶片,并按电子显微镜样品固定的要求裁剪样品[9],迅速放入含φ=3%戊二醛的固定液进行固定。
1.2.3 超薄切片样品的制备 将经过前固定处理的样品,用1 g/mL四氧化锇固定液在室温下固定3 h,再经浓度梯度酒精及环氧丙烷等处理后,用820树脂进行包埋,并于37 ℃孵育4 h,70 ℃ 过夜聚合。聚合完成后,对包埋块进行切片,从而获得可使用透射电子显微镜观察的超薄切片(厚70 nm),最后采用醋酸双氧铀饱和溶液及柠檬酸铅2种溶液的双染法对超薄切片进行染色及观察。
2 结果与分析
2.1 不同品种马铃薯植株受PVY侵染后症状差异
DAS-ELISA检测结果显示,各PVY株系分离物均能成功侵染4个马铃薯品种,并使其获毒,且不同PVY分离物在马铃薯品种上表现的生理症状差异较大。其中,经PVYN-Wi株系侵染的4个马铃薯品种表现的生理症状均较轻微,仅表现出花叶症状。SYRⅠ和SYRⅡ可致‘费乌瑞它’‘克新13’和‘克新18’3个马铃薯品种产生花叶、主茎坏死、茎坏死和叶片黑色点斑等症状,且‘克新13’和‘克新18’植株受害症状更明显,出现主茎坏死、叶片大面积黑色点斑、垂叶枯萎以及更快的发病速度等,甚至植株过早死亡。其中,SYRⅠ可导致‘克新13’产生花叶、主茎坏死、茎坏死和叶片黑色点斑等症状,却不能致其过早死亡,但能使‘克新18’过早死亡;SYRⅡ可导致‘克新13’快速死亡(表1)。PVYN:O可导致‘克新13’‘克新18’及‘费乌瑞它’植株主茎坏死、叶脉坏死,并使部分叶片出现黑色点斑,而‘克新13’于接种PVYN:O1个月后死亡,致病能力比PVYN-Wi强,但弱于PVYNTN-NW(表1,图2)。

表1 接种不同PVY株系后马铃薯植株症状Table 1 Symptoms of different potato varieties inoculated with different strains of PVY
注:接种时间为2015-09-04。M.花叶;SSN.主茎坏死;VN.叶脉坏死;BSL.叶片黑色点斑;DPL.垂叶干枯;DP.植株死亡;PTNRD .薯块环斑坏死。a.植株死亡时间为接种后30 d;b.植株死亡时间为接种后15 d;c 植株死亡时间为接种后25 d。
Note:Infect time is 2015-09-04.M.Mosaic; SSN.Stem streak necrosis; VN. Necrosis on leaves veins; BSL.Black spots on leaves; DPL.Dry and pendulous leaves; DP.Dead plants; PTNRD.Potato tuber necrotic ringspot disease.a.Time of plant death is 30 days after inoculated with virus; b.Time of plant dead is 15 days after inoculated with virus; c.Time of plant dead is 25 days after inoculated with virus.

A.接种PVYN:O后,‘克新13’叶片出现花叶 Mosaic after ‘Kexin 13’ inoculated with PVYN:O;B.接种PVYN:O后,‘克新13’主茎坏死 Stem streak necrosis after ‘Kexin 13’ inoculated with PVYN:O;C.接种PVYNTN-NW(SYRⅠ)后,‘费乌瑞它’叶片叶脉坏死 Veins necrosis after ‘Favorita’ inoculated with PVYNTN-NW(SYRⅠ);D.接种PVYNTN-NW(SYRⅡ)后,‘克新13’叶片出现黑色点斑 Black spots after ‘Kexin 13’ inoculated with PVYNTN-NW(SYRⅡ) on leaves;E.接种PVYNTN-NW(SYRⅠ)后,‘克新18’植株叶片垂叶干枯 Dry and pendulous leaves after ‘Kexin 18’ inoculated with PVYNTN-NW(SYRⅠ);F.接种PVYNTN-NW(SYRⅡ)后,‘克新13’植株死亡 Plants was dead after ‘Kexin 13’ inoculated with PVYNTN-NW(SYRⅡ);G.接种PVYNTN-NW(SYRⅠ)后,‘克新18’薯块产生环斑坏死 Potato tuber necrotic ringspot disease (PTNRD) in the tuber after ‘Kexin 18’ inoculated with PVYNTN-NW(SYRⅠ);H.未接种病毒的对照植株 Negative control that not inoculated with PVY
图2接种PVY后马铃薯植株症状
Fig.2SymptomsofdifferentpotatovarietiesinoculatedwithdifferentstrainsofPVY
4个品种,‘中克新13’‘克新18’ 和‘费乌瑞它’均较敏感,感染不同株系后发病症状差异明显,致病力弱的症状温和,致病力强的坏死严重,甚至植株死亡;而‘兴加2号’耐病性较好,感染后仅出现花叶症状,不同PVY类型造成的症状差异也仅是花叶轻重程度的差异。
2.2透射电子显微镜观察受侵染植株细胞超微结构差异
PVY侵染后,马铃薯细胞的超显微结构发生改变,不同PVY株系病毒对不同马铃薯品种的细胞伤害有较大差异,这些差异体现在多个方面,不仅对植物细胞整体结构有影响,对各细胞器也有不同程度的破坏。其中,‘克新13’的细胞超显微结构中,风轮状内含体的数量较多,且细胞中表现较为明显,这种现象在PVYN-Wi、PVYN:O、PVYNTN-NW(SYRⅠ)株系侵染后的马铃薯细胞中均可发现。其他2个品种则与‘克新13’相反,相同研究条件下,受PVY侵染后,‘费乌瑞它’植株细胞中几乎未观察到有产生风轮状内含体的独特标志性结构。另外,在其他2个品种植株细胞中观察到风轮状内含体的数量则与侵染的PVY分离物有关, PVYNTN-NW(SYRⅡ)和PVYN-Wi会导致‘费乌瑞它’和‘兴加2号’植株细胞中出现风轮状内含体,并较明显,而其他品种则未在细胞中发现有这种特异性结构(表2和图3)。

表2 接种不同PVY株系后马铃薯细胞超微结构Table 2 Different symptoms of cellular ultrastructure after PVY infected with different strains of PVY
注:PW .风轮状内含体;LIC.线状内含体;CD.细胞变形;ChD.叶绿体变形;ChDe.叶绿体裂解;MB.髓鞘样结构;M.多泡体结构;PM.多膜结构。
Note: PW.Pinwheels; LIC.Laminate inclusion components; CD.Cell deformation; ChD.Chloroplast deformation; ChDe.Chloroplast degradation; MB.Myeloid body; M.Multivesicular; PM.Proliferated membranes.
PVY病毒对马铃薯细胞的破坏及细胞内细胞器的形态结构的变化,会导致植株产生相应的症状,用来分析PVY对马铃薯植株的危害。研究发现,所有受PVY侵染的马铃薯植株均会在细胞中产生或多或少、或大或小的改变。如在‘克新13’和‘克新18’中,无论受到何种PVY分离物侵染后,该品种的细胞均会表现出细胞变形(CD)、叶绿体变形(ChD)或多膜结构(PM)。而当‘克新13’受SYRⅡ侵染后,该品种的细胞变化更加明显,叶绿体发生大面积的变形及裂解(ChDe),同时,细胞中其他细胞器的形态也发生改变(如线粒体聚集、多泡体结构、多膜结构等),说明细胞结构已经遭到破坏。与‘克新13’相似的是,在‘费乌瑞它’和‘兴加2号’植株细胞中,均可发现由PVY侵染引起的各种现象,如叶绿体变形、结构被破坏、出现单层膜结构小泡等现象,这些现象或多或少的出现在各品种的马铃薯细胞中(表2)。
2.3 生理症状与超显微结构的相关性
观察马铃薯植株症状及其细胞的超显微结构发现,植株表现出较严重的症状时,其细胞器的受害表现更为严重,有些细胞的细胞器甚至出现破裂、消融、不完整,且细胞形态不正常,并且在部分马铃薯细胞中发现较多的风轮状内含体、线状内含体等,这是仅有在PVY病毒侵染后才能发现的特异性结构;当植株受害症状表现较轻微时,细胞的细胞器结构均较为完整,同时,很少在这些马铃薯细胞中发现风轮状内含体、线状内含体等标志性结构。‘克新13’‘克新18’和‘费乌瑞它’对PVYN:O、PVYNTN-NW(SYR I)、PVYNTN-NW(SYRⅡ)3个株系的侵染表现较敏感,受害后植株发病严重。观察它们对应的细胞超显微结构,发现仅在PVYN:O和PVYNTN-NW(SYRⅠ)侵染‘克新13’,PVYNTN-NW(SYRⅡ)侵染‘克新18’和‘费乌瑞它’ 的植株细胞中发现风轮状内含体(图4),而不是所有样品中均能观察到风轮状内含体等较为明显的特征结构(表2)。经4个不同PVY株系侵染后,‘兴加2号’植株均未表现出明显的生理症状,而仅出现花叶。观察‘兴加2号’细胞的超显微结构,也未发现其细胞器受到较严重的破坏,同时仅在受PVYN-Wi侵染的植株细胞中观察到风轮状内含体结构,说明植株症状表现与细胞内观察结果密切相关。
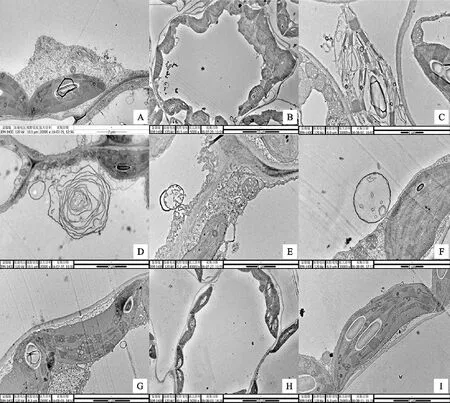
A.PVYN-Wi侵染后,‘克新13’产生风轮状内含体,×20 000 After being infected by PVYN-Wi,‘Kexin 13’ was found to be with pinwheel inclusion in leaf cells,×20 000;B.PVYNTN-NW(SYRⅠ)侵染后,‘克新13’细胞形态发生改变,×5 000 Cellular morphology of ‘Kexin 13’ after being infected by PVYNTN-NW,×5 000;C.PVYNTN-NW(SYRⅠ)侵染后,‘克新13’叶绿体变形并裂解,×30 000 Cellular chloroplast morphology changes and lysis of ‘Kexin 13’ after being infected by PVYNTN-NW(SYRⅠ),×30 000;D.PVYNTN-NW(SYRⅠ)侵染后,‘兴加2号’细胞内的髓鞘样结构,×20 000 After being infected by PVYNTN-NW,‘Xingjia 2’ was found to be with myeloid body inclusion in leaf cells,×20 000;E.PVYN-Wi侵染后,‘克新13’及‘费乌瑞它’细胞内出现多膜结构,×40 000 After being infected by PVYN-Wi,cells of ‘Kexin 13’ and ‘Favorita’ have multi-film structure,×40 000,;F. PVYN-Wi侵染后,‘克新13’及‘费乌瑞它’细胞内出现多膜结构,×30 000 After being infected by PVYN-Wi,cells of Kexin 13 and Favorita have multi-film structure,×30 000;G,I.未接种PVY的正常马铃薯植株细胞结构,×25 000 The negative control that did not inoculated with PVY,×25 000;H.未接种PVY的正常马铃薯植株细胞结构,×5 000 The negative control that did not inoculated with PVY,×5 000
图3PVY侵染后马铃薯植株细胞的超显微结构
Fig.3PerformanceofmicrostructurewithdifferentpotatovarietiesinoculatedwithdifferentstrainsofPVY
3 讨 论
PVY作为最常见的马铃薯病毒病,受到高度关注。大多数研究者通过观察寄主植物受病原侵染后产生的症状及相应的血清学检测、分子生物学检测结果,从而判断马铃薯植株受病原侵害的情况。如Ali等[10]利用薯块症状及对PVY全序列测序,确定新的PVY株系,Nie[11]利用多种方式测试PVY的侵染途径,并通过症状判断及血清学检测确定PVY的侵染方式为机械摩擦传播。目前,采用电子显微镜技术研究PVY病毒的文献较少[11]。徐玲等[12]观察经烟草假单胞杆菌侵染的烟草细胞的超微结构,发现侵染后植株细胞叶绿体破坏严重,接种2 d后甚至出现叶绿体完全裂解的现象。另外,在接种后期,细胞中大量的细胞器也发生解体,甚至细胞仅留有空腔。刘国顺等[13]采用电子显微镜等技术进行观察,发现经花叶病毒侵染后的烟草植株及叶片细胞的保护酶活性及细胞中细胞器发生变化,电镜技术为病理研究提供一条直观的路径。

A.PVYN:O侵染后,‘克新13’叶片出现花叶 Mosaic after ‘Kexin 13’ inoculated with PVYN:O;B.PVYNTN-NW(SYRⅠ)侵染后,‘克新18’叶片出现花叶 Mosaic after ‘Kexin 18’ inoculated with PVYNTN-NW(SYRⅠ);C.PVYNTN-NW(SYRⅡ)侵染后,‘费乌瑞它’叶片出现花叶 Mosaic after Favorita inoculated with PVYNTN-NW(SYRⅡ);D.PVYN-Wi侵染后,‘兴加2号’叶片出现花叶 Mosaic after ‘Xingjia 2’ inoculated with PVYN-Wi;E.PVYN:O侵染后,‘克新13’主茎坏死 Stem streak necrosis after‘ Kexin 13’ inoculated with PVYN:O;F.PVYNTN-NW(SYRⅠ)侵染后,‘克新18’主茎坏死、垂叶干枯 Stem streak necrosis and dry and pendulous leaves after ‘Kexin 18’ inoculated with PVYNTN-NW(SYRⅠ);G.PVYNTN-NW(SYRⅠ)侵染后,‘费乌瑞它’叶片叶脉坏死 Veins necrosis after ‘Favorita’ inoculated with PVYNTN-NW(SYRⅠ);H.PVYN:O侵染后,‘兴加2号’叶片出现花叶 Mosaic after ‘Xingjia 2’ inoculated with PVYN:O;I.PVYN:O侵染后,‘克新13’叶片细胞出现风轮状内含体,×30 000 After infected by PVYN:O,‘Kexin 13’ was found to be with pinwheel inclusion in leaf cells,×30 000;J.PVYNTN-NW(SYRⅡ)侵染后,‘克新18’叶片细胞出现风轮状内含体,×30 000 After infected by PVYNTN-NW(SYRⅡ),‘Kexin 18’ was found to be with pinwheel inclusion in leaf cells,×30 000;K.PVYNTN-NW(SYRⅡ)侵染后,‘费乌瑞它’叶片细胞出现风轮状内含体,×30 000 After infected by PVYNTN-NW(SYRⅡ),‘Favorita’ was found to be with pinwheel inclusion in leaf cells,×30 000;L.PVYN-Wi侵染后,‘兴加2号’细胞出现风轮状内含体,×25 000 After infected by PVYN-Wi,‘Xingjia 2’ was found to be with pinwheel inclusion in leaf cells,×25 000;M.PVYN:O侵染后,‘克新13’细胞形态,×3 000 Cellular morphology of ‘Kexin 13’ after infected by PVYN:O,×3 000;N.PVYNTN-NW(SYRⅠ)侵染后,‘克新18’细胞出现多膜结构,×15 000 After infected by PVYNTN-NW(SYRⅠ),cells of ‘Kexin 18’ have multi-film structure,×15 000;O.PVYNTN-NW(SYRⅠ)侵染后,‘费乌瑞它’细胞叶绿体形态发生改变,×25 000 Change of cellular chloroplast morphology in ‘Favorita’ infected by PVYNTN-NW(SYRⅠ),×25 000;P.PVYN:O侵染后,‘兴加2号’细内叶绿体形态改变,×25 000 Cellular chloroplast morphology changes in ‘Xingjia 2’ infected by PVYN:O,×25 000
图4不同品种马铃薯接种后症状及超微结构差异
Fig.4DifferencesamongdifferentpotatovarietiesinoculatedwithdifferentstrainsofPVY
本研究通过观察不同株系PVY侵染后马铃薯植株症状及超显微结构的差异,从而掌握不同株系PVY对马铃薯品种的危害。结果显示,经SYRⅡ株系侵染后,‘克新13’植株受害症状表现最为明显,整株植株提前死亡。通过透射电镜观察‘克新13’细胞的超显微结构,发现该植株细胞的叶绿体变形,且裂解程度明显较其他品种及株系侵染后要严重,这可能是导致该品种提前死亡的原因之一。彭晏辉等[7]研究认为,经PVY侵染后,马铃薯细胞的叶绿体会出现过早成熟和早衰,进而导致植株光合作用能力下降;郭兴启等[14]利用PVY侵染烟草以研究PVY与其他病毒的协生作用,发现PVYN株系单独侵染后会导致植物细胞中出现风轮状内含体,而受损的细胞还会出现叶绿体严重损伤、髓鞘样结构、多膜结构等明显特征。本研究中,在经不同PVY株系侵染的马铃薯植株中也观察到与上述研究相同的现象;但不同的是,并不是在所有的植株细胞中均能发现这种受PVY侵染后的标志性结构——风轮状内含体,这可能是由于不同品种的抗PVY能力有差异;同时,不同遗传背景的PVY分离物的致病能力也有差异,不同PVY病毒分离物与不同马铃薯品种的发病的速度、症状与细胞内部结构变化建立某种联系。
本研究中,未出现风轮状内含体结构的样品主要有‘克新13’,其仅在接种SYRⅡ时,发病迅速,出现细胞器裂解、细胞膜破裂等现象,植株快速死亡,这是因为接种的时期为苗期,植株抗性较弱,反应比较强烈。在其他品种中,植株表现出不同的发病程度,细胞中出现风轮状内含体、多泡(多膜)结构和髓鞘状结构。尤其是‘兴加2号’,植株长势正常,症状轻微,细胞破坏也比其他品种轻微。内含体和多膜、多泡状结构的形成很可能是对PVY病毒抗性的一种反映,这一系列变化过程,可能将病毒毒力部分化解、转移,使病毒的致病力弱化,也是细胞内病毒与细胞防御体系斗争的结果。接种SYRⅡ的‘克新13’则是由于病毒对细胞的危害巨大,导致其细胞迅速衰亡,细胞内尚未产生有效的防御反应;植株只表现受害症状而未死亡的,是因为细胞正常代谢虽受到影响,但尚能维持病毒破坏与光合作用的平衡。
本研究通过对不同马铃薯品种及不同PVY株系的病毒症状和超微结构变化进行研究,很好地揭示品种抗性的原因,发现在不同PVY株系作用下,马铃薯植株的表观症状与细胞超微结构间有密切联系。且发现所研究的4个品种有明显的抗性异, ‘克新13’在苗期高感PVY,在其他资料里‘克新13’均表现为PVY田间过敏抗性[15],‘克新18’和‘费乌瑞它’也表现为感病品种,而‘兴加2号’表现出显著的耐病性。该结果为进一步研究PVY致病机理提供有关病毒与寄主互作的细胞病理学资料,并为PVY的防治及鉴定提供一定的生物学及影像学参考。
Reference:
[1] SINGH R P,VALKONEN J P,GRAY S M,etal.Discussion paper:the naming of potato virus Y strains infecting potato[J].ArchivesofVirology,2008,153(1):1-13.
[2] NIE B,SINGH M,MURPHY A,etal.Response of potato cultivars to five isolates belonging to four strains of potato virus Y[J].PlantDisease,2012,96(10):1422-1429.
[3] MARTELLI G P,RUSSO M.Use of thin sectioning for visualization and identification of plant viruses[J].MethodsinVirology,1984,8:143-224.
[4] MARAMOROSCH K .The Atlas of Insect and Plant Viruses,Including Mycoplasmaviruses and Viroids[M].New York:Academic Press,1977:1-30
[5] FRANCKI R I B,MILNE R G,HATTA T.Atlas of Plant Viruses[M].Boca Raton:CRC Press,1985:39-49.
[6] 胡向武,唐剑云,张林普.烟草花叶病毒的侵染部位及细胞病理变化的电镜观察[J].安徽师范大学学报(自然科学版),1996,19(2):140-143.
HU X W,TANG J Y,ZHANG L P.Observation on the infected position of TMV particles and pathologic changes of cells under the electron microscope[J].JournalofAnhuiNormalUniversity(NaturalScienceEdition),1996,19(2):140-143 (in Chinese with English abstract).
[7] 彭晏辉,雷娟利,黄黎锋,等.马铃薯Y病毒侵染对叶绿体超微结构、光合和荧光参数的影响[J].植物病理学报,2004,34(1):32-36.
PENG Y H,LEI J L,HUANG L F,etal.Effects of potato virus Y infection on chloroplast ultrastructure,photosynthesis and chlorophyll fluorescence quenching in potato leaves[J].ActaPhytopathologicaSinica,2004,34(1):32-36 (in Chinese with English abstract).
[8] 聂碧华.马铃薯Y病毒新变异株系的克隆鉴定及马铃薯-病毒互作机制研究[D].武汉:华中农业大学,2010:100-101.
NIE B H.Cloning and reeognition of novel variant of potato virus Y and preliminary exploring of mechanism in potato-virus interaetions[D].Wuhan:Huazhong Agriculturail University,2010:100-101 (in Chinese with English abstract).
[9] 郭 欣,申家恒,王艳杰,等.水稻双受精过程的超微结构观察[J].植物学报,2013,48(4):429-437.
GUO X,SHEN J H,WANG Y J,etal.Ultrastructure observation of double fertilization inOryzasativa[J].ChineseBulletinofBotany,2013,48(4):429-437 (in Chinese with English abstract).
[10] ALI M C,MAOKA T,NATSUAKI T,etal.PVYNTN-NW,a novel recombinant strain of potato virus y predominating in potato fields in Syria[J].PlantPathology,2010,59(1):31-41.
[11] NIE X.Detection of molecular markers linked toRygenes in potato germplasm for marker-assisted selection for extreme resistance to PVY in AAFC’s potato breeding program[J].CanadianJournalofPlantScience,2016,96(5):737-742.
[12] 徐 玲,张世珖.烟草野火病毒素对烟草叶片组织超微结构的影响[J].云南农业大学学报,2006,21(1):57-60.
XU L,ZHANG SH G.The effect of tabtoxin to the ultra-structure of tobaccos’ leaves[J].JournalofYunnanAgriculturalUniversity,2006,21(1):57-60 (in Chinese with English abstract).
[13] 刘国顺,张彩霞,王婵娟,等.受烤烟花叶病病毒侵染后叶中保护酶活性和超微结构的变化[J].植物生理学报,2009,45(5):459-463.
LIU G SH,ZHANG C X,WANG CH J,etal.Changes in protective enzyme activities and ultrastructures of flue-cured tobacco infected with tobacco mosaic virus[J].PlantPhysiologyCommunications,2009,45(5):459-463(in Chinese with English abstract).
[14] 郭兴启,冯 炘,李向东,等.PVY/PVX协生作用对病毒浓度及寄主细胞超微结构的影响[J].中国农业科学,2003,36(3):281-286.
GUO X Q,FENG X,LI X D,etal.Effect of synergism between PVY and PVX on the viruses titer and the ultrastructure of infected cells of tobacco plant[J].ScientiaAgriculturaSinica,2003,36(3):281-286 (in Chinese with English abstract).
[15] 洪乃武,张 生,林长春,等.马铃薯新品种‘克新13号’育成报告[J].中国马铃薯,1999(3):188.
HONG N W,ZHANG SH,LI CH CH,etal.Report on the breeding of new potato variety ‘Kexin 13’[J].ChinesePotatoJournal,1999(3):188(in Chinese).
CorrespondingauthorWEN Jingzhi,female,professor,doctoral supervisor.Research area:plant pathology.E-mail: jzhwen2000@163.com
(责任编辑:郭柏寿Responsibleeditor:GUOBaishou)
PathogenicityofPotatoVirusYStrainsinDifferentPotatoVarieties
BAI Yanju1,2,HAN Shuxin1,GAO Yanling1,2,ZHANG Wei1,2, FAN Guoquan2,QIU Cailing2,SHEN Yu2,ZHANG Shu2, SHANG Hui1,NIE Xianzhou3and WEN Jingzhi1
(1.College of Agriculture,Northeast Agricultural University,Harbin 150030,China; 2.Virus-free Seeding Research Institute of Heilongjiang Academy of Agricultural Sciences,Harbin 150086,China; 3.Fredericton Research and Development Centre,Agriculture and Agri-Food Canada,Fredericton,New Brunswick E3B 4Z7)
Potato virus Y (PVY) is one of the most common and worldwide destructive viruses that affects potato production.To unveil the effects and the pathogenicity of different strains of PVY in different potato varieties,four natural recombinant PVY strains including PVYN:O,PVYN-Wi,PVYNTN-NW(SYR-Ⅰ) and PVYNTN-NW(SYR-Ⅱ) were mechanically inoculated onto four potato varieties.In addition to the visual foliar and tuber symptom observations,the ultrastructure and cellular morphology changes were also monitored by electron microscopy.Generally,PVYN-Wicaused mild symptoms (mainly mosaic) on all varieties,whereas the remaining strains caused severe foliar and/or tuber symptoms.The variety ‘Xingjia 2’ exhibited mild foliar symptoms compared with other varieties especially ‘Kexin 13’ and ‘Kexin 18’ upon infection with different strains of PVY.Interestingly,in spite of the fact that PVYN-Wionly caused mild symptoms in all varieties,it induced cellular morphological in varying-degrees and changed ranging from pinwheel formation in ‘Xingjia 2’ to pinwheel formation,chloroplast degradation,membrane proliferation and cell deformation in ‘Kexin 18’.The pathogenicity of PVYNTN-NW(SYR-Ⅰ and SYR-Ⅱ) was the strongest in the tested strains,which not only caused serve foliar symptoms in ‘Kexin 13’,‘Kexin 18’ and ‘Favorita’,but also incited necrotic ringspots in tubers of at least two varieties (i.e.,‘Kexin 13’ and ‘Xingjia 2’).The pathogenicity of PVYN:Ofalled between PVYN-Wiand PVYNTN-NW,and it caused intermediate level of symptoms in plants and intermediate degree of changes in ultrastructure.This study illuminated the interactions between different PVY strains and different potato varieties in both whole-plant and ultrastructural levels,thus this provided insights for better management of this destructive virus in potato crops.
Potato virus Y (PVY); Potato varieties; Strains; Symptoms; Ultrastructure
2017-01-18
2017-04-06
Modern Agriculture Potato Industry Technology System(No.CARS-10-P14).
BAI Yanju,female,research fellow,doctoral student.Research area:plant pathology.E-mail: yanjubai@163.com
日期:2017-11-17
网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20171117.1101.036.html
2017-01-18
2017-04-06
国家现代农业马铃薯产业技术体系(CARS-10-P14)。
白艳菊,女,研究员,博士研究生,研究方向为植物病理。E-mail:yanjubai@163.com
文景芝,女,教授,博士生导师,研究方向为植物病理。E-mail:jzhwen2000@163.com
S435.32
A
1004-1389(2017)11-1713-08

