血小板在中老年宫颈癌患者发展过程中的变化及对预后的影响
陈小燕 韩丽辉
(山东大学医学院免疫研究所,山东 济南 250000)
·肿瘤·
血小板在中老年宫颈癌患者发展过程中的变化及对预后的影响
陈小燕1韩丽辉
(山东大学医学院免疫研究所,山东 济南 250000)
目的研究血小板数量在中老年宫颈癌患者发生发展过程中的变化,探讨其在宫颈癌进展中的作用,研究其与宫颈癌临床参数的相关性。方法选择进行宫颈癌筛查和治疗的女性361例,年龄45~73岁,中位年龄62岁。根据是否感染高危人乳头瘤病毒(HPV)分为HPV阴性组和HPV阳性组,比较两组血小板数量是否有显著差异。根据病理检查结果分为宫颈慢性炎症组、宫颈上皮内瘤样病变(CIN)Ⅰ级或Ⅱ级组,CIN Ⅲ级组,浸润性宫颈癌组,比较各组血小板数量是否有显著差异。在浸润性宫颈癌患者中,分析不同的组织分化程度、组织病理类型、肿瘤间质浸润深度、肿瘤体积大小、淋巴结转移情况、国际妇产科联盟(FIGO)分期、5年生存率与血小板数量是否相关。结果HPV感染与否对血小板数量具有显著影响(P=0.000),其均值分别为HPV阳性组(250±55)×109/L,HPV阴性组(274±62)×109/L。以血小板数量判断是否感染HPV,其ROC曲线下面积为0.621,以253×109/L为判断标准,敏感性为67%,特异性为56%。宫颈慢性炎症组、CINⅠ级或Ⅱ级组、CIN Ⅲ级组和浸润性宫颈癌组血小板数量无显著差异(P=0.456)。在浸润性宫颈癌组中,治疗前血小板数量与肿瘤体积(P=0.003)、是否有淋巴结转移(P=0.000)、5年生存率(P=0.032)明显相关。血小板数量与FIGO临床分期(P=0.463)、宫颈癌的组织病理类型(P=0.782)、细胞分化程度(P=0.522)、宫颈间质浸润深度(P=0.176)无关。结论血小板数量可作为是否感染HPV的辅助诊断指标。
血小板;人乳头瘤病毒;宫颈癌
宫颈癌是中老年女性中的常见恶性疾病之一,恶性程度高,通常预后较差〔2〕。中老年女性由于增龄、慢性疼痛种类增多、性能力减退等原因,导致其对宫颈癌早期症状不敏感,通常检出时已处于临床中晚期,给后续治疗带来极大的困难。人乳头瘤病毒(HPV)已经被证实为引起宫颈癌的首位致病因素。作为一种炎症指标,血小板在HPV感染后会发生怎样的变化,目前尚未见有关研究报道。晚期宫颈癌通常需要通过同步放化疗或者新辅助化疗结合手术治疗,但疗效及预后情况很多研究结论不一,甚至完全相反。本研究旨在探讨女性高危型HPV染后血小板的变化;从宫颈慢性炎症至宫颈上皮内瘤样变(CIN)再发展至宫颈癌的过程中,血小板数量的变化;同时研究血小板与宫颈癌临床特征参数的相关性,进而探讨其在宫颈癌诊断和预后中的价值。
1 对象与方法
1.1对象 2009年2月至2016年12月在临沂市妇女儿童医院妇科就诊的患者361例,年龄45~73岁,中位年龄62岁。均采集阴道分泌物进行高危HPV检测,其中阳性261例,阴性100例。所有患者经宫颈组织活检、病理学诊断,其中宫颈慢性炎症133例,CINⅠ级或Ⅱ级46例,CINⅢ级89例,浸润性宫颈癌93例。患者均已签署自愿匿名参与科研的同意书,本研究已通过临沂市妇女儿童医院伦理委员会的审查。
1.2方法 浸润性宫颈癌患者治疗前由2位资深妇科肿瘤医师确定宫颈癌患者的国际妇产科联盟(FIGO,2009)临床分期,其中Ⅰ期26例,Ⅱ期52例,Ⅲ和Ⅳ期15例;所有患者无论是否进行过新辅助化疗或放疗,均接受宫颈癌广泛性手术,术后进行病理检查。术后资料包括组织类型、细胞分化程度、宫颈间质浸润深度、淋巴结转移情况。病理组织学检查显示鳞癌79例,非鳞癌14例。淋巴结转移者26例,未发生淋巴结转移者67例。宫颈间质浸润深度≥1/2者51例,lt;1/2者37例,未知5例。宫颈癌患者均于术后进行定期随访,随访时间截至患者死亡或2016年12月,中位随访时间为46个月(40~84个月)。具体随访方案为治疗后2年内每3个月随访1次,此后3年每半年1次,以后每年1次(终生随访);随访内容包括妇科检查、宫颈细胞学检查、盆腔CT或磁共振成像(MRI)检查。
1.3检测方法与试剂
1.3.1高危型HPV检测 所有患者在宫颈组织活检前用Hybrid Capture Cervical Sampler采集宫颈样本,采用Hybrid Capture®2技术对宫颈样本中的13种高危型HPV DNA进行定性检测。检测的HPV类型包括16/18/31/33/35/39/45/51/52/56/58/59/68高危型HPV。检测试剂为digene Hybrid Capture®2(HC2) High-Risk HPV DNA Test试剂盒,生产厂家为美国QIAGEN公司。
1.3.2血小板检测 患者均于放疗或化疗和手术前采集静脉血液标本2 ml,用EDTA-K2进行抗凝。应用日本sysmex1000i全自动血细胞分析仪进行血小板计数。所用检测试剂均为sysmex仪器配套试剂。
1.4统计学分析 利用SPSS19.0软件,组间连续性变量资料采用独立样本t检验或Mann-Whitney检验。多组间比较采用ANOVA单因素方差分析或非参数检验。血小板对是否有HPV感染的评价能力检验采用ROC曲线下面积分析。
2 结 果
2.1血小板数量与浸润性宫颈癌临床参数之间的相关性 在93例浸润性宫颈癌患者中,Ⅰ期、Ⅱ期、Ⅲ和Ⅳ期血小板数量均值分别为(258±40)×109/L,(262±58)×109/L和(277±23)×109/L,各组之间差异无统计学意义(P=0.463)。
在所有的浸润性宫颈癌患者中,发生淋巴结转移26例,未发生淋巴结转移67例,其均值分别为(292±57)×109/L、(252±42)×109/L,两者有显著差异(P=0.000)。手术后综合评估,肿瘤直径≥4 cm 52例,lt;4 cm 41例,其均值分别为(280±53)×
109/L、(250±43)×109/L,两者差异有统计学意义(P=0.003)。不同的组织分化程度、肿瘤间质浸润深度、鳞癌和非鳞癌之间比较血小板数量差异无统计学意义(Pgt;0.05)。血小板数量与5年生存率呈负相关,两组数量具有统计学差异(P=0.032)。见表1。
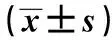
表1 血小板数量与宫颈癌临床参数的关系
2.2在宫颈不同病变程度中患者血小板数量的变化 宫颈慢性炎症组〔(256±62)×109/L〕、CINⅠ级或Ⅱ级组〔(256±55)×109/L〕、CINⅢ级组〔(249±60)×109/L〕与浸润性宫颈癌组〔(263±49)×109/L〕血小板数量无显著差异(P=0.456),但各组年龄差异具有统计学意义〔分别为(49.4±3.6)岁、(53.6±5.9)岁、(58.3±6.3)岁、(62.9±7.1)岁,Plt;0.05〕。
2.3血小板数量与是否感染高危HPV的相关性 在所调查的女性中,HPV阳性261例,HPV阴性100例,其外周血中血小板数量有显著差异,HPV阳性组均值为(250±55)×109/L,HPV阴性组为(274±62)×109/L,P=0.000。在所研究的年龄范围内,血小板数量对HPV感染的预测能力进行ROC曲线下面积分析,其曲线下面积为0.621,以血小板数量253×109/L为判断界值,其敏感性为67%,特异性为56%。血小板预测宫颈癌发生淋巴转移的ROC曲线,判断界值PLT=249×109/L,曲线下面积为0.704,敏感度为88.5%,特异度为52.2%。血小板预测宫颈癌肿瘤直径的ROC曲线,判断界值PLT=249×109/L,曲线下面积为0.680,敏感度为81.0%,特异度为58.8%。血小板预测宫颈癌5年生存期的ROC曲线,判断界值PLT=257×109/L,曲线下面积为0.658,敏感度为73.7%,特异度为52.7%。见图1。

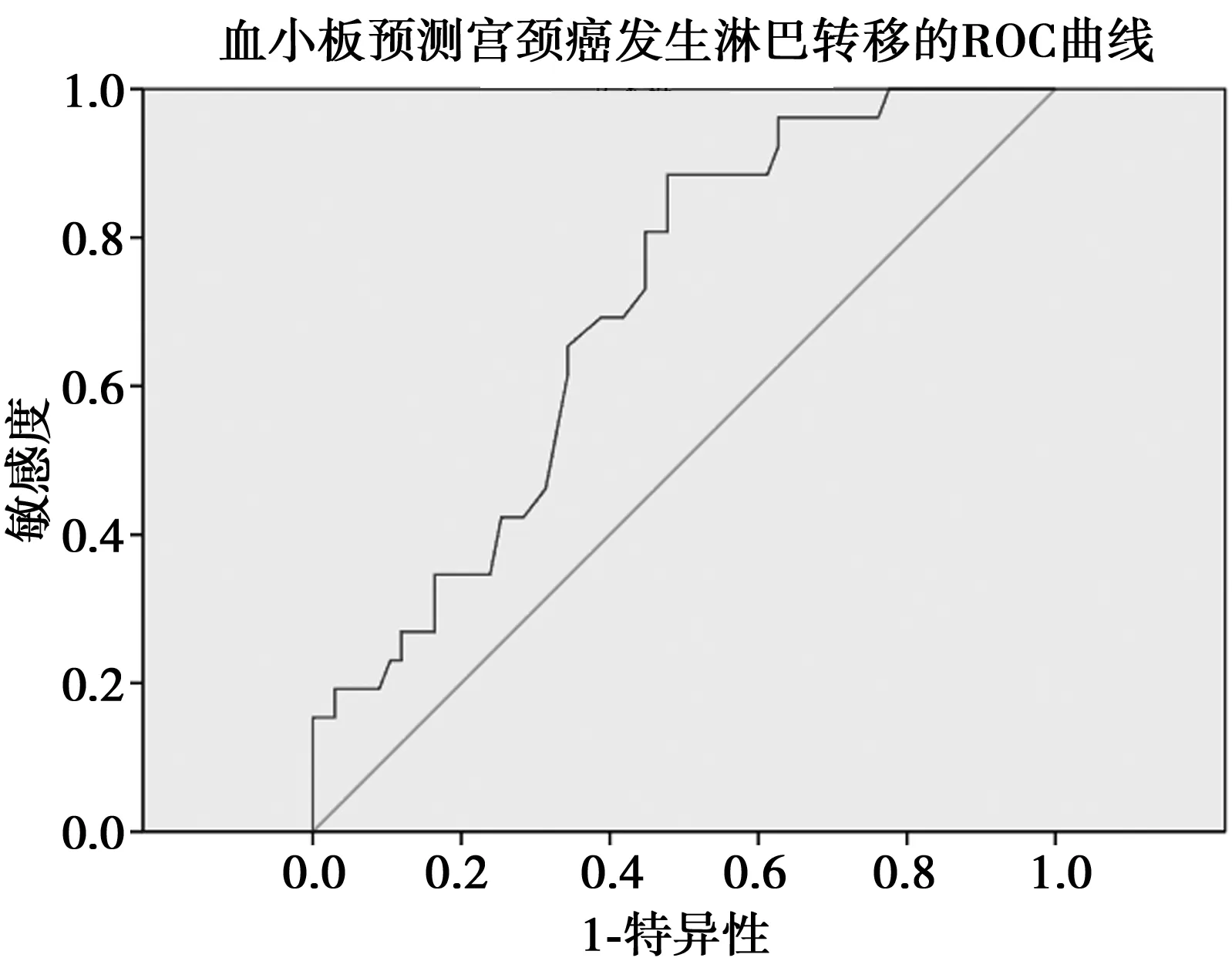


图1 血小板预测HPV感染、宫颈癌淋巴转移、肿瘤直径及5年生存率的ROC曲线
3 讨 论
HPV感染与宫颈癌的发病密切相关。2007年Dunne等〔3〕调查了美国HPV流行的现状,发现美国14~59岁的女性HPV感染率为26.8%。中国目前缺乏HPV感染的流行病学数据。HPV感染后,病毒多数会在2年之内被清除,但少数会持续感染并引起宫颈病变和癌变。几乎所有的宫颈癌患者都感染过HPV。宫颈癌和癌前病变中HPV16和HPV18感染约占70%〔4〕。但从HPV感染进展到宫颈癌是一个长期的过程,作为一种病毒感染人体后,机体产生的炎症反应会引起受侵害器官的组织发生变化。血小板是一种具有酶和生理活性的细胞,具有活化、黏附、聚集等功能。很多种病毒感染后都可引起血小板减少,在特发性血小板减少性紫癜患者中,约80%急性患者有病毒感染史。在本研究中,HPV感染人体后,引起外周血中血小板数量下降。
Wang等〔5〕研究发现,宫颈癌组与健康对照组血小板数量有显著性差异,其均值分别为247(208~297)×109/L和225(198~251.3)×109/L,差异具有统计学意义(Plt;0.000 1)。滑艳〔6〕研究发现,血小板数量也与宫颈癌的发生密切相关,在健康对照组中,血小板数量平均水平为(159.28±57.68)×109/L,而宫颈癌组的血小板平均水平为(279.52±82.89)×109/L,差异具有统计学意义(Plt;0.01)。Bailey等〔7〕研究了40 000例血小板gt;400 × 109/L的40岁以上的人群与10 000例血小板低于400× 109/L的患者,发现血小板升高的患者中,男性发生癌症的风险为11.6%,女性发生癌症的风险为6.2%。如果在6个月内血小板数量继续上升,则男性发生癌症的风险上升为18.1%,女性上升至10.1%。因此在gt;40岁的人群中,血小板升高的患者值得进一步检查以排除恶性肿瘤。本研究的数据与上述研究都不相同,也可能是因为本研究所选的对照组与上述研究不同,或病人性质的不同质性有关。
Hernandez等〔8〕对294例宫颈癌患者进行研究,患者处于Ⅱb~Ⅳa期,与治疗前血小板正常的患者相比,血小板增多的患者(gt;400 × 109/L)肿瘤体积更大,盆腔淋巴结转移的发生率更多,更易发生双侧宫旁浸润和盆腔侧壁固定。与lt;400 ×109/L患者相比,死亡风险增加了55%,两者之间具有显著性差异。因此治疗前血小板水平是影响宫颈癌患者预后的独立因素。Zhao等〔9〕的研究显示宫颈癌患者中有25.5%的患者出现血小板升高,血小板升高与肿瘤的临床分期、肿瘤体积的大小、复发率相关。因此其研究认为血小板和肿瘤患者的临床特征参数之间呈负性相关。本研究结果与 Hernandez等〔8〕和Zhao等〔9〕的报道一致。
血小板具有活化、黏附、聚集等功能,肿瘤细胞通过释放组织因子、凝血酶等诱导血小板活化,活化后的血小板聚集在肿瘤细胞周围,形成血小板-肿瘤细胞复合物,该过程被称为肿瘤细胞诱导的血小板活化或血小板聚集,不但影响机体凝血-纤溶过程,而且还影响肿瘤的侵袭、转移及放化疗效果。另外,血小板具有可以与肿瘤细胞和血管内皮细胞黏附的分子,通过黏附、融合到损伤的血管内皮细胞,促进肿瘤细胞在血管内皮细胞的黏附。恶性肿瘤细胞还能产生白细胞介素6和血管内皮生长因子促进血小板生成,而血小板又可通过增强血小板源性生长因子和血小板反应素的分泌促进肿瘤细胞增殖、肿瘤血管生成和肿瘤转移〔10〕。
Zhao等〔9〕报道血小板升高与肿瘤的临床分期有关,马爽等〔11〕研究也认为妇科恶性肿瘤患者血小板数量与肿瘤分期相关。Li等〔12〕研究发现,在FIGO分期的各个阶段中,血小板数量升高(PLT≥300× 109/L)的比例具有显著性差异。但在本研究中,在FIGO临床分期和阶段中,血小板数量无显著差异。
在Li等〔12〕的研究中,血小板水平与宫颈癌患者的组织分化程度、肿瘤的间质浸润深度及组织病理类型无关。本研究的结果与其相同;但马爽等〔11〕的研究认为血小板数量与组织病理类型相关,不同文献报道结果的差异可能与患者人群的不均一性不同有关,也可能与研究样本量的大小有关。
王丹等〔13〕在研究111例新辅助化疗的宫颈癌患者,认为治疗前血小板水平与宫颈癌患者的预后无相关性。Gadducci等〔14〕研究认为术前血小板水平与5年生存率无关。Li等〔12〕的研究也认为血小板水平与宫颈癌患者的5年生存率无关。但也有研究结果与之相反,Henandez等〔8〕研究显示血小板升高与5年生存率呈负相关。Yu等〔15〕研究显示,在纳入研究的14个研究中,有12个研究结果显示血小板升高与5年总生存率呈负性相关。
1Siegel RL,Miller KD,Jemal A,etal.Cancer Statistics,2017〔J〕.Ca Cancer J Clin,2017;67:7-30.
2Chen W,Zheng R,Baade PD,etal.Cancer statistics in China〔J〕.2015,CA Cancer J Clin,2016;66:115-32.
3Dunne EF,Unger ER,Sternberg M,etal.Prevalence of HPV infection among females in the United States〔J〕.JAMA,2007;297(8):813-9.
4Wardak S.Human papillomavirus(HPV) and cervical cancer〔J〕.J Indian Med Assoc,2000;98(2):53-5.
5Wang L,Jia J,Lin L,etal.Predictive value of hematological markers of systemic inflammation for managing cervical cancer〔J〕.Oncotarget,2017;8(27):44824-32.
6滑 艳.宫颈癌患者的凝血象研究〔J〕.中国医药导报,2006;3(23):58-9.
7Bailey SER,Ukoumunne OC,Shephard EA,etal.Clinical relevance of thrombocytosis in primary care:a prospective cohort study of cancer incidence using English electronic medical records and cancer registry data〔J〕.Br J Gen Pract,2017;67(659):e405-13.
8Hernandez E,Donohue KA,Anderson LL,etal.The significance of thrombocytosis in patients with locally advancedcervical carcinoma:a Gynecologic Oncology Group study〔J〕.Gynecol Oncol,2000;78(2):137-42.
9Zhao K,Deng H,Qin Y,etal.Prognostic significance of pretreatment plasma fibrinogen and platelet levels in patients with early-stage cervical cancer〔J〕.Gynecol Obstet Invest,2015;79(1):25-33.
10Salven P,Orpana A,Joensuu H.Leukocytes and platelets of patients with cancer contain high levels of vascular endothelial growth factor〔J〕.Clin Cancer Res,1999;5(3):487-91.
11马 爽,童 英,李春东,等.妇科恶性肿瘤患者血小板数量变化及意义〔J〕.中华临床医师杂志(电子版),2012;6(18):5698-700.
12Li X,Tan C.Correlation between platelet and hemoglobin levels and pathological characteristics and prognosis of early-stage squamous cervical carcinoma〔J〕.Med Sci Monit,2015;21:3921-8.
13王 丹,吴 鸣,任 彤,等.化疗前血红蛋白及血小板水平对子宫颈癌新辅助化疗后手术患者化疗疗效及预后的影响〔J〕.中华妇产科杂志,2012;47(8):577-81.
14Gadducci A,Cosio S,Zola P,etal.Pretreatment platelet and hemoglobin levels are neither predictive nor prognostic variables for patients with locally advanced cervical cancer treated with neoadjuvant chemotherapy and radical hysterectomy:a retrospective Itatian study〔J〕.Int J Gynecol Cancer,2010;20(8):1399-404.
15Yu M,Liu L,Zhang BL,etal.Pretreatment thrombocytosis as a prognostic factor in women with gynecologic malignancies:a meta-analysis〔J〕.Asian Pac J Cancer Prev,2012;13(12):6077-81.
〔2017-08-10修回〕
(编辑 郭 菁)
R73
A
1005-9202(2017)22-5606-04;
10.3969/j.issn.1005-9202.2017.22.054
国家自然科学基金(81670706-3)
1 临沂市妇女儿童医院
韩丽辉(1976-),女,博士,教授,主要从事免疫学、肿瘤学研究。
陈小燕(1979-),女,副主任技师,主要从事免疫学、血液学研究。

