穿心莲内酯对乙醇诱导肝细胞氧化应激损伤的作用及机制
, ,, ,
(1.南华大学附属第二医院急诊科,湖南 衡阳 421001;2.南华大学附属第二医院超声医学科)
·基础医学·
穿心莲内酯对乙醇诱导肝细胞氧化应激损伤的作用及机制
李旎1,李晶1,周定耕1,王彪1,曹衡玉2*
(1.南华大学附属第二医院急诊科,湖南 衡阳 421001;2.南华大学附属第二医院超声医学科)
目的研究穿心莲内酯(AD)对乙醇诱导肝细胞氧化应激损伤的保护作用,并探讨其作用机制。方法体外培养肝细胞L-02,用0~30 μmol/L AD孵育1 h后,采用酶学方法测定处理前后谷胱甘肽巯基转移酶(GST)及其过氧化物酶(GPx)和还原酶(GR)活性变化,实时定量PCR检测其mRNA表达;同时采用Western blot分析丝裂原活化蛋白激酶家族(MAPKs)中p38,JNK和ERK以及Akt的磷酸化变化,并采用PI3K/Akt和ERK抑制剂LY294002和PD98059处理细胞,观察其在介导核转录因子Nrf2转位和GST、GPx和GR表达中的作用;MTT检测细胞活性变化。结果0~30 μmol/L AD处理L-02细胞后,GST、GPx和GR的酶活性显著增高,同时其mRNA表达也明显增多。AD也能诱导ERK和Akt磷酸化,但对p38和JNK无明显影响。采用LY294002或PD98059处理细胞后,可抑制AD诱导Nrf2核转位及Akt和ERK磷酸化,同时也能明显消除AD对乙醇处理后L-02细胞毒性的保护作用。结论AD经PI3K/Akt和ERK上调抗氧化蛋白GST、GPx和GR的表达而发挥对乙醇毒性的保护作用。
穿心莲内酯; 肝细胞; 乙醇
长期过量饮酒是导致酒精性肝病(alcoholic liver disease,ALD)的主要因素,也是引起肝硬化和肝功能衰竭的重要原因[1]。ALD是一种慢性病理过程,其特征是进行性肝功能损害,随后导致肝脂肪变性、脂肪肝及纤维化,最后可引起肝硬化,部分患者可能进一步发展为肝失代偿和肝细胞癌[2]。ALD的发病机制复杂,目前认为乙醇摄入所导致的脂质过氧化以及炎症反应是导致肝细胞损伤的重要因素[3]。在ALD的早期,临床治疗目标是逆转肝脂肪变性。但从长远角度来看,戒酒后再配合饮食调节是防治ALD的重要途径。研究表明多种来源于自然界的天然植物提取物对乙醇所致的肝细胞损伤具有保护作用。穿心莲内酯(Andrographolide,AD)是从中药穿心莲中提取出来的一种二萜类化合物。现代药理学研究表明,AD具有多种生物学活性,包括抗氧化应激、抗炎症以及抗病毒、抗血小板活性,并对多种毒性物质所致的肝损伤具有保护作用[4-5]。本课题组的前期研究表明,AD可能通过激活Nrf2上调HO-1表达而拮抗乙醇所致肝细胞损伤[6]。但除此之外是否还具有其他保护机制目前仍不明确。本研究旨在进一步探讨穿心莲内酯对乙醇诱导肝细胞氧化应激损伤的机制。
1 材料与方法
1.1实验材料穿心莲内酯(AD,货号90281)、LY294002、PD98059购自Sigma (St.Louis,CA)。Anti-AKT 及磷酸化-AKT (p-AKT),anti-ERK1/2及磷酸化-ERK1/2 (p-ERK),anti-JNK1/2及磷酸化JNK1/2 (p-JNK),anti-p38及磷酸化p38抗体购自Cell Signaling Technology。Anti-GPx,anti-GR,抗多聚ADP多聚酶 (anti-PARP)及抗生长因子受体结合蛋白2(anti- GRB2)购自Santa Cruz。RNA提取试剂盒购自Qiagen,实时定量PCR所用引物由上海生工合成,dNTPs 及逆转录酶购自Promega,Taq酶购自Roche。
1.2细胞培养与处理人肝细胞细胞株L-02(ATCC,Manassas,VA)采用含有10%胎牛血清,1%葡萄糖,1%谷氨酰胺,100 U/mL青霉素和100 μg/mL链霉素的RPMI-1640基中,置于含5% CO2的恒温培养箱中37 ℃条件下培养。
1.3谷胱甘肽巯基转移酶(GST)及其过氧化物酶(GPx)、还原酶(GR)活性测定细胞处理结束后用PBS漂洗并于800 rpm离心5 min获取细胞沉淀,随后加入悬浮缓冲液(含20 mmol/L Tris,5 mmol/L EDTA和0.5 mmol/L 巯基乙醇)2 mL,经超声并于3 000 rpm条件下离心15 min,获取上清用于GPx和GR活性测定。GPx和GR活性测定参照参考文献提供的方法进行[7- 8]。GSH的测定按照Biovision公司提供的试剂盒进行(GST Fluorometric Activity Assay Kit,CA)。在该试剂盒中提供了一种染料monochlorobimane(MCB),它能与谷胱甘肽特异结合,非结合状态的MCB不发出任何荧光,当其与氧化或还原状态的GSH结合后,在380 nm激发波长下可发蓝色荧光,通过测定荧光强度间接测定GSH活性。
1.4 RNA提取与实时定量PCR 采用TRIzol试剂提取细胞总RNA,并将其逆转录为cDNA。加入10 mmol/L 正向和反向引物以及SYBR后(Invitrogen,Carlsbad,CA),实时定量PCR于ABI 7500上进行扩增。扩增条件:94 ℃预变性1 min,随后进入以下40个循环:94 ℃ 1 min,58 ℃ 1min,72 ℃ 2 min。本研究所用的引物如下:GPx,forward 5′-CCTCAAGTACGTCCGACCTG-3′,reverse 5′-TAGGAGTTGCCAGACTGCTG-3′;GR,forward 5′-CAGTGGGACTCACGGAAGAT-3′,reverse 5′- TTCACTGCAACAGCAAAACC GST-3′;β-actin,forward 5′-ACC CAC ACT GTG CCC ATC TA-3′,reverse 5′-CGG AAC CGCTCA TTG CC-3′。结果以2-ΔΔCt表示。
1.5蛋白提取与Western blot分析细胞处理结束后,无菌PBS洗涤,采用Pierce提供的试剂盒提取细胞核与细胞浆蛋白。测定其蛋白浓度后,将加入等体积的2×SDS上样缓冲液煮沸5 min,取20 μL蛋白用于SDS-PAGE。电泳结束后,将其电转印到硝酸纤维素膜上。用5%脱脂奶粉室温封闭2 h,后,加入相应一抗4 ℃孵育过夜,并采用ECL发光(Millipore,Billerica,MA)、显影(VL Chemi-Smart 3000,Viogene BiotekSunnyvale,CA)。并采用Quantitative One软件进行灰度扫描。
1.6 MTT检测细胞活性采用MTT法分析细胞活性。即,培养于96孔板中的L-02细胞(1×105/mL),经0~30 μmol/L AD和10~500 mmol/L 乙醇作用24 h后,弃培养上清,加入100 μL MTT溶液(将10 μL 10 μg/mL MTT用90 μL培养基稀释),37 ℃继续孵育2 h。孵育结束后加入100 μL DMSO溶液,充分震荡以溶解甲瓒,并于570 nm波长处测定其吸光度(μQuant,Bio-Tek),并计算细胞相对活性(相对活性=处理组吸光度/对照组吸光度×100%)。
1.7统计学分析采用SPSS 17.0统计软件进行数据分析,计量数据用均数±标准差表示,多组间比较采用方差分析,组间比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 AD上调乙醇处理后肝细胞中GPx,GR和GST活性在前期研究当中已经证实AD处理能增强乙醇处理后肝细胞的活性,并能下调细胞内ROS的水平[6]。考虑到氧化应激是ALD发生的重要因素,因此对肝细胞内抗氧化/解毒功能的相关酶类的活性进行了检测。结果如图1所示,给予5 μmol/L、10 μmol/L和30 μmol/L AD孵育24 h后,随着AD浓度的增强,GPx、GR和GST的酶活性逐渐增高。
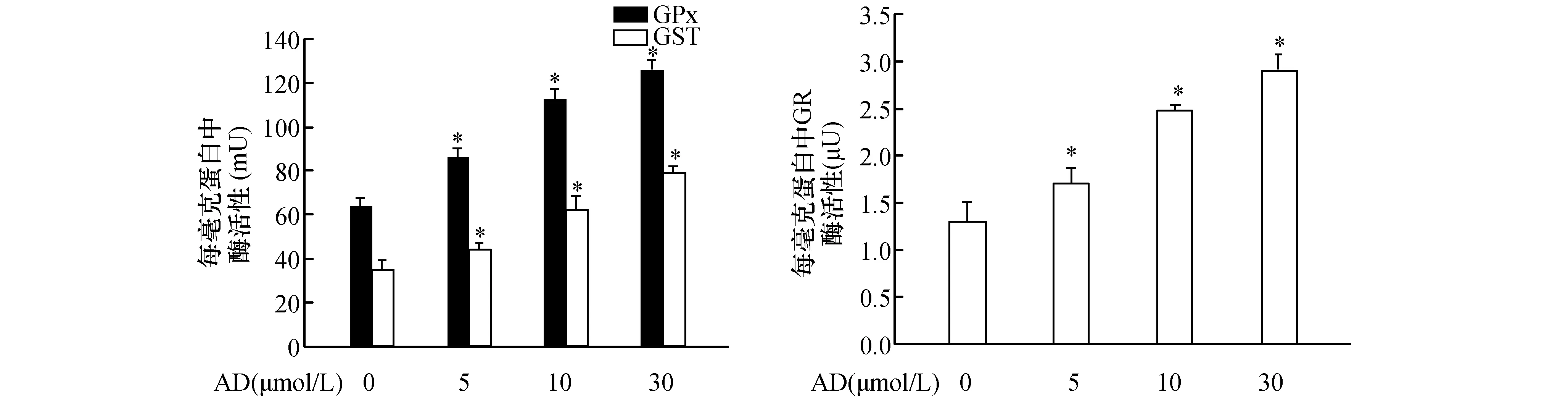
图1 不同浓度AD上调GPx、GR和GST的酶活性A:不同浓度AD对GPx和GST酶活性的影响;B:不同浓度AD对GR酶活性的影响 与对照组(0 μmol/L)比较,*P<0.05
2.2 AD促进肝细胞中GPx,GR和GST mRNA表达采用实时定量PCR检测了其表达水平。结果显示, AD处理后,GPx,GR和GST mRNA表达水平随之增高(图2)。以上结果示5 μmol/L、10 μmol/L和30 μmol/L AD能影响GPx,GR和GST mRNA和蛋白表达。

图2 不同浓度AD上调GPx、GR和GST mRNA表达与对照组(0μmol/L)相比,*P<0.05
2.3 AD促进L-02细胞中Akt和ERK磷酸化Western blot结果显示,不同浓度AD处理1 h后,细胞内Akt和ERK的磷酸化水平随着AD浓度的递增而增加,而p38和JNK的磷酸化水平无明显变化(图3)。
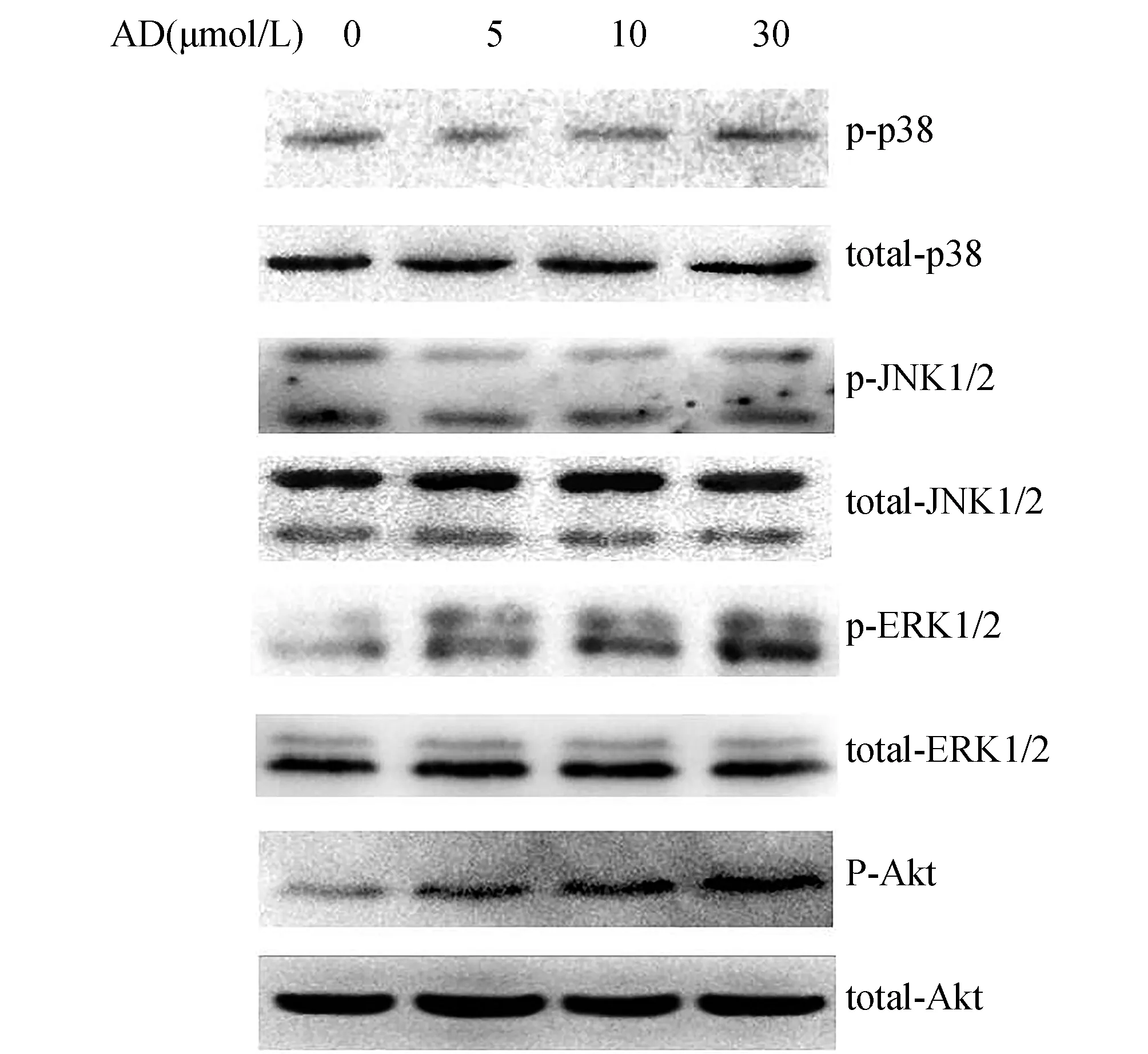
图3 不同浓度AD诱导Akt和ERK磷酸化
2.4 AD经PI3K/Akt和ERK途径诱导Nrf2核转位
采用LY294002或PD 98059预处理细胞1 h后,细胞核内Nrf2含量明显低于未处理组,而内参PARP保持恒定(图4)。
2.5 AD经PI3K/Akt和ERK促进GPx,GR和GST表达实时定量PCR结果也显示,LY294002和PD98059预处理细胞1 h后,可明显逆转AD对GPx,
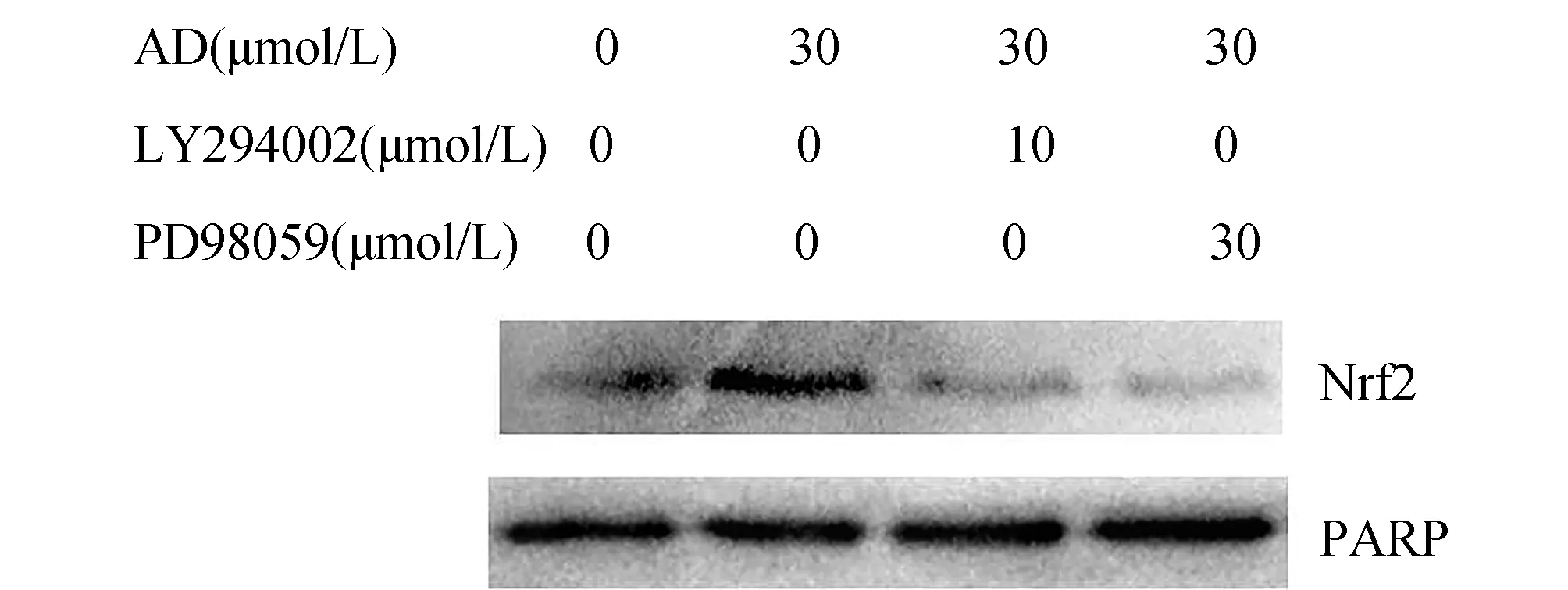
图4 PI3K/Akt和ERK抑制剂对Nrf2核转位的影响
GR和GST的诱导效应(图5A)。此外,LY294002和PD98059处理也能明显削弱AD对GPx,GR和GST活性的影响(图5B、C)。
2.6 AD激活PI3K/Akt和ERK发挥对乙醇所致细胞毒性MTT结果显示,AD可明显改善乙醇处理后的细胞毒性作用。而在AD处理前先将细胞用LY294002或PD98059预处理1 h后,结果显示均可逆转AD的保护效应(图6)。

图5 PI3K/Akt和ERK抑制剂对GPx,GR和GST表达的影响与对照组(0μmol/L AD)比较,*:P<0.05;与30 μmol/L AD比较,#:P<0.05
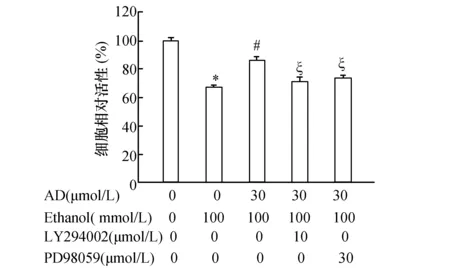
图6 PI3K/Akt和ERK抑制剂抑制AD对乙醇所致毒性的保护作用与对照组(0 μmol/L AD)比较,*:P<0.05;与100 mmol/L 乙醇比较,#:P<0.05;与30 μmol/L AD+乙醇比较,§:P<0.05
3 讨 论
AD是从中草药植物穿心莲中提取出来的一种二萜类化合物,现有的研究证实AD具有抗氧化应激损伤的作用,其机制可能与清除自由基有关。本文作者前期研究也发现,AD可能通过激活Nrf2上调HO-1表达而发挥对乙醇所致肝细胞损伤的保护作用[6]。在本研究中,对AD参与细胞保护作用的抗氧化相关酶类的表达进行了探讨。细胞内源性抗氧化谷胱甘肽及其相关酶类如GR、GPx和GST在拮抗各种氧自由基损伤中发挥重要作用。GST和GPx主要参与清除过氧化物[9-10],而GR主要参与氧化型谷胱甘肽的再生[11]。因此谷胱甘肽相关酶类在氧化应激损伤中发挥重要作用。本研究也发现,AD处理后细胞内GPx、GR以及GST的酶活性、mRNA及蛋白表达水平明显增高,这表明AD能调节GSH相关酶基因的表达,这也意味着AD处理后可能同时诱导这些抗氧化相关基因而拮抗氧化应激损伤。
前期研究表明AD可激活核转录因子Nrf2而诱导HO-1表达。考虑到Nrf2的激活受上游信号通路如MAPKs和Akt的调控,并与其丝氨酸/酪氨酸残基的磷酸化有关[12-13],因此随后对这些激酶进行了观察。结果发现AD处理可明显诱导Akt和ERKs的磷酸化,而对JNK,p38无明显影响。随后通过采用ERK和PI3K特异性抑制剂PD98059和LY294002处理后,细胞核内Nrf2水平明显减少,表明Nrf2的激活有赖于ERK和PI3K。此外,PD98059和LY294002处理后,GPx,GR和GST的表达及活性,这表明Nrf2和GPx,GR和GST之间可能存在某种关联。
考虑到细胞内具有保护性的酶类能拮抗氧化应激损伤,因此随后对AD的细胞保护作用进行了探讨。细胞毒性实验结果显示,AD处理后能明显上调乙醇的细胞毒性。同时采用ERK或PI3K抑制剂处理后,AD对细胞的保护效应消失,这表明AD抗乙醇所致的毒性与ERK和PI3K的激活有关。
总之,本研究证实AD能增强肝细胞的抗氧化功能,从而发挥对乙醇所致的氧化应激保护作用,这种保护作用有赖于PI3K/Akt和ERK通路的激活,随后诱导Nrf2核转位,后者可能通过某种未知的机制上调GPx,GR和GST的表达,最终改善乙醇对肝细胞的毒性作用。因此,AD除了自身的自由基清除效应外,它本身也具有调控细胞内信号通路的作用,从而具有拮抗乙醇所致肝细胞毒性的潜能。
[1] Almeda-Valdes P,Altamirano-Barrera A,Uribe M,et al.Metabolic features of alcoholic liver disease[J].Rev Recent Clin Trials,2016,11(3):220-226.
[2] Alpert L,Hart J.The Pathology of alcoholic liver disease[J].Clin Liver Dis,2016,20(3):473-489.
[3] Abenavoli L,Masarone M,Federico A,et al.Alcoholic hepatitis:pathogenesis,diagnosis and treatment[J].Rev Recent Clin Trials,2016,11(3):159-166.
[4] 万君,叶菊风,叶俊,等.穿心莲内酯对小鼠急性四氯化碳肝损伤的保护作用[J].实用医学杂志,2014, 30(14):2204-2207.
[5] 欧阳德亮,胡杨,王又保,等.穿心莲内酯对胃癌AGS细胞增殖侵袭的影响[J].中南医学科学杂志,2014,42(3):246-250.
[6] 曹衡玉,欧阳征仁,尹海辉,等.穿心莲内酯激活Nrf2抑制乙醇诱导肝细胞氧化应激损伤[J].基因组学与应用生物学,2016,35(11):2897-2902.
[7] Günzler WA,Kremers H,Flohé L.An improved coupled test procedure for glutathione peroxidase (EC 1-11-1-9-) in blood[J].Z Klin Chem Klin Biochem,1974,12(10):444-448.
[8] Spooner RJ,Delides A,Goldberg DM.Heat stability and kinetic properties of human serum glutathione reductase activity in various disease states[J].Biochem Med,1981,26(2):239-248.
[9] Dokic I,Hartmann C,Herold-Mende C,et al.Glutathione peroxidase 1 activity dictates the sensitivity of glioblastoma cells to oxidative stress[J].Glia,2012,60(11):1785-1800.
[10] Hayes JD,Flanagan JU,Jowsey IR.Glutathione transferases[J].Annu Rev Pharmacol Toxicol,2005,45:51-88.
[11] Argyrou A,Blanchard JS.Flavoprotein disulfide reductases:advances in chemistry and function[J].Prog Nucleic Acid Res Mol Biol,2004,78(6):89-142.
[12] Li L,Dong H,Song E,et al.Nrf2/ARE pathway activation,HO-1 and NQO1 induction by polychlorinated biphenyl quinone is associated with reactive oxygen species and PI3K/AKT signaling[J].Chem Biol Interact,2014,209(2):56-67.
[13] Zipper LM,Mulcahy RT.Erk activation is required for Nrf2 nuclear localization during pyrrolidine dithiocarbamate induction of glutamate cysteine ligase modulatory gene expression in HepG2 cells[J].Toxicol Sci,2003,73(1):124-134.
EffectofAndrographolideonethanol-induceddamageinhumanlivercells
LI Ni,LI Jing,ZHOU Dinggeng,et al
(DepartmentofEmergency,theSecondAffiliatedHospitalofUniversityofSouthChina,Hengyang421001,Hunan,China)
ObjectiveTo investigate the molecular mechanism involved in the protection exerted by Andrographolide (AD) on ethanol-induced damage in human L-02 liver cells.MethodsThe human L-02 liver cells were cultured in vitro and were treated with 0~30 μmol/L AD,the activity of glutathione-related enzymes such as glutathione peroxidase (GPx),glutathione reductase (GR) and glutathione S-transferase (GST) were measured by enzymic methods,the expression of mRNA were detected by real-time PCR.Phosphotylation of the mitogen-activated protein kinase family member of p38,JNK,ERK,and Akt were detected by Western blot.The cell viability was measured by MTT.ResultsTreatment of L-02 cells with Andrographolide increased the expression of mRNA and the activity of glutathione-related enzymes such as GPx,GR and GST.Andrographolide also induced the phosphorylation of Akt and ERK,but there was no difference in the phosphorylated levels of p38 and JNK.Further studies with PI3K and ERK specific inhibitors LY294002 and PD98059 confirmed that both molecular pathways are critical for the nuclear translocation of Nrf2,the increased enzyme expression and activity and the beneficial effect against oxidative stress induced by Andrographolide.ConclusionAndrographolide prevents ethanol-induced damage through the modulation of PI3K/Akt and ERK pathways involved in antioxidant enzymes GST,Gpx and GR regulation.
Andrographolide; Hepatic cell; Ethanol
10.15972/j.cnki.43-1509/r.2017.04.006
2017-04-23;
2017-06-10
湖南省卫生厅科研基金(B2014-054)
*通讯作者,E-mail:caohengyuhengyang@163.com.
R575.5
A
蒋湘莲)

