艾塞那肽联合二甲双胍治疗新诊断超重或肥胖2型糖尿病的疗效及后续观察
,,,,,,
(1.海南边防总队医院内科,海南 海口 570208;2.海南省人民医院内分泌科)
·临床医学·
艾塞那肽联合二甲双胍治疗新诊断超重或肥胖2型糖尿病的疗效及后续观察
何煦芳1,全会标2*,魏伟平2,张华川2,陈道雄2,方团育2,陈开宁2
(1.海南边防总队医院内科,海南 海口 570208;2.海南省人民医院内分泌科)
目的评估艾塞那肽联合二甲双胍治疗新诊断超重或肥胖2型糖尿病(T2DM)患者的疗效及安全性,以及停用艾塞那肽12周后患者各项指标的变化。方法选取新诊断超重或肥胖T2DM患者50例为研究对象,检测治疗前及艾塞那肽联合二甲双胍治疗12周后患者体重、血糖、C肽、胰岛素、脂联素、C反应蛋白(CRP)、肿瘤坏死因子(TNF-α)及抵抗素以及其他血液生化指标,而后停用艾塞那肽12周,再重复检测上述指标。结果艾塞那肽联合二甲双胍治疗改善了患者胰岛素抵抗和分泌功能,有效降低患者血糖(P<0.01),安全性好,低血糖发生率低,同时可减轻患者体重(P<0.01),升高患者脂联素水平(P<0.05),降低CRP(P<0.05)、TNF-α(P<0.01)及抵抗素水平(P<0.05)。即使停用艾塞那肽12周,患者体重也没有明显反弹(P>0.05),除血糖较前稍升高外(P<0.01),其余指标无显著变化。结论对新诊断超重或肥胖T2DM患者,艾塞那肽联合二甲双胍是安全、有效、优化的治疗方案,并且对患者体重及胰岛素抵抗的改善可产生一定的后续效应。
2型糖尿病; 肥胖; 艾塞那肽; 二甲双胍
近年来,中国糖尿病患病率迅速升高,20岁以上人群糖尿病患病率达到9.7%。随着经济的发展和人民生活水平的提高,超重和肥胖的人群明显增加。肥胖与胰岛素抵抗密切相关,是引发糖代谢紊乱的重要因素之一。肥胖的2型糖尿病患者可产生更多的游离脂肪酸、炎症物质,加剧胰岛素抵抗,加重胰岛细胞的负担[1],但有研究表明,肥胖T2DM患者通常具有较好的胰岛分泌功能,因此与非肥胖者相比,肥胖患者在改善胰岛细胞功能方面有更大的潜力[2]。近年来胰高血糖素肽-1(GLP-1)成为糖尿病治疗研究的热点,艾塞那肽(exenatide)是首个被美国食品及药物管理局(FDA)批准用于临床的GLP-1受体激动剂,艾塞那肽具有一药多效的临床特点,呈葡萄糖依赖的方式降血糖、单药使用极少发生低血糖,还可以降低T2DM患者的体重,改善脂代谢和改善胰岛功能[3],经典降糖药物二甲双胍在降糖同时不增加体重,亦可改善患者的脂代谢,因此,本文采用艾塞那肽联合二甲双胍的方案,观察该联合治疗方案对新诊断超重或肥胖T2DM患者的疗效以及后续停用艾塞那肽后患者各指标的变化,以寻求针对这部分人群早期最合适的优化降糖方案。
1 资料与方法
1.1一般资料选取2012年2月~2015年8月在海南省人民医院内分泌科和海南边防总队医院就诊的新诊断2型糖尿病患者50例为研究对象。纳入标准:2型糖尿病诊断标准符合1999年WHO糖尿病诊断标准,体质指数(BMI)≥24 kg/m2,腰围男性>90 cm、女性>85 cm,糖化血红蛋白(HbA1c)为7.0%~10.0%,未接受过降糖药、降脂药物治疗,肝、肾功能正常。排除标准:高血压未能控制;存在严重心脏病、血液或任何可能影响试验结果的疾病或药物;孕妇、哺乳期、有妊娠计划的妇女及近期曾有应用减肥药物者。
1.2方法由专职人员对患者进行饮食、运动教育,培训指尖血糖监测、艾塞那肽(商品名:百泌达,剂型为5 μg与10 μg)及胰岛素注射技术,不良事件、低血糖事件识别及处理并正确记录。在饮食控制,适量锻炼的基础上,50例患者均一开始就给予艾塞那肽联合二甲双胍(Metformin,MET)治疗。二甲双胍(商品名:格华止,施贵宝公司)0.5 (每天2次,早晚餐后服用);艾塞那肽(商品名:百泌达,美国礼来制药公司)开始5 μg ,每天2次,早、晚餐前60 min内皮下注射4周,接着10 μg, 每天2次,早、晚餐前60 min内皮下注射8周,治疗12周后,停用艾塞那肽继续二甲双胍0.5 (每天2次,早晚餐后服用)治疗12周。
观察指标:(1)体重指标:所有研究对象分别在治疗前、治疗后4、8、12、24周检测体重、腰围和身高,计算BMI。(2)实验室指标:所有研究对象分别在治疗前、治疗后4、8、12、24周检测:① 血脂全项、肝肾功能、空腹血糖、餐后2小时血糖、空腹胰岛素、空腹C肽及餐后2小时胰岛素、餐后2小时C肽、糖化血红蛋白。所有生化检查均在BeckmanAU5400自动分析仪(美国贝克曼公司)上完成,采用比色法检测LDL-C、HDL-C,酶法检测TC、TG、ALT、AST、BUN、Cr和静脉血糖。 HbA1c采用免疫聚集法(美国BAYER公司DCA2000HbA1c测定仪及HbA1c试剂盒)。② 按HOMA模型计算胰岛素抵抗指数HOMA-IR=(FINS×FBG)/22.5和胰岛素分泌指数HOMA-IS=20×FINS/(FBG-3.5)。③ 炎症因子:采用酶联免疫法测定CRP、抵抗素、脂联素和TNF-a。
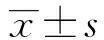
2 结 果
2.1人口统计学及临床特征共50例受试者符合人选条件,均为初发2型糖尿病。年龄 48±10岁,共48例完成临床观察(男/女:25/23例)。退出试验的2例均因反复出现恶心、呕吐无法耐受继续用药,于第2周中止试验。
2.2体重指标12周时,受试者BMI较前明显下降(P<0.01),45例体质量减轻达(3.2±1.6)kg,3例体质量无明显变化,无受试者体质量增加;停用艾塞那肽12周后(24周时),受试者BMI与12周时比较,有下降趋势,但差异无显著性(P>0.05)。
2.3 HbA1c、血糖比较经治疗12周后,患者血糖控制理想,治疗后FPG、2hPG、HbA1c均较前显著下降(P均<0.01);停用艾塞那肽12周后(24周时),FPG、2hPG、HbA1c均较前上升,差异有显著性(P均<0.01)。见表1。
2.4血脂的比较经12周的治疗后患者的血脂代谢紊乱得到改善,治疗后的TG、TC、LDL较治疗前降低(P<0.05),HDL较治疗前无显著差异(P>0.05);停用艾塞那肽12周后(24周时),TG、TC、LDL较12周时有上升趋势,但差异无显著性(P>0.05),HDL较12周时无变化(P>0.05)。
2.5胰岛功能比较治疗12周后空腹胰岛素水平较前有所下降,但差异无显著性(P>0.05),治疗后空腹C肽水平及餐后2小时C肽水平较治疗前无明显改变(P>0.05)。胰岛素抵抗指数(HOMA-IR)较前下降,差异有显著性(P<0.05),胰岛素分泌指数(HOMA-Is)较前升高,差异有显著性(P<0.05)。
停用艾塞那肽12周后(24周时):空腹胰岛素水平、空腹C肽水平及餐后2小时C肽水平较12周时无明显改变(P>0.05)。胰岛素抵抗指数(HOMA-IR)较12周时上升,差异有显著性(P<0.05),胰岛素分泌指数(HOMA-Is)较12周时下降,差异有显著性(P<0.05)。
2.6炎症因子改变治疗12周后脂联素水平较前上升(P<0.01);C反应蛋白水平下降(P>0.05);抵抗素水平下降(P<0.01);TNF-a水平下降(P<0.01)。停用艾塞那肽12周后(24周时):脂联素、抵抗素、CRP水平与12周时比较,差异无显著性(P>0.05),但TNF-a水平升高(P<0.05)。
2.7安全性50例患者中共4例发生12例次低血糖事件(低血糖事件:血糖≤3.9 mmol/L,无论是否有低血糖症状,或出现低血糖症状,但没有测血糖),无重大低血糖事件发生(严重低血糖事件:血糖≤2.8 mmol/L,无论是否有低血糖症状,或出现了严重低血糖症状,需要旁人帮助,出现意识障碍等神经系统表现)。9例(34%)患者出现轻中度消化道反应,最常见为恶心(22%),其次为腹胀(16%),腹泻(4%),多以用药初始时明显,随着用药时间的延长,症状不同程度的缓和或消失。治疗过程中未观察到淀粉酶、脂肪酶、肝肾功能的明显改变。
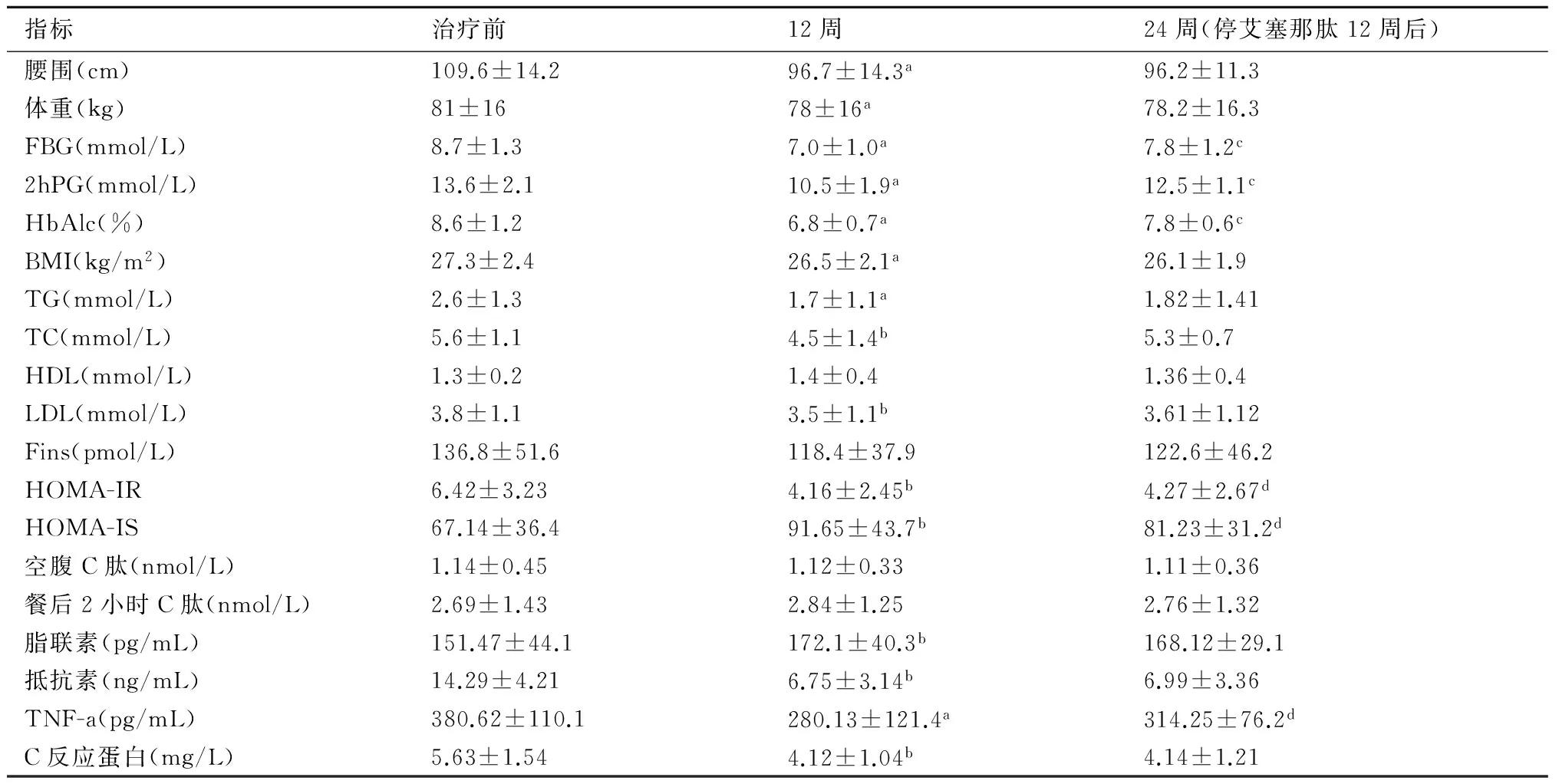
表1 2型糖尿病患者在不同时间各项指标的比较
与同指标治疗前比较,a:P<0.01,b:P<0.05;与同指标治疗12周时比较,c:P<0.01,d:P<0.05;FBG:空腹血糖;2hPG:餐后2小时血糖;HbAlc:糖化血红蛋白;BMI:身高体重指数;TG:甘油三酯;TC:总胆固醇;HDL:高密度脂蛋白;LDL:低密度脂蛋白;Fins:空腹胰岛素;HOMA-IR:胰岛素抵抗指数;HOMA-IS:胰岛素分泌指数
3 讨 论
肥胖是2型糖尿病发生发展的独立环境危险因素,肥胖诱发的高胰岛素血症,脂代谢紊乱,全身炎症状态是促进胰岛素抵抗发生发展的重要因素[1,4]。目前我国现有2型糖尿病患者中约有58.3%的患者超重[5]。研究发现[3],在初发的T2DM患者中,肥胖患者虽然处于更强的胰岛素抵抗状态,但胰岛分泌功能通常优于非肥胖者,在改善胰岛细胞功能方面潜力更大。因此,在控制血糖的同时能最大限度地控制体重,改善胰岛素抵抗、延缓β细胞功能衰退将成为肥胖型的T2DM患者治疗的理想方案。
胰高糖素样肽-1(GLP-1)是一种进食后肠道分泌的激素,具有增强葡萄糖依赖性的胰岛素分泌,抑制胰岛α细胞分泌胰高血糖素,降低胃排空速率、促进饱食感等多种生理活性,以调节血糖代谢。艾塞那肽治疗除了可帮助糖尿病患者更好地控制血糖外,还可改善胰岛β细胞功能,刺激胰岛β细胞的增殖与分化[6-7]。二甲双胍可改善糖代谢,增加胰岛素敏感性,同时有不增加患者体重,改善脂代谢等作用,是肥胖T2DM患者的一线降糖药物。本研究联合艾塞那肽与二甲双胍对肥胖初发2型糖尿病患者进行治疗,结果显示,联合治疗12周后,患者的FPG、2hPG及HbA1c明显下降,餐后2小时血糖的降低幅度大于空腹血糖,可能与艾塞那肽的葡萄糖依赖性促胰岛素分泌作用以及延缓胃排空、降低食欲等作用有关[8]。治疗过程中仅4例(9%)发生低血糖事件,无重大低血糖事件发生,提示该治疗方案安全性较好。12周的治疗虽然对空腹C肽水平无明显改善,餐后2小时C肽水平有轻度升高趋势,差异无统计学意义,但胰岛素抵抗指数(HOMA-IR)较前明显降低,胰岛素释放指数(HOMA-IS)较前升高,提示联合治疗减轻胰岛素抵抗,增加机体对胰岛素的敏感性,提高外周组织对胰岛素的使用效率。
艾塞那肽治疗可显著降低患者的体重、BMI及腰围,这种作用在治疗的第2周就开始显现, 且这种降低体重的作用与患者基线时的体重指数(BMI)呈正相关,在超重及肥胖患者中表现更明显[9-12]。患者的TG、TC、LDL均有降低,提示该治疗方案还可以在一定程度上改善血脂代谢紊乱,与国外研究相符[12]。降低体重可减轻胰岛抵抗,减少胰岛β细胞的负担,增加外周组织对胰岛素的敏感性,血脂的改善可以减少脂毒性对胰岛功能的损伤,延缓胰岛β细胞的衰竭。
近年来研究发现脂肪组织不仅可以作为能量储存器官,还可以分泌激素以及多种生物活性物质[13]。脂联素对糖、脂代谢有影响,与胰岛素抵抗、动脉粥样硬化有密切联系[14-17],改善胰岛分泌功能[18]。艾塞那肽可以通过促进脂联素的合成,抑制CRP的生成[19-20],从而增加小鼠胰岛β细胞的数量。二甲双胍治疗对脂联素分泌的影响,目前尚存在争议[21],但Adamia[22]认为其对脂联素有改善作用。本研究中,经过12周艾塞那肽联合二甲双胍的治疗后,体内脂联素的水平较前显著增加。本研究还发现,艾塞那肽联合二甲双胍的联合治疗可以降低抵抗素和TNF-a水平,与国外研究相符[23-24]。
国外有研究表明,艾塞那肽联用二甲双胍的方案在血糖、体重、血脂等各方面获益要明显优于单用二甲双胍,且单用二甲双胍对于炎症因子影响不大,进一步证实了艾塞那肽在该治疗方案中所起的主导地位[23]。本文观察了停用艾塞那肽,单用二甲双胍治疗12周后患者的各项指标,结果显示,停用艾塞那肽后,患者的整体血糖水平较前升高,体重虽有上升趋势,但差异没有统计学意义,C肽水平较前无明显变化,TG,TC,LDL较前有上升趋势但无统计学意义,HDL无明显变化,炎症因子方面,除TNF较前升高外,脂联素、抵抗素、CRP均较前无明显变化。而上述指标的稳定,则为患者进一步调整降糖方案奠定了坚实的基础,也为患者带来更为长久的获益。
综上所述,对于肥胖的初发的2型糖尿病患者,经过艾塞那肽联合二甲双胍的治疗,可带来良好的血糖控制,其胰岛β细胞功能、脂代谢紊乱、体重均可获得持久改善,该方案可通过调节部分脂肪因子,以达到改善胰岛素抵抗的作用,而上述的获益,即使在停用艾塞那肽后仍可以在一定时间内持续存在。
[1] 陈玉,周玲,徐耀初,等.2型糖尿病与遗传和环境因素相互关系的研究[J].中华预防医学杂志,2002,36(3):191-194.
[2] Park JY,Lee KU,Kim CH,et al.Past and current obesity in Koreans with non-insulin-dependent diabetes mellitus[J].Diabetes Res Clin Pract,1997,35(1):49-56.
[3] Gracia Arnaiz M.Obesity as disease and as social problem[J].Gac Med Mex,2010,146(6):389-396.
[4] 高维国,董砚虎,南海荣,等.青岛地区2型糖尿病患病危险因素的调查与分析[J].中华内分泌代谢杂志,2005,21(1):65-66.
[5] Birch LL,Davison KK.Family environmental factors influencing the developing behavioral controls of food intake and childhood overweight[J].Pediatr Clin North Am,2001,48(4):893-907.
[6] Fehse F,Trautmann M,Holst JJ.Exenatide augments first-and second-phase insulin secretion in response to intravenous glucose in subjects with type 2 diabetes[J].Journal of Clinical Endocrinology and Metabolism,2005,90(11):5991-5997.
[7] Xu G,Stoffers DA,Habener JF,etal.Exendin-4 stimulates both beta-cell replication neogenesis,resulting in increased beta-cell mass improved glucose tolerance in diabetic rats[J].Diabetes,1999,48(12):2270-2276.
[8] De Heer J,Holst JJ.Sulfonylurea compounds uncouple the glucose dependence of the insulinotropic effect of glucagon-like peptide 1[J].Diabetes,2007,56(2):438-443.
[9] Buse JB,Henry RR,Han J,et a1.Effects of exenatide(exendin-4) on glycemic control over 30 weeks in sulfonylurea-treated patients with type2 diabetes[J].Diabetes Care,2004,27(11):2628-2635.
[10] DeFronzo RA, Ratner BE, Han J, et a1.Effects of exenatide(exendin-4) on glycemic control and weight over 30 weeks in mefformin-treated patients with type 2 diabetes[J].Diabetes Care,2005,28(5):1092-1100.
[11] Kendall DM,Riddle MC,Rosenstock J,et a1.Effects of exenatide(exendin-4) on glycemiec control over 30 weeks in patients with type 2 diabetes treated with metformin and a sulfonylurea[J].Diabetes Care,2005,28(5):1083-1091.
[12] Klonoff DC,Buse JB,Nielsen LL,et a1.Exenatide effects on diabetes,obesity,cardiovascular risk factor and hepatic biomarkers in patients with type2 diabetes Treated for 3 years[J].Curr Med Res Opin,2008,24(1):275-286.
[13] Choi SH,Hong ES,Lim S.Clinical implications of adipocytokines and newly emerging metabolic factors with relation to insulin resistance and cardiovascular health[J].Front Endocrinol (Lausanne),2013,21(4):97-104.
[14] Arita Y,Kihara S,Ouchi N.Paradoxical decrease of an adipose-specific protein,adiponectin,in obesity[J].Biochem Biophys Res Commun,2012,425(3):560-564.
[15] Yamauchi T,Kamon J,Waki H.The fat-derived hormone adiponectin reverses insulin resistance associated with both lipoatrophy and obesity[J].Nature Medicine,2001,7(8):941-946.
[16] Halleux CM TM,Delporte ML.Secretion of adiponectin and regulation of apM1 gene expression in human visceral adipose tissue[J].Biochem Biophys Res Commun,2001,288(5):1102-1107.
[17] Maeda N,Funahashi T.PPARgamma ligands increase expression and plasma concentrations of adiponectin,an adipose-derived protein[J].Diabetes, 2001,50(9):2094-2099.
[18] Kaltenbach S,Weisser M,Haas C,et al.Adiponectin receptor gene expression in human skeletal muscle cells is not regulated by fibrates and thiazolidinediones[J].Int J Obes(Lond),2005,29(7):760-765.
[19] H Quan,Gao Y,Zhang H,et al.Exenatide enhances INS-1 rat pancreatic cell mass by increasing the protein levels of adiponectin and reducing the levels of C-reactive protein[J].Molecular Medicine Reports, 2014,10(5):2447-2452.
[20] Derosa G,Putignano P,Bossi AC,et al.Exenatide or glimepiride added to metformin on metabolic control and on insulin resistance in type 2 diabetic patients[J].Eur J Pharmacol,2011,666(1-3):251-256.
[21] Kanda Y,Matsuda M,Tawaramoto K,et al.Effects of sulfonylurea drugs on adiponectin production from 3T3-L1 adipocytes:Implication of different mechanism from pioglitazone[J].Diabetes Res Clin Pract,2008,81(1):13-18.
[22] Adamia N,Virsaladze D,Charkviani N,et al.Effect of metformin therapy on plasma adiponectin and leptin levels in obese and insulin resistant postmenopausal females with type 2 diabetes[J].Georgian Med News,2007,(145):52-55.
[23] Giuseppe,Derosa,Ivano G,et al.Variation in inflammatory markers and glycemic parameters after 12 months of exenatide plus metformin treatment compared with metformin alone:a randomized placebo-controlled trial[J].Pharmacotherapy,2013,33(8):817-826.
[24] 张奇志,陈诗鸿,王蒙,等.沙格列汀对高糖高脂饮食大鼠糖脂代谢的影响及其对脂肪因子的作用[J].中华老年医学杂志,2014,33(3):315-318.
Observationoncombinationofexenatideandmetformintreatingnewly-diagnosedtype2diabeticpatientsthatareoverweightorobese
HE Xufang,Quan Huibiao,Zhang Huachuan,et al
(DepartmentofInternalmedicine,HainanfrontiercorpshospitalofArmedPolice,Haikou570208,Hainan,China)
ObjectiveObjective This study evaluates the efficacy and safety of combination of Exenatide and metformin in the treatment of newly-diagnosed type 2 diabetic patients with overweight or obesity,and the change of indicators in patients after 12 weeks of withdrawal of Exenatide.Methods50 overweight or obese patients were chosen to detect body weight,blood glucose,C-peptide,Insulin,adiponectin,C-reactive protein,Tumor Necrosis Factor-а,resistin and other biochemical markers in blood before and 12 weeks after treatment.Detection were also repeated after 12 weeks of Exenatide withdrawal.ResultsInsulin resistance and secreting function were well-improved with the treatment of Exenatide and metformin.Blood glucose was reduced effectively and safely with low incidence of hypoglycemia(P<0.01).at the same time,weight loss(P<0.01),increase of adiponectin(P<0.05),decrease of CRP(P<0.05),TNF-α(P<0.01)and resistin(P<0.05) were also displayed during observation.There was no obvious weight regain or changes in other indicators even after 12 weeks of Exenatide withdrawal except a slight rise in blood glucose(P<0.01).ConclusionThe combination of Exenatide and Metformin is a safe,effective and optimized treatment for type 2 diabetic patients that are either overweight or obese.It also demonstrates legacy effects on weight management and improvement of insulin resistance.
type 2 diabetes mellitus; obesity; Metformin
10.15972/j.cnki.43-1509/r.2017.04.010
2016-12-29;
2017-05-30
海南省重点科技计划项目资助ZDXM20120046.
*通讯作者,E-mail:quanhuibiao@aliyun.com.
R587.1
A
蒋湘莲)

