基于基因表达谱筛查小鼠脑缺血再灌注后星形胶质细胞活化相关基因
董雯,王拥军
中国卒中发病率和患病率在过去30年呈上升趋势,我国仍是世界上脑血管疾病负担第一大国[1]。其中缺血性卒中占卒中发病率的87%左右[2]。但是,目前对于急性缺血性卒中的治疗,除美国食品药品监督管理局(Food and Drug Administration,FDA)批准的重组组织型纤溶酶原激活物(recombinant tissue plasminogen activator,rt-PA),尚无其他有效的神经保护剂进入临床。rt-PA由于其严格的时间窗以及出血转化等风险,发达国家仅有不到5%的缺血性卒中患者能受益[3]。因此,明确急性缺血性卒中损伤的分子机制,筛选出缺血性卒中后具有潜在神经保护作用的新干预靶点,具有重大的社会效益和科学价值。
脑组织细胞中,星形胶质细胞不仅为神经元提供营养、支持和信息传递,而且其终足包绕微血管内皮细胞,是连接神经元和微血管的重要中介,其在脑缺血再灌注损伤过程中的作用也逐渐受到关注[4]。本研究通过分析小鼠基因芯片结果,探寻急性脑缺血再灌注后星形胶质细胞活化的信号通路,拟筛查脑缺血再灌注后星形胶质细胞中的新干预靶点,为脑缺血再灌注后神经保护剂的开发提供新的思路。
1 材料和方法
1.1 材料 美国基因表达汇编(gene expression omnibus,GEO)数据库中小鼠脑组织分离的星形胶质细胞基因表达谱芯片(Affymetrix Gene Chip Mouse Genome 430 2.0 Arrays)数据共8张,GEO编号为GSE35338。将8只醛脱氢酶1家族l1-绿色荧光蛋白(Aldehyde dehydrogenase 1 family member l1-Green Fluorescent Protein,Aldh1l1-GFP)转基因小鼠分为脑缺血再灌注模型组(脑缺血1 h再灌注24 h)和假手术组,每组各4只。利用线栓法制作小鼠大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)模型,脑缺血1 h后将线栓从颈内动脉拔出实现再灌注。假手术组不插入线栓,其余操作同缺血再灌注组。再灌注24 h后,处死并取材脑组织,应用2’3’5’-氯化三苯基四氮唑(2’3’5’-triphenyltetrazolium chloride,TTC)染色验证脑缺血再灌注模型成功。取脑缺血再灌注模型组缺血侧和假手术组脑组织皮层,木瓜酶消化后,得到单细胞悬液,应用荧光激活细胞分离仪(fluorescence activated cell sorter,FACS)筛选的GFP阳性细胞即为星形胶质细胞。
每组芯片各4张。该芯片可检测34 000个小鼠基因,较完整地覆盖了小鼠全基因组表达谱。
1.2 差异基因的筛选 应用随机方差模型(random variance model,RVM)t检验方法,对脑缺血再灌注组和假手术组表达谱芯片数据进行比较,通过计算两组间基因差异的显著性水平(P)和差异倍数(fold change)筛选两组间表达水平有差异的基因。根据P<0.05、fold change≥2进行筛选,得到差异基因。
1.3 信号通路分析(pathway analysis) 应用京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库对基因参与的信号通路进行系统化分析,通过自适应线性向上(adaptive linear step up,ALSU)的方法控制假发现率(false discovery rate,FDR),分析具有显著统计学意义的信号通路。
1.4 核心信号通路的筛选 基于KEGG数据库中各信号通路的上下游关系,构建信号通路之间的相互作用网络图即信号通路关系网络(pathway relation network,Path-net),分析参与脑缺血后星形胶质细胞活化的核心信号通路。度(Degree)值越大代表信号通路越靠近网络图的中心,即越核心。
1.5 统计学处理 依据P<0.05且fold change≥2的标准,采用RVMt检验法筛选脑缺血再灌注组与假手术组间的显著差异表达基因。应用Fisher精确检验对目标基因参与的信号通路进行显著性分析,按照P<0.05进行筛选,得到显著性的信号通路。
2 结果
2.1 急性局灶性脑缺血再灌注损伤后星形胶质细胞中差异表达基因的筛选 通过对芯片数据分析,共筛选出1966个在急性局灶性脑缺血再灌注后差异表达的基因,其中表达上调的基因有1210个,表达下调的基因有756个。急性脑缺血再灌注后星形胶质细胞中,表达上调5倍以上的基因有208个;表达下调5倍以上的基因有6个。
根据芯片数据分析的结果,对脑缺血再灌注组和假手术组星形胶质细胞中差异表达基因进行聚类分析,以得到差异基因的聚类图(图1)。8例样本被分为2组,前4列为脑缺血再灌注组,后4列为假手术组。应用不同颜色区分差异表达基因在脑缺血再灌注组与假手术组间的表达情况。脑缺血再灌注组与假手术组相比,红色表示基因表达上调;绿色表示基因表达下调。由聚类分析图可见红色和绿色形成显著的4个部分,并且同一基因在同组内表达情况相对一致,不同组间的基因表达存在明显不同的聚类群。
2.2 急性局灶性脑缺血再灌注后星形胶质细胞中的核心信号通路 对脑缺血再灌注组和假手术组间差异基因参与的信号通路进行分析,按照P<0.05进行筛选,得到154个差异表达的信号通路。通过信号通路关系网络(pathway relation network,Path-net),根据Degree值由大到小排序,初步筛选出15条关键信号通路。其中,丝裂原活化蛋白激酶(mitogenactivated protein kinases,MAPK)信号通路的Degree值为34,在所有信号通路中的Degree值最大,其次为凋亡(apoptosis)、细胞周期(cell cycle)、p53信号通路(表1)。以MAPK信号通路为核心的信号通路网络图如图2所示。
2.3 脑缺血再灌注后星形胶质细胞中起重要调节作用的基因 本研究进一步分析了MAPK、p53信号通路中起关键作用的差异基因。MAPK信号通路中的差异基因有31个;p53信号通路中有19个差异基因。对MAPK和p53信号通路的50个差异基因按照P值进行排序,以选择在星形胶质细胞中起关键作用的基因。P值最小的两个基因分别为细丝蛋白c(filamin,Flnc)和细胞周期蛋白d1(cyclin-dependent kinases,Ccnd1)(表2)。
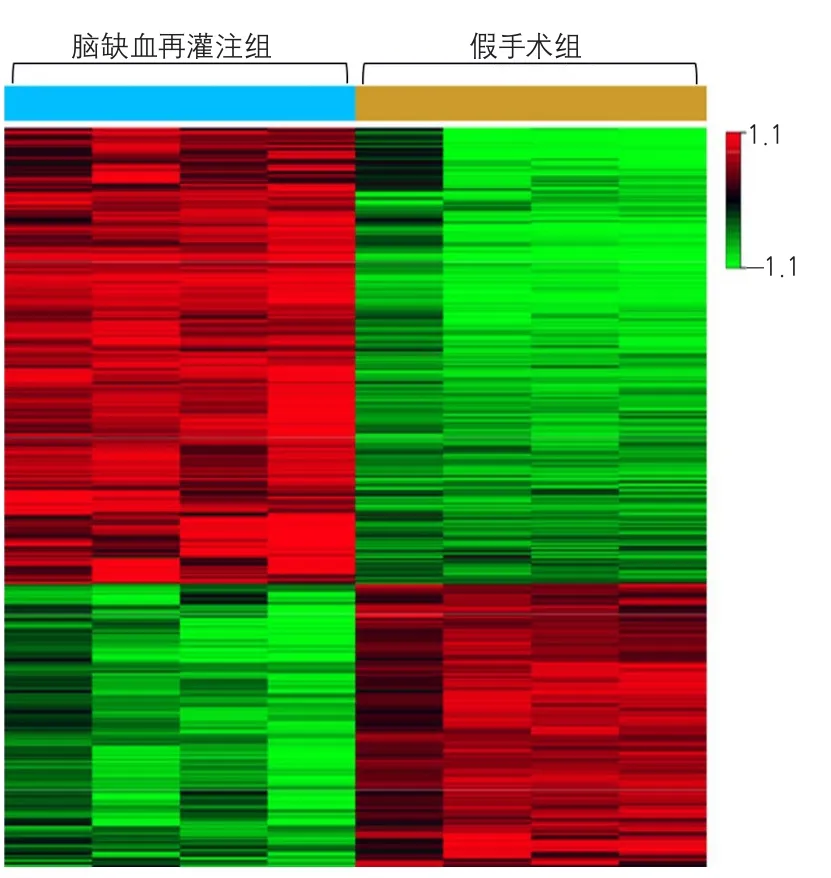
图1 差异基因聚类分析图
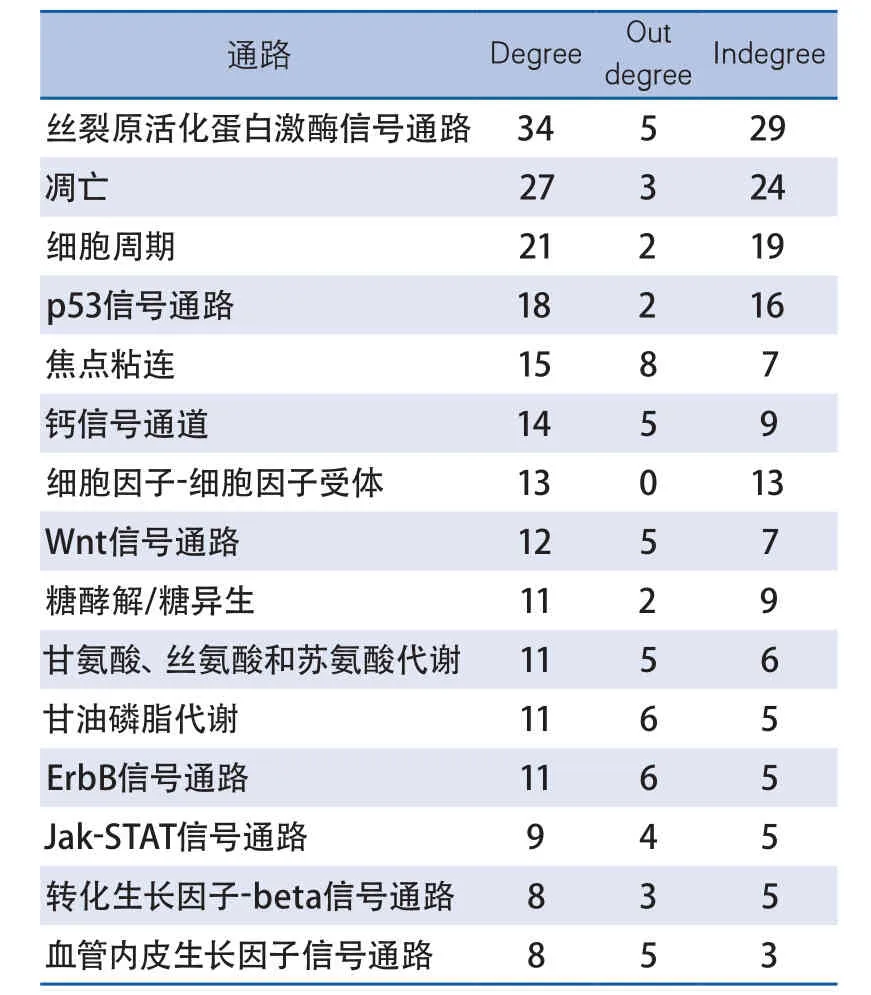
表1 脑缺血再灌注后星型胶质细胞中15条关键信号通路
3 讨论
本研究对脑缺血再灌注组和假手术组小鼠分离的星形胶质细胞中的基因表达谱进行分析。结果显示,与假手术组相比,脑缺血再灌注组星形胶质细胞中有1966个差异表达基因。进一步分析发现,上调5倍以上的基因有208个,远多于6个表达下调的基因。该结果提示,脑缺血再灌注激活星形胶质细胞中大量基因异常高表达。
信号通路是细胞内传递“信息”的关键网络,它通过蛋白质间的相互作用影响细胞的生命活动。对差异基因参与的信号通路进行分析,发现了MAPK信号通路、p53信号通路、凋亡、细胞周期是在脑缺血再灌注后星形胶质细胞中起关键作用的信号通路。以往的研究表明,MAPK信号通路在许多细胞过程中发挥作用,如增殖、分化、应激反应、凋亡、自噬和存活[5]。而且,MAPK信号通路在脑缺血损伤中的作用逐渐受到关注[6]。
本研究通过对信号通路中差异基因的P值进行筛选,发现编码CyclinD1的基因Ccnd1的P值(0.000 046)最小。CyclinD1是调控细胞周期的重要因子,促进细胞周期正向进行。已有研究表明,脑缺血后,脑组织星形胶质细胞中CyclinD1表达水平上调从而诱导细胞凋亡,最终导致脑缺血损伤[7-9]。
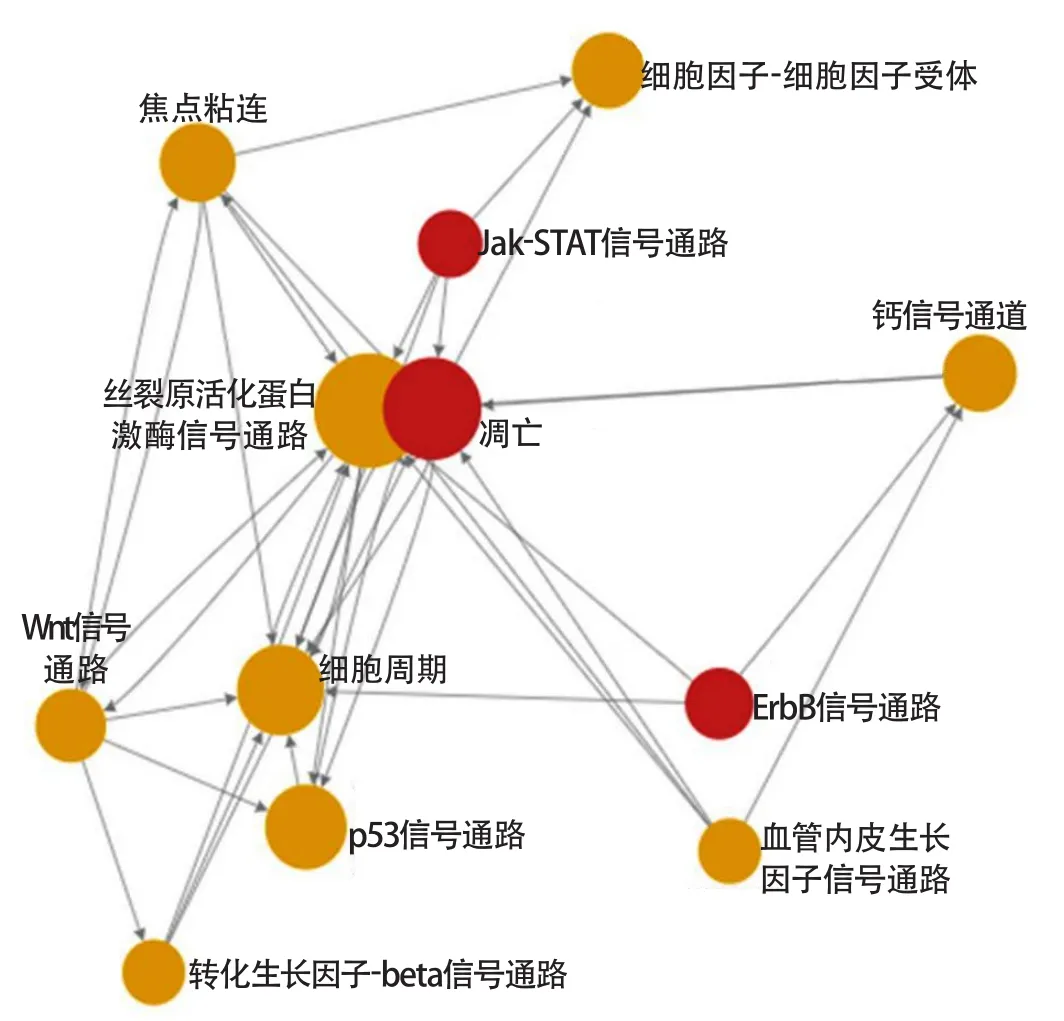
图2 脑缺血再灌注后星形胶质细胞中信号通路关系网络
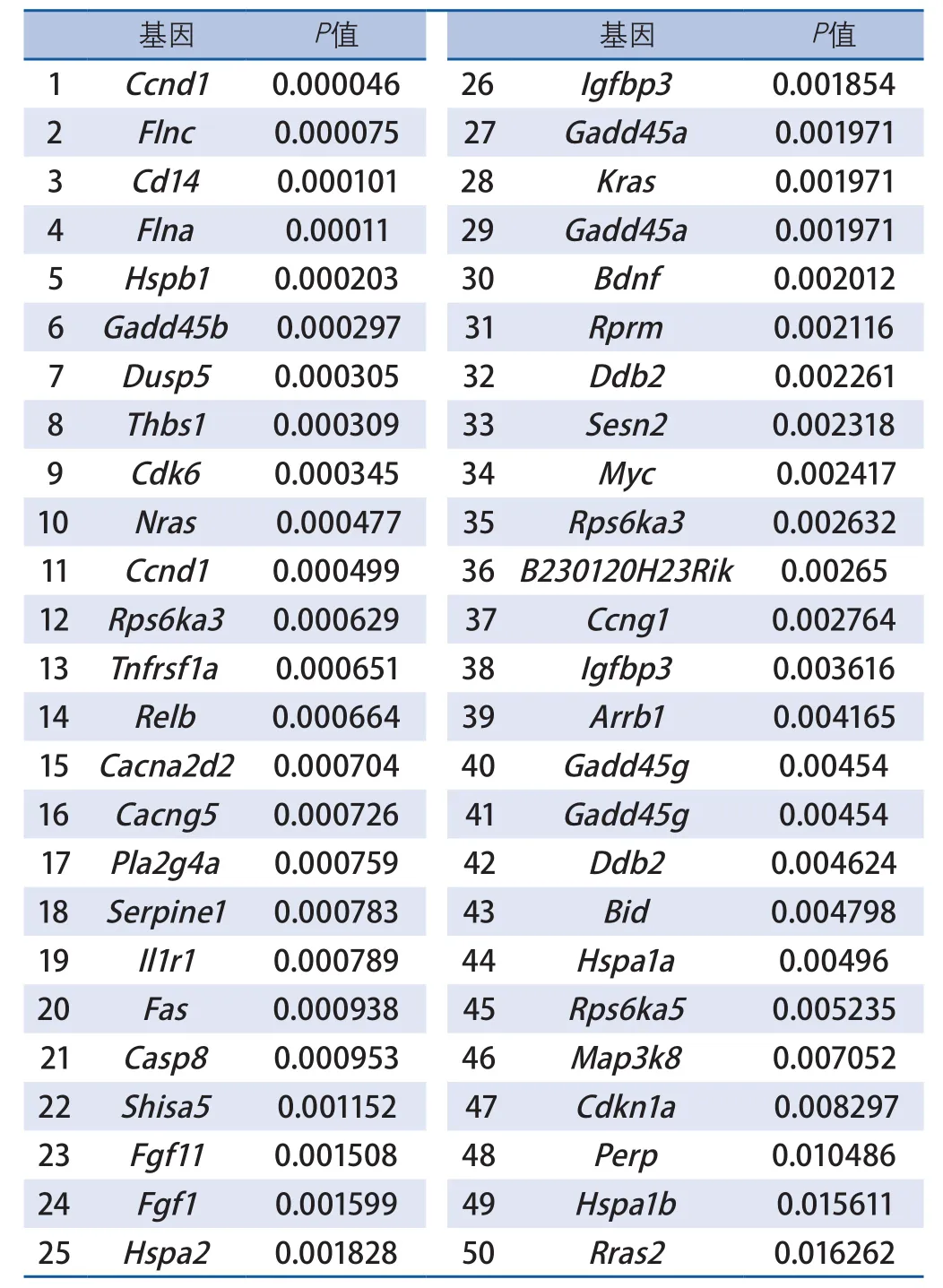
表2 MAPK和p53信号通路中的差异基因
由Flnc基因编码的细丝蛋白C(Filamin C),常表达于肌肉组织[10-11];但也有研究发现其在中枢神经系统中大量表达[12-13]。MASAYO等[14]的研究表明,Filamin C在胶质瘤中表达明显升高,且其表达水平与胶质瘤的分级程度相关。另外,细丝蛋白除与胞内多种骨架蛋白结合发挥细胞骨架作用之外,还与其他许多信号分子和受体结合,传递胞内信号,促使细胞迁移和黏附[15],但是其在脑缺血再灌注后星形胶质中的作用还未见报道。本研究结果显示,Flnc是脑缺血再灌注后星形胶质细胞活化过程中的关键差异基因,推测其可能成为保护脑缺血再灌注损伤的潜在靶点。
本研究结果对于深入探索脑缺血再灌注损伤后星形胶质细胞活化的分子机制、寻找神经保护新靶点,提供了一定的研究基础。由于本文结论是基于小样本数据分析得到的结果,后续需要增加样本量或者在细胞、小动物水平进行实验验证。另外,Flnc参与脑缺血再灌注损伤的机制还有待进一步深入探究。
[1]WANG W,JIANG B,SUN H,et al. Prevalence,incidence,and mortality of stroke in China:results from a nationwide population-based survey of 480 687 adults[J]. Circulation,2017,35(8):759-771.
[2]FAVATEAS,YOUNGER D S. Epidemiology of ischemic stroke[J]. Neurologic clinics,2016,34(4):967-980.
[3]HACKEW,KASTEM,BLUHMKIE,et al. Thrombolysis with alteplase 3 to 4. 5 hours after acute ischemic stroke[J]. N Engl J Med,2008,359(13):1317-1329.
[4]ARAI K,LOK J,GUO S,et al. Cellular mechanisms of neurovascular damage and repair after stroke[J]. J Chil Neuro,2011,26(9):1193-1198.
[5]SUN Y,LIU WZ,LIU T,et al. Signaling pathway of MAPK/ERK in cell proliferation,differentiation,migration,senescence and apoptosis[J]. J Recept Signal Transduct Res,2015,35(6):600-604.
[6]YAOB,WANGS,XIAOP,et al. MAPK signaling pathways in eye wounds:multifunction and cooperation[J]. Exp Cell Res,2017,359(1):10-16.
[7]KATCHANOVJ,HARMSC,GERTZK,et al. Mild cerebral ischemia induces loss of cyclin-dependent kinase inhibitors and activation of cell cycle machinery before delayed neuronal cell death[J]. J Neurosci,2001,21(14):5045-5053.
[8]KATOH,TAKAHASHIA,ITOYAMAY. Cell cycle protein expression in proliferating microglia and astrocytes following transient global cerebral ischemia in the rat[J]. Brain Res Bull,2003,60(3):215-221.
[9]ZHUZ,ZHANGQ,YUZ,et al. Inhibiting cell cycle progression reduces reactive astrogliosis initiated by scratch injury in vitro and by cerebral ischemia in vivo[J]. Glia,2007,55(5):546-58.
[10]STOSSELTP,CONDEELISJ,COOLEYL,et al. Filamins as integrators of cell mechanics and signalling[J]. Nature reviews. Nat Rev Mol Cell Biol,2001,2(2):138-145.
[11]ZHOUAX,HARTWIGJH,AKYUREKLM. Filamins in cell signaling,transcription and organ development[J]. Trends Cell Biol,2010,20(2):113-123.
[12]XIEZ,XUW,DAVIEEW,et al. Molecular cloning of human ABPL,an actin-binding protein homologue[J]. Biochem Biophys Res Commun,1998,251(3):914-919.
[13]PUDASR,KIEMATR,BUTLERPJ,et al. Structural basis for vertebrate filamin dimerization[J]. Structure,2005,13(1):111-119.
[14]ADACHI-HAYAMAM,ADACHIA,SHINOZAKIN,et al. Circulating anti-filamin C autoantibody as a potential serum biomarker for lowgrade gliomas[J]. BMC cancer,2014,14:452.
[15]NAKAMURAF,STOSSELTP,HARTWIGJH. The filamins:organizers of cell structure and function[J]. Cell Adh Migr,2011,5(2):160-169.

