基于多模态成像技术监测基因修饰支架中血管生成及修复临界性骨缺损的研究
李 健 孙语韬 刘成波 林日强 郑 炜 任培根
1(中国科学院深圳先进技术研究院 转化医学研究与发展中心 深圳 518055)
2(中国科学院深圳先进技术研究院 生物医学光学与分子影像研究室 深圳 518055)
1 引 言
据统计,我国每年因创伤、先天性畸形、骨质疏松和骨肿瘤等原因造成的骨缺损人数超过350 万[1]。大范围骨缺损的修复和功能重建一直是矫形外科、颅面外科和整形外科所共同面临的难题,也是国内外重大研究课题之一。
传统的骨缺损治疗方法包括自体骨移植、同种异体骨移植和人工骨移植等[2-4]。与传统方法不同的是,骨组织工程改变了以往创伤修复的传统模式,能以少量组织细胞修复大范围组织缺损,并可按需塑形达到理想形态,为实现创伤修复及完美的生物学重建提供了理论和方法。这也给临界性骨缺损的修复带来了新的希望。基因修饰支架原位促血管化是用于临界性骨修复的有效途径之一。众所周知,骨组织工程包括 3 个关键因素:生长因子、生物支架材料和种子细胞[5]。其中,生物支架材料的选择是骨组织工程的核心问题。在新骨形成之前,生物支架不仅为细胞提供黏附、生长、增殖、分化、营养交换、新陈代谢的空间及机械支撑,而且也是细胞外基质分泌的空间场所,是形成新的具有一定形态和功能的组织、器官的物质基础,是决定组织工程骨能否用于临床的关键[6,7]。
传统方法制备的支架材料,由于内部缺乏必要的供营养物质交流的通道及可控的微孔结构,不利于细胞和血管长入[8-12]。3D 打印作为一种新型制造技术,因具有操作简单、支架各参数可控性高、可保持材料生物活性并可根据缺损部位的影像学扫描数据按需塑形等优势,而被迅速应用于骨组织工程支架材料的成型研究[13-17]。目前大部分研究主要集中于分析 3D 打印的支架材料本身的微观结构、孔径尺寸、孔隙率、机械力学强度,或者体外细胞生物相容性等对细胞黏附增殖的影响[18,19]。研究表明,3D 打印支架植入体内后,其细胞存活范围仅在血供弥散的 150~200 μm范围内[20]。当移植体积大于 3mm3时,支架不能依靠组织液的弥散支持种子细胞的生存,此时必须通过血管的再生来实现氧和营养物质的供给,否则将因为缺氧和营养匮乏,种子细胞很快会坏死或凋亡导致移植物失效。因此,促血管化的生物支架是促进骨组织再生的关键环节,其在体内的血管化速度及程度将决定和制约其是否能够用于修复骨缺损治疗。
目前,组织工程骨促血管生成常采用的方法是单独或联合应用促血管生成生长因子[21-23],已在临床及基础研究中取得较多成果。在众多生长因子中,血小板源性生长因子-BB(PDGFBB),不但具有促进间充质干细胞(MSCs)的增殖和向成骨细胞分化[24,25]的作用,同时还能够诱导 MSCs 的趋化[26,27]。Caplan 等[24]和 Dohle 等[28]学者研究发现,PDGF-BB 与血管生成素/tie2 及TNF-β等蛋白协同在促进血管形成、壁细胞动员方面必不可少。此外,PDGF-BB 还能促进周细胞动员向新生血管或向平滑肌细胞分化[29]。因此,PDGF-BB 在骨组织重建的早期、中期和后期 3 个阶段均能发挥多方面的作用:成骨细胞前体细胞的动员、增殖和分化,新生骨组织健康生长所必需的血管生成等,这是目前其他常用促进骨再生的生长因子(VEGF、bFGF、BMP-2、TGF-β)所不具备的。为了解决目前使用生长因子存在的半衰期短、生物活性低、局部浓度不易调控、价格高昂等问题[30,31],以及大量使用成体干细胞时存在的各种问题,本文采用将含有编码生长因子基因的载体负载到生物支架上,使其进入体内细胞后原位、持续表达生长因子,达到诱导相关细胞的增殖、迁移和分化,从而促进缺损组织再生的目的。在本研究中,选择慢病毒载体进行实验。该载体具有能长期稳定表达目的基因、高转染率、低免疫原性、全身副作用少等优点,已在多种人类疾病中做过临床试验[32],也是目前T 细胞受体疗法(TCR-T)、嵌合抗原受体-T 细胞(CAR-T)等细胞基因治疗中的首选治疗载体。目前关于慢病毒修饰支架的研究并不多[33],也不系统,基于慢病毒介导的基因修饰组织工程研究仍在发展中。骨缺损的修复是一个由干细胞等多种细胞驱动的组织形成的动态变化过程,其通过复杂的内分泌、自分泌和旁分泌作用使得骨再生和血管生成得以有序发生[34]。其中,缺损区的血管再生早于骨再生,因此在没有血液运输到达的缺损区不可能有成骨活动。骨组织支架植入机体后能否成活,关键看其能否在早期血管化并和周围组织建立血供,其血管化过程贯穿于整个移植修复过程。
对组织工程骨中血管化程度进行评估的传统方法包括 X-线片光密度测定、放射性核素骨显像(ECT)、CT 灌注成像、磁共振成像(MRI)、灌注成像和经典的组织学方法等,但这些方法均难以满足研究的需要[35,36]。自从 1990 年,美国 Cornell 大学的 Denk 等学者将双光子成像用于生物学观测,它通过激发生物组织中的内源性物质产生非线性信号进行成像,可对样本在不被固定、染色标定以及切片的自然状态下进行在体实时、连续、无创成像检查,在临床上可以作为一种快速辅助诊断技术。由于该显微镜具有低细胞损伤、大成像深度和可用于活细胞甚至活体组织长时间三维成像等优点,很快得到广泛的应用[37]。此外,在相同实验设计中,研究者还探索了光声成像在骨组织工程中的应用。样品被短脉冲激光照射后会受激产生超声波,这种现象被称为光声效应。光声成像作为一种混合型的成像方式,结合了光学成像的高对比度和光谱识别特性,以及超声成像大穿透深度下仍具备较高分辨率的特点,已在临床及生物医学研究领域体现出巨大的应用潜力[38,39]。然而,运用非线性双光子及光声显微成像技术在体、实时、连续、无创地监测和定量骨组织工程支架在骨缺损修复过程中的血管化进程以及血管化程度的相关研究鲜有报道。
因此,在本研究中,我们将采用多模态双光子-光声显微成像技术,通过在体、实时、连续地监测,研究骨修复过程中多孔骨组织支架诱导血管化的动态过程证明基因修饰的多孔支架对在促血管生成方面的作用,建立血管再生与骨组织重建之间的偶联相关性。该研究对组织工程支架血管化的科学研究和临床应用具有重要意义,可为基因修饰骨组织支架促进临界性骨缺损修复奠定基础。
2 实验材料与方法
2.1 实验材料
实验动物 C57BL/6 小鼠,8 周龄,雄性,体重 20~25 g,由广东省医学实验动物中心提供,动物实验经由中国科学院深圳先进技术研究院实验动物伦理委员会批准(受理号 SIAT-IRB-170305-YGS-LIJ-A0313);聚乳酸-羟基乙酸共聚物(Poly Lactic-co-Glycolic Acid,PLGA)购买于Sigma-Aldrich 公司,其中丙交酯、乙交酯比例为75∶25;1, 4-二氧六环购买于上海凌峰化学试剂有限公司;PDGFB-pcDNA3.1(+)购买于北京义翘神州科技有限公司;Anti-PDGF-BB 多克隆抗体和 PDGF-BB 重组蛋白购买于 BioVision 公司;第三代慢病毒载体表达系统(pLP1、pLP2、pLPVSVG、pLVX-mCMV-zsGreen)由汕头大学魏炽炬教师惠赠。除特别注明外,实验中用于细胞培养的试剂,包括 DMEM 培养基、DPBS(磷酸盐缓冲液)、FBS(胎牛血清)等均购买于 Gibco 公司,质粒去内毒素大提试剂盒(货号 12362)购买于 QIAGEN 公司。
2.2 实验方法
2.2.1 含有 pdgf-b 基因的慢病毒表达载体的构建、生产、制备及滴度测定
通过分子克隆技术,利用EcoRI 和SpeI 限制性酶切位点将pdgf-b基因的 cDNA 片段插入到第三代慢病毒表达载体中,构建新的慢病毒表达载体,用磷酸钙转染法大量制备伪病毒颗粒[40]。在 293FT 细胞中包装的伪病毒颗粒经低温高速离心沉淀培养基上清获得,并利用 eGFP(增强型绿色荧光蛋白)报告基因检测确定浓缩后的病毒液滴度,随后保存于-80℃ 备用。
2.2.2 制备 3D 打印多孔支架
PLGA/nHAp 支架材料的制备工艺流程:称取适量 PLGA 固体粉末,加入 1,4-二氧六环溶液(PLGA 和 1,4-二氧六环溶液的质量比为 1∶20),二者混合后磁力搅拌 4 h,充分溶解 PLGA 材料,随后再向溶液中加入纳米级 HAp(含量占混合固体质量的 3%),并继续搅拌 4 h,形成均匀体系。利用 3D 打印低温快速成型系统(图1),于-35℃下进行直径为 4mm 三维多孔支架的制备,完成后置于冷冻干燥机中,冻干 24 h,制备结束。

图1 由控制系统和成型系统构成的低温快速 3D 打印机及打印出的 3D 支架Fig. 1 The 3D low temperature rapid prototyping printer comprised control system and molding system
2.2.3 基因修饰多孔支架的制备及体外病毒缓释的生物活性研究
制备基因修饰支架步骤:把含有编码pdgf-b基因的活性病毒颗粒溶液(已确定其病毒滴度)与多孔 PLGA/nHAp 支架在 37℃ 条件下共孵育 1 h,利用病毒颗粒和多孔支架中的纳米羟基磷灰石(nHAp)表面之间的强静电结合作用[41],随后洗脱支架上未结合的病毒颗粒(P洗脱),经低温真空冷冻干燥,从而将慢病毒颗粒修饰固定在多孔骨组织支架的表面及内部孔洞中,得到携带有基因修饰多孔支架材料。其中,未结合而被洗脱掉的病毒颗粒(P洗脱)转染 293T 细胞,根据慢病毒转染 293T 细胞的感染复数(MOI=M)及 293T 阳性细胞(eGFP 作为报告基因)表达数量N确定P洗脱数值(P洗脱=M×N),进而确定支架负载病毒颗粒数量为P结合=P总数-P洗脱=P总数-M×N,结合效率W=(P总数-M×N)/P总数×100%。
慢病毒介导基因修饰多孔 LV-pdgfb/PLGA/nHAp 支架上的病毒颗粒体外缓释分析及优化:通过流式细胞术(FACS)测定病毒在支架上 5 天内的缓释效率,调整加载慢病毒的条件以及优化静电吸附和低温冷冻方法的各种参数,包括静电结合作用时间(T)、结合效率(P)以及低温冷冻条件(C)等对病毒活性的影响,以求达到最佳缓释效果,最终验证静电吸附和低温冷冻制备慢病毒介导基因修饰多孔 PLGA/nHAp 支架的可行性。
2.2.4 建立小鼠顶骨临界性骨缺损模型及支架移植
小鼠手术均在 3% 异氟烷-100% 氧气呼吸麻醉下进行,同时设有保温和防脱水处理,包括呼吸麻醉管道中加蒸馏水及术前皮下推注生理盐水(200 μL)。动物麻醉后,用碘酊及 70% 酒精对手术部位皮肤进行消毒处理,沿矢状缝在头顶皮肤作约 10mm 切口以暴露左侧顶骨,用无菌棉签将骨膜推开,用安装有圆锯的高速牙医钻在生理盐水散热下移除直径 4mm 的顶骨,缺损处不与任何骨缝接触,且移除骨片时不能损伤硬脑膜。给予不同实验处置后,恢复颅骨膜、头部皮肤位置,缝合皮肤。小鼠顶骨临界性骨缺损模型将分为 3 个组,每组 5 只。其中,A 组:骨缺损处不做任何处理(Empty);B 组:移植 PLGA/nHAp支架;C 组:移植 LV-pdgfb/PLGA/nHAp 支架。
2.2.5 建立双光子显微成像条件下正常小鼠顶骨内血管的形态结构及分布
试验选取两个光学通道用于收集正常小鼠颅骨组织的荧光信号。其中,一个通道选取388~420 nm 较窄波长范围用于收集颅骨表层皮质骨胶原蛋白产生的二次谐波(Second Harmonic Generation,SHG)信号,用绿色像素代表该荧光信号;另一个通道选取 450~650 nm 较宽波长范围用于收集颅骨内血管的双光子激发荧光(Two-Photon Excited Fluorescence,TPEF)信号,用红色像素代表该荧光信号。在试验中,为了进一步提高颅骨内血管的 TPEF 荧光信号对比度,给小鼠尾静脉注射 150 μL、2 mg/mL 的 FITCDextran。每张成像图片的像素为 256×256,图片的大小为 512 μm×512 μm,获取每张图像耗时均为 8 s。具体步骤如下:对准焦距找到清晰成像部位后,首先进行x-y平面成像;然后适度调节焦距,沿z轴方向进一步扫描成像,扫描深度为 200 层,每层间隔为 2 μm。
2.2.6 在 SHG/TPEF 显微成像条件下监测临界性骨缺损部位血管生成的动态变化过程
利用建立起来的顶骨内血管非线性双光子显微成像的基本参数,分别在第 2、3、4、5、6、7、8 周对 A、B、C 三组进行监测和定量在骨缺损修复过程中血管生成动态变化情况,探究基因修饰多孔 PLGA/nHAp 支架对诱导血管生成的重要作用。
2.2.7 光声成像监测正常小鼠顶骨内血管分布
在保留小鼠头皮和不保留小鼠头皮 2 种情况下,分别用声学(AR-PAM)和光学分辨率(OR-PAM)的多尺度光声显微成像观测顶骨内血管分布,评估光声成像在顶骨血管成像的精度(深度和分辨率),并建立起小鼠正常顶骨血管光声显微成像的基本参数和具体步骤,为后续骨缺损部位移植支架血管再生的检测奠定基础。
2.2.8 Micro-CT 分析骨缺损部位骨再生情况
术后 8 周进行活体 Micro-CT 扫描分析骨缺损部位再生情况,并进行三维骨结构重建,通过对比分析基因修饰和未修饰多孔 PLGA/nHAp 支架修复骨缺损比例的结果,探究基因修饰多孔PLGA/nHAp 支架可以加快促进骨组织的再生,建立骨组织重建与血管再生之间的相关性。
2.2.9 组织学方法检查
Micro-CT 扫描之后,安乐处死小鼠,取出颅骨,并采用 4% 多聚甲醛进行颅骨的固定,5%硝酸脱钙,浸泡、透明、石蜡包埋后,连续切片(厚度 5 μm),随后进行组织学染色(H&E),观察新骨形成和骨缺损部位连接情况。
2.3 统计学分析
3 实验结果与讨论
3.1 含有 pdgf-b 基因的慢病毒颗粒浓缩及滴度测定
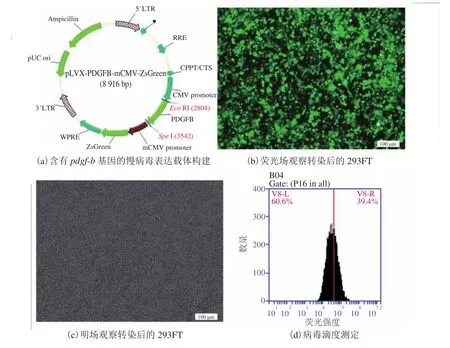
图2 慢病毒颗粒的生产制备及病毒滴度测定Fig. 2 Preparation of the lentivirus and evaluation of virus titer
本实验采用的第 3 代慢病毒系统由包膜质粒 pLP1、pLP2 和 pLP-VSVG 及慢病毒表达质粒pLVX-PDGFB-mCMV-zsGreen 组成。其中,表达质粒 pLVX-PDGFB-mCMV-zsGreen 表达 PDGFBB 蛋白及绿色荧光蛋白。在荧光显微镜下观察可看到,慢病毒表达质粒与包膜质粒共转染293FT 细胞 24 h 后,大部分细胞可见绿色荧光表达(图2)。这说明慢病毒表达载体及包膜质粒已经顺利转染细胞并表达相应蛋白。接着,换取含有丙酮酸钠的培养液继续培养 48 h ,此时可见少量细胞漂浮,细胞有融合现象,收集培养上清,即为含有慢病毒颗粒的病毒上清。与腺病毒和逆转录病毒不同,慢病毒不能在包装细胞中进行自我复制扩增。为了获得足够量的病毒上清,首先,将细胞转染于 10 个直径为 15 cm 培养皿中进行培养,最终收集病毒上清 200 mL;随后,采用超高速离心机在 4℃、25 000 rpm 条件下,离心 2 h,对病毒上清进行浓缩;最后用 1 mL 冷DPBS 缓冲液重悬病毒颗粒,获得浓缩后的病毒溶液,并按照每次实验用量进行分装,于-80℃保存备用。用浓缩后的 1 μL 病毒原液,进行 10 倍倍比稀释至 10-5后转染 293T 细胞(5×104/孔),24 h 后用流式细胞术进行绿色荧光蛋白阳性细胞计数,确定其病毒滴度为 1.0×108TU/ mL。
3.2 3D 多孔 PLGA/nHAp 骨组织支架结构表征
从图3(a)可以看到,3D 打印的圆柱型多孔 PLGA/nHAp 骨组织支架形态规则,孔隙均匀。将制备的 3D 多孔 PLGA/nHAp 支架切成厚度为 5~6mm 的薄片,喷金后用扫描电子显微镜进行观察,结果如图3(b)~(d)所示。扫描电子显微镜结果表明,多孔支架的孔径范围分布在200~400 μm,各孔隙间具有较高的连通性;在5 000 倍放大后可发现,在多孔支架表面分布着大量的微孔结构,微孔大小范围在 2~10 μm(图3(d))。3D 打印的支架表面及内部具有众多的孔洞结构有利于细胞的贴附、迁移、增殖及分化,为细胞之间的交流通讯提供了条件,有利于支架内部血管生成和骨组织的长入。

图3 3D PLGA/nHAp 骨组织支架结构表征Fig. 3 Structural characterization of the 3D PLGA/nHA scaffold
3.3 静电吸附和低温冷冻方法制备基因修饰多孔支架及病毒缓释的生物活性研究
利用病毒颗粒和多孔支架中的纳米羟基磷灰石(nHAp)表面之间的强静电结合特性,经低温真空冷冻干燥,将慢病毒颗粒固定在多孔骨组织支架的表面及内部孔洞中,得到携带有基因修饰多孔支架材料。为了进一步确定结合到支架表面的病毒活性及其释放曲线,在体外进行病毒颗粒缓释及活性检测实验。研究发现,慢病毒颗粒从支架上持续(可长达 5 天)释放出的病毒颗粒能够有效转染 293T 细胞并表达 PDGF-BB 因子(图4),这为基因修饰支架体内移植提供了基础。
3.4 多模态双光子及光声显微成像监测和定量骨缺损部位血管生成
按照实验分组,将多孔支架移植到小鼠临界性骨缺损模型上,术后第 2 周开始利用双光子显微成像(SHG/TPEF)技术实时监测和定量移植支架上血管生成及分布(图5)。术后 8 周双光子显微成像结果发现,在移植 LV-pdgfb/PLGA/nHAp 支架上有大量的血管生成,其血管生成的数量显著高于 PLGA/nHAp 组,同时在移植支架的实验组上发现伴随着新生胶原的出现;但在对照(Empty)组并没有发现有血管生成和胶原的生成(图5(b))。此外,利用 ImageJ 软件从术后第 2 周开始统计骨缺损部位血管生成面积发现,在移植LV-pdgfb/PLGA/nHAp 支架组血管生成的面积显著大于其他两组(图5(c))。在相同实验设计中,我们利用具有声学(AR-PAM)和光学分辨率(OR-PAM)的多尺度光声显微成像设备观察到了正常小鼠顶骨血管分布情况(图6、7)。本文利用光声显微成像技术在监测实验组小鼠骨缺损部位血管再生的过程中,由于骨组织的反射性高、密度高等特点,目前没有获得高清晰度的实验图片。为了解决光声成像在骨组织工程应用中所遇到的难题,本文合作者团队已开始搭建新的光声显微成像系统平台,包括提高其分辨率(5~10 μm)、大视野成像范围(10mm)、成像速度以及提高信噪比等方面,这将为后续骨缺损部位血管再生的实时检测和定量提供条件。相信伴随着光声显微成像技术的发展,其将为生物医学成像领域提供一种新的具有颠覆价值的成像思路和方法。
3.5 Micro-CT 观察骨再生
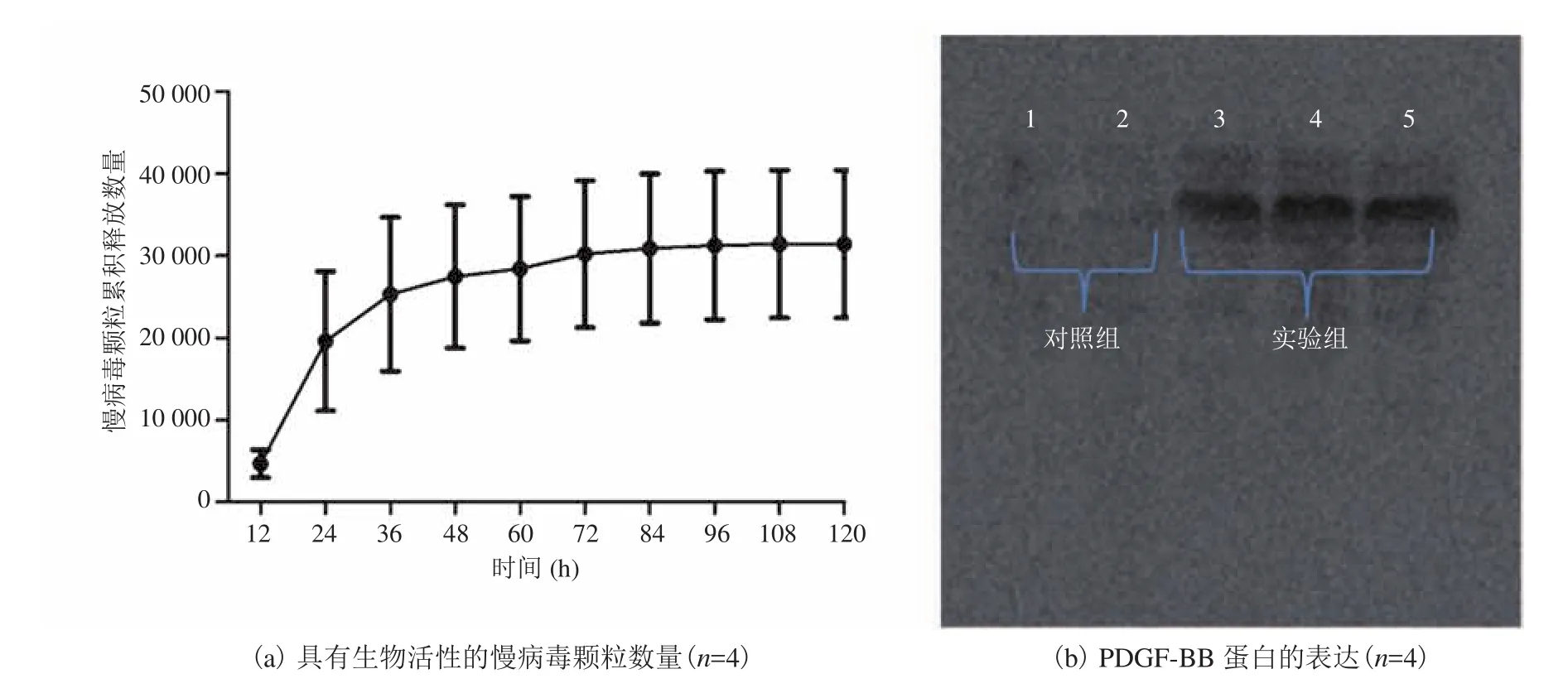
图4 体外测定支架上释放的慢病毒生物活性及 PDGF-BB 蛋白表达情况Fig. 4 Assessment of the bioactivity of virus particles cumulatively released from PLGA/nHAp scaffolds and PDGF-BB expressed
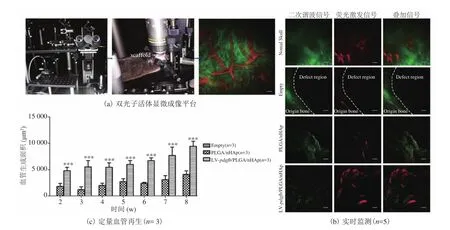
图5 多模态双光子显微成像监测和定量骨缺损部位血管生成Fig. 5 Two-photon microscopy (SHG/TPEF) imaging and quanti fi cation of angiogenesis in the bone defect region
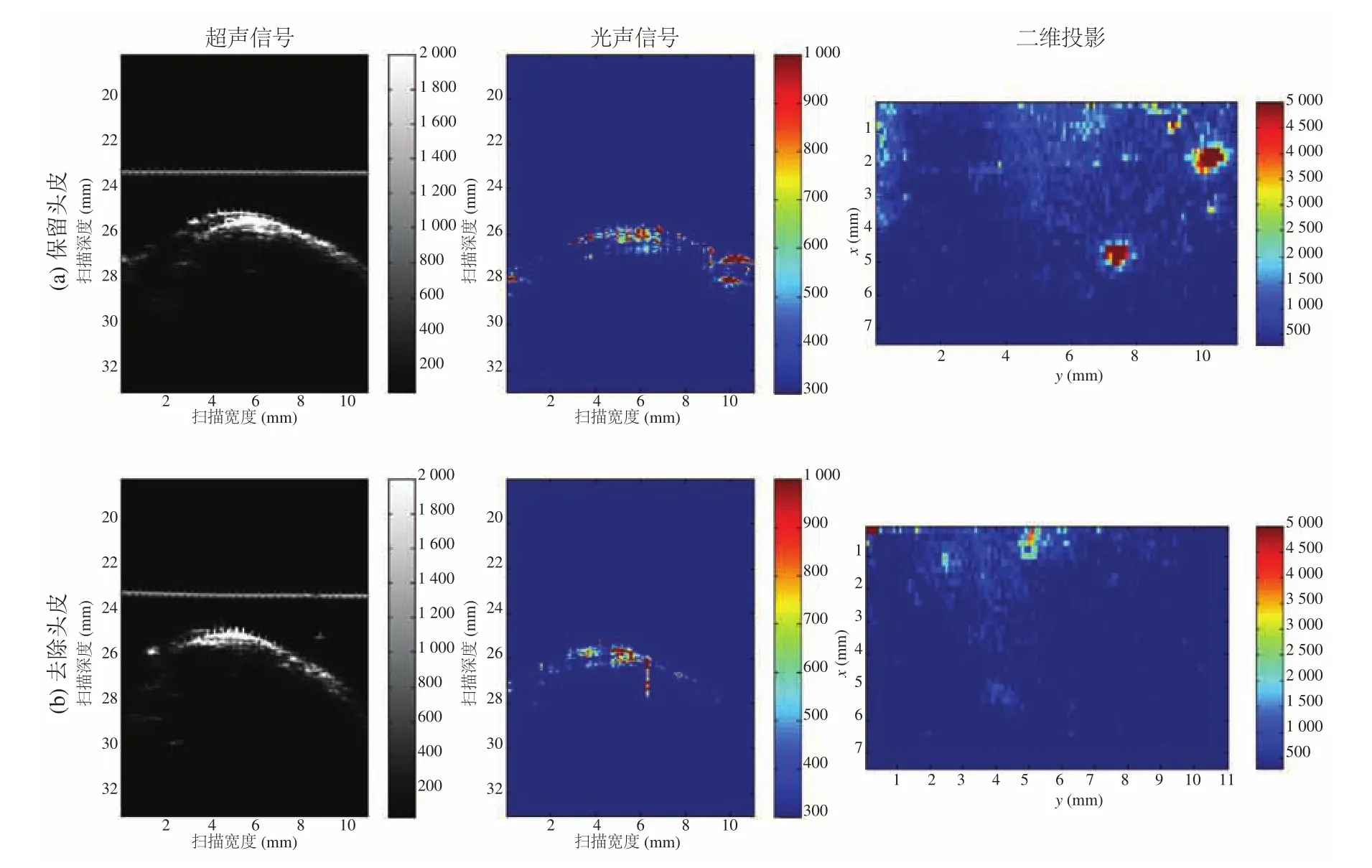
图6 声学分辨光声显微成像(AR-PAM)在保留头皮(a)和去除头皮的条件下(b)观察正常小鼠顶骨血管分布(n=6)Fig. 6 Ultrasound (US) and photoacoustic (PA) images along with their 2D images of normal tissue components of the cranial area with(a) or without skin (b) by AR-PAM (n=6)
术后 8 周对实验小鼠进行 Micro-CT 扫描,并进行三维骨结构重建。结果显示,在有移植支架的实验组观察到有不同数量的新生骨组织长入支架中,并观察到不同程度的生物支架降解。统计数据结果发现,移植基因修饰支架的实验组的骨密度(BMD)、骨体积分数(BV/TV)以及骨小梁数量(Tb.N)显著高于另外两实验组(图8),表明基因修饰多孔 PLGA/nHAp 支架可以加快促进骨组织的再生。
3.6 组织学观察染色
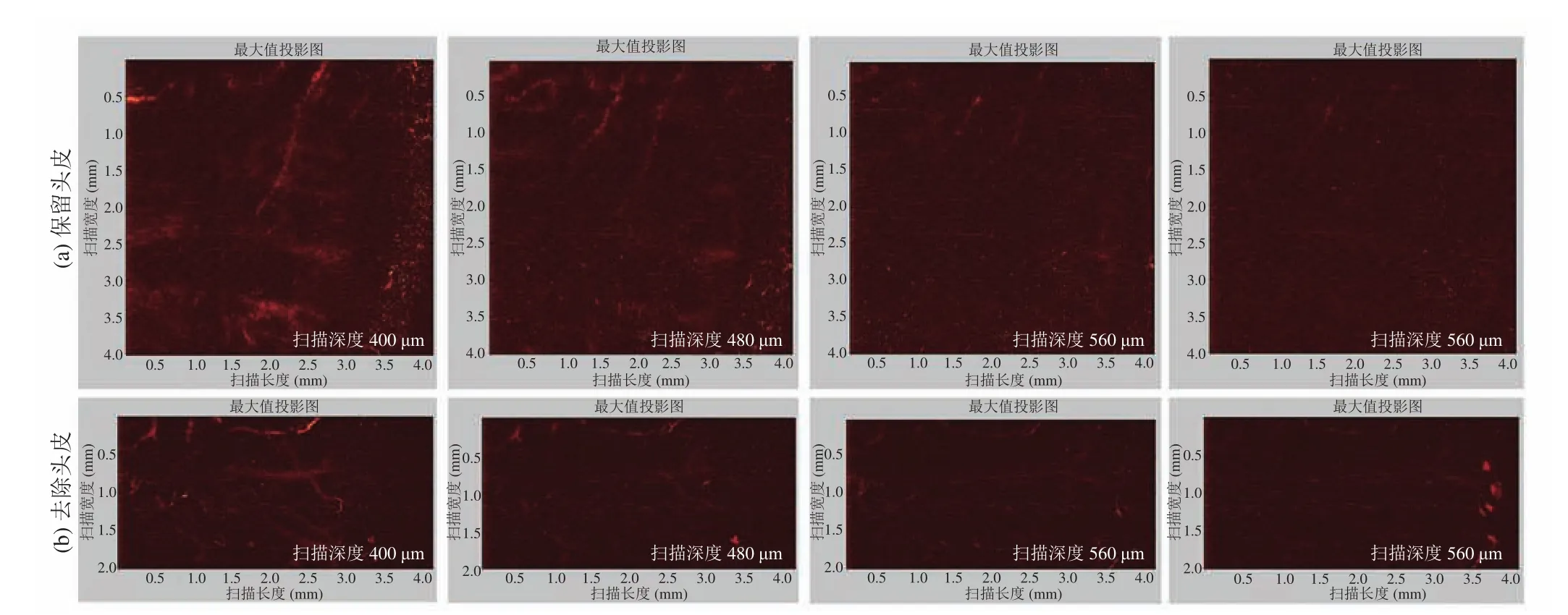
图7 光学分辨光声显微成像(OR-PAM)在保留头皮(a)和无头皮的条件下(b)观察不同扫描深度下正常小鼠顶骨血管分布(n=6)Fig. 7 Imaging of normal tissue components of the cranial area with (a) or without skin (b) at different depths by OR-PAM (n=6)
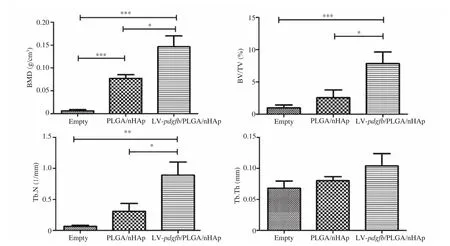
图8 术后 8 周 micro-CT 评估骨缺损部位新生骨组织再生情况Fig. 8 Micro-CT scanning evaluation of bone formation at 8-weeks post-implatation
对组织切片进行苏木精-伊红(Hematoxylin-Eosin Saining)染色,在显微镜下观察结果如下:在没有移植支架(Empty)组发现,骨缺损部位被较多的纤维组织覆盖,没有新生骨组织的出现;在 LV-pdgfb/PLGA/nHAp 和 PLGA/nHAp 组均发现了有新生骨组织的生成,并且观察到多孔支架降解现象,其中,LV-pdgfb/PLGA/nHAp 组多孔支架降解程度最高,降解空间被大量新生的骨组织填充,而在 PLGA/nHAp 组多孔支架还基本保持着原有空间结构,降解速率较慢(图9)。表明基因修饰多孔 PLGA/nHAp 支架可以加快促进骨组织的再生。
4 与国内外相似研究的对比分析
骨缺损修复重建是个复杂的生物学过程[34]。骨组织支架植入机体后能否成活,关键看其能否早期血管化并和周围组织建立血供。如果错过了这一个关键期,血管新生的速度和效率就会显著降低,从而影响骨修复重建的速度[42]。
目前,常用单独或联合应用促血管生成生长因子[21-23]达到促进血管化的目的,但存在很多问题[30,31]:(1)细胞因子与材料复合制备时,往往造成其生物活性显著下降;(2)体内易扩散或被蛋白酶降解,半衰期短,作用于靶细胞的时间受限;(3)局部含量不易调控,低含量因子作用效果十分有限,而高含量可能导致变形的、无功能的血管生成,有潜在的致瘤性。为了解决临界性骨缺损部位血管化速度和程度缓慢的问题,促进血管网络在生物支架表面、内部及周围尽早重建,基因修饰生物支架诱导血管化是骨再生的有效方法之一,其血管化程度是决定和制约骨修复效率的关键环节。基于多模态双光子-光声显微成像技术可以从分子与细胞层面实现骨组织支架血管发生、发展过程的动态监测。本研究通过静电吸附和低温冷冻方法制备慢病毒介导基因修饰促血管化的多孔 PLGA/nHAp 功能性支架,实现生长因子 PDGF-BB 在内源性细胞中原位、持续表达,诱导体内 MSCs、成骨前体细胞、内皮祖细胞的增殖、迁移、分化,促使血管生成贯穿于整个骨再生过程。
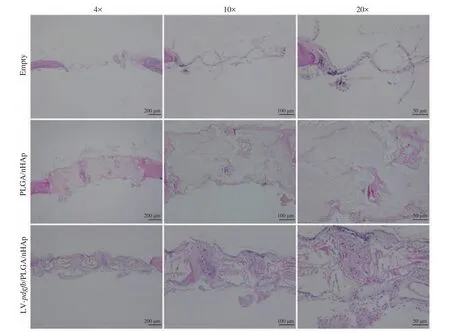
图9 术后 8 周骨缺损部位组织切片苏木精-伊红(HE)染色Fig. 9 Histological analysis of tissue regeneration in bone defect areas at 8 weeks post-implantation
在骨缺损修复的过程中,骨再生和血管生成是两个相互协调的作用过程。从时间和空间尺度同步分析骨生成和血管生成之间的关联作用,是研究骨修复的重要内容,而传统的技术手段和成像条件难以实时、在体地达成此研究目的[35,36]。以往对组织工程骨血管化程度进行监测主要采用 X-线片光密度测定、ECT、CT灌注成像、MRI 灌注成像和经典的组织学方法——血管免疫组化检查等。但这些方法均存在一定的缺陷[35,43]:(1)X-线片光密度测定不能对组织工程骨的血管化进行早期监测,灵敏度差,存在射线辐射情况;(2)ECT 需要使用放射性药物,对实验动物尚能使用检查,但对于临床应用的病人难以接受;(3)CT 灌注成像、MRI 灌注成像对设备要求条件较高、操作较复杂、检查所需时间较长、需要注射对比剂、分辨率低、检查成本较高;(4)组织学方法需要制作病理切片,耗时较长,且需要使用抗体,费用昂贵,对于实验动物需要处死取出样本观察,而对于病人患者则会引起局部的创伤疼痛。为了解决监测和定量组织工程骨血管化过程存在的难题,本研究以小鼠顶骨临界性骨缺损为模型,利用多模态双光子-光声显微成像技术在体、实时、连续、无创地监测,研究骨修复过程中多孔 PLGA/nHAp 支架血管化发生、发展的动态过程,并阐明该功能性支架植入体内后调控内源性细胞促成骨、成血管的偶联作用机制。
5 结 论
本文以慢病毒介导基因修饰多孔 PLGA/nHAp 支架诱导血管生成在骨修复中的作用为研究对象,采用静电吸附和低温冷冻方法制备基因修饰多孔 PLGA/nHAp 支架,并在体外进行长达5 天的病毒缓释的生物活性研究;并以小鼠顶骨临界性骨缺损为动物模型,进行体内血管再生研究。研究结果表明,慢病毒介导的基因修饰多孔PLGA/nHAp 骨组织支架,可以实现 PDGF-BB因子原位表达,促进局部、远处干细胞等细胞迁移,加快诱导血管生成从而提高骨缺损部位骨组织的再生能力。此外,本文成功使用并比较了多模态双光子及光声显微成像技术在体、实时、连续监测 3D 骨组织支架内血管形成的动态变化过程,并验证了基因修饰对于提高 3D 打印支架的生物学反应性的作用。本研究为研究不同支架对血管生成作用的监测与鉴定提供了新的技术手段。
[1]俞兴. 仿生组织工程骨的研制与开发 [J]. 中国科技成果, 2011, 12(7): 9.
[2]Jakoi AM, Iorio JA, Cahill PJ. Autologous bone graft harvesting: a review of grafts and surgical techniques [J]. Musculoskeletal Surgery, 2015,99(3): 171-178.
[3]Nauth A, Lane J, Watson JT, et al. Bone graft substitution and augmentation [J]. Journal of Orthopaedic Trauma, 2015, 29(Supplement 12):S34-S38.
[4]赵文博, 张智, 阳波, 等. 异种骨移植与大段骨缺损修复现状及研究进展 [J]. 现代临床医学, 2016,42(4): 245-248.
[5]Ward BB, Brown SE, Krebsbach PH.Bioengineering strategies for regeneration of craniofacial bone: a review of emerging technologies [J]. Oral Diseases, 2010, 16(8): 709-716.
[6]Ortolani A, Bianchi M, Mosca M, et al. The prospective opportunities offered by magnetic scaffolds for bone tissue engineering: a review [J].Joints, 2016, 4(4): 228-235.
[7]Khademhosseini A, Vacanti JP, Langer R. Progress in tissue engineering [J]. Scienti fi c American, 2009,300(5): 64-71.
[8]Kunjachan V, Subramanian A, Hanna M, et al.Comparison of different fabrication techniques used for processing 3-dimensional, porous,biodegradable scaffolds from modified starch for bone tissue engineering [J]. Biomedical Sciences Instrumentation, 2004, 40: 129-135.
[9]Sachlos E, Czernuszka JT. Making tissue engineering scaffolds work. review: the application of solid freeform fabrication technology to the production of tissue engineering scaffolds [J]. European Cells &Materials, 2003, 5(5): 29-39, 39-40.
[10]Wust S, Muller R, Hofmann S. Controlled positioning of cells in biomaterials-approaches towards 3D tissue printing [J]. Journal of Functional Biomaterials, 2011, 2(3): 119-154.
[11]Ma PX. Scaffolds for tissue fabrication [J].Materials Today, 2004, 7(5): 30-40.
[12]Janik H, Marzec M. A review: fabrication of porous polyurethane scaffolds [J]. Materials Science & Engineering: C, Materials for Biological Applications, 2015, 48: 586-591.
[13]Mitsouras D, Liacouras P, Imanzadeh A, et al.Medical 3D printing for the radiologist [J].Radiographics: a Review Publication of the Radiological Society of North America, Inc., 2015,35(7): 1965-1988.
[14]Dawood A, Marti B, Sauret-Jackson V, et al. 3D printing in dentistry [J]. British Dental Journal,2015, 219(11): 521-529.
[15]Ho CM, Ng SH, Li KH, et al. 3D printed micro fl uidics for biological applications [J]. Lab on a Chip, 2015, 15(18): 3627-3637.
[16]党莹, 李月, 李瑞玉, 等. 骨组织工程支架材料在骨缺损修复及 3D 打印技术中的应用 [J]. 中国组织工程研究, 2017, 21(14): 2266-2273.
[17]金灿, 陈振琦. 应用 3D 打印技术制作组织工程支架: 修复骨缺损的研究回顾 [J]. 中国组织工程研究, 2017, 21(10): 1611-1616.
[18]Hannink G, Arts JJ. Bioresorbability, porosity and mechanical strength of bone substitutes: what is optimal for bone regeneration? [J]. Injury, 2011, 42(Supplement 2): S22-S25.
[19]Sheikh Z, Drager J, Zhang YL, et al. Controlling bone graft substitute microstructure to improve bone augmentation [J]. Advanced Healthcare Materials, 2016, 5(13): 1646-1655.
[20]Colton CK. Implantable biohybrid arti fi cial organs[J]. Cell Transplantation, 1995, 4(4): 415-436.
[21]Bao XG, Zhu LJ, Huang XD, et al. 3D biomimetic artificial bone scaffolds with dual-cytokines spatiotemporal delivery for large weight-bearing bone defect repair [J]. Scientific Reports, 2017,7(1): 7814.
[22]Duan X, Bradbury SR, Olsen BR, et al. VEGF stimulates intramembranous bone formation during craniofacial skeletal development [J]. Matrix Biology: Journal of the International Society for Matrix Biology, 2016, 52-54: 127-140.
[23]Barati D, Shariati SRP, Moeinzadeh S, et al. Spatiotemporal release of BMP-2 and VEGF enhances osteogenic and vasculogenic differentiation of human mesenchymal stem cells and endothelialcolony-forming cells co-encapsulated in a patterned hydrogel [J].Journal of Controlled Release: Official Journal of the Controlled Release Society, 2016, 223:126-136.
[24]Caplan AI, Correa D. PDGF in bone formation and regeneration: new insights into a novel mechanism involving MSCs [J]. Journal of Orthopaedic Research: Official Publication of the Orthopaedic Research Society, 2011, 29(12): 1795-1803.
[25]Xie H, Cui Z, Wang L, et al. PDGF-BB secreted by preosteoclasts induces angiogenesis during coupling with osteogenesis [J]. Nature Medicine,2014, 20(11): 1270-1278.
[26]Lienemann PS, Devaud YR, Reuten R, et al.Locally controlling mesenchymal stem cell morphogenesis by 3D PDGF-BB gradients towards the establishment of an in vitro perivascular niche[J]. Integrative Biology: Quantitative Biosciences from Nano to Macro, 2015, 7(1): 101-111.
[27]Phipps MC, Xu YY, Bellis SL. Delivery of plateletderived growth factor as a chemotactic factor for mesenchymal stem cells by bone-mimetic electrospun scaffolds [J]. PloS One, 2012, 7(7):e40831.
[28]Dohle E, Fuchs S, Kolbe M, et al. Comparative study assessing effects of sonic hedgehog and VEGF in a human co-culture model for bone vascularisation strategies [J]. European Cells &Materials, 2011, 21: 144-156.
[29]Andrae J, Gallini R, Betsholtz C. Role of plateletderived growth factors in physiology and medicine[J]. Genes & Development, 2008, 22(10): 1276-1312.
[30]Singh K, Ahmadinia K, Park DK, et al.Complications of spinal fusion with utilization of bone morphogenetic protein: a systematic review of the literature [J]. Spine, 2014, 39(1): 91-101.
[31]Nguyen LH, Annabi N, Nikkhah M, et al.Vascularized bone tissue engineering: approaches for potential improvement [J]. Tissue Engineering Part B, Reviews, 2012, 18(5): 363-382.
[32]Uchida E, Igarashi Y, Sato Y. Collaborative study on regulatory science for facilitating clinical development of gene therapy products for genetic diseases [J]. Kokuritsu Iyakuhin Shokuhin Eisei Kenkyujo Hokoku=Bulletin of National Institute of Health Sciences, 2014(132): 10-12.
[33]Shin S, Shea LD. Lentivirus immobilization to nanoparticles for enhanced and localized delivery from hydrogels [J]. Molecular Therapy: the Journal of the American Society of Gene Therapy, 2010,18(4): 700-706.
[34]Ramasamy SK, Kusumbe AP, Wang L, et al.Endothelial notch activity promotes angiogenesis and osteogenesis in bone [J]. Nature, 2014,507(7492): 376-380.
[35]Guldberg RE, Duvall CL, Peister A, et al.3D imaging of tissue integration with porous biomaterials [J]. Biomaterials, 2008, 29(28): 3757-3761.
[36]Anzidei M, Lucatelli P, Napoli A, et al. CT angiography and magnetic resonance angiography fi ndings after surgical and interventional radiology treatment of peripheral arterial obstructive disease [J]. Journal of Cardiovascular Computed Tomography, 2015, 9(3): 165-182.
[37]Majewska AK. Imaging visual cortical structure and function in vivo [J]. Journal of Glaucoma, 2013,22( Suppl 5): S21-S23.
[38]Wu D, Huang L, Jiang MS, et al. Contrast agents for photoacoustic and thermoacoustic imaging a review [J]. International Journal of Molecular Sciences, 2014, 15(12): 23616-23639.
[39]Berg PJVD, Daoudi K, Steenbergen W. Review of photoacoustic fl ow imaging its current state and its promises [J]. Photoacoustics, 2015, 3(3): 89-99.
[40]Kutner RH, Zhang XY, Reiser J. Production,concentration and titration of pseudotyped HIV-1-based lentiviral vectors [J]. Nature Protocols, 2009,4(4): 495-505.
[41]Boehler RM, Shin S, Fast AG, et al. A PLG/HAp composite scaffold for lentivirus delivery [J].Biomaterials, 2013, 34(21): 5431-5438.
[42]Kalfas IH. Principles of bone healing [J].Neurosurgical Focus, 2001, 10(4): E1.
[43]Anzidei M, Lucatelli P, Napoli A, et al. CT angiography and magnetic resonance angiography fi ndings after surgical and interventional radiology treatment of peripheral arterial obstructive disease [J]. Journal of Cardiovascular Computed Tomography, 2015, 9(3): 165-182.

