生物打印技术在组织与器官修复中的应用进展
吴明明 林子锋 程德林 潘浩波 阮长顺
(中国科学院深圳先进技术研究院 人体组织与器官退行性研究中心 深圳 518055)
1 引 言
组织和器官病变、创伤和正常生理功能衰竭是人类医学面临的最棘手的问题之一,也是引起人类疾病和死亡的重要原因,严重危害着人类的健康和生活质量。临床统计数据显示,美国每年用于器官及组织损伤患者身上的资金高达 4 000多亿美元,几乎占全美国医疗费用的一半[1]。美国医院每年能完成 800 万例次组织移植手术,但并不能保证成功挽救每一条生命或避免残疾。此外,每年大约有 4 000 人在等待合适的器官时死亡,近 10 万人在未被列入等待器官移植时就已死亡。可见,组织或器官缺损的修复和功能重建是现代医学领域所面临的亟待解决的重大挑战。传统的组织工程方法是细胞经体外增殖后接种到支架材料上,构成“支架+细胞”的复合体,体外培养一定时间后植入到患者体内,随着生物材料在体内的逐渐降解和吸收,植入细胞在体内不断地增殖分化并分泌细胞外基质,最终形成相应的组织或器官,从而达到组织或器官修复和功能重建的目的。在过去几十年的发展中,组织工程取得了长足的进步,但传统方法如溶液浇铸/粒子沥出法[2,3]、热致相分离法[4,5]和静电纺丝法等不能有效地控制孔径、孔隙率以及构造有序贯通的网络结构,且可重复性差[6,7]。而三维打印技术通过计算机辅助设计(Computer Aided Design,CAD)建模能够精确地控制打印物的外型和内部结构[8],它的出现使得多孔支架的设计与构建得到突飞猛进的发展。
三维打印构建支架方法主要有熔融沉积技术(FDM)[9]、选择性激光烧结技术(SLS)[10]和光固化成型技术(SLA)[11]等。其优点是可自由设计支架的三维结构,通过调整成型参数,获得多变可控的机械强度、精确的外形尺寸、内部完全贯通的预血管化网络以及可控的孔隙率[12]。虽然使用这些技术构建结构仿生的组织工程支架取得了令人称赞的结果,但这些技术的成型条件苛刻,如高温、紫外光照及有机溶剂等,不利于生长因子甚至细胞参与支架的构建。而且种植于支架的细胞往往游离在支架表面,难以长入支架内部,分布也不均匀,容易团聚[13]。如何将细胞精确有序地排布在三维支架上,实现自然组织结构和功能,一直是限制组织工程发展的科学问题之一。自 2009 年以来,热门技术“三维生物打印(Three-Dimensional Bio-Printing,Bio-3DP)”快速发展,有望突破传统组织工程方法中细胞无法长入且分布不均的瓶颈[14,15]。将快速成型技术和生物制造技术的有机结合,突破了传统组织工程技术空间分辨率低的局限性,可精确控制细胞在支架材料中的定点分布,微观上构建具有适合细胞生存的微环境,为细胞提供了真正的三维均衡生长环境,使得复杂组织和器官的体外再造成为可能[16]。
2 生物打印技术
美国克莱姆森大学的 Thomas Boland 教授在2000 年首次提出“三维生物打印(Bio-3DP)”的概念[17]。生物打印是指能够将细胞、生长因子和支架结合在一起形成一个完整的整体结构,同时能够实现不同类型的细胞在支架内部的准确定位,通过细胞、生长因子以及支架之间的相互作用,实现组织功能化。因此,三维生物打印被认为是现代组织工程中最有发展潜力的技术,相应流程图及潜在应用见图1。三维生物打印技术通过改进原有传统的 3D 打印技术,以及对打印墨水进行优化,能够在室温常态下进行 3D 打印,从而提高了生长因子的活性和细胞相容性。与传统的组织工程技术相比,生物打印技术有诸多优势:(1) 能够快速构建出宏观以及微观结构仿生的组织工程支架;(2) 构建二维或三维的“多细胞/材料”体系,在组织成分和细胞构成上更接近天然组织;(3)可以精确地控制细胞和材料在时间和空间上的分布;(4)构建仿生的细胞外基质环境等。目前生物打印技术主要包括挤出式、喷墨式和激光辅助三种(图2)。

图1 生物打印的流程及潜在应用Fig. 1 Bioprinting process and potential application

图2 普通的三维打印和生物打印技术Fig. 2 Normal 3D print and bioprinting techniques
2.1 挤出式生物打印
挤出成型是将流体沉积技术与自动化三维打印技术相结合,通过挤压技术实现材料的三维结构打印。根据流体沉积系统驱动力的不同,该三维生物打印方式可分为 3 种:气压驱动、机械驱动(活塞或螺杆)和螺线管驱动。目前应用较多的是气压驱动和活塞驱动的方法。挤出成型常用的材料为剪切变稀水凝胶。随着施加压力的增大,水凝胶的黏度降低,能够从针头处挤出[18]。挤出方式可以分为直接挤出成型和间接挤出成型。其中,直接挤出生物打印为对含细胞的生物墨水进行外部加压,从而挤出细纤维并沉积于接收平台。Zhang 等[19]使用同轴的针头将海藻酸直接挤出成型,得到了管状支架。同轴针头的内通道挤出含脐带血管平滑肌细胞的海藻酸,外通道为氯化钙溶液,在挤出海藻酸水凝胶的同时对其进行交联固化;细胞培养 7 天后的生存率仍然高达84%,具有很好的应用前景。挤出式打印更有利于控制支架的孔隙结构,Luo 等[20]制备了海藻酸和聚乙烯醇复合生物墨水,在常温常压下制得孔隙率可控以及具有多级孔结构的支架,通过控制孔隙率能够调整支架的力学性能以及活性因子的释放速率。间接挤出生物打印是将含细胞的打印材料挤出于另一种基质材料中,随后去除打印材料和固化基质材料,在基质材料中得到了细胞均匀分布的管道。Bertassoni 等[21]将含成骨细胞的甲基丙烯酰胺化明胶作为基质材料,打印琼脂糖于基质材料中,随后对基质材料进行紫外光交联固化并去除琼脂糖。该方法在基质材料中得到了管状网络,提高了物质的传输和细胞的活性。
2.2 喷墨生物打印
在喷墨生物打印中,生物墨水的成分为培养基或者水凝胶,以液滴的形式精确地打印在接收平台的凝胶基质上,随后固化[22]。每个液滴中包裹少量细胞,液滴的驱动模式主要有热驱动和压电驱动[23,24]。其中,热驱动通过加热针头产生气泡,气泡破裂的压力驱动液滴挤出针头。Cui 和 Boland[23]将人微血管内皮细胞悬浮于含凝血酶和钙离子的培养基,热驱动喷墨打印于纤维蛋白原的通道中,最终打印的细胞在通道中取向排列。结果表明,该方法有利于促进内皮细胞的增殖和微血管的形成。Xu 等[25]利用压电驱动的喷墨打印技术,将海藻酸生物墨水打印于氯化钙溶液中。其中,氯化钙溶液除了作为离子交联剂还可以提供浮力,从而作为支撑材料。利用这一方法,成功得到了分叉状的血管支架,细胞的存活率高达 90%[26]。
2.3 激光辅助生物打印
除了喷墨和基于挤出的打印技术之外,光辅助生物打印平台也越来越多地被用于细胞印刷和组织工程应用。激光辅助生物打印可分为两个类别,一是激光导致局部射流形成的细胞打印,二是过程涉及光聚合的成型技术。前者使用激光对生物墨水进行局部加热,形成高压气泡,导致射流形成[27]。射流的粗细与激光能量、生物墨水黏度和接收平台的距离等因素有关,接收平台通常覆盖着凝胶材料,打印过程中实现热交联或者离子交联。后者使用细胞相容性较好的光敏聚合物作为打印材料,通过紫外光交联的形式精确控制交联区域,得到精确度较高的三维打印支架。Ovsianikov 等[28]使用聚乙二醇二丙烯酸酯作为打印材料,利用双光子聚合的方法制备了三维支架,并使用激光诱导射流在支架上进行细胞打印。荧光照片结果显示,平滑肌细胞和内皮细胞区域具有明显的过渡,精确地控制了细胞在支架上的密度和位置。
3 生物墨水
在人工组织或器官制造过程中,生物墨水主要承担了构建三维结构和重建组织的功能,即让活体细胞按照预先设计好的形状来生长。因此,生物墨水合适与否直接决定生物三维打印技术能否应用于临床[29]。尽管金属、无机物(羟基磷灰石、磷酸三钙、生物活性玻璃)、高分子聚合物等已经被广泛地应用于三维打印技术中,但与这些传统的三维打印支架不同的是,三维细胞打印技术需要将细胞与被打印材料均匀地混合在一起,故打印材料必须具备可打印性和可交联性,同时还需具备良好的生物相容性和必要的力学性能[30,31]。典型的生物墨水由水凝胶的前驱体溶液和细胞组成。其中,水凝胶与细胞直接接触,不仅对细胞提供了三维力学支撑,还决定了细胞所处的微化学和物理环境,从而促进细胞的增殖和分化[32]。交联方式主要有两类:化学(pH、离子作用)和物理(光、电)交联。理想的生物墨水打印成型后需要具备类似于天然细胞外基质的结构[33],材料的差异导致交联后力学性能也存在差异,这也决定了该三维支架的应用位置,如骨、软骨、皮肤、心脏等。目前研究常用的材料如表1 所示。
3.1 胶原
胶原是动物体内数量最多的蛋白,是所有连接组织和细胞外基质的成分之一[34]。胶原最常见的来源是鼠尾、牛皮肤和跟腱,具有很好的生物相容性和较低的免疫原性,是组织工程最为常用的材料之一[35]。Ⅰ型胶原中含有的氨基酸 RGD 序列可以与整联蛋白受体相结合,不仅可以调控细胞与细胞外基质间的相互作用,还可用做信号转换器,激活细胞内信号通路等。胶原作为天然的生物材料也被应用于 3D 打印领域,但胶原具有温度敏感性,在大多数灭菌过程中容易发生降解,因此胶原支架往往需要交联或与其他材料复合使用。Yeo 等[36]使用同轴挤出生物打印技术制备了胶原和人成骨肉瘤细胞为内层、海藻酸为外层的核壳支架,获得的细胞活性高达(92±3)%;对照组为含人成骨肉瘤细胞的海藻酸支架且细胞活性为(83±4)%。结果表明,当海藻酸作为外层支撑材料时,内层的胶原更有利于保持细胞活性。另一组实验证明使用该支架载人脂肪干细胞,具有更好的诱导其向成肝组织分化的能力。同样地,Ashwini 等[37]也制备了以胶原为核层、海藻酸为壳层的支架,经过京尼平交联后,支架具有更好的力学性能。Koch 等[38]利用激光生物打印的方法制备了含成纤维细胞和角质细胞的胶原支架,并用于皮肤组织工程修复。该实验采用分层打印的支架模拟天然皮肤组织细胞的分布情况,细胞实验表明该支架具有较好的细胞相容性。Xu 等[39]配置了含平滑肌细胞的重组胶原蛋白溶液,使用喷墨生物打印制备了生物芯片,细胞的活性高达 94%。Daniela 等[40]使用喷墨生物打印制备了含间充质干细胞的胶原-琼脂糖支架,在培养 21 天后细胞存活率高达99%。虽然胶原具有较好的生物相容性,但胶原难以形成黏度合适的搭载细胞的生物墨水,支架强度低且对金属蛋白酶非常敏感,需要进一步地探索以胶原为核心的复合生物墨水。
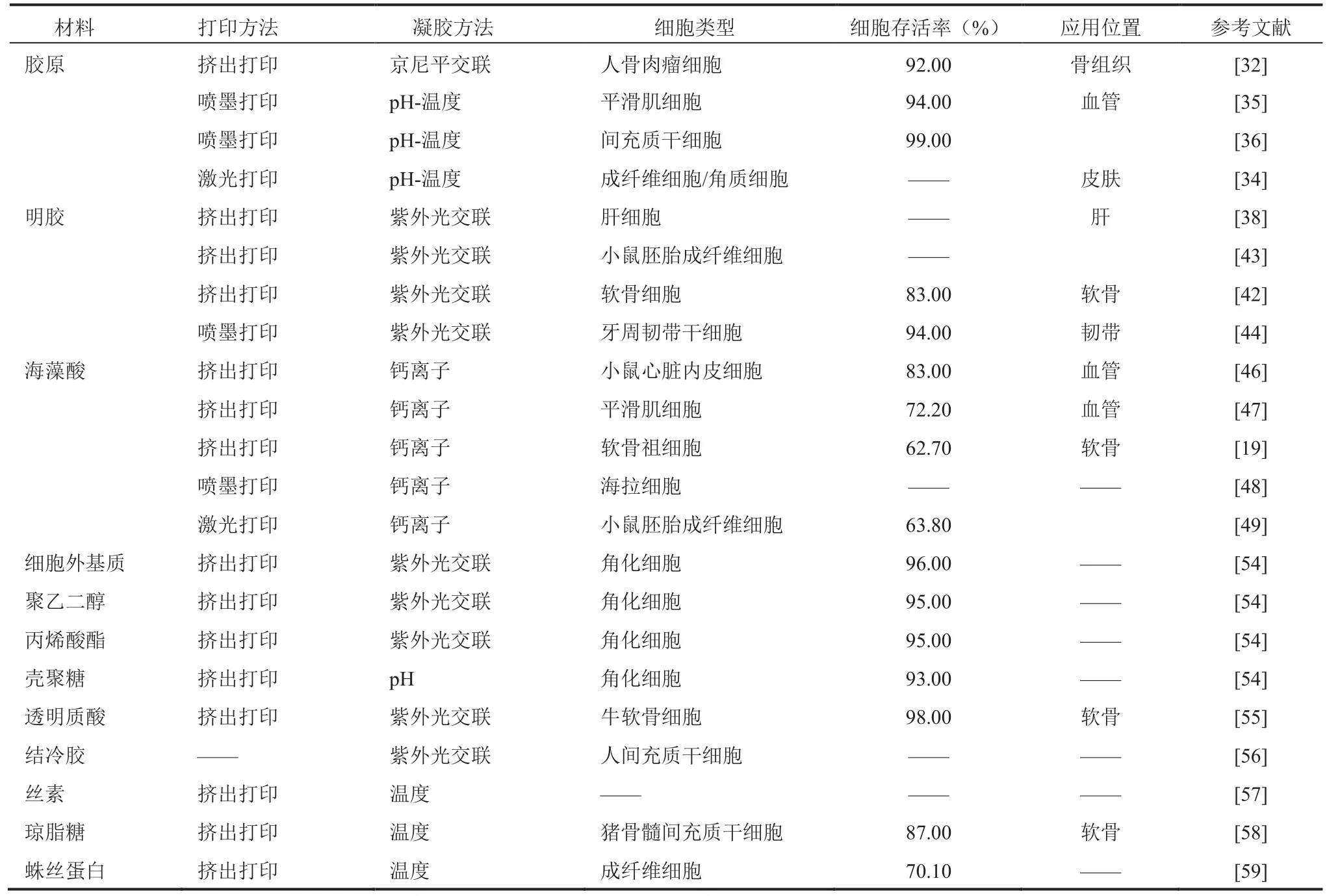
表1 构建生物墨水常用材料Table 1 Materials for construction of bioink
3.2 明胶
明胶作为胶原的水解产物,具有很好的生物相容性、高吸水率且无免疫原性,同时明胶在体温下具有流动性,在低温下形成的凝胶能够很好地悬浮细胞[41,42]。Yan 等[43]采用明胶和壳聚糖复合体系与肝脏细胞混合悬浮后,经三维打印成型构建了具有肝脏组织结构的活性支架体系,最后通过戊二醛交联固定成型。然而,明胶与壳聚糖组成的凝胶作为支架的骨架材料,力学强度较低,容易塌陷。尽管凝胶体系形状固定率经戊二醛交联后有显著提高,且支架形态孔隙保持完好,但戊二醛的使用又会降低支架的生物相容性。基于明胶的这种特性,纯明胶通常被用做三维打印中的牺牲材料,即随着打印后培养时间的延长,明胶逐渐溶于培养基中并在三维支架中形成通道,该通道有利于氧气以及营养物质的传输,从而有利于细胞的生存、增殖甚至分化。为了保留明胶原有的生物相容性同时提高力学强度,对明胶进行改性并使用紫外光交联吸引了大量研究者关注[44-47]。Schuurman等[48]合成了甲基丙烯酰胺化的明胶,包裹软骨细胞并用于挤出生物打印。支架打印完成后使用紫外光交联 15 min,一天后细胞活性维持在(83±13)%,三天后细胞活性降至(73±2)%。复合了透明质酸和明胶甲基丙烯酰胺的生物墨水对细胞活性的维持得更好,在三天后细胞活性仍然有(82±8)%。Skardal 等[49]将明胶甲基丙烯酰胺和透明质酸-甲基丙烯酰胺作为生物墨水,分别搭载了人肝癌细胞、正常肠上皮细胞和小鼠胚胎成纤维细胞,细胞实验结果表明均具有较高的细胞活性。Ma 等[50]使用喷墨打印了含牙周韧带干细胞的明胶甲基丙烯酰胺-聚乙二醇二甲基丙烯酸阵列,并使用紫外光交联 30 s,细胞活性高达94%。进一步的研究需要聚焦在缩短紫外光交联时间,同时提高支架的力学性能,使其符合临床标准。
3.3 海藻酸
海藻酸是由古罗糖醛酸和甘露糖醛酸组成的天然存在的、无毒的、可生物降解的和非免疫原性的线性多糖[51]。海藻酸盐最常用的凝胶成型方式就是在三维打印后采用氯化钙(CaCl2)溶液作为螯合剂引发海藻酸盐交联固化,同时这一方法也能较好地保持打印后支架的生物相容性,因此被广泛用于三维生物打印[52]。Khalil 和 Sun[53]通过挤出三维打印和钙离子交联得到了搭载鼠心脏内皮细胞的海藻酸支架,细胞具有较高的活性,达 83%。为了进一步增强海藻酸支架的力学性能,Dolati 等[54]在海藻酸浆料中加入碳纳米管,并用来搭载平滑肌细胞。结果显示,支架的弹性模量得到了显著性的提高,同时细胞的活性没有受到太大影响,复合了碳纳米管的支架细胞活性下降至 72.2%(相对于对照组的 75.6% 并没有显著差异)。Luo 等[55]在以海藻酸作为基质材料,掺杂生物活性玻璃制备骨修复支架。生物活性玻璃中的二价离子能提高海藻酸的打印稳定性,支架具有更优异的力学性能以及促进干细胞成骨分化的能力。Zhang 等[19]设计了微流体装置,外层流通含软骨祖细胞的海藻酸溶液,内层流通氯化钙交联溶液,通过挤出打印制备了管状结构的海藻酸支架。该管内径约为 186 μm,适合用于微血管组织工程,细胞平均生存率为 62.7%。基于压电驱动的喷墨生物打印,Arai 等[56]制备了含海拉细胞的海藻酸支架:通过液滴逐层堆积形成金字塔型后进行活死染色。结果显示,每层的细胞生存率均较高。Xiong 等[57]使用激光三维生物打印技术制得搭载小鼠成纤维细胞的海藻酸支架,该支架设计为直管状和“Y”型,并使用钙离子进行物理交联。结果显示,打印后细胞的活性为 63.8%,培养一天后细胞的存活率上升至 68.2%。虽然钙离子能够快速交联海藻酸支架,但在生理环境下容易和钠离子发生置换,从而导致支架的降解和后续力学性能的下降。而且只有在海藻酸钠浓度较低时,细胞打印的存活率才能有效提高,而此时获得的支架力学强度较差。另外,由于纯海藻酸钠支架具有良好的亲水性特点,细胞很难在材料内部相互作用、增殖甚至分化。因此,对海藻酸钠进行改性,如氧化海藻酸钠,或者修饰 RGD 多肽以及胶原等[58],来改善细胞在海藻酸钠支架上的黏附、伸展以及增殖情况,成为目前用海藻酸钠进行三维细胞打印的趋势。
3.4 其他
其他具有较好生物相容性的材料也被广泛应用于三维生物打印领域。Murphy 等[59]对各类凝胶的可打印性和生物相容性进行研究。结果发现,细胞外基质构建的凝胶和可光交联的细胞外基质凝胶具有最好的细胞活性,分别高达 97%和 96%;而聚乙二醇丙烯酸酯凝胶的细胞活性下降至 95%;壳聚糖凝胶由于使用乙酸溶解,其细胞活性最低,为 93%。甲基丙烯酸酯化这一方法使得很多材料能够用于三维生物打印。Kesti 等[60]将透明质酸和硫酸软骨素功能化,分别制备了可光交联的甲基丙烯酸酯化透明质酸、甲基丙烯酸酯化硫酸软骨素和热敏性的聚(N-异丙基丙烯酰胺)化透明质酸。结果显示,牛软骨细胞在聚(N-异丙基丙烯酰胺)化透明质酸生物墨水中的存活率最高,为 98%,优于甲基丙烯酸酯化透明质酸。而甲基丙烯酸酯化硫酸软骨素不利于细胞黏附,细胞培养一段时间后从凝胶中脱落。其他材料,如丝素、琼脂糖、结冷胶等也逐渐有研究者将其用于制备生物墨水[61-63]。Schacht等[64]制备了蛛丝蛋白生物墨水,细胞存活率较低,仅为 (70.1±7.6)%。但该生物墨水不需要其他材料辅助成型和后续交联处理,同时蛛丝蛋白也促进了细胞在支架中的黏附。由上述可知,单一生物墨水的限制性较大。因此,为了满足更多的性能需求,构建复合型的生物墨水是目前三维生物打印的发展趋势之一。
4 三维生物打印趋势
三维打印技术在制备组织工程支架中具有无可比拟的优势。其中,生物打印技术可将细胞精确排布于支架的内部,为细胞提供了类似细胞外基质的生长环境,使得复杂组织和器官的体外培育成为可能。虽然在过去 10 年间取得了很多的研究成果,但生物打印技术和生物墨水的构建尚有很大的提升空间。
4.1 打印技术的提升
与传统的三维打印技术相比,三维生物打印技术具有明显的优势,但也存在需要提升的方面,具体见表2。挤压式三维生物打印技术打印速度较快,易于实现大规模打印。除了常规载有细胞的凝胶以及细胞聚集体外,挤出式还能打印载有细胞的微球以及细胞外基质。细胞密度可控,即使打印墨水中的细胞密度较高,也不会造成碰头堵塞的情况。挤出式打印过程对细胞造成的损伤较小,是目前使用最为广泛的方法。但该打印方式的精度较差,最小打印尺寸仅可控制在100 μm 左右。因此,细胞在精准定位方面存在一定的误差;对生物墨水的要求也较高,不仅具有剪切变稀的特性,还需要在线条打印出来后能够迅速成型。使用喷墨式打印技术得到的细胞活性较高且成本较低,但无法打印黏度较高的生物墨水,细胞在培养液中的分散程度也不可控,而且效率较低。挤出和喷墨生物打印机在简单性、灵活性和低成本方面具有独特的优势。然而,这两种方法也有局限性。首先,由于剪切应力和用于输送生物油墨的喷嘴的小孔直径,这两种方法都存在细胞损伤和死亡以及细胞沉淀和聚集[65]。此外,打印分辨率受到喷嘴的物理限制,打印结构的完整性也是另一个障碍。因此,主要挑战是在保持细胞活力和打印速度的同时又能降低压力或者减小喷嘴尺寸。激光辅助的生物打印虽然解决了生物墨水的黏度限制,分辨率也提高至 5 μm,但也同样存在着效率较低的问题。此外,激光容易损伤细胞,且该方法不利于多种细胞的混合打印,效率也较低。
打印技术的提升主要体现在提升打印的精度、提高搭载细胞的活性以及加大效率。基于挤出式的打印方式和静电纺丝技术,发展出熔融3D 电纺打印技术[66-68],极大地缩小了打印丝束的尺寸,但不利用结合细胞进行生物打印。通过设计新的辅助打印模块,有希望在进一步提高挤出式打印精度的同时保证细胞的存活。压电驱动的喷墨方式降低了热驱动可能的局部高温对细胞活性的影响,进一步提升压电驱动器的性能使其更加适用于黏度较大的材料是研究方向之一。对生物墨水采取屏蔽的措施来降低激光的损伤,使用多束激光和梯度化的生物墨水有希望提高激光辅助打印的效率和解决细胞单一的问题[28]。
三维打印支架虽然在宏观尺度上满足了个性化组织工程的需求,但支架内部的结构对整体力学性能以及调控细胞行为上有着重要的意义。Schacht 等[64]研究了三维打印支架内部的结构对性能的影响,通过对结构的调控可以调节支架的孔隙率、比表面积和力学性能等,从而进一步在微观尺度上模拟天然的骨组织[69]。
4.2 复合型生物墨水
单一材料构成的生物墨水在可打印性、可交联性、力学性能和诱导干细胞增殖分化等方面往往难以满足组织和器官打印的要求。且与打印技术相比,生物墨水的组成对支架的成型和性能至关重要。因此,目前的研究重心在于研究各方面性能更好的生物墨水。

表2 不同生物打印技术的优缺点Table 2 Advantage and disadvantage of different bioprinting technology
胶原与纤维蛋白复合的生物墨水具有可控的黏度、更短的凝胶时间和忽略不计的支架收缩率[59,70]。种植于其上的角质细胞显示出更快的增殖速率,而种植间充质干细胞的移植物具有更好的伤口愈合率和血管化程度。胶原、海藻酸和细胞外基质组成的混合生物墨水通过海藻酸与钙离子结合快速交联成型,而胶原显著地提高了支架的细胞相容性,细胞外基质成分提高了支架的力学性能[71]。相对于天然生物材料,人为设计的生物相容性聚合物水凝胶具有更好的力学性能和交联性能。N-丙烯酰基甘氨酰胺单体具有快速光交联的特性,通过复合黏土颗粒的三维打印支架被应用于骨组织修复。该支架具有很好的应变恢复性能和高度稳定性,同时黏土释放的镁硅离子有利于干细胞的成骨分化[32]。另有研究者使用双网络水凝胶作为生物墨水搭载细胞,不仅提高了水凝胶前驱体的黏度使其适合打印,而且提高了交联成型之后的力学性能,支架的稳定性更高。Hong 等[72]将双键修饰的聚乙二醇与海藻酸钠混合,并将其应用于三维细胞打印中。结果显示,该双网络结构的水凝胶结合了聚乙二醇以及海藻酸钠两种水凝胶的优势,具有良好的力学性能,断裂能可达到 1 500 J/m2,同时细胞存活率在打印 7 天后可以达到(75.5±11.6)%。生物墨水最常搭载的细胞是间充质干细胞,其具有多向分化的能力,在不同的物理和化学因素诱导下能够实现定向分化[73]。因此,在应用于不同的组织和器官修复时往往需要考虑生物墨水构建的微环境对细胞的影响[74]。Gao 等[75]将纳米级的羟基磷灰石与二甲基丙烯酸修饰的聚乙二醇(PEG-MA)混合,并将其应用于人间充质干细胞的三维打印技术中,细胞存活率可以达到 80%,且纳米级羟基磷灰石的加入明显提高了三维支架的力学性能,纳米级羟基磷灰石作为骨的基础成分之一促进了人间充质干细胞向成骨细胞的分化。Lee 等[71]构建了聚己内酯作为支撑材料,接枝 RGD 多肽的海藻酸作为生物墨水的一体化支架,并用于椎体骨修复。结果显示,聚己内酯极大地提高了支架的压缩模量,接枝了 RGD 多肽促进了细胞在海藻酸凝胶内部的黏附[72,76]。除了在成分上对天然组织进行仿生外,细胞所处的三维支架微环境为细胞提供了适宜的力学和表面结构,在细胞增殖、分化和发挥细胞功能上起关键的作用[77-79]。Fattahi 等[80]用 3D 近场电纺技术制备了规整的聚甲基丙烯酸甲酯网络,并用胶原凝胶搭载人间充质干细胞,纤维的取向结构极大地影响了细胞的取向和铺展。多细胞相互作用也是目前的研究热点之一[81],基于同轴 3D 打印技术,Costantini等[82]成功构建了海藻酸和聚乙二醇/纤维蛋白原生物墨水,分别搭载成纤维细胞和成肌细胞。而Jang 等[83]对心脏组织脱细胞,构建了基于细胞外基质生物墨水,分别搭载心脏祖细胞和间充质干细胞/血管内皮生长因子。打印的支架空间结构增强了两种干细胞之间的相互交流,血管内皮生长因子促进了在体外的预先血管化作用,构建出适宜细胞增殖和分化的微环境。体内实验表明,该仿生支架增强了心肌的功能,减少心肌肥大和纤维化,同时促进了细胞往心肌梗死区域迁移。优秀的生物墨水必须具有可控的黏度,原料合成简易,且能够在常温常态下进行打印。同时还要提供适宜细胞增殖和分化微环境,从而构建功能完整的组织工程支架。
5 结论与展望
如何使细胞在打印后具有高存活率,并将其应用于组织或器官的修复和功能重建,仍面临着很多挑战。笔者认为以下两点至关重要:构建物质自由交换、保持细胞活性和结构稳定的生物墨水,以及在微观和宏观尺度上均对天然组织或器官进行结构上的仿生,从而诱导不同区域细胞的特向分化。在目前已发表的研究中,使用的生物墨水均取得了较高的细胞存活率,但仅有少数研究涉及到仿生的成分和结构对细胞行为的影响。生物墨水除了搭载细胞,其本身具有的仿生成分对细胞黏附、迁移、增殖和功能化等均具有很重要的意义。更进一步地,生物墨水凝胶后内部形成的凸起和沟槽等表面结构都能调控细胞的行为。针对不同的组织与器官,细胞对应的微环境也不尽相同。此外,选择用于生物打印的细胞种类以及细胞空间分布状态也均需要进一步研究。体内组织中的细胞是动态的,随时可对外界环境的刺激做出响应。如何构建合适的组织培养器,从而充分模拟体内组织与器官中细胞的生理状态,使得细胞自行进行重新分布,也是三维生物打印支架体外培养成熟的要点之一。
总之,生物打印功能化的组织和器官需要制造技术、材料科学、生物学和医学等多个领域跨学科交叉结合。整个打印系统工艺还需要进行生物安全性的评估和相应法规标准考核。通过生物打印实现组织或器官的修复和功能重建,是一项极具科学挑战的工作,需要广大科研工作者的不懈努力。
[1]Richard L. Tissue engineering: replacing damaged organs with new tissues [J]. Science News, 1995,148(2): 24-26.
[2]Kim TG, Chung HJ, Park TG. Macroporous and nanofibrous hyaluronic acid/collagen hybrid scaffold fabricated by concurrent electrospinning and deposition/leaching of salt particles [J]. Acta Biomaterialia, 2008, 4(6): 1611-1619.
[3]Huri PY, Ozilgen BA, Hutton DL, et al. Scaffold pore size modulates in vitro osteogenesis of human adipose-derived stem/stromal cells [J]. Biomedical Materials, 2014, 9(4): 045003.
[4]Mirmohammadi SA, Imani M, Uyama H, et al. International journal of polymeric materials and polymeric biomaterials 63: hybrid organicinorganic nanocomposites based on poly(epsiloncaprolactone)/polyhedral oligomeric silsesquioxane:synthesis and in vitro evaluations [J]. International Journal of Polymeric Materials and Polymeric Biomaterials, 2014, 63(12): 624-631.
[5]Zhao JH, Han WQ, Tu M, et al. Preparation and properties of biomimetic porous nanofibrous poly(L-lactide) scaffold with chitosan nanofiber network by a dual thermally induced phase separation technique [J]. Materials Science and Engineering: C, 2012, 32(6): 1496-1502.
[6]Samavedi S, Vaidya P, Gaddam P, et al. Electrospun meshes possessing region-wise differences in fi ber orientation, diameter, chemistry and mechanical properties for engineering bone-ligament-bone tissues [J]. Biotechnology and Bioengineering,2014, 111(12): 2549-2559.
[7]Deepthi S, Jeevitha K, Sundaram MN, et al.Chitosan-hyaluronic acid hydrogel coated poly(caprolactone) multiscale bilayer scaffold for ligament regeneration [J]. Chemical Engineering Journal, 2015, 260: 478-485.
[8]Peltola SM, Melchels FPW, Grijpma DW, et al. A review of rapid prototyping techniques for tissue engineering purposes [J]. Annals of Medicine,2008, 40(4): 268-280.
[9]Melnikova R, Ehrmann A, Finsterbusch K. 3D printing of textile-based structures by fused deposition modelling (FDM) with different polymer materials [C]// IOP Conference Series: Materials Science and Engineering, 2014: 012018.
[10]Trenke D, Müller N, Rolshofen W. Selective laser sintering of metal and ceramic compound structures[C]// Intelligent Production Machines and Systems,2nd I*PROMS Virtual International Conference,2006: 198-203.
[11]Amit JL, Eric M, Ryan BW. Integrating stereolithography and direct print technologies for 3D structural electronics fabrication [J]. Rapid Prototyping Journal, 2012, 18(2): 129-143.
[12]Do AV, Khorsand B, Geary SM, et al. 3D printing of scaffolds for tissue regeneration applications [J].Advanced Healthcare Materials, 2015, 4(12): 1742-1762.
[13]Jia J, Richards DJ, Pollard S, et al. Engineering alginate as bioink for bioprinting [J]. Acta Biomaterialia, 2014, 10(10): 4323-4331.
[14]Mandrycky C, Wang Z, Kim K, et al. 3D bioprinting for engineering complex tissues [J]. Biotechnology Advances, 2016, 34(4): 422-434.
[15]Gao GF, Cui XF. Three-dimensional bioprinting in tissue engineering and regenerative medicine [J].Biotechnology Letters, 2015, 38(2): 203-211.
[16]Kolesky DB, Truby RL, Gladman AS, et al. 3D bioprinting of vascularized, heterogeneous cellladen tissue constructs [J]. Advanced Materials,2014, 26(19): 2966.
[17]Pfister A, Landers R, Laib A, et al. Biofunctional rapid prototyping for tissue-engineering applications: 3D bioplotting versus 3D printing[J]. Journal of Polymer Science Part A: Polymer Chemistry, 2004, 42(3): 624-638.
[18]Fedorovich NE, Swennen I, Girones J, et al.Evaluation of photocrosslinked lutrol hydrogel for tissue printing applications [J]. Biomacromolecules,2009, 10(7): 1689-1696.
[19]Zhang YH, Yu Y, Ozbolat IT. Direct bioprinting of vessel-like tubular microfluidic channels [J].Journal of Nanotechnology in Engineering and Medicine, 2013, 4(2): 0210011-0210017.
[20]Luo YX, Luo GL, Gelinsky M, et al. 3D bioprinting scaffold using alginate/polyvinyl alcohol bioinks [J].Materials Letters, 2017, 189(Supplement C): 295-298.
[21]Bertassoni LE, Cecconi M, Manoharan V, et al.Hydrogel bioprinted microchannel networks for vascularization of tissue engineering constructs [J].Lab on a Chip, 2014, 14(13): 2202-2211.
[22]Datta P, Ayan B, Ozbolat IT. Bioprinting for vascular and vascularized tissue biofabrication [J].Acta Biomaterialia, 2017, 51: 1-20.
[23]Cui XF, Boland T. Human microvasculature fabrication using thermal inkjet printing technology[J]. Biomaterials, 2009, 30(31): 6221-6227.
[24]De Jos J, de Gerrit B, Reinten H, et al. Air entrapment in piezo-driven inkjet printheads [J].The Journal of the Acoustical Society of America,2006, 120(3): 1257-1265.
[25]Xu CX, Zhang ZY, Christensen K, et al. Freeform vertical and horizontal fabrication of alginate-based vascular-like tubular constructs using inkjetting [J].Journal of Manufacturing Science and Engineering,2014, 136(6): 061020.
[26]Christensen K, Xu CX, Chai WX, et al. Freeform inkjet printing of cellular structures with bifurcations [J]. Biotechnology and Bioengineering,2015, 112(5): 1047-1055.
[27]Desrus H, Chassagne B, Moizan F, et al. Effective parameters for fi lm-free femtosecond laser assisted bioprinting [J]. Applied Optics, 2016, 55(14): 3879-3886.
[28]Ovsianikov A, Gruene M, Pflaum M, et al.Laser printing of cells into 3D scaffolds [J].Biofabrication, 2010, 2(1): 014104.
[29]董丽. 采用多用途的生物墨水打印三维组织支架[J]. 现代材料动态, 2015(3): 4-5.
[30]Zhang YS, Khademhosseini A. Advances in engineering hydrogels [J]. Science, 2017,356(6337): eaaf3627.
[31]钟恩意, 刘瑞源, 高杰, 等. 3D 生物打印技术及其在牙周骨缺损修复中的应用 [J]. 中国医学物理学杂志, 2016, 33(1): 49-53.
[32]Zhai XY, Ma YF, Hou CY, et al. 3D-Printed high strength bioactive supramolecular polymer/clay nanocomposite hydrogel scaffold for bone regeneration [J]. ACS Biomaterials Science &Engineering, 2017, 3(6): 1109-1118.
[33]Stantonmm, Samitier J, Sánchez S. Bioprinting of 3D hydrogels [J]. Lab on A Chip, 2015, 15(15):3111.
[34]Chevallay B, Herbage D. Collagen-based biomaterials as 3D scaffold for cell cultures:applications for tissue engineering and gene therapy[J]. Medical and Biological Engineering and Computing, 2000, 38(2): 211-218.
[35]Silvipriya KS, Kumar KK, Bhat AR, et al. Collagen:animal sources and biomedical application [J].Journal of Applied Pharmaceutical Science, 2015,5(3): 123-127.
[36]Yeo M, Lee JS, Chun W, et al. An innovative collagen-based cell-printing method for obtaining human adipose stem cell-laden structures consisting of core–sheath structures for tissue engineering [J].Biomacromolecules, 2016, 17(4): 1365-1375.
[37]Akkineni AR, Ahlfeld T, Lode A, et al. A versatile method for combining different biopolymers in a core/shell fashion by 3D plotting to achieve mechanically robust constructs [J]. Biofabrication,2016, 8(4): 045001.
[38]Koch L, Deiwick A, Schlie S, et al. Skin tissue generation by laser cell printing [J]. Biotechnology and Bioengineering, 2012, 109(7): 1855-1863.
[39]Xu FQ, Moon S, Emre AE, et al. Cell bioprinting as a potential high-throughput method for fabricating cell-based biosensors (CBBs) [C]// 2009 IEEE Sensors Conference, 2009: 387-391.
[40]Duarte Campos DF, Blaeser A, Korsten A, et al. The stiffness and structure of three-dimensional printed hydrogels direct the differentiation of mesenchymal stromal cells toward adipogenic and osteogenic lineages [J]. Tissue Engineering Part A, 2014, 21(3-4): 740-756.
[41]Lee W, Lee V, Polio S, et al. On-demand threedimensional freeform fabrication of multi-layered hydrogel scaffold with fluidic channels [J].Biotechnology & Bioengineering, 2010, 105(6):1178-1186.
[42]韩钊, 刘兴炎, 厉孟, 等. 载骨髓间充质干细胞明胶微球的制备 [J]. 解放军医学院学报, 2012,33(5): 512-515.
[43]Yan YN, Wang XH, Pan YQ, et al. Fabrication of viable tissue-engineered constructs with 3D cellassembly technique [J]. Biomaterials, 2005, 26(29):5864-5871.
[44]Billiet T, Gevaert E, De Schryver T, et al. The 3D printing of gelatin methacrylamide cell-laden tissue-engineered constructs with high cell viability[J]. Biomaterials, 2014, 35(1): 49-62.
[45]张传昕, 李梁, 吴海山. 甲基丙烯酰胺基明胶水凝胶在关节软骨损伤修复领域中的研究进展 [J].中国骨与关节杂志, 2017, 6(8): 633-637.
[46]方幸幸. 仿生明胶甲基丙烯酰胺水凝胶支架的骨组织工程研究 [D]. 广州: 南方医科大学, 2016.
[47]Nichol JW, Koshy ST, Bae H, et al. Cell-laden microengineered gelatin methacrylate hydrogels [J].Biomaterials, 2010, 31(21): 5536-5544.
[48]Schuurman W, Levett PA, Pot MW, et al. Gelatinmethacrylamide hydrogels as potential biomaterials for fabrication of tissue-engineered cartilage constructs [J]. Macromolecular Bioscience, 2013,13(5): 551-561.
[49]Skardal A, Zhang JX, McCoard L, et al.Photocrosslinkable hyaluronan-gelatin hydrogels for two-step bioprinting [J]. Tissue Engineering Part A, 2010, 16(8): 2675-2685.
[50]Ma YF, Ji Y, Huang GY, et al. Bioprinting 3D cell-laden hydrogel microarray for screening human periodontal ligament stem cell response to extracellular matrix [J]. Biofabrication, 2015, 7(4):044105.
[51]Pawar SN, Edgar KJ. Alginate derivatization: a review of chemistry, properties and applications [J].Biomaterials, 2012, 33(11): 3279-3305.
[52]薛世华, 吕培军, 王勇, 等. 人牙髓细胞共混物三维生物打印技术 [J]. 北京大学学报(医学版),2013, 45(1): 105-108.
[53]Khalil S, Sun W. Bioprinting endothelial cells with alginate for 3D tissue constructs [J]. Journal of Biomechanical Engineering, 2009, 131(11): 111002.[54]Dolati F, Yu Y, Zhang YH, et al. In vitro evaluation of carbon-nanotube-reinforced bioprintable vascular conduits [J]. Nanotechnology, 2014, 25(14):145101.
[55]Luo GL, Ma YF, Cui X, et al. 13-93 bioactive glass/alginate composite scaffolds 3D printed under mild conditions for bone regeneration [J]. RSC Advances, 2017, 7(20): 11880-11889.
[56]Arai K, Iwanaga S, Toda H, et al. Threedimensional inkjet biofabrication based on designed images [J]. Biofabrication, 2011, 3(3): 034113.
[57]Xiong RT, Zhang ZY, Chai WX, et al. Freeform drop-on-demand laser printing of 3D alginate and cellular constructs [J]. Biofabrication, 2015, 7(4):045011.
[58]Lawson MA, Barralet JE, Wang L, et al. Adhesion and growth of bone marrow stromal cells on modi fi ed alginate hydrogels [J]. Tissue Engineering,2004, 10(9-10): 1480-1491.
[59]Murphy SV, Skardal A, Atala A. Evaluation of hydrogels for bio-printing applications [J]. Journal of Biomedical Materials Research Part A, 2013,101(1): 272-284.
[60]Kesti M, Müller M, Becher J, et al. A versatile bioink for three-dimensional printing of cellular scaffolds based on thermally and photo-triggered tandem gelation [J]. Acta Biomaterialia, 2015,11(Supplement C): 162-172.
[61]Sant S, Coutinho DF, Gaharwar AK, et al. Selfassembled hydrogel fiber bundles from oppositely charged polyelectrolytes mimic micro-/nanoscale hierarchy of collagen [J]. Advanced Functional Materials, 2017, 27(36): 1606273.
[62]Rodriguez MJ, Brown J, Giordano J, et al. Silk based bioinks for soft tissue reconstruction using 3-dimensional (3D) printing with in vitro and in vivo assessments [J]. Biomaterials, 2017,117(Supplement C): 105-115.
[63]Daly AC, Critchley SE, Rencsok EM, et al. A comparison of different bioinks for 3D bioprinting of fibrocartilage and hyaline cartilage [J].Biofabrication, 2016, 8(4): 045002.
[64]Schacht K, Jüngst T, Schweinlin M, et al.Biofabrication of cell-loaded 3D spider silk constructs [J]. Angewandte Chemie (International ed. in English), 2015, 54(9): 2816-2820.
[65]Miller JS. The billion cell construct: will threedimensional printing get us there? [J]. PLoS Biology, 2014, 12(6): e1001882.
[66]Delalat B, Harding F, Gundsambuu B, et al. 3D printed lattices as an activation and expansion platform for T cell therapy [J]. Biomaterials, 2017,140: 58-68.
[67]Hon KKB, Li L, Hutchings IM. Direct writing technology—Advances and developments [J]. CIRP Annals-Manufacturing Technology, 2008, 57(2):601-620.
[68]Li JL, Cai YL, Guo YL, et al. Fabrication of threedimensional porous scaffolds with controlled filament orientation and large pore size via an improved E-jetting technique [J]. Journal of Biomedical Materials Research, Part B: Applied Biomaterials, 2014, 102(4): 651-658.
[69]Gómez S, Vlad MD, López J, et al. Design and properties of 3D scaffolds for bone tissue engineering [J]. Acta Biomaterialia, 2016,42(Supplement C): 341-350.
[70]Skardal A, Mack D, Kapetanovic E, et al.Bioprinted amniotic fluid-derived stem cells accelerate healing of large skin wounds [J]. STEM Cells Translational Medicine, 2012, 1(11): 792-802.
[71]Lee HJ, Kim YB, Ahn SH, et al. A new approach for fabricating collagen/ecm-based bioinks using preosteoblasts and human adipose stem cells [J].Advanced Healthcare Materials, 2015, 4(9): 1359-1368.
[72]Hong S, Sycks D, Chan HF, et al. 3D printing of highly stretchable and tough hydrogels into complex, cellularized structures [J]. Advanced Materials, 2015, 27(27): 4035-4040.
[73]Kong L, Zheng LZ, Qin L, et al. Therole of mesenchymal stem cells in osteoarthritis treatment[J]. Journal of Orthopaedic Translation, 2017,9(Supplement C): 89-103.
[74]Cui HT, Nowicki M, Fisher JP, et al. 3D Bioprinting for organ regeneration [J]. Advanced Healthcare Materials, 2017, 6(1): 1601118.
[75]Gao GF, Schilling AF, Yonezawa T, et al. Bioactive nanoparticles stimulate bone tissue formation in bioprinted three-dimensional scaffold and human mesenchymal stem cells [J]. Biotechnology Journal,2014, 9(10): 1304-1311.
[76]Daly AC, Cunniffe GM, Sathy BN, et al. 3D Bioprinting of developmentally inspired templates for whole bone organ engineering [J]. Advanced Healthcare Materials, 2016, 5(18): 2353-2362.
[77]Lin XX, Shi Y, Cao YL, et al. Recent progress in stem cell differentiation directed by material and mechanical cues [J]. Biomedical Materials, 2016,11(1): 014109.
[78]Lin ZF, Zhao XJ, Chen S, et al. Osteogenic and tenogenic induction of hBMSCs by an integrated nanofibrous scaffold with chemical and structural mimicry of the bone-ligament connection [J]. Journal of Materials Chemistry B, 2017, 5(5): 1015-1027.
[79]Zhang DH, Shadrin IY, Lam J, et al. Tissueengineered cardiac patch for advanced functional maturation of human ESC-derived cardiomyocytes[J]. Biomaterials, 2013, 34(23): 5813-5820.
[80]Fattahi P, Dover JT, Brown JL. 3D near-field electrospinning of biomaterial microfibers with potential for blended microfiber-cell-loaded gel composite structures [J]. Advanced Healthcare Materials, 2017, 6(19): 1700456.
[81]Ozler SB, Bakirci E, Kucukgul C, et al. Threedimensional direct cell bioprinting for tissue engineering [J]. Journal of Biomedical Materials Research Part B: Applied Biomaterials, 2017,105(8): 2530-2544.
[82]Costantini M, Testa S, Mozetic P, et al. Micro fl uidicenhanced 3D bioprinting of aligned myoblast-laden hydrogels leads to functionally organized myo fi bers in vitro and in vivo [J]. Biomaterials, 2017, 131:98-110.
[83]Jang J, Park HJ, Kim SW, et al. 3D printed complex tissue construct using stem cell-laden decellularized extracellular matrix bioinks for cardiac repair [J].Biomaterials, 2017, 112: 264-274.

