播量和行距对苜蓿根际土壤生物性质的影响
南丽丽, 汪 堃, 李小彦, 赵克明
(1. 甘肃农业大学草业学院, 甘肃 兰州 730070; 2. 草业生态系统教育部重点实验室, 甘肃 兰州 730070;3. 甘肃省草业工程实验室, 甘肃 兰州 730070; 4. 中美草地畜牧业可持续发展研究中心, 甘肃 兰州 730070)
根际是受植物根系及其生长活动显著影响的土壤微域环境,由于其特殊的物理、化学和生物性质,根际土壤环境影响着土壤微生物和酶活性。根际土壤微生物参与根际生态系统的物质转化和循环,微生物群落的组成是衡量土壤性质和功能的一个重要指标[1],在维持土壤健康方面扮演着重要的角色[2]。土壤酶活性对土壤碳氮的转化、腐殖质的合成与分解等发挥着重要的作用,并在一定程度上反映土壤生物学状况,能敏感地指示土壤品质的变化,可作为土壤肥力、土壤品质及土壤健康的重要指标[3]。土壤呼吸是土壤碳库的主要输出途径,作为衡量土壤生物活性的指标,一定程度上反映了土壤养分转化和供应能力[4]。
有关播量和行距对苜蓿产量[5]、品质[6-7]及苜蓿草地土壤微生物[8]、酶活性变化[9]的影响已有报道,不同种植密度对小麦根际土壤微生物数量及酶活性[10]的影响也已见报道,但关于不同播量和行距配置下苜蓿根际土壤微生物、酶活性的变化鲜见报道,而播量影响苜蓿群体大小,行距影响苜蓿群体均匀性,二者配置下苜蓿的群体数量、根量有明显差异,便会直接影响根际周围土壤微生物活动、根系分泌物及根系残体。本研究采用田间小区试验,比较不同播量和行距配置对苜蓿根际土壤微生物(细菌、真菌、放线菌)、呼吸速率和酶活性(脲酶、碱性磷酸酶、脱氢酶)的影响以及它们之间的相关关系,旨在明确苜蓿与其根际土壤微生物和酶活性间的相互作用,为苜蓿生产实践中选择合理的栽培方式奠定科学基础。
1 材料与方法
1.1 试验地概况
甘肃农业大学武威黄羊镇牧草试验站(37°55′ N,102°40′ E)地处河西走廊东端,属大陆性气候,农业区划为中温带荒漠灌区。冬春干旱,夏季酷热,日照长,降水少,蒸发量大。年均温7.2℃,年降水量150 mm,分布很不均匀,生长季节的前期降水一般偏少。年蒸发量2 019.9 mm,约为降水量的14倍。海拔1 530.88 m,无霜期154 d。土壤类型为沙壤土,0~20 cm土层pH为8.70,有机质、全氮、全磷含量分别为10.60,7.07 和3.32 g·kg-1,速效氮、磷、钾含量分别为88.2,13.24和119.95 mg·kg-1。
1.2 试验设计
供试苜蓿为甘农3号紫花苜蓿(M.sativaL.‘Gannong No.3’)。试验采用裂区设计,主区设4个播量,分别为12.0,16.0,20.0,24.0 kg·hm-2;副区为行距,分别为10,15,20 cm,共12个处理,重复3次,小区面积4 m×5 m,小区间距为40 cm。2014年7月15日人工开沟条播,播深2 cm。播前浇一次底墒水,施磷酸二胺400 kg·hm-2作为基肥。生长期间,每茬苜蓿测产后进行灌溉。
1.3 测定指标及方法
于2015年4月25日、7月25日、10月25日,在各小区选取10株植株,将0~20 cm、20~40 cm土层根系挖出,抖掉根系外围土,取紧贴在根表附近的土样,混合后作为根际土,土样使用前过2 mm筛。
土壤微生物数量采用平板涂布计数,细菌采用牛肉膏蛋白胨琼脂培养基[11],放线菌采用改良高氏1号培养基[12],真菌采用马丁孟加拉红培养基[11],结果以每克干土所含数量表示。土壤脲酶采用靛酚蓝比色法[13],以24 h后1 g土壤中NH3-N质量(mg)表示;碱性磷酸酶采用磷酸苯二钠(用硼酸缓冲液)比色法[13],以24 h后1 g土壤中释放出的酚质量(mg)表示;脱氢酶采用氯化三苯基四氮唑(TTC)比色法,用培养24 h后1g土壤中生成的TTC质量分数来表示(mg)[13]。土壤呼吸速率采用LICOR-6400便携式光合作用仪连接6400-09土壤叶室测定(Li-Cor Inc,Lincoln,NE,USA)[14],每次测定时,齐地面剪去管中的苜蓿;测定所用PVC基座直径10 cm、高5 cm,提前24 h嵌入土中约3 cm,每个小区2次重复。
1.4数据分析
采用Excel2007进行数据整理,用SPSS16.0统计软件进行方差分析和相关分析,用Duncan氏新复极差法进行多重比较。
2 结果与分析
2.1 根际土壤可培养微生物数量的比较
2.1.1细菌 由表1可知,细菌数量随播量递增呈先增加后减小趋势,随行距递增呈增大趋势。春、夏、秋3季细菌数量分别在3.46~16.81(×103)cfu·g-1,11.42~37.37(×103)cfu·g-1,6.92~34.65(×103)cfu·g-1范围内,在不同采样时间表现为夏季>秋季>春季,且随土层深度的增加而显著下降(P<0.05)。播量分别为12.0,16.0,20.0,24.0 kg·hm-2,行距为20 cm时,细菌数量最高,不同生长季节0~40 cm土层平均细菌数量分别为15.73,20.12,24.08,23.70(×103)cfu·g-1;同一行距下,以播量20.0 kg·hm-2细菌数量最多。
注:不同小写字母表示土层间有差异(P<0.05);不同大写字母表示处理间有差异(P<0.05);不同拉丁字母表示季节间有差异(P<0.05),下同
Note:Different lowercase letters indicate significant difference at different soil depths at the 0.05 level;Different capital letters indicate significant difference in different combinations at the 0.05 level;Different latin letters indicate significant difference in different seasons at the 0.05 level, The same as below
2.1.2放线菌 由表2可见,不同播量和行距配置苜蓿根际土壤放线菌数量随土层深度的增加显著减小(P<0.05),随播量增加大体呈先增加后降低趋势,随行距增加呈增大趋势。春、夏、秋3季放线菌数量分别在1.06~5.86(×103)cfu·g-1、3.92~17.85(×103)cfu·g-1、2.77~13.30(×103)cfu·g-1范围内,在不同季节,放线菌数量在夏季最高、秋季次之、春季最小。播量分别为12.0,16.0,20.0,24.0 kg·hm-2,行距为20 cm时,放线菌数量最多,不同生长季节0~40 cm土层平均放线菌数量分别为6.29,8.49,8.74,6.41(×103)cfu·g-1;同一行距下,以播量16.0 kg·hm-2平均放线菌数量较大。

表2 苜蓿根际土壤放线菌数量季节变化Table 2 Seasonal changes of soil actinomycetes quantity in the rhizosphere of alfalfa/103cfu·g-1
2.1.3真菌 由表3可知,真菌数量总体上随苜蓿播量的增加呈降低趋势,随行距的增加呈先上升后下降趋势。春、夏、秋3季真菌数量分别在8.64~32.07 cfu·g-1、10.92~35.71 cfu·g-1、10.69~58.45 cfu·g-1范围内,在不同采样时间,真菌数量表现为秋季>夏季>春季。在土壤剖面上真菌数量差异显著(P<0.05),且随土层深度的加深呈下降趋势。播量分别为12.0,16.0,20.0,24.0 kg·hm-2,行距为15 cm时,真菌数量最多,不同生长季节0~40 cm土层平均真菌数量分别为29.98,30.68,28.74,25.88 cfu·g-1;行距为10和20 cm时,以播量12.0 kg·hm-2平均真菌数量最大,而行距为15 cm时,以播量16.0 kg·hm-2平均真菌数量最大。
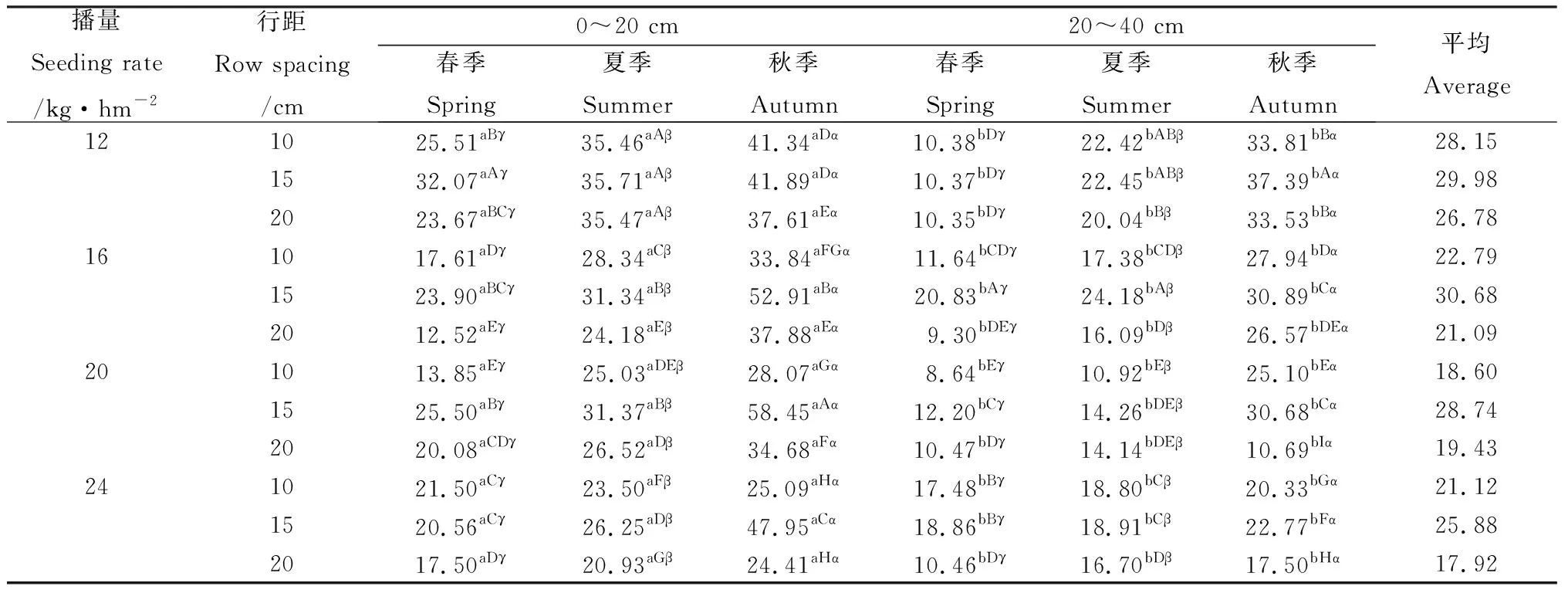
表3 苜蓿根际土壤真菌数量季节变化Table 3 Seasonal changes of soil fungi quantities in the rhizosphere of alfalfa/cfu·g-1
2.2 根际土壤呼吸的比较
由图1可知,根际土壤呼吸随苜蓿播量的增加呈先升高后降低趋势,随行距的增加呈增大降趋势,春、夏、秋3季土壤呼吸分别在1.13~3.19 μmol·m-2·s-1,3.54~6.68 μmol·m-2·s-1,2.05~3.74 μmol·m-2·s-1范围内,可见土壤呼吸在夏季最快,秋季次之,春季最慢。播量分别为12.0,16.0,20.0,24.0 kg·hm-2,行距为20 cm时,土壤呼吸最高,不同生长季节0~40 cm土层平均呼吸分别为3.79,3.47,3.87,3.64 μmol·m-2·s-1;同一行距下,土壤呼吸速率以播量20.0 kg·hm-2最大。

图1 苜蓿根际土壤呼吸的比较Fig.1 Comparison of soil respiration in the rhizosphere of alfalfa注:S1,S2,S3,S4分别代表播量为12.0,16.0,20.0,24.0 kg·hm-2;R1,R2,R3分别代表行距为10,15,20 cm;小写字母表示不同季节间的差异(P<0.05),大写字母表示不同处理间的差异(P<0.05)Note: S1, S2, S3, and S4 represent seeding rates of 12.0, 16.0, 20.0, and 24.0 kg·hm-2, respectively. R1, R2, and R3 represent row spacing of 10, 15, 20 cm, respectively. Lowercase letters indicate significant differences among different seasons at the 0.05 level; capital letters indicate significant differences among different combinations at the 0.05 level
2.3 根际土壤酶活性的比较
2.3.1脲酶 脲酶是决定土壤中氮转化的关键酶。由表4可知,春、夏、秋3季土壤脲酶分别在0.12~0.90 mg·g-1、0.28~1.65 mg·g-1、0.89~2.76 mg·g-1范围内,总体看,脲酶活性随播量增加呈先增大后减小趋势,随行距增加呈增大趋势。播量分别为12.0,16.0,20.0,24.0 kg·hm-2,行距为20 cm时,脲酶活性最大,不同生长季节0~40 cm土层平均脲酶活性分别为1.17,1.54,1.34,0.96 mg·g-1;同一行距下,其活性以播量16.0 kg·hm-2最高。脲酶活性在上下两土层均秋季最高,夏季次之,春季最小,0~20 cm土层显著高于20~40 cm土层(P<0.05)。
2.3.2碱性磷酸酶 由表5可知,碱性磷酸酶活性总体上随苜蓿播量增加呈先升高后降低趋势,随行距增加呈增大趋势。春、夏、秋3季根际碱性磷酸酶活性分别在0.004~0.036 mg·g-1、0.227~1.575 mg·g-1、0.174~0.841 mg·g-1范围内,不同采样时间,碱性磷酸酶活性上下土层均表现为夏季>秋季>春季;在土壤剖面上碱性磷酸酶活性差异显著(P<0.05),除春季个别处理外,其余均随土层加深呈下降趋势。播量分别为12.0,16.0,20.0,24.0 kg·hm-2,行距为20 cm时,碱性磷酸酶活性最高,不同生长季节0~40 cm土层平均碱性磷酸酶活性分别为0.482,0.622,0.492,0.437 mg·g-1;同一行距下,以播量16.0 kg·hm-2的酶活性最高。

表4 苜蓿根际土壤脲酶活性季节变化Table 4 Seasonal changes of soil urease activity in the rhizosphere of alfalfa/mg·g-1·24h-1

表5 苜蓿根际土壤碱性磷酸酶活性季节变化Table 5 Seasonal changes of soil alkaline phosphatase activity in the rhizosphere of alfalfa/mg·g-1·24h-1
2.3.3脱氢酶 由表6可知,根际脱氢酶活性随播量增加呈先升高后降低趋势,随行距增加呈增高趋势,春、夏、秋3季脱氢酶活性的变化范围分别为0.02~0.20 μg·g-1、0.18~0.82 μg·g-1、0.09~0.51 μg·g-1,在不同采样时间其活性为夏季>秋季>春季,在土壤剖面上其活性随土层的加深而显著降低(P<0.05)。播量分别为12.0,16.0,20.0,24.0 kg·hm-2,行距为20 cm时,脱氢酶活性最高,不同生长季节0~40 cm土层平均脱氢酶活性分别为0.20,0.36,0.21,0.20 μg·g-1;同一行距下,播量为16.0 kg·hm-2时,其酶活性最高。

表6 苜蓿根际土壤脱氢酶活性季节变化Table 6 Seasonal changes of soil dehydrogenase activity in the rhizosphere of alfalfa/μg·g-1·24h-1
2.4 根际土壤生物学性质相关分析
由表7可知,春、夏、秋3季0~40 cm土层平均细菌与真菌显著负相关,相关系数为-0.623;放线菌与脲酶、碱性磷酸酶、脱氢酶分别呈极显著、显著正相关关系,相关系数分别为0.897、0.808、0.700;土壤呼吸与脱氢酶呈显著正相关,相关系数为0.609;脲酶与碱性磷酸酶、脱氢酶极显著正相关,相关系数分别为0.912,0.848;碱性磷酸酶与脱氢酶极显著正相关,相关系数为0.909。

表7 苜蓿根际土壤生物学性质相关分析Table 7 Correlation analysis among soil biological properties in the rhizosphere of alfalfa
注:*表示在0.05水平上显著相关;**表示在0.01水平上显著相关
Note:* indicate significantly correlated at the 0.05 level;** indicate significantly correlated at the 0.01 level
3 讨论
3.1 播量和行距对苜蓿根际土壤生物学性质的影响
土壤微生物种群数量变化可以反映土壤生物活性水平,土壤细菌和放线菌种群数量越高,土壤的生物活性就高,而土壤真菌种群数量上升,则会使土壤地力衰竭[15]。土壤酶主要来自于土壤微生物,其活性可以反映不同栽植条件和模式下土壤的质量,定植植物会影响土壤微生物数量[16],从而使土壤酶活性变化。本研究表明,不同播量和行距配置下苜蓿根际土壤细菌、放线菌及呼吸速率均以播量20.0 kg·hm-2和行距20 cm下最大,真菌以播量16.0 kg·hm-2行距15 cm下最高,3种酶均以播量16.0 kg·hm-2行距20 cm下最高,这是由于低播量(12.0 kg·hm-2)下植株量、根量及根系分泌物较少,对土壤酶的酶源及根际生长环境产生了影响,降低了根际土壤酶的活性、微生物数量和呼吸速率;高播量(24.0 kg·hm-2)下因群体增大,植株总量及根系总量增多,但单株营养竞争加剧,单株光合能力降低,向根系输送的光合产物减少[17];中等播量(16.0,20.0 kg·hm-2)下植株根量适宜,植株光合能力得到有效发挥,光合产物充足,根部微生物量及其有效活动提高,进而增加了土壤酶活性和呼吸速率。
3.2 土层和季节对苜蓿根际土壤生物学性质的影响
本研究发现,土壤微生物数量、酶活性及呼吸速率主要分布在土壤表层,这与许多研究者的结果相似[8,18],一方面表层土壤植物根系分布密集、枯枝落叶大量聚积,腐熟分解后为植物生长提供了有效养分;另一方面表层土壤的通气状况、温度、湿度良好,利于酶和微生物的生长。根际土壤中的微生物以细菌数量最多,放线菌次之,真菌最少,与大多数学者的研究结果[19-20]一致,这是因为甘肃荒漠灌区土壤呈碱性(pH值8.70),适宜于中性偏碱的细菌生长繁殖,不利于喜偏酸性环境的真菌生长,反映出细菌、放线菌对该生态环境的适应性强。土壤酶、微生物数量及呼吸速率随季节性变化比较明显,这与前人研究结果[21-22]一致,其中碱性磷酸酶、脱氢酶、细菌、放线菌、土壤呼吸在夏季最大,春季最小,而脲酶和真菌在秋季最大,春季最小,适宜的温度和水分条件可能是主要的原因。
本研究发现,土壤酶、土壤微生物之间存在着一定的相关性,这是因为微生物在其生命活动过程中释放分泌酶[23];在土壤酶的作用下,土壤有机物质和有机残体分解成不同的中间产物和最终产物,为微生物提供了营养物质和能量[24];但土壤呼吸与根际土壤中细菌、真菌以及放线菌的数量无显著相关性,这与保护性耕作黄土旱塬玉米的研究结果[25]一致,与不同刈割年限天然草地上的研究结果[26]不同,这可能与研究地点的地理位置、气候、环境条件等之间的差异有关,因此,仍需对根系呼吸以及其他环境因子做进一步研究。
4 结论
不同播量和行距组合下苜蓿根际土壤细菌、放线菌、脲酶、碱性磷酸酶、脱氢酶及呼吸速率均随播量增加呈先增高后降低趋势,随行距增加呈增大趋势,而真菌随播量增加呈降低趋势,随行距增加呈先升高后下降趋势。根际土壤细菌、放线菌及呼吸速率在中等播量20.0 kg·hm-2和行距20 cm时,数量最多;真菌在中等播量16.0 kg·hm-2和行距15 cm下数量最大;3种酶均在中等播量16.0 kg·hm-2和行距20 cm下活性最强。土壤微生物数量、酶活性及呼吸速率均随土层的加深而显著降低,且各指标季节变化比较明显。

