负载型磷化镍催化剂上乙酸加氢制乙醇反应宏观动力学
任 杰, 吴鸿均, 袁海宽, 慎 炼
(浙江工业大学 化工学院, 浙江 杭州 310014)
乙醇作为一种清洁燃料,将其加入到汽油中,能够改善汽油燃烧性能和减少污染物排放,得到国内外普遍关注。现在广泛以农作物秸秆和林业加工废料为原料生产乙醇,受到原料和技术的限制,生产成本较高,难以满足燃料乙醇的需求。另外,煤制气合成甲醇与甲醇羰基化合成乙酸工艺成熟且成本低廉,乙酸相对乙醇有较大的价格差。以煤基乙酸为原料通过催化加氢反应得到乙醇是由煤间接制液体燃料的有效途径。因此,开展乙酸加氢制乙醇催化反应研究具有重要的意义。
乙酸加氢制乙醇的方法包括间接法和直接法,间接法是原料乙酸先酯化生成乙酸酯,乙酸酯加氢生成乙醇;而直接法是乙酸直接催化加氢生成乙醇,直接法比间接法的工艺流程简单[1-3]。生成乙醇的催化加氢反应常用Pt、Pd等贵金属催化剂,为了降低催化剂成本,非贵金属催化剂的研究受到关注[4]。Cu基催化剂较早用于甲酸甲酯的催化加氢反应,具有较高的催化活性,但易发生热失活[5-7]。以Fe2O3作为前驱体,石墨烯氧化物为载体,制备活性较高的铁基加氢催化剂[8]。在制备负载型Ni基催化剂时加入Co、Cu、Fe、La、W等第二活性组分,提高了活性成分Ni的分散性,并且降低了Ni基催化剂的还原反应温度[9-11]。经过浸渍、还原或硫化过程制备Mo-Ni/γ-Al2O3催化剂,还原处理后的催化剂的乙酸加氢活性明显高于硫化处理,两者的乙醇选择性分别为23.80%和9.22%[12]。对Pt/γ-Al2O3催化剂进行碱金属改性,钝化催化剂表面酸性,降低乙酸加氢的乙酸乙酯选择性,抑制催化剂结焦失活,提高催化剂活性稳定性[13]。
过渡金属磷化物是一种新型加氢催化剂,首先用于加氢脱硫(HDS)和加氢脱氮(HDN),由于它比氮化物和碳化物具有更好的抗硫中毒性能,因而受到人们的极大关注[14]。在相同金属负载量时,MoP/SiO2催化剂的HDS活性是MoS2/SiO2的4倍,MoP/Al2O3催化剂的HDN活性比MoS2/Al2O3高6倍[15-16]。在4-甲基酚加氢脱氧(HDO)中,随着Mo基催化剂的MoO3、MoO2、MoS2和MoP中Mo的电子密度递增,催化剂的加氢脱氧性能逐渐提高,MoP的催化性能最高[17]。磷化物催化剂的邻甲氧基苯酚加氢脱氧活性稳定性好于CoMoS/Al2O3催化剂[18]。Fe2P/SiO2、Ni2P/SiO2和CoP/SiO2过渡金属磷化物催化剂都具有较高的加氢精制初活性,只是Ni2P/SiO2催化剂的活性最高、活性稳定性最好[19]。Ni2P/SiO2的加氢脱氧催化性能优于Co2P/SiO2,并且当n(P)/n(Ni)=3时,催化活性较高[20]。在300℃、4.0 MPa条件下的苯酚加氢脱氧反应中,Ni2P/MCM-41催化剂的苯酚转化率达到100%[21]。通过300℃磷化处理,制备Ni2P/Al2O3催化剂,由n(P)/n(Ni)=3初始原料制备的催化剂的二苯并噻吩加氢脱硫活性较高[22]。金属Ti的引入改善Ni2P活性相的分散度,使Ni2P/Ti-MCM-41的加氢脱硫催化活性明显高于Ni2P/MCM-41[23]。Ni2P/Ti-SBA-15催化剂加氢脱氮催化活性高于Ni2P/SBA-15,并且当n(Si)/n(Ti)=25时催化剂活性最高[24]。在负载型Ni2P催化剂制备过程中,Ni(H2PO2)2和NH4H2PO2热分解生成Ni2P、P2O3、PH3、H2、NH3和水[25-26]。次磷酸盐还原法制备金属磷化物的关键是次磷酸根自身发生歧化反应,生成PH3气体,然后PH3气体将金属离子还原,最终使其完全磷化[27-28]。目前,负载型磷化镍催化剂用于乙酸加氢反应和动力学研究均鲜见报道。
笔者在制备Ni2P/SiO2催化剂的基础上,经过乙酸加氢反应实验、反应动力学模型方程推导和模型参数估值,研究了乙酸加氢制乙醇反应宏观动力学,并优化了加氢反应条件。
1 实验部分
1.1 原料
乙酸,分析纯,杭州化学试剂有限公司产品;高纯H2和高纯N2,杭州今工特种气体有限公司产品;次磷酸镍(Ni(H2PO2)2·6H2O)和次磷酸钠(NaH2PO2·H2O),分析纯,上海笛柏化学品技术有限公司产品;硝酸,化学纯,浙江中星化工试剂有限公司产品;活化硅胶,分析纯,青岛海洋化工分厂产品。
1.2 催化剂制备
首先,对比表面积350 m2/g、孔体积0.5 mL/g、粒度40~60目的活化硅胶进行预处理。配制30%稀硝酸溶液,在25℃下将活化硅胶浸泡24 h,过滤,水洗,在烘箱中110℃下干燥24 h,然后在马福炉中以1.5℃/min的速率从100℃升温到550℃,恒温焙烧4.0 h,得到催化剂载体。测定载体的饱和吸水率为1.65 mL/g。
以次磷酸镍作为镍源和磷源,次磷酸钠作为补充磷源,在确定Ni占Ni、P和载体总质量分数为7.0%、n(P)/n(Ni)为3的条件下,通过等体积浸渍、N2气流中热处理过程,制备Ni2P/SiO2催化剂。具体制备过程为:(1)将4.3350 g的Ni(H2PO2)2·6H2O 溶解于适量的蒸馏水中,再加入1.5588 g的 NaH2PO2·H2O,补加蒸馏水并搅拌,得到16.7 mL的浸渍溶液;(2)对10.1005 g处理过的活化硅胶载体搅拌,滴加浸渍溶液,然后静置24 h,在烘箱中60℃真空干燥12 h,得到催化剂前驱体;(3)将7.5 g干燥的催化剂前驱体装入固定床反应器中,在N2流量45 mL/min、反应压力1.5 MPa 条件下,以2℃/min的速率从25℃加热至250℃,恒温保持3 h,得到Ni2P/SiO2催化剂。
1.3 加氢反应实验
采用固定床反应装置进行乙酸加氢反应,不锈钢反应器尺寸为内径10 mm、外径14 mm、长100 cm,催化剂装在反应器中部的恒温区,反应器两端填满惰性石英砂。反应温度由反应温度控制仪表控制,由背压阀调节加氢反应压力。反应原料乙酸由双柱塞计量泵注入固定床反应器上端,乙酸与H2的混合物流经催化剂床层,从反应器下端流入储罐,气体从储罐上部流出,经过背压阀、转子流量计和湿式气体流量计,经皂膜流量计测定流量后排空;液体产物储存在储罐中,并定时取样和分析。乙酸的进料量由电子天平称取,以催化剂前驱体填装量(7.5 g)为基准计算乙酸质量空速。
1.4 产物分析与数据处理
采用岛津GC-2014C气相色谱仪分析反应产物组成,色谱检测器为热导检测器,色谱柱为2 m×4 mm 的GDX-102填充柱,进样器温度为140℃,柱温为120℃,检测器温度为130℃,色谱数据处理方法为校正面积归一化法。
乙酸加氢反应生成的产物含有乙醇(EtOH)、乙酸乙酯(EtOA)、乙醛(ALDE)、丙酮(ACET),以及未转化的乙酸(HAc),相对乙酸总有机物的量(B0)为:
(1)
乙酸转化率(XHAc)为:
(2)
以Yi分别表示乙醇、乙酸乙酯、乙醛、丙酮产率,关系式为:
(3)
式中,Ai为i组分色谱面积分率;Mi为i组分摩尔质量,g/mol;λi为i组分色谱校正因子,其中λHAc=1.0208,λEtOH=1.3158,λEtOA=2.9321,λACET=0.9763,λALDE=1.0000。
2 结果与讨论
利用制备的Ni2P/SiO2催化剂,采用固定床反应器进行乙酸加氢反应,单因素考察反应温度(T)、反应压力(p)、质量空速(MHSV)、氢/酸摩尔比(nH2/HAc)的影响,将反应实验结果列于表1。
从表1可以看出,乙酸转化率、乙醇产率、乙酸乙酯产率均随着反应温度升高和反应压力增大而提高,而随着质量空速和氢/酸摩尔比增大呈现降低趋势。这是因为,提高反应温度和反应压力会增大加氢反应速率,降低质量空速,使反应流体与催化剂接触时间延长,强化这些反应条件均导致乙酸转化率,以及乙醇、乙酸乙酯产率增大。在H2远远过剩和其他条件不变的情况下,随着氢/酸摩尔比增大,反应流体与催化剂接触时间缩短,致使乙酸转化率,以及乙醇、乙酸乙酯产率降低。
另外,由表1数据得知,乙醛产率随着反应压力增大而提高,丙酮产率随着反应温度升高而提高;随其他反应条件变化,乙醛和丙酮产率的变化趋势不明显。
3 加氢反应动力学
3.1 加氢反应动力学模型方程的确定
3.1.1 反应流体相态的确定
乙酸加氢反应流体相态对物料混合程度和传质速率影响很大。如果反应流体处于气相,乙酸和H2混合较均匀,传质速率较大,有利于催化反应。乙酸加氢反应流体中主要含有H2和乙酸,还含有水、乙醇、乙酸乙酯、丙酮及少量的乙醛。利用Antoine蒸气压方程计算各组分不同反应温度的饱和蒸气压(pS),结果见图1。由于乙醛产率较低,且饱和蒸气压较大,未计算其饱和蒸气压。
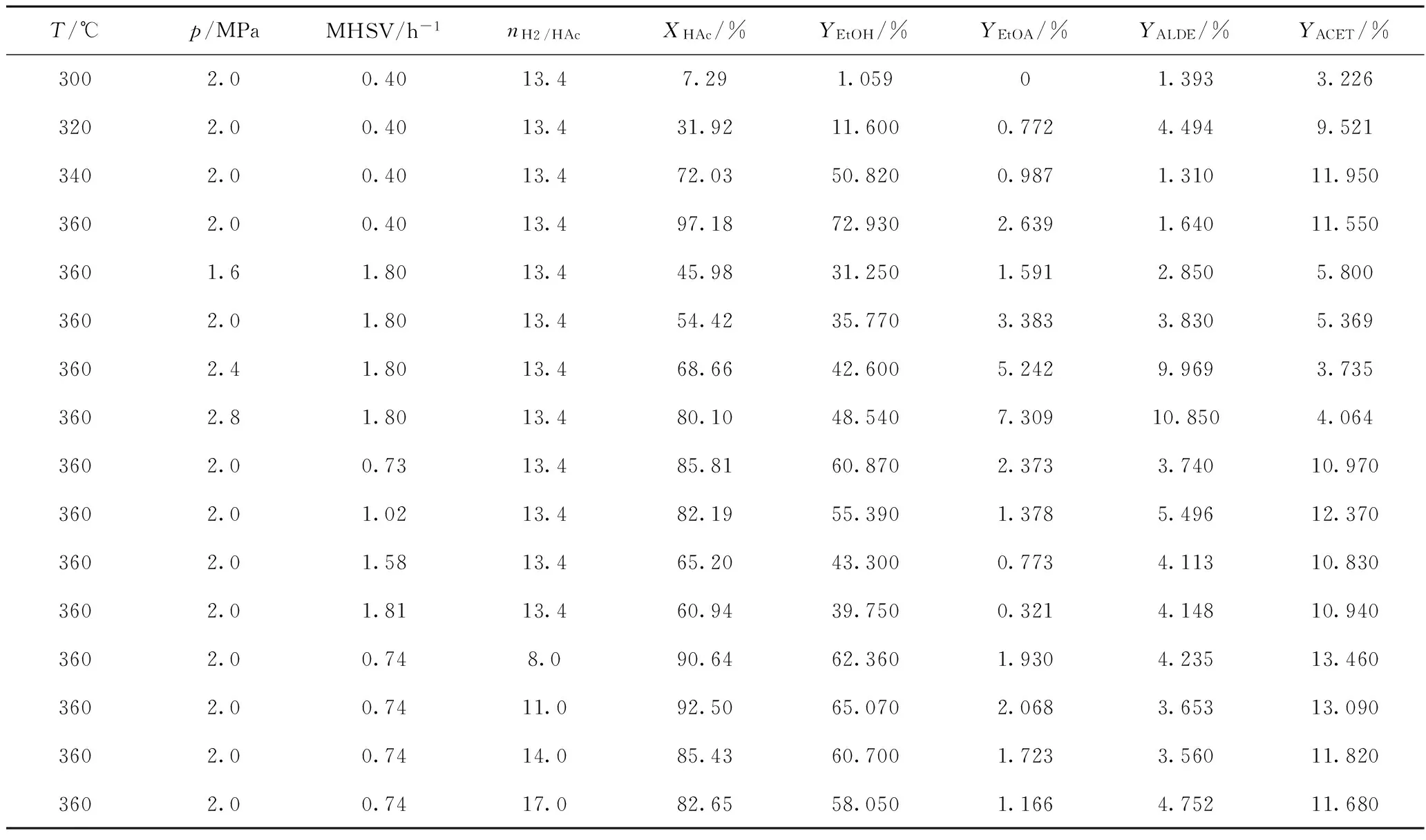
表1 乙酸加氢反应实验结果Table 1 Experimental results of acetic acid hydrogenation

图1 各组分饱和蒸气压(pS)与反应温度(T)的关系Fig.1 The relationship between the saturation vapor pressure (pS) and reaction temperature (T) for each component
由图1得知,反应产物混合物中乙酸的饱和蒸气压最低。以乙酸作为模型化合物,如果反应系统气相乙酸分压小于乙酸的饱和蒸气压,则反应流体处于气相。在反应实验中,当反应温度范围为300~360℃、反应压力为1.6~2.8 MPa、氢/酸摩尔比为8~17时,反应系统气相乙酸分压明显小于乙酸的饱和蒸气压,催化剂床层中反应流体处于气相。
3.1.2 反应气体变化分析
由于加氢反应的氢/酸摩尔比为nH2/HAc,催化剂床层入口处的H2分率为yH20=nH2/HAc/(nH2/HAc+1),入口气体总摩尔流量与乙酸进料摩尔量之比nD0=nH2/HAc+1,入口H2分率与nD0之比为yH20/nD0=nH2/HAc/(nH2/HAc+1)2。
反应气体通过催化剂床层,发生系列加氢脱氧反应,气体H2分率和气体总摩尔流量均逐渐减小。依据氢/酸摩尔比、乙酸转化率、各产物产率,确定催化剂床层出口H2分率(yH2)、出口气体总摩尔流量与乙酸进料摩尔量之比(nD)、出口H2分率与nD之比的关系式,分别表示为:
(4)
nD=1+nH2/HAc-XHAc+YEtOA+YACET+YALDE
(5)
(6)
将表1数据代入式(4),计算催化剂床层出口H2分率,其比床层入口H2分率减小0.5591%~13.1108%,平均减小5.8513%。由式(5)计算出口nD,其比床层入口nD0减小0.1855%~7.8906%,平均减小3.8649%。由式(6)计算床层出口的yH2/nD,其比床层入口yH20/nD0减小0.3743%~5.6675%,平均减小2.0854%。这是因为反应气体经过催化剂床层,其yH2和nD均减小,致使yH2/nD的减小幅度小于yH2。
在乙酸加氢制乙醇反应动力学研究中,为了简化数据处理,假设催化剂床层中的yH2/nD不变,取催化剂床层入口yH20/nD0=nH2/HAc/(1+nH2/HAc)2的数值。
3.1.3 反应动力学模型方程推导
将催化剂床层中乙酸摩尔流量与乙酸转化率的关系表示为式(7)。
vCHAc=v0CHAc0(1-XHAc)
(7)
对催化剂床层高度x处的ΔV床层体积微元进行乙酸物料衡算,将流出与流入微元的乙酸摩尔流量之差表示为:
(8)
关于气相加氢反应系统,在较高反应温度条件下,由于组分吸附平衡常数和浓度均较小,忽略组分吸附对反应速率的影响,将反应物和H2浓度对反应速率的影响均表示为1级幂函数形式[29-30]。假设乙酸浓度和H2浓度对乙酸加氢反应的影响均为1级,催化剂床层高度x处的相对高度为x与总高度之比,以Z表示。将式(7)代入式(8),得到式(9)。
(9)
考虑反应气体为理想气体,反应器催化剂装填质量为催化剂床层体积(V)与催化剂堆积密度(ρ)之积,由理想气体状态方程计算气体体积流量,H2浓度CH2=p·yH2/[R×(T+273.15)],乙酸浓度CHAc=v0CHAc0(1-XHAc)/v,对式(9)在Z为0~1范围内积分,得到乙酸转化率的反应动力学模型方程式(10)。
(10)
假设乙酸浓度和H2浓度对乙醇生成反应的影响均为1级,经过与上述相似的方法推导,得到乙醇生成速率方程式(11)和乙醇产率的动力学模型方程式(12)。
(11)
(12)
假设乙酸发生平行加氢反应,同理推导出乙酸乙酯、乙醛、丙酮具有相同形式的生成动力学模型方程,统一表示为式(13)。
(13)上述式中,气体常数R=8.314×10-3L·MPa/(K·mol),MHAc=60.05 g/mol,ρ=690.0 g/L。
依据Arrhenius方程,将反应温度对反应速率常数影响的关系式表示为:
(14)
其中,T1=360℃,ki1为T1反应温度下的乙酸加氢或各产物生成速率常数,Ei为乙酸加氢或各产物生成反应表观活化能。
3.2 动力学参数估值及模型统计检验

从表2可以看出,乙醇在反应温度360℃下的生成速率常数及表观活化能均明显大于其他产物,说明在实验条件范围内,乙酸加氢反应主要生成乙醇,并且在360℃基础上进一步升高反应温度有利于提高乙醇产率。另外,由于乙酸转化率和乙醇产率的相关系数均较大,说明乙酸加氢反应和乙醇生成反应动力学模型均具有较高的模拟计算精度。表1 数据中从大到小的顺序大致为乙酸转化率、乙醇产率、丙酮产率、乙醛产率、乙酸乙酯产率,该顺序与表2中相关系数数值大小顺序相同。由此推断,可能因为乙酸乙酯、乙醛、丙酮的产率均较低,实验误差较大,它们的相关系数均不大,模型计算精度偏低。
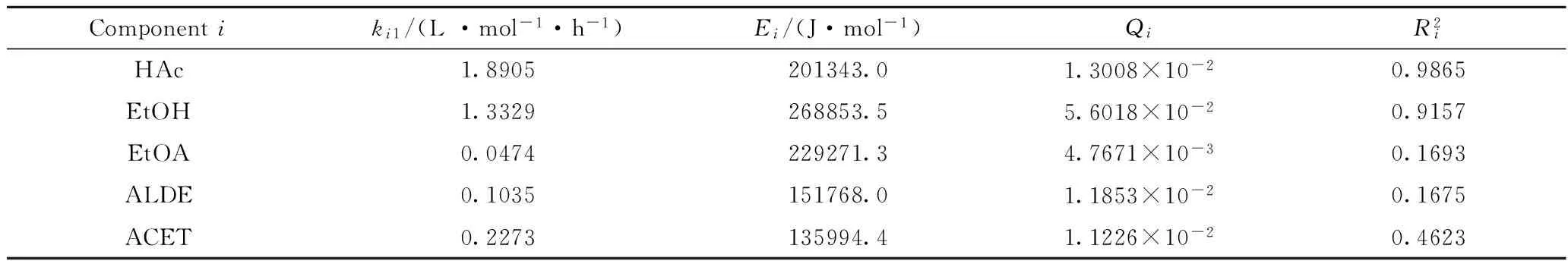
表2 动力学模型参数估值及统计检验结果Table 2 Results of paramter estimation and statistic test for kinetic models
3.3 模型预测分析
采用所建动力学模型进行反应条件预测分析,优化反应工艺条件,开展模型应用研究[31-32]。在反应压力2.5 MPa、氢/酸摩尔比10的反应条件下,将表2中的乙酸加氢速率常数和表观活化能代入式(14),计算不同反应温度下的乙酸加氢速率常数,由乙酸加氢动力学模型式(10)预测不同加氢反应温度、质量空速条件下的乙酸转化率;利用表2中的乙醇生成速率常数和表观活化能,由式(12)预测乙醇产率,结果见图2。由图2可知,随着反应温度升高或质量空速减小,乙酸转化率和乙醇产率均持续增大。在反应温度375℃、反应压力2.5 MPa、质量空速1.0 h-1、氢/酸摩尔比10加氢反应条件下,乙酸转化率和乙醇产率分别达到99.92%和94.79%。
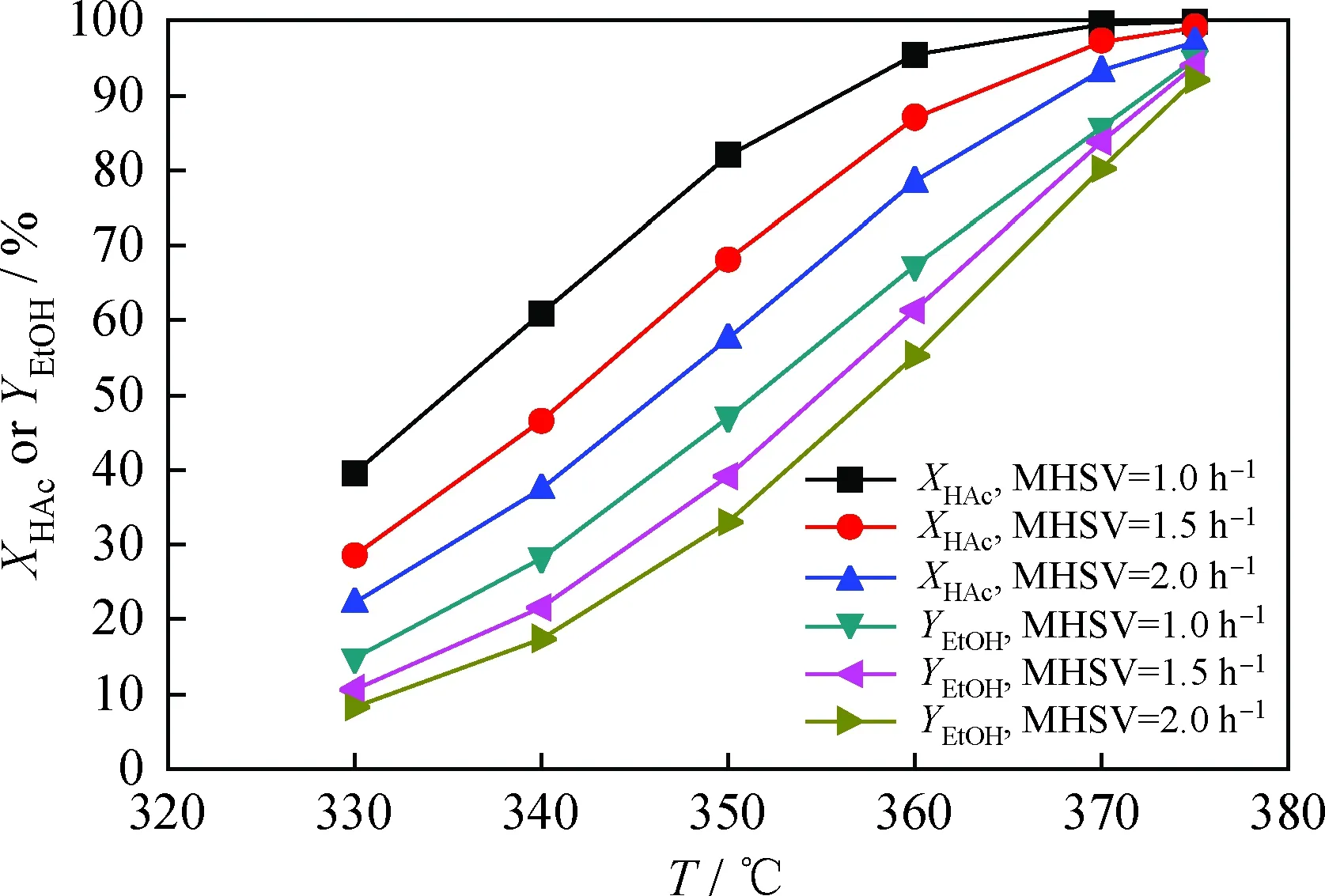
图2 反应温度(T)或质量空速(MHSV)对 乙酸转化率(XHAc)和乙醇产率(YEtOH)的影响Fig.2 Effects of reaction temperature (T) or MHSV on acetic acid conversion (XHAc) and ethanol yield (YEtOH) p=2.5 MPa; nH2/HAc=10
在反应温度370℃、质量空速1.0 h-1的条件下,由乙酸加氢动力学模型式(10)和乙醇生成动力学模型式(12)预测不同加氢反应压力、氢/酸摩尔比的乙酸转化率和乙醇产率,结果见图3。可见,在H2进料量相对乙酸远远过剩情况下,提高反应压力或减小氢/酸摩尔比均有利于增大乙酸转化率和乙醇产率。
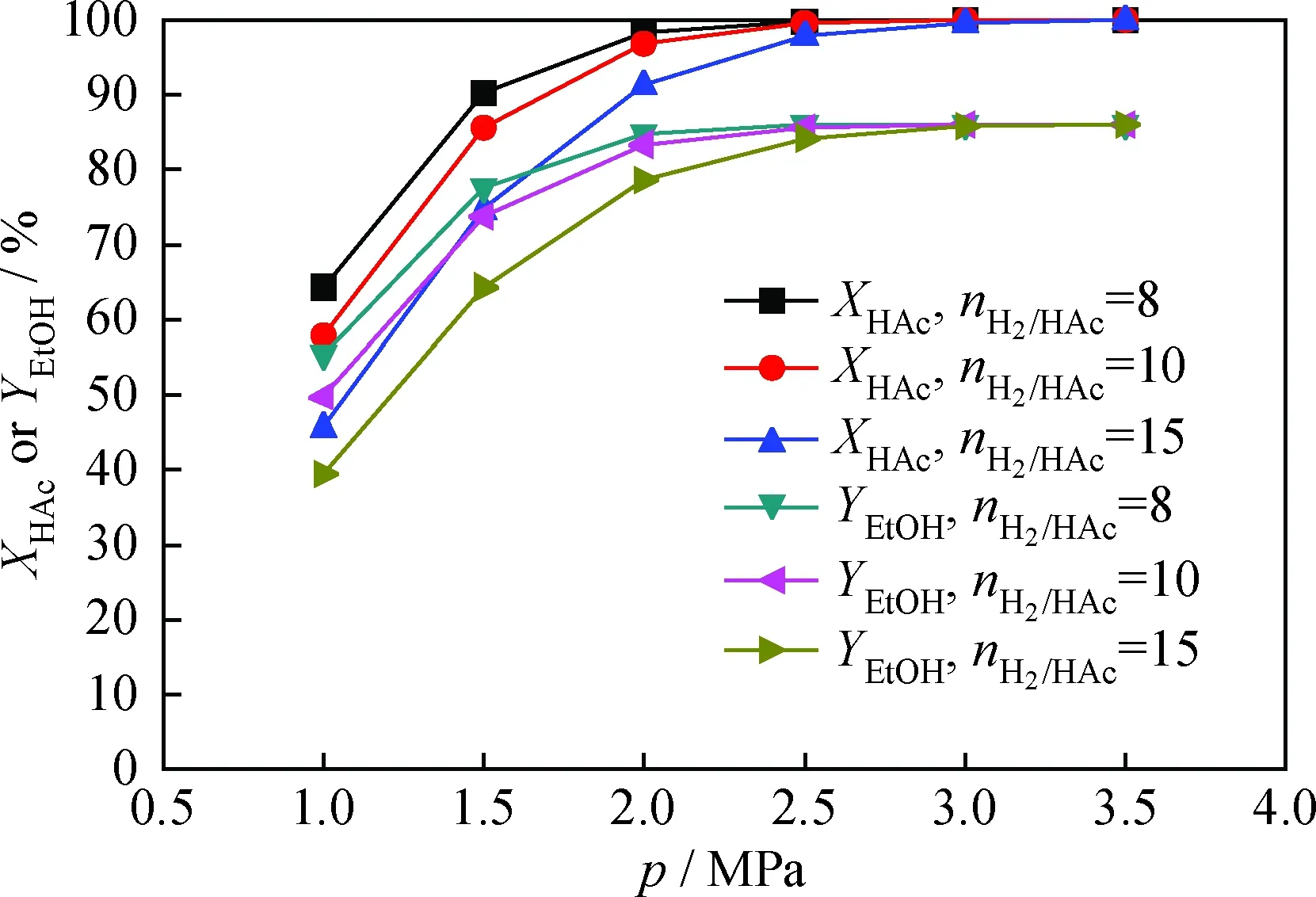
图3 反应压力(p)或氢/酸摩尔比(nH2/HAc)对 乙酸转化率(XHAc)和乙醇产率(YEtOH)的影响Fig.3 Effects of reaction pressure (p) or molar ratio of hydrogen to acid (nH2/HAc) on acetic acid conversion (XHAc) and ethanol yield (YEtOH) T=370℃; MHSV=1.0 h-1
4 结 论
(1)以次磷酸镍作为磷源和镍源、次磷酸钠作为补充磷源,通过等体积浸渍、N2流中250℃热处理过程,制备了Ni2P/SiO2催化剂。在反应温度 300~360℃、反应压力1.6~2.8 MPa、质量空速0.73~1.81 h-1、氢/酸摩尔比8~17反应条件范围内,采用固定床反应装置进行乙酸加氢反应。实验结果显示,随着反应温度升高、反应压力增大、质量空速及氢/酸摩尔比减小,乙酸转化率和乙醇产率均逐渐增大。
(2)在确定乙酸加氢反应流体为气体、分析反应气体变化的基础上,经过推导确定了乙酸加氢反应动力学模型方程,以及乙醇及其他产物生成动力学模型方程。利用加氢反应实验数据确定了各反应的360℃反应速率常数和表观活化能。统计检验结果表明,乙酸加氢反应和乙醇生成反应动力学模型均具有较高的模拟计算精度。
(3)反应动力学模型预测结果表明,随着反应温度升高、质量空速减小、反应压力提高、氢/酸摩尔比减小,乙酸转化率和乙醇产率均持续增大。在反应温度375℃、反应压力2.5 MPa、质量空速1.0 h-1、氢/酸摩尔比10加氢反应条件下,乙酸转化率和乙醇产率分别达到99.92%和94.79%。
符号说明:
B0——相对乙酸总有机物的量;
CH2——H2摩尔浓度,mol/L;
CHAc——乙酸摩尔浓度,mol/L;
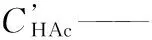
CHAc0——乙酸初始摩尔浓度,mol/L;
Ei——i组分反应表观活化能,J/mol;
kEtOH——乙醇生成速率常数,L/(mol·h);
kHAc——乙酸反应速率常数,L/(mol·h);
ki——i组分生成速率常数,L/(mol·h);
ki1——360℃的i组分速率常数,L/(mol·h);
MACET——丙酮摩尔质量,g/mol;
MALDE——乙醛摩尔质量,g/mol;
MEtOA——乙酸乙酯摩尔质量,g/mol;
MEtOH——乙醇摩尔质量,g/mol;
MHAc——乙酸摩尔质量,g/mol;
MHSV——质量空速,h-1;
nH2/HAc——氢/酸摩尔比;
p——反应压力,MPa;
pS——饱和蒸气压,MPa;
Qi——转化率或产率残差平方和;
R——气体常数,L·MPa/(mol·K);
-rHAc——乙酸加氢速率,mol/(L·h);
T——反应温度,℃;
T1——反应温度,360℃;
v——气体流量,L/h;
v’——某床层高度流出气体流量,L/h;
v0——反应器入口气体流量,L/h;
V——催化剂床层体积,L;
x——催化剂床层高度,dm;
XHAc——乙酸转化率,%;
yH2——气体中H2分率;
YACET——丙酮产率,%;
YALDE——乙醛产率,%;
YEtOA——乙酸乙酯产率,%;
YEtOH——乙醇产率,%;
Z——催化剂床层相对高度;
ρ——催化剂堆积密度,g/L。
[1] 李扬, 曾健, 王科, 等. 醋酸酯化合成乙醇工艺及经济性分析[J].精细化工原料及中间体, 2011, (11): 6-10.(LI Yang, ZENG Jian, WANG Ke, et al. Technology and economic analysis of ethanol synthesis by acetic acid esterification[J].Fine Chemical Raw Materials and Intermediates, 2011, (11): 6-10.)
[2] 刘继业. 我国醋酸乙酯合成技术进展及市场分析[J].精细与专用化学品, 2010, 18(8): 5-12.(LIU Jiye. Production technologies progress and market analysis of ethyl acetate in China[J].Fine and Specialty Chemicals, 2010, 18(8): 5-12.)
[3] 王科, 陈鹏, 胡玉蓉, 等. 一种用醋酸酯加氢制备乙醇的方法: CN, 102093162A[P].2010-12-13.
[4] JOHNSTON V J, CHEN L Y, KIMMICH B F, et al. Direct and selective production of ethanol from acetic acid utilizing a platinum/tin catalyst: US, 7863489[P].2011-06-04.
[5] 王峰云, 陆大勋. 铜基催化剂上甲酸甲醋的分解和加氢动力学[J].燃料化学学报, 1988, 16(1): 17-23.(WANG Fengyun, LU Daxun. Kinetics of methyl formate decomposition and hydrogenolysis over copper based catalyst[J].Journal of Fuel Chemistry and Technology, 1988, 16(1): 17-23.)
[6] STROUPE J D. An X-ray diffraction study of the copper chromites and of the “copper-chromium oxide” catalyst[J].Journal of the American Chemical Society, 1949, 71(2): 569-572.
[7] YU Jun, MAO Dongsen, HAN Lupeng, et al. CO hydrogenation over Fe-promoted Rh-Mn-Li/SiO2catalyst: The effect of sequences for introducing the Fe promoter[J].Fuel Processing Technology, 2013, 112: 100-105.
[8] ZHAO Huabo, ZHU Qingjun, GAO Yongjun, et al. Iron oxide nanoparticles supported on pyrolytic grapheme oxide as model catalysts for Fischer Tropsch synthesis[J].Applied Catalysis A: General, 2013, 456: 233-239.
[9] ECHEANDIA S, ARIAS P L, BARRIO V L, et al. Synergy effect in the HDO of phenol over Ni-W catalysts supported on active carbon: Effect of tungsten precursors[J].Applied Catalysis B: Environmental, 2010, 101(1-2): 1-12.
[10] HOFFER B W, CREZEE E, DEVRED F, et al. The role of the active phase of Raney-type Ni catalysts in the selective hydrogenation of d-glucose to d-sorbitol[J].Applied Catalysis A: General, 2003, 253(2): 437-452.
[11] 王雪峰, 王锋, 陈满英, 等. Ni基双金属催化剂加氢脱氧性能的研究[J].燃料化学学报,2005, 33(5): 612-616.(WANG Xuefeng, WANG Feng, CHEN Manying, et al. Studies on nickel-based bimetallic catalysts for hydrodeoxygenation[J].Journal of Fuel Chemistry and Technology, 2005, 33(5): 612-616.)
[12] 吕恩静, 张怀科, 任杰. 预处理方法对Mo-Ni/γ-Al2O3催化剂加氢脱氧性能的影响[J].石油学报(石油加工), 2012, 28(5): 764-768.(LÜ Enjing, ZHANG Huaike, REN Jie. Effect of pretreatment methods of Mo-Ni/γ-Al2O3catalyst on its catalytic performance for hydrodeoxygenation[J].Acta Petrolei Sinica (Petroleum Processing Section), 2012, 28(5): 764-768.)
[13] PRASERTHDAM P, CHOUNGCHAISUKASAM P, ASSABUMRUNGRAT S, et al. Role of Sn and K on hydrogen spillover on Pt/γ-Al2O3catalyst[J].Journal of the Chinese Institute of Chemical Engineers, 2001, 32(2): 143-149.
[14] WU Zili, SUN Fuxia, WU Weicheng, et al. On the surface sites of MoP/SiO2catalyst under sulfiding conditions: IR spectroscopy and catalytic reactivity studies[J].Journal of Catalysis, 2004, 222(1): 41-52.
[15] PHILLIPS D C, SAWHILL S J, SELF R, et al. Synthesis, characterization, and hydrodesulfurization properties of silica-supported molybdenum phosphide catalysts[J].Journal of Catalysis, 2002, 207(2): 266-273.
[16] STINNER C, PRINS R, WEBER T H. Formation, structure, and HDN activity of unsupported molybdenum phosphide[J].Journal of Catalysis, 2000, 191(2): 438-444.
[17] WHIFFEN V M L, SMITH K J. Hydrodeoxygenation of 4-Methyphenol over unsupported MoP, MoS2, and MoOxcatalysts[J].Energy & Fuels, 2010, 24(9): 4728-4737.
[18] ZHAO H Y, LI D, BUI P, et al. Hydrodeoxygenation of guaiacol as model compound for pyrolysis oil on transition metal phosphide hydroprocessing catalysts[J].Applied Catalysis A: General, 2011, 391(1-2): 305-310.
[19] WANG X Q, CLARK P, OYAMA S T. Synthesis, characterization, and hydrotreating activity of several iron group transition metal phosphides[J].Journal of Catalysis, 2002, 208(2): 321-331.
[20] OYAMA S T, WANG X, LEE Y K, et al. Effect of phosphorus content in nickel phosphide catalysts studied by XAFS and other techniques[J].Journal of Catalysis, 2002, 210(1): 207-217.
[21] DUAN Xinping, TENG Yang, WANG Anjie, et al. Role of sulfur in hydrotreating catalysis over nickel phosphide[J].Journal of Catalysis, 2009, 261(2): 232-240.
[22] LIU Dapeng, WANG Anjie, LIU Chenguang, et al. Bulk and Al2O3-supported Ni2P HDS catalysts prepared by separating the nickel and hypophosphite sources[J].Catalysis Communications, 2016, 77: 13-17.
[23] 宋华, 王紫东, 宋华林, 等. Ni2P/Ti-MCM-41的催化加氢脱硫性能[J].石油学报(石油加工), 2015, 31(6): 1275-1280.(SONG Hua, WANG Zidong, SONG Hualin, et al. Hydrodesulfurization performance of Ni2P/Ti-MCM-41 catalyst[J].Acta Petrolei Sinica (Petroleum Processing Section), 2015, 31(6): 1275-1280.)
[24] 王海彦, 齐振东, 鄢景森, 等. Ti掺杂对Ni2P/SBA-15催化剂加氢脱氮催化性能的影响[J].石油学报(石油加工), 2015, 31(6): 1281-1287.(WANG Haiyan, QI Zhendong, YAN Jingsen, et al. The effect of Ti doping in Ni2P/SBA-15 catalyst on its catalytic hydrodenitrogenation performance[J].Acta Petrolei Sinica (Petroleum Processing Section), 2015, 31(6): 1281-1287.)
[25] SHI Guojun, SHEN Jianyi. Mesoporous carbon supported nickel phosphide catalysts prepared by solid phase reaction[J].Catalysis Communications, 2009, 10(13): 1693-1696.
[26] SHI Guojun, SHEN Jianyi. New synthesis method for nickel phosphide nanoparticles: Solid phase reaction of nickel cations with hypophosphites [J].Journal of Materials Chemistry, 2009, 19(16): 2295-2297.
[27] 李景锋, 李学辉, 柴永明, 等. 磷化镍的制备、表征及其催化性能研究进展[J].化工进展, 2013, 32(11): 2621-2630.(LI Jingfeng, LI Xuehui, CHAI Yongming, et al. Progress in the fabrication, characterization and catalytic reactivity of nickel phosphide[J].Chemical Industry and Engineering Progress, 2013, 32(11): 2621-2630.)
[28] GUAN Qingxin, LI Wei, ZHANG Minghui, et al. Alternative synthesis of bulk and supported nickel phosphides from the thermal decomposition of hypophosphites[J].Journal of Catalysis, 2009, 263(1): 1-3.
[29] NEGAHDAR L, ALSHAAL M G, HOLZHAUSER F J, et al. Kinetic analysis of the catalytic hydrogenation of alkyl levulinates toγ-valerolactone[J].Chemical Engineering Science, 2017, 158: 545-551.
[30] PIRARD S L, HEINRICHS B, HEYEN G, et al. Optimization of experimental procedure and statistical data treatment for kinetics of ethylene hydrogenation on a copper-magnesia catalyst [J].Chemical Engineering Journal, 2008, 138(1-3): 367-378.
[31] TOHIDIAN T, DEHGHANI O, RAHIMPOUR M R. Modeling and simulation of an industrial three phase trickle bed reactor responsible for the hydrogenation of 1,3-butadiene: A case study[J].Chemical Engineering Journal, 2015, 275: 391-404.
[32] ABOGHANDER N S, LOGIST F, GRACE J R, et al. Heterogeneous modeling of an autothermal membrane reactor coupling dehydrogenation of ethylbenzene to styrene with hydrogenation of nitrobenzene to aniline: Fickian diffusion model[J].Chemical Engineering and Processing, 2014, 77: 50-65.

