5株木霉菌株对鸭茅生长及营养品质的影响
袁 扬,王胤晨,曾 兵,张锦华,韩玉竹
(1.贵州省农业科学院畜牧兽医研究所,贵州 贵阳 550000; 2.西南大学动物科学学院,重庆 荣昌 402460)
近年来,畜牧业发展迅速,我国畜牧业的发展主要依靠粮食生产,使得我国人畜争粮的问题日益加剧,牧草是草食家畜的优良饲料,因此提高牧草的质量和产量能够从一定程度上解决人畜争粮的问题[1]。目前,农业生产中多以施用农药和化肥的方式提高其产量,使得土壤的肥力急剧降低,对环境和生态也造成了不同程度的破坏。因此,为了实现农业的可持续发展,对环境无害的生物肥料和生物农药的开发和应用越来越重要。
木霉属(Trichoderma)为双核菌门丝孢纲丛梗孢目丛梗孢科的真菌,是一类次级定殖真菌,广泛地分布于自然界中,主要腐生于土壤,是土壤微生物群落的重要成员。国内外的大量学者均证实了木霉菌对许多种作物的生防效果[2-4],针对牧草的促生作用及对牧草生理生化特性的影响也已有研究报道。近几年来,木霉菌被普遍认为是最有可能代替多种化学杀菌剂的生防因子,其作为一类能够促进作物生长的资源丰富的拮抗微生物,在农业可持续发展中具有越来越重要的作用[5]。
土壤微生物与植物在根际微环境中进行着复杂的互作。土壤微生物在土壤环境中扮演着重要角色,在土壤有机质降解、营养循环中是一个重要因子[6]。一些真菌菌丝与高等植物根系形成菌根,有利于提高植物的抗逆性,还有一些土壤微生物所分泌的植物激素能刺激植物根系的发育和促进植物对营养元素的吸收[7]。夏北成[8]揭示了植物通过对土壤环境的作用来影响土壤微生物群落结构和多样性。
鸭茅(Dactylisglomerata)又名鸡脚草、果园草,隶属于禾本科鸭茅属,原产于欧洲、北非及亚洲温带地区,是世界优良的多年生丛生型冷季性禾本科牧草之一,具有适应性强、营养价值高、叶量丰富、耐阴、再生速度快等特点,在欧洲、大洋洲和北美等地均有广泛种植,其中在北美的种植历史已有200多年,是目前美国大面积栽培的主要牧草之一[9-10]。我国是鸭茅的起源地之一,有很丰富的野生鸭茅资源,草质柔嫩,牛、马、羊、兔等均喜食,可用作青饲、青贮或调制干草。因此,鸭茅目前已经作为西南地区混播草地、石漠化治理以及草地畜牧业的骨干草种,有着广阔的应用前景[11]。 本研究通过对鸭茅根际微生物进行研究,分离筛选获得了5株优良木霉促生菌株,并接种在鸭茅植株上,研究其对鸭茅的生长发育、营养特征以及产量品质的影响,为生产适合我国西南地区气候、生境的生物菌肥提供菌株资源,为木霉菌剂生产上的高效利用提供理论基础和技术指导。
1 材料与方法
1.1 试验材料
供试鸭茅品种为特诺拉,其为前期筛选的适合西南地区的鸭茅优良品种,购买于北京百绿草业有限公司。
供试菌株为前期从鸭茅根际分离筛选获得的5株木霉促生菌株,来源于西南大学荣昌校区草业教研室。
1.2 试验地概况
试验地位于西南大学荣昌校区动科系草业科学教学科研示范园区,地处105°17′-105°44′ E,29°15′-29°41′ N,年降水量为1 099 mm,年活动积温6 383 ℃·d,年日照1 083 h,相对湿度72%,年均温17 ℃,超过40 ℃的天数有15 d左右。1月份最低温-4 ℃,最热7月平均气温27 ℃。试验地土壤为棕色水稻土,土质为沙壤土,土壤pH为6.5,有机质含量小于0.5%。其中,含铵态氮16.0 mg·kg-1,有效磷12.5 mg·kg-1,速效钾85.6 mg·kg-1。
1.3 试验设计
采用口径25 cm花盆,装入5 kg采自试验地的均衡混匀土壤。选取籽粒饱满、无损伤、大小一致的鸭茅种子,按每盆30粒播种量置于90 mm的培养皿中,根据前期试验发现3个哈茨木霉菌株(M1,M2,HM)在PDA培养基上的菌落形态不同,故将3个菌株均作为此次试验不同处理。用浓度均为10-9cfu·cm-3的哈茨木霉1(Trichodermaharzianum,M1)、哈茨木霉2(M2)、哈茨木霉3(HM)、长梗木霉(Trichodermalongibrachiatum,LM)、里氏木霉(Trichodermareesei,LS)的孢子悬浮液进行种子浸泡,每皿20 mL浸泡4 h后,孢子悬浮液和种子一起均匀播种于花盆中,播种深度1.5~2.0 cm, 对照(CK)不接种木霉菌株,与木霉浸种处理播种量相同,种子经无菌水浸泡4 h,每个处理设4次重复。盆栽置于开放式大棚内,待花盆鸭茅齐苗后进行间苗,每盆留生长良好的鸭茅6株,再浇一次20 mL 10-9cfu·cm-3的木霉孢子液。培养期间定期浇水、除草,保持土壤含水量15%左右。自鸭茅播种120 d(分蘖期)进行生长指标和品质指标的测定。
1.4 测定指标与方法
1.4.1生长指标的测定
株高:分别测定每盆内6株鸭茅植株和地面垂直时的高度,即把植株拉直后的长度。分蘖数:分别测定每盆内6株鸭茅植株在地面以下或近地面处所发生的分枝数。叶长:分别测定每盆内6株鸭茅植株从上至下的第3片叶子的长度。叶宽:分别测定每盆内6株鸭茅植株从上至下的第3片叶子最宽处的长度。鲜重及干重为每盆6株鸭茅植株的重量。
1.4.2品质指标
干物质(DM):采用烘箱干燥法,105 ℃烘干至恒重。粗蛋白(CP):采用半微量凯氏定氮法。粗脂肪(EE):采用索氏提取法。钙(Ca):采用高锰酸钾滴定法。磷(P):采用钼锑抗比色法。中性洗涤纤维(NDF)、酸性洗涤纤维(ADF):采用酸碱消煮法。具体测定步骤参照第三版《饲料分析及饲料质量检测技术》[12]。
1.5 数据统计与分析
对试验测定数据采用Excel 2007和SPSS 13.0进行统计与方差分析,各个处理的多重比较采用Duncan新复极差法,试验数据均表示为平均数±标准差。
2 结果与分析
2.1 木霉菌对鸭茅生长指标的影响
接种木霉菌处理,鸭茅株高、叶长均小于对照处理(表1),其中HM菌株处理极显著降低了鸭茅株高(P<0.01),显著降低了叶长(P<0.05)。M1菌株和LM菌株处理下的,植物株高和LM菌株处理的叶长最接近对照处理,且与对照差异不显著(P>0.05)。各处理平均株高和叶长分别较对照减少了6.31 cm(8.17%)和7.19 cm(10.93%)。接种5株木霉菌的处理均极显著(P<0.01)提高了鸭茅植株的分蘖数,其中M1和M2菌株的处理后分蘖数最多,达5个,各处理分蘖数较对照平均增加2.22个(83.15%)。各处理对鸭茅植株的叶宽也稍有提高,其中M1菌株处理的叶宽显著大于对照(P<0.05),达6.66 mm,其余各处理与对照无显著差异(P>0.05),各处理平均叶宽较对照增加0.31 cm(5.17%)。接种5株木霉菌的处理对鸭茅植株的地上生物量和地下生物量均有所提高(表1)。其中地上鲜重和干重仅LM处理与对照差异不显著(P>0.05),其余4株木霉处理均极显著(P<0.01)或显著(P<0.05)高于对照,M1处理的地上鲜重和干重最高,分别达48.80和12.94 g,各处理地上鲜重和地上干重较对照平均增加8.74 g(27.46%)和2.88g(37.80%)。M1菌株处理的地下鲜重和干重极显著(P<0.01)和显著大于对照(P<0.05),分别达13.12和4.89 g,各处理平均地下鲜重和干重分别较对照增加2.74 g(32.85%)和0.40 g(9.50%)(表1)。
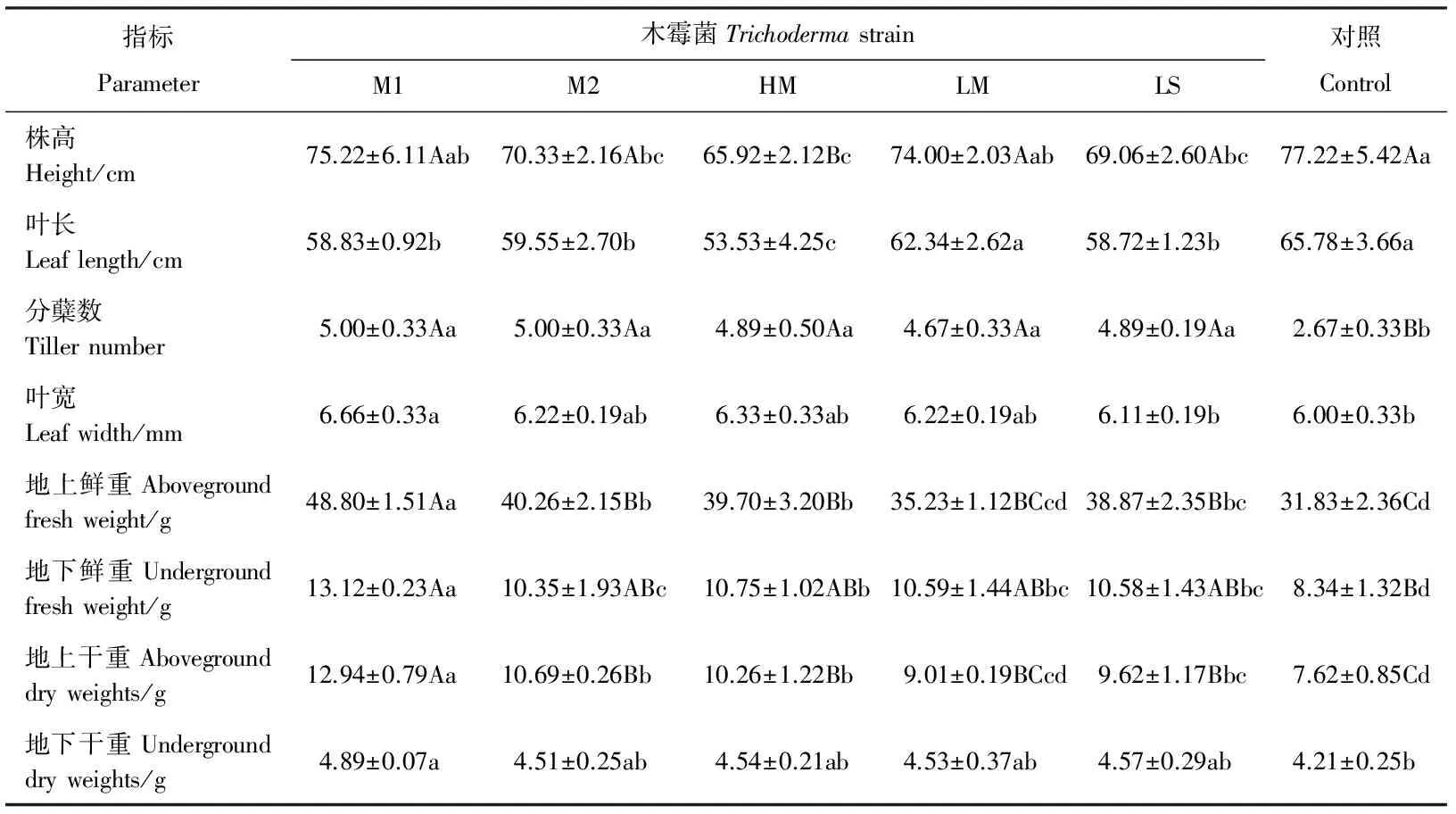
表1 木霉菌对鸭茅生长的影响Table 1 Effect of Trichoderma strains on Dactylis glomerata growth
同行不同大写字母和小写字母分别表示不同木霉菌与对照间差异极显著(P<0.01)和显著(P<0.05)。M1,M2,HM,LM,LS分别为哈茨木霉1-3,长梗木霉,里氏木霉。下同。
Different capital letters and lowercase letters within the same row indicate significant difference among different treatments at 0.01 and 0.05 levels, respectively. M1, M2, HM, LM, LS indicateTrichodermaharzianum1-3,T.longibrachiatumandT.reesei; similarly for Table 2.
2.2 木霉菌对鸭茅营养成分的影响
木霉菌处理的鸭茅植株干物质以及粗灰分含量均高于对照(表2)。其中M1、M2菌株处理的干物质含量显著高于对照(P<0.05),分别达26.51%和26.58%,其余3株木霉处理与对照差异不显著(P>0.05)。各处理粗灰分含量与对照差异不显著(P>0.05),其中M1菌株粗灰分含量最高,达14.99%。各处理平均干物质量及粗灰分含量分别较对照增加了8.16%和5.73%。
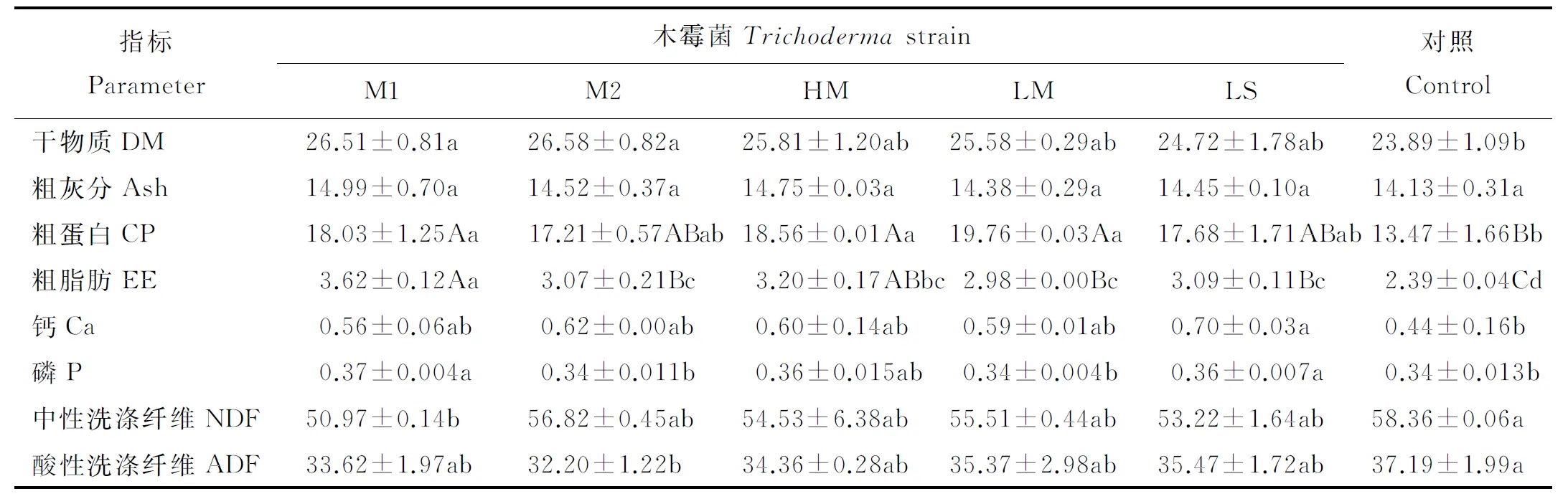
表2 木霉菌对鸭茅营养成分的影响Table 2 Effect of Trichoderma strain on nutrient levels of Dactylis glomerata %
DM, dry matter; Ash, thick ash; CP, crude protein; EE, ether extract; Ca, calcium; P, phosphorus; NDF, neutral detergent fiber, ADF, acid detergent fiber.
木霉处理显著提高了鸭茅植株的粗蛋白含量(P<0.05),且极显著提高了鸭茅植株粗脂肪的含量(P<0.01)(表2)。LM菌株处理的粗蛋白含量最高,达19.76%, M1菌株处理的粗脂肪含量最高,达3.62%。各处理的平均粗蛋白和粗脂肪的含量分别较对照增加了34.48%和33.47%。
从钙、磷含量来看,木霉处理均能提高鸭茅植株的钙和磷含量(表2)。其中,LS菌株处理的钙含量为0.7%,显著高于对照(P<0.05),其余4株木霉处理与对照差异不显著(P>0.05)。M1菌株和LS菌株处理的磷含量分别为0.37%和0.36%,显著高于对照,其余3株木霉处理与对照差异不显著。各处理的钙、磷平均含量分别较对照增加38.64%和5.95%。
5株木霉处理对鸭茅植株的中性洗涤纤维和酸性洗涤纤维的含量均有降低作用(表2)。M1菌株的中性洗涤纤维含量为50.97%,显著低于对照(P<0.05),其余4株木霉处理与对照差异不显著(P>0.05)。M2菌株处理的酸性洗涤纤维含量为32.20%,显著低于对照,其余4株木霉处理与对照差异不显著。各处理中性洗涤纤维和酸性洗涤纤维的平均含量分别较对照降低7.11%和8.04%。
3 讨论与结论
3.1 木霉菌对鸭茅生长指标的影响
国内外已经有许多研究报道指出,很多木霉菌株对多种作物均有一定程度促生效应,能够促进植物种子的萌发、植株的生长,并提高作物产量等[13]。通过深绿木霉发酵液处理盆栽黑麦草(Loliumperenne)和白三叶(Trifoliumrepens),结果表明,黑麦草幼苗的株高、植株鲜重、干重的相对增长率分别为13.33%、40.57%、73.68%,白三叶的株高、植株鲜重、干重的相对增长率分别为13.18%、57.73%、54.35%[14-15]。温室及大田试验表明,哈茨木霉T22及深绿木霉(T.atroviride)P1对莴苣(Lactucasativa)、番茄(Lycopersiconesculentum)和胡椒(pipernigrum)均有促生长作用,作物产量较未经木霉处理的有极显著提高[16]。对辣椒(Capsicum)种子进行哈茨木霉菌剂处理,并在移栽时施用木霉菌剂,结果发现,种子发芽率明显提高,后期辣椒的株高及叶片面积也得到显著促进[17]。6 株木霉菌剂对土壤处理后进行盆栽试验结果显示,供试木霉菌株对大豆(Glycinemax)植株的生长均有促进作用,各处理的株高、茎粗、根长及干物质积累均高于对照[18]。
本研究中,5株木霉处理后的鸭茅植株的地上鲜重、地下鲜重、地上干重、地下干重、分蘖数及叶宽均较对照有所增加,与前人的研究结果一致;5株木霉处理的株高和叶长却较对照有所降低,原因可能是木霉菌株很大程度上增加了鸭茅植株的分蘖数,从而影响了株高及叶长。但综合所有生长指标来看,木霉菌株对鸭茅植株的生长有显著的促进作用。
3.2 木霉菌对鸭茅常规养分的影响
牧草的营养价值是衡量其饲用价值高低的非常重要的指标,是指草食家畜能够吸收利用的营养物质,影响畜产品的质量及产量[19-21]。干物质(DM)、粗灰分(Ash)、粗蛋白(CP)、粗脂肪(EE)、钙(Ca)、磷(P)、中性洗涤纤维(NDF)及酸性洗涤纤维(ADF)等含量的高低是评价牧草营养价值的主要指标。国内外有许多研究指出,木霉菌株对寄主产生促生作用均是通过生长性能及抗性指标的变化来体现的[22-25],对植株本身营养物质变化的研究甚少。本研究中经5株木霉菌株处理的鸭茅植株的干物质、粗灰分、粗蛋白、粗脂肪及钙、磷等营养物质的含量均有不同程度的增加,中性洗涤纤维和酸性洗涤纤维也有不同程度的降低。研究结果表明,木霉菌株不仅能提高鸭茅植株的产量,对营养物质的含量也有促进作用。
3.3 木霉菌促生机制
木霉菌对植物具有如此好的促生作用,其促生机制也引起了大量学者们的研究,其促生机制很复杂,因此目前还没有公认的能够解释木霉促生作用的机制[26],学者们的研究结果主要有以下几方面,即能够产生植物生长调节剂、提高植物养分利用率、影响植物根际微生态、诱导植物产生抗性[27]。
植物生长调节剂,是能显著调节植物生长发育的一类微量有机物质,又称外源植物激素。已有许多研究表明,植物根际或与植物共生的微生物能够产生植物激素,从而影响植物的生长。科学家们通过温室接种哈茨木霉后发现,能促进番茄幼苗根的生长且提高了产量,并证明原因可能是吲哚乙酸产生的作用[28]。另有学者从木霉菌的次代谢产物中分离纯化出了一种类植物生长素6-PP,不仅对番茄和油菜(Brassicanapus)的生长有促进作用,还能减少植物病害的发生[16]。
土壤中存在许多不能被植物完全吸收利用的以微溶或难溶状态存在的营养元素,而通过施用木霉菌使其在植物根部定殖后,可以螯合或降解以提高植物对矿物质及某些微量元素的吸收能力。在辣椒栽培中应用黄绿木霉(T.aureoviride)菌剂能提高土壤中有效磷及碱解氮的含量,并提高了辣椒的质量和产量[23]。棘孢木霉(T.asperellum)可以改善土壤中的水解氮质量分数,促进青蒿(Artemisiaannua)的生长[29]。
植物根际周围存在一些非致病但不利于植物生长的有害菌群,这些菌群通常会产生有利于其自身生长但是对植物生长有抑制作用的化合物,如氰化物。通过研究发现,木霉菌不仅对氰化物有耐受性,并能产生两种降解该氰化物的酶,以防止对植物根部造成伤害[30]。
诱导抗性是指植物自身的防御系统被外来刺激激活,使植物能够抵御病原菌或害虫以及逆境条件下对植物的伤害,从而促进植物生长的特性。有研究表明,木霉菌种衣剂能够诱导作物对玉米弯孢叶斑病产生系统抗病性,哈茨木霉处理黄瓜(Cucumissativus)根、叶能明显使其产生诱导抗性[31]。通过绿色木霉处理黄瓜,结果发现,黄瓜可被刺激产生分裂素蛋白激酶,从而被诱导产生系统抗性,对丁香假单胞菌(Pseudomonassyringae)在黄瓜上引起的细菌性角斑病有明显的抑制作用[32]。因此,木霉不仅能够通过自身产生的抗菌物质来抑制病原真菌的生长,还能够诱导植物产生抗菌物质以抵抗病原菌对植物的入侵[33]。
5株木霉菌株对鸭茅植株均有良好的促生作用,能明显提高鸭茅的营养品质。各处理与对照组相比,地上鲜重、地下鲜重、地上干重、地下干重、分蘖数及叶宽等均有所增加,株高及叶长较对照有一定程度降低。5株木霉处理均能提高鸭茅植株干物质、粗灰分、粗蛋白、粗脂肪及钙、磷的含量;有效降低了鸭茅植株中的中性洗涤纤维、酸性洗涤纤维的含量。综合5株木霉菌株在鸭茅植株上的接种效果来看,M1菌株即哈茨木霉1菌株表现最优。
References:
[1] 王国刚,王明利,王济民.中国南方牧草产业发展基础前景与建议.草业科学,2015,32(12):2114-2121.
Wang G G,Wang M L,Wang J M.China southern grass industry development foundation,prospects and suggestions.Pratacultural Science,2015,32(12):2114-2121.(in Chinese)
[2] 姜传英,朱国栋,姚志红.3个棘孢木霉菌株对山新杨组培移栽苗生长和光合特性的影响.草业科学,2016,33(6):1189-1199.
Jiang C Y,Zhu G D,Yao Z H.Effects of threeTrichodermaasperellumstrains on the growth and photosynthetic characteristics of tissue-culturedPopulusdavidiana×P.albavar.pyramidalisseedlings,Pratacultural Science,2016,33(6):1189-1199.(in Chinese)
[3] 席亚东,陈国华,谢丙炎.不同木霉菌株对辣椒疫霉菌的防控作用.北方园艺,2016(21):115-119.
Xi Y D,Chen G H,Xie B Y.Prevention and control ofPhytophthoracapsiciby differentTrichodermastrains.Northern Horticulture,2016(21):115-119.(in Chinese)
[4] 王建锋,陆宁海.木霉菌在农业中的研究与应用前景.安徽农学通报,2008,14(14):41-43.
Wang J F,Lu N H.Research and application prospect ofTrichodermain agriculture.Anhui Agricultural Science Bulletin,2008,14(14):41-43.(in Chinese)
[5] 苏胜荣.木霉菌生防机制及分类的研究进展.黄山学院学报,2007,9(3):97-102.
Su S R.Research progress on the mechanism and classification of the prevention and control ofTrichoderma.Journal of Huangshan University,2007,9(3):97-102.(in Chinese)
[6] 李硕,聂中南,姜哲浩.鸭茅与伴生种不同混播比例对土壤微生物和酶活性的影响.草原与草坪,2017,37(2):12-19.
Li S,Nie Z N,Jiang Z H.Effects of different mixture proportion of orchardgrass and associated species on soil microorganism and enzyme activity.Grassland and Turf,2017,37(2):12-19.(in Chinese)
[7] 韩东苗.柏木低效林生态经济型改造对土壤微生物、酶活性及养分的影响.成都:四川农业大学硕士学位论文,2016.
Han D M.Effects of ecological eonomy transformation on soil microorganism and enzyme activity and nutrient in low-efficiency forest of cedarwood.Master Thesis.Chengdu:Sichuan Agricultural University,2016.(in Chinese)
[8] 夏北成.土壤微生物群落及其活性与植被的关系.中山大学学报(自然科学版),1998(3):94-98.
Xia B C.Relationship between soil microbial community and its activity and vegetation.Journal of Sun Yat-sen University (Natural Science Edition),1998(3):94-98.(in Chinese)
[9] Stewart A V,Ellison N W.The GenusDactylisin Wealth of wild Species:Role in Plant Genome Elucidation and Improvement.New York:Springer,2010:32-33.
[10] Boller B,Posselt U K,Veronesi F.Fodder Crops and Amenity Grasses Handbook of Plant Breeding.New York:Springer,2010:317-328.
[11] 曾兵,罗登,谢文刚.鸭茅物种的起源、分布及其遗传多样性研究进展.草地学报,2014,22(3):448-454.
Zeng B,Luo D,Xie W G.Research progress on the genetic diversity,origin and distribution ofDactylisglomerataspecies.Acta Agrestia Sinica,2014,22(3):448-454.(in Chinese)
[12] 张丽英.饲料分析及饲料质量检测技术.第3版.北京:中国农大出版社,2007:1-435.
Zhang L Y.Feed Analysis and Quality Detection Technology.Third edition.Beijing:China Agricultural University Press,2007:1-435.(in Chinese)
[13] Harman G E.Overview of mechanisms and uses ofTrichodermaspp.Phytopathology,2006,96(2):190-194.
[14] 张树武,徐秉良,程玲娟,薛应钰.深绿木霉对白三叶草促生作用及生理生化特性的影响.草业学报,2015,24(2):161-167.
Zhang S W,Xu B L,Cheng L J,Xue Y Y.Effects ofTrichodermavirideon growth and physiological and biochemical characteristics ofTrifoliumrepens.Acta Prataculturae Sinica,2015,24(2):161-167.(in Chinese)
[15] 吴晓青,赵忠娟,李哲.施加木霉可湿性粉剂对冬小麦田间生长的影响.山东科学,2015,28(6):35-42.
Wu X Q,Zhao Z J,Li Z.Effects of the application of wood mold powder on the growth of winter wheat field.Shandong Science,2015,28(6):35-42.(in Chinese)
[16] Vinale F,Sivasithamparam K,Ghisalberti E L.A novel role forTrichodermasecondary metabolites in the interactions with plants.Physiological and Molecular Plant Pathology,2008,72(1):80-86.
[17] 胡琼.哈茨木霉TC对辣椒促生效果的研究.安徽农业科学,2013(21):8941.
Hu Q.Effect ofTrichodermaharzianumTC on the growth of pepper.Anhui Agricultural Sciences,2013(21):8941.(in Chinese)
[18] 台莲梅,郭永霞,张亚玲.木霉生防菌对大豆幼苗的促生作用及对根腐病的防治效果.安徽农业科学,2013,41(11):4820-4821.
Tai L M,Guo Y X,Zhang Y L.Effects ofTrichodermaspp. on growth of soybean seedlings and control of root rot.Anhui Agricultural Sciences,2013,41(11):4820-4821.(in Chinese)
[19] 邹小艳,罗彩云,徐世晓.不同种牧草的产量和品质.草地学报,2015,23(5):1064-1067.
Zou X Y,Luo C Y,Xu S X.Production and quality of different forage species.Acta Agrestia Sinica,2015,23(5):1064-1067.(in Chinese)
[20] 韩东辰.有机肥对黑麦草营养品质和土壤N、P含量的影响.吉林:吉林农业大学硕士学位论文,2015.
Han D C.Effects of organic fertilizer on the nutritional quality of ryegrass and soil N,the content of P.Master Thesis.Jilin:Jilin Agricultural University,2015 (in Chinese)
[21] 罗登,吴佳海,王少青.8个鸭茅品种(系)在渝西地区的品比试验.草业科学,2016,33(5):935-941.
Luo D,Wu J H,Wang S Q.8 cocksfoot species (lines) in the western area of the comparative test.Pratacultural Science,2016,33(5):935-941.(in Chinese)
[22] Al-Hazmi A S,Tariqjaveed M.Effects of different inoculum densities ofTrichodermaharzianumandTrichodermavirideagainstMeloidogynejavanicaon tomato.Saudi Journal of Biological Sciences,2016,23(2):288-292.
[23] 迟莉.黄绿木霉菌及其混剂对辣椒植株及土壤的影响.黑龙江农业科学,2013(7):42-44.
Chi L.Effects ofTrichodermaaureovirideand its mixture on pepper plant and soil.Heilongjiang Agricultural Sciences,2013(7):42-44.(in Chinese)
[24] Valenzuela N L,Angel D N,Ortiz D T,Rosas R A,García C F O,Santos M O.Biological control of anthracnose by post harvest application ofTrichodermaspp. on maradol papaya fruit.Biological Control,2015,91:88-93.
[25] 邢芳芳,高明夫,胡兆平,范玲超.木霉菌M2的鉴定及其对小白菜促生效果研究.农业资源与环境学报,2017(1):80-85.
Xing F F,Gao M F,Hu Z P,Fan L C.Identification ofTrichodermaM2 and related growth promoting effects onBrassicachinensis.Journal of Agricultural Resources And Environment,2017(1):80-85.(in Chinese)
[26] 朱双杰,高智谋.木霉对植物的促生作用及其机制.菌物研究,2006,4(3):107-111.
Zhu S J,Gao Z M.Effects ofTrichodermaon plant growth and its mechanism.Journal of Fungal Research,2006,4(3):107-111.(in Chinese)
[27] Hussain A,Arshad M,Hussain E.Response of maize (Zeamays) toAzotobacterinoculation under fertilized and unfertilized conditions.Biology and Fertility of Soils,1987,4(1/2):73-77.
[28] Gravel V,Antoun H,Tweddell R J.Growth stimulation and fruit yield improvement of greenhouse tomato plants by inoculation withPseudomonasputidaorTrichodermaatroviride:Possible role of indole acetic acid (IAA).Soil Biology and Biochemistry,2007,39(8):1968-1977.
[29] 唐磊,赵敏,张荣沭.棘孢木霉对青蒿生长量及土壤水解氮质量分数的影响.东北林业大学学报,2014(4):70-72.
Tang L,Zhao M,Zhang R S.Effects ofTrichodermaon the growth ofArtemisiaannuaand the content of hydrolysable nitrogen in soil.Journal of Northeast Forestry University,2014(4):70-72.(in Chinese)
[30] Baek J M,Bharkes R,Howell C R,Kenerley C M.The role of excellular chitinase fromTrichodermavirensGv29-8 in the biocontrol ofRhizoctoniasolani.Current Genct,1999,35(1):41-45.
[31] 陈捷,蔺瑞明,高增贵.玉米弯孢叶斑病菌毒素对寄主防御酶系活性的影响及诱导抗性效应.植物病理学报,2002,32(1):43-48.
Chen J,Lin R M,Gao Z G.The influence ofCurvularialunatatoxin on defense enzyme activities and its function in the induced resistance of corn.Journal of Plant Pathology,2002,32(1):43-48.(in Chinese)
[32] Viterbo A,Harel M,Horwitz B A,Chet I,Mukherjee P K.Trichodermamitogen-activated protein kinase signaling is involved in induction of plant systemic resistance.Applied and Environmental Microbiology,2005,71(10):6241-6246.
[33] 戚玮真.生防木霉菌对植物的解盐促生作用及其机制的硏究.济南:山东师范大学硕士学位论文,2012.
Qi W Z.Study of the biocontrol strainTrichodermaasperellumand its mechanism on plant growth promotion under salt stress.Master Thesis.Jinan:Shandong Normal University,2012.(in Chinese)

