应用消化系统全仿生模型分析酸奶发酵对钙形态的影响
陈尚龙,陈安徽,刘 辉,刘恩岐,巫永华,秦 旭
0 引 言
Ca是人体第5大营养元素,也是人体骨骼的重要成分,约占人体质量的1.8%,它对调节生理功能和维持健康具有重要意义[1],如何科学地补Ca一直都是研究热点。之前,对食品中Ca的分析多限于总量测定[2-3],形态分析较少。近年来相关研究报告[4-10]表明,无机态有益元素不易被人体吸收,生物活性低,摄入不当还会引起疾病;而有机态有益元素易被人体吸收[11],对人类科学地补充有益元素有着更重要的意义。但牛奶在发酵成酸奶后,其中富含的有机Ca是否发生改变,对补Ca而言是否有利,这方面的研究报道甚少。
本试验以市售纯牛奶和实验室发酵的酸奶为研究对象,采用体外全仿生消化(含消化酶)技术[12-15]对其进行预处理,研究酸奶发酵对Ca形态和生物可给性的影响。正辛醇在结构上与人体内的碳水化合物和脂肪类似[16],试验以正辛醇模拟细胞膜,建立正辛醇吸收模型,模拟纯牛奶和酸奶中Ca在人体胃、肠中的吸收;鉴于消化道和血管间的生物膜为类脂质膜[17-19],试验以单层脂质体模拟细胞膜,建立单层脂质体吸收模型,模拟纯牛奶和酸奶中Ca在人体胃、肠中的吸收。采用微波消解作为前处理方式,使用连续光源火焰原子吸收光谱法(continuum source flame atomic absorption spectrometry,CS FAAS)[20-27]测定各形态Ca的质量分数,为科学补Ca提供基础数据。
1 材料与方法
1.1 材料与试剂
市售纯牛奶,实验室自制酸奶(以上述纯牛奶为原料发酵制得)。
高峰α-淀粉酶、胃蛋白酶、胰酶、脂肪酶、猪胆粉、氨基葡萄糖盐酸盐、尿酸、粘蛋白、牛血清白蛋白、葡萄糖醛酸、尿素、硫氰酸钾、卵磷脂(均为分析纯) 上海源叶生物科技有限公司;无水乙醇、丙酮、无水葡萄糖、盐酸、氢氧化钠、磷酸氢二钠、无水氯化钙、碳酸氢钠、磷酸二氢钾、氯化铵、磷酸三钠、氯化镁、氯化钠、氯化钾、磷酸二氢钠、正辛醇(均为分析纯),国药集团化学试剂有限公司;浓硝酸、30%(体积分数,下同)过氧化氢、KCl、La(NO3)3(均为优级纯),国药集团化学试剂有限公司;乳酸菌酸奶发酵剂,北京川秀科技有限公司;绵白糖(食品级),徐州人和居食品厂;Ca标准溶液(1 g/L),国家化学试剂质检中心。
1.2 仪器与设备
ContrAA700高分辨-连续光源原子吸收光谱仪(配MPE60自动进样器,简称HR-CSAAS),德国Analytik Jena公司;XT-9900型智能微波消解仪、XT-9800多用预处理加热仪,上海新拓微波溶样测试技术有限公司;Cascada实验室超纯水系统,美国Pall公司;SIGMA3-30K台式高速冷冻离心机,德国SIGMA公司;L550台式低速离心机,湖南湘仪实验室仪器开发有限公司。
1.3 试验方法
1.3.1 仪器工作条件
使用HR-CS AAS(火焰法)测定Ca的工作条件:波长为422.672 8 nm,火焰类型为C2H2-Air,燃烧器类型为100 mm。
在使用HR-CS AAS测定Ca时,流量比(乙炔/空气)和燃烧器高度都是影响测定结果的重要参数[1]。由于ContrAA 700 HR-CS AAS的空气流量为470 L/h,无法调节,改变流量比只能通过调节乙炔流量。通过优化,试验选择最佳乙炔流量为70 L/h,最佳燃烧器高度为6 mm。
1.3.2 标准工作曲线的配制
用0.5% HNO3将Ca标准溶液(1 g/L)进行逐级稀释,配制成0~10 mg/L的标准系列溶液,并向其中添加KCl和La(NO3)3溶液[1],使其都含有质量分数1% KCl和质量分数0.5% La(NO3)3。
1.3.3 酸奶发酵
工艺流程:纯牛奶→配料→杀菌→冷却→接种→搅拌→灌装→发酵→冷藏→成品。
操作要点:本试验以分析所用纯牛奶为原料,加入质量分数4%绵白糖,溶解后煮沸5 min以达到杀菌效果。冷却至室温后加入质量分数0.1%乳酸菌酸奶发酵剂,搅拌混匀后将其装入玻璃罐中(高温杀菌),密封,放入 45℃恒温培养箱中,培养6 h后转移至冰箱中冷藏备用。
1.3.4 样品前处理及其Ca的测定
将样品(5~10 g,精确至0.1 mg)、浓HNO3(5~10mL)和30% H2O2(2~5 mL)一起置于微波消解罐中,在多用预处理加热仪上进行预处理0.5~1 h,温度由室温逐级上升至120℃。再加入2 mL 30% H2O2,按表1中条件进行微波消解,结束后将溶液转移至50 mL烧杯中加热至近干,用0.5% HNO3溶液多次冲洗烧杯中的样液,并将冲洗液转移至25 mL容量瓶中,用0.5% HNO3溶液定容至刻度,摇匀备用,同时以同样方法做空白对照[27]。根据Ca浓度的高低,用0.5% HNO3溶液对其进行适当倍数的稀释,稀释时向其中添加KCl和La(NO3)3溶液,使其都含有质量分数1% KCl和质量分数0.5% La(NO3)3,然后再用HR-CS FAAS进行测定。

表1 微波消解条件Table 1 Conditions of microwave digestion
在使用HR-CS AAS测定Ca时,为了消除磷酸根等离子的干扰,通常选择添加硝酸镧作为释放剂,镧离子可以与磷酸根形成磷酸镧,从而将Ca从磷酸钙中释放出来,干扰和释放反应方程如公式(1)~(2)[1]。
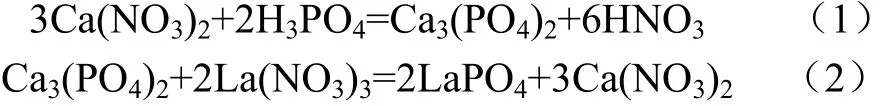
试验固定其他参数,只改变待测样品中硝酸镧质量分数,测定Ca的吸光度,如图1所示。
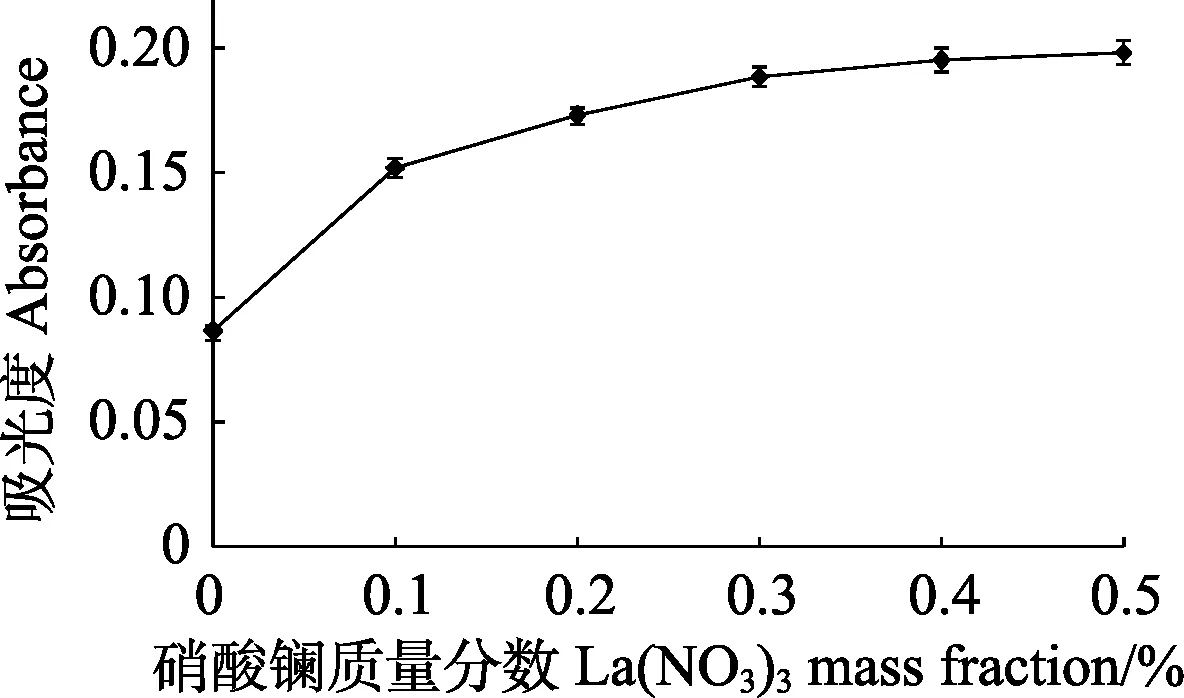
图1 硝酸镧质量分数对吸光度的影响Fig.1 Effect of La(NO3)3 mass fraction on absorbance
由图 1可知,硝酸镧质量分数对吸光度有较大的影响,试验选择待测样品中最佳硝酸镧质量分数为0.5%。
1.3.5 仿生液的制备
胃、肠全仿生消化液的制备:根据表2,分别加入唾液、胃液、十二指肠液和胆汁中所含的有机物和无机物,利用HCl和NaHCO3调整pH值,再用超纯水定容至500 mL,置于 4℃冷藏保存备用。使用前,在此基础上分别加入相应的消化酶。
胃全仿生提取液的制备:准确称取125 g纯牛奶(酸奶)置于1 000 mL三角瓶中,加入5.00 mL唾液,在37℃下恒温振荡5 min后(振荡速度为60 r/min),再加入75.0 mL胃液,在37℃下恒温振荡2 h(振荡速度为60 r/min),结束后离心20 min(离心速度为4 200 r/min)达到固液分离,得上清液(胃全仿生提取液),并称量质量,置于4℃冷藏保存备用。
肠全仿生提取液的制备:准确称取125 g纯牛奶(酸奶)置于1 000 mL三角瓶中,加入5.00 mL唾液,在37℃下恒温振荡5 min后(振荡速度为60 r/min),加入75.0 mL胃液,在37℃下恒温振荡2 h(振荡速度为60 r/min),再加入100.0 mL十二指肠液和40.0 mL胆汁,在37℃下恒温振荡7 h(振荡速度为 60 r/min),结束后离心20 min(离心速度为4 200 r/min)达到固液分离,得上清液(肠全仿生提取液),并称量质量,置于4℃冷藏保存备用。
1.3.6 不同形态Ca的分离和测定
可溶态与悬浮态的分离和测定:准确称取40 g全仿生提取液置于50 mL离心管中,离心10 min(离心速度为11 000 r/min)后取上清液,再过0.45 μm滤膜,得可溶态溶液[18],并称量质量。按 1.3.4节方法对可溶态溶液进行消解和测定,测定结果为可溶态Ca质量分数,再将剩余可溶态溶液置于4℃冷藏保存备用。
悬浮态Ca = Ca总量 - 可溶态Ca (3)
可溶态中有机态和无机态的分离和测定:准确称取5.0 g可溶态溶液,过D101大孔吸附树脂(用2倍体积左右的无水乙醇浸泡24 h左右,去离子水冲至中性),用1% HNO3以2.0 mL/min的流速洗涤树脂,收集250 mL洗出液,按1.3.4节方法对洗出液进行消解和测定[28],测定结果为可溶态中无机态Ca质量分数。

表2 唾液、胃液、十二指肠液、胆汁组成成分表[18,29]Table 2 Main components of saliva, gastric juice,duodenal juice and bile
1.3.7 吸收模型的制备及其体外吸收
正辛醇吸收模型的制备:取适量正辛醇与超纯水以体积比 1∶10进行混合,强力振荡均匀后转移至分液漏斗中,避光静置12 h待其分层,上层为被水饱和的正辛醇,下层为被正辛醇饱和的水,避光保存,备用。
正辛醇吸收模型的体外吸收:准确移取1.00 mL可溶态溶液置于50 mL离心管中,加入1.00 mL被水饱和的正辛醇和20.00 mL被正辛醇饱和的水,在37 ℃下恒温振荡5 h(震荡速度为250 r/min)后,再在4 ℃下恒温离心10 min(离心速度为11 000 r/min),结束后用胶头滴管吸去离心管上层正辛醇相,最后用超纯水将剩余溶液定容至25 mL,按1.3.4节方法对上述溶液进行消解和测定,测定结果为正辛醇吸收模型中水溶态Ca质量分数。

正辛醇吸收模型中分配系数 KOW值为正辛醇醇溶态Ca和正辛醇吸收模型中水溶态Ca的比值,KOW值越大,说明亲脂性Ca质量分数越高,越有利于人体吸收。
单层脂质体吸收模型的制备:准确称取0.001 g蛋黄卵磷脂溶于10.00 mL氯仿,溶解后将其转移至具塞圆底烧瓶中,然后置于 37 ℃真空旋转蒸发,直至形成均匀的多层脂质体膜。
单层脂质体吸收模型的体外吸收:准确移取5.00 mL可溶态溶液置于50 mL容量瓶中,用超纯水定容至刻度后,全部转移至上述圆底烧瓶中,充氮气后盖好涂有凡士林的塞子,在 37 ℃下恒温振荡 1 h(振荡速度为 100 r/min),使脂质体膜全部进入溶液中。然后将全部溶液转移至100 mL塑料管中,在超低温冰箱(-80 ℃)中冷冻20 min后取出,置于37 ℃水浴中融化,重复冻融3次,促进可溶态在单层脂质体-水体系中的分配。由于单层脂质体粒径为0.3~0.35 μm,用0.22 μm滤膜抽滤上述冻融液,收集滤液[18],按1.3.4节方法对滤液进行消解和测定,测定结果为单层脂质体吸收模型中水溶态Ca质量分数。
单层脂质体亲和态Ca
= 可溶态Ca - 单层脂质体吸收模型中水溶态Ca (5)
单层脂质体吸收模型中分配系数DMW值为单层脂质体亲和态Ca和单层脂质体吸收模型中水溶态Ca的比值,DMW值越大,说明亲脂性Ca质量分数越高,越有利于人体吸收。
1.3.8 Ca生物可给性的计算
纯牛奶(酸奶)胃、肠全仿生提取液中Ca生物可给性的计算如式(6)。
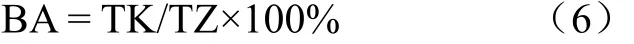
式中BA为Ca的生物可给性,%;TK为纯牛奶(酸奶)胃、肠全仿生提取液中可溶态Ca质量分数,mg/g;
TZ为纯牛奶(酸奶)中Ca总量(mg/g)。
2 结果与分析
2.1 标准工作曲线的绘制
在选定工作条件下,使用HR-CS FAAS顺序测定Ca标准系列溶液。以质量浓度(c)为横坐标、吸光度(A)为纵坐标,经ASpect CS软件绘制非线性标准工作曲线,如图2所示,所得回归方程为A=(0.002 934 2+0.047 136 5×c)/(1+0.020 721 6×c),特征浓度0.097 mg/L,相关系数为0.999 1,说明在0~10 mg/L范围内,Ca质量浓度与吸光度呈现良好的关系。

图2 标准工作曲线Fig.2 Standard working curves
2.2 加标回收率
在纯牛奶样品中加入一定量Ca标准溶液(加标水平为5.0 mg/g),然后置于微波消解罐中进行微波消解,按1.3.4节进行操作,重复6次。在选定工作条件下进行测定,计算加标回收率[30],分别为96.3%、95.7%、97.8%、94.3%、95.7%和96.5%,平均加标回收率为96.1%,RSD=1.20%,表明使用该方法测定Ca,结果准确可靠。
2.3 纯牛奶、酸奶胃全仿生提取液中 Ca的形态分析及生物可给性
按上文方法分别对纯牛奶和酸奶进行处理,根据Ca的标准工作曲线计算出各形态Ca质量分数,同时通过t检验检验数据之间是否有显著差异,结果见表3。
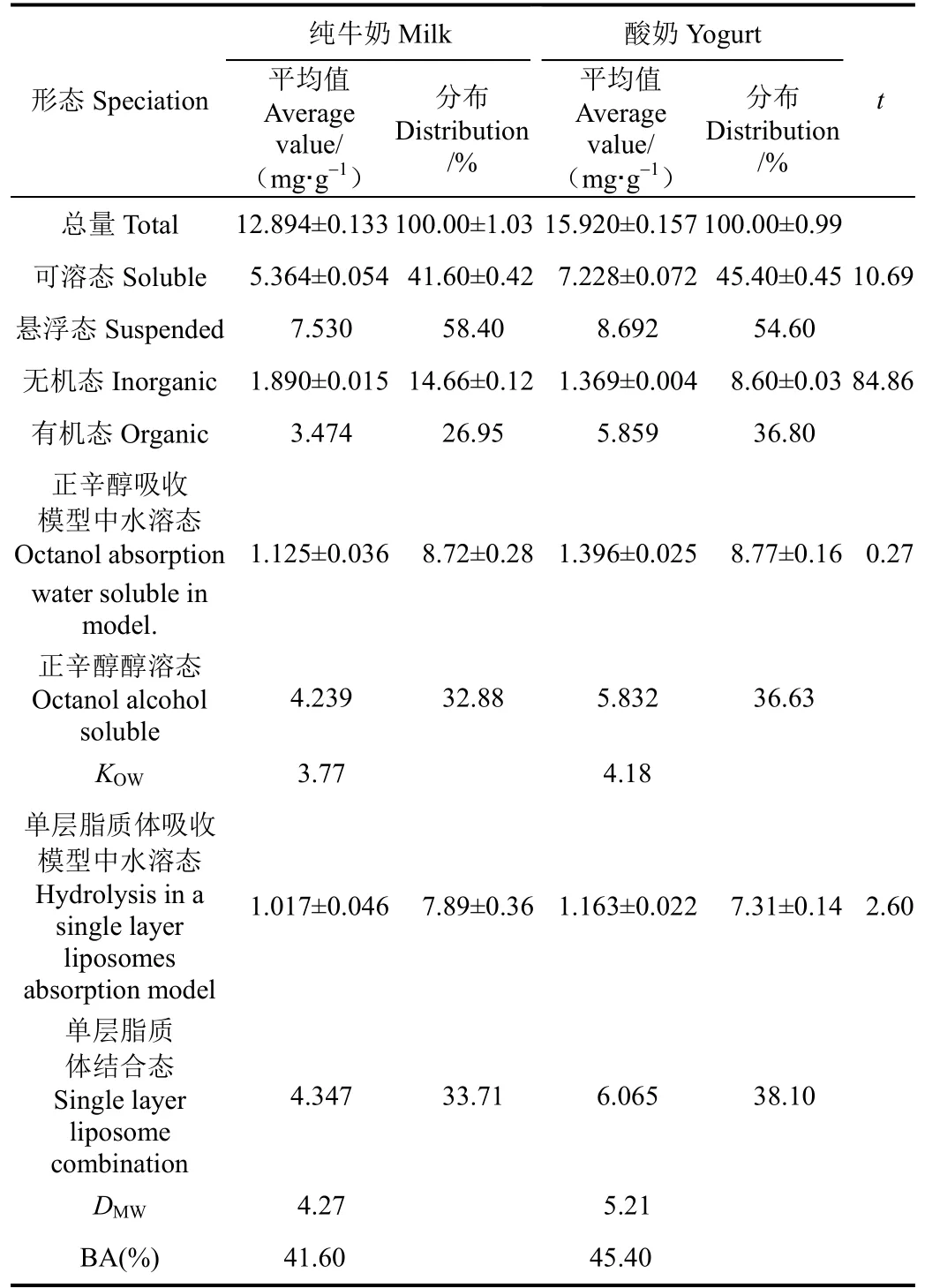
表3 纯牛奶、酸奶胃全仿生提取液中各形态Ca质量分数及生物可给性Table 3 Speciation analysis and bioavailability assessment of Ca in gastric all bionic extraction solutions of milk and yogurt
由表3可知,纯牛奶和酸奶中都含有丰富的Ca,分别为 12.894±0.133 mg/g和15.920±0.157 mg/g,酸奶中Ca质量分数高于纯牛奶,这是由于试验在发酵酸奶时,没有添加增稠剂,导致大量的乳清析出,使酸奶质量变小,Ca质量分数变高。在纯牛奶胃全仿生提取液中可溶态 Ca为5.364 mg/g,其中有机态Ca占总量的26.95%,正辛醇醇溶态Ca和单层脂质体结合态Ca分别占总量的32.88%和33.71%,KOW值和DMW值分别为3.77和4.27,Ca的生物可给性为41.60%;在酸奶胃全仿生提取液中可溶态Ca为7.228 mg/g,其中有机态Ca占总量的36.80%,正辛醇醇溶态Ca和单层脂质体结合态Ca分别占总量的36.63%和38.10%,KOW值和DMW值分别为4.18和5.21,Ca的生物可给性为45.40%。
可溶态和无机态的t值都大于2.78,表明在0.05显著性水平上所测得结果的平均值显著差异;正辛醇吸收模型和单层脂质体吸收模型中水溶态的t值都小于2.78,表明在0.05显著性水平上所测得结果的平均值没有显著差异。
综上所述,在酸奶胃全仿生提取液中可溶态Ca、有机态Ca、正辛醇醇溶态Ca和单层脂质体结合态Ca的质量分数和所占总量百分比都高于纯牛奶,KOW值、DMW值和生物可给性也高于纯牛奶。因此,在胃消化阶段,酸奶的补Ca效果优于纯牛奶。
2.4 纯牛奶、酸奶肠全仿生提取液中 Ca的形态分析及生物可给性
按上文方法分别对纯牛奶和酸奶进行处理,根据Ca的标准工作曲线计算出各形态Ca质量分数,同时通过t检验检验数据之间是否有显著差异,结果见表4。
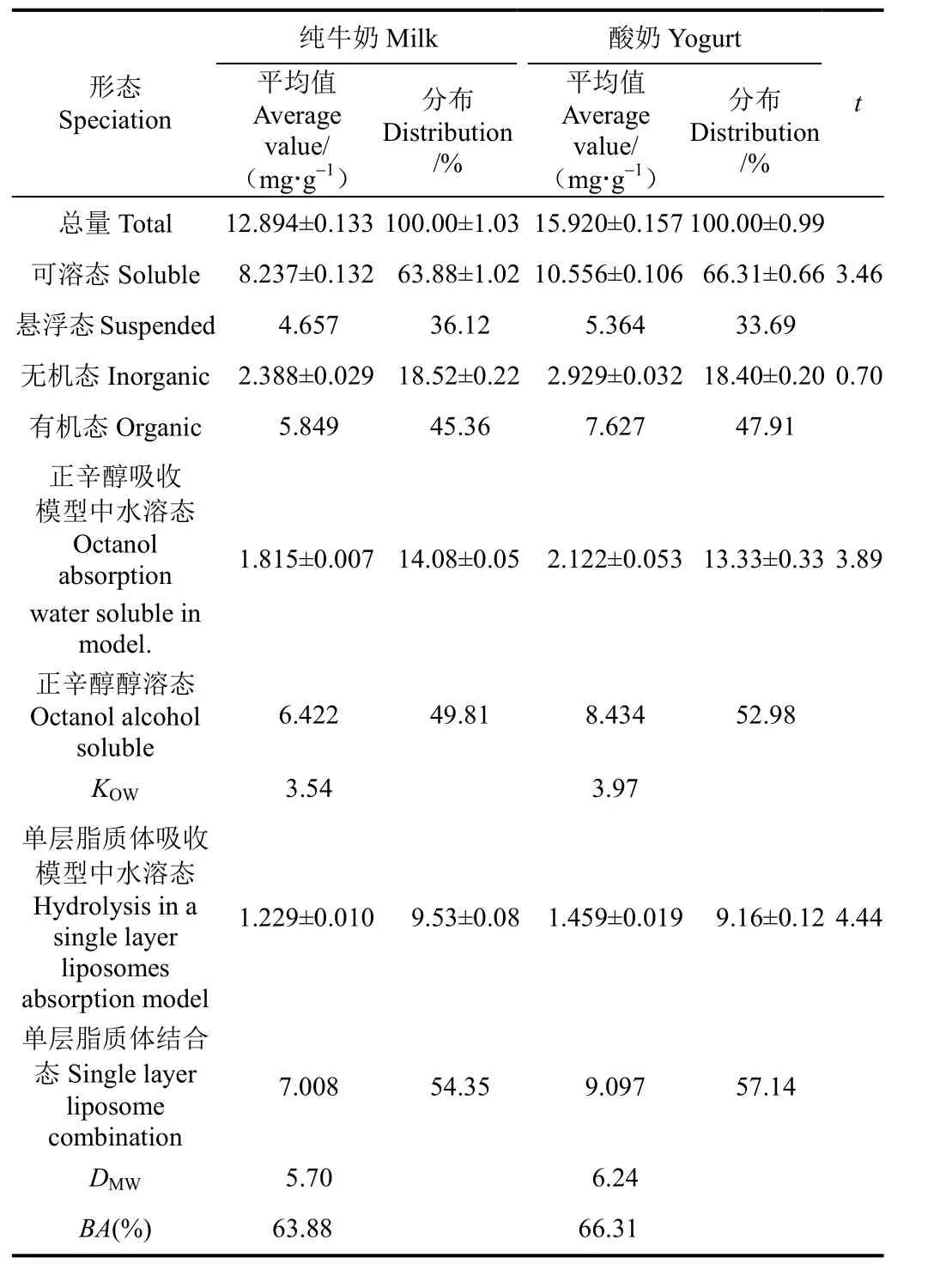
表4 纯牛奶、酸奶肠全仿生提取液中各形态Ca质量分数及生物可给性Table 4 Speciation analysis and bioavailability assessment of Ca in intestinal all bionic extraction solutions of milk and yogurt
由表4可知,在纯牛奶肠全仿生提取液中可溶态Ca为8.237 mg/g,其中有机态Ca占总量的45.36%,正辛醇醇溶态Ca和单层脂质体结合态Ca分别占总量的49.81%和54.35%,KOW值和DMW值分别为3.54和5.70,Ca的生物可给性为63.88%;在酸奶肠全仿生提取液中可溶态Ca为10.556 mg/g,其中有机态Ca占总量的47.91%,正辛醇醇溶态 Ca和单层脂质体结合态 Ca分别占总量的52.98%和57.14%,KOW值和DMW值分别为3.97和6.24,Ca的生物可给性为66.31%。
可溶态和正辛醇吸收模型中水溶态的 t值都大于2.78,表明在 0.05显著性水平上所测得结果的平均值显著差异;无机态和单层脂质体吸收模型中水溶态的t值都小于2.78,表明在0.05显著性水平上所测得结果的平均值没有显著差异。
综上所述,在酸奶肠全仿生提取液中可溶态Ca、有机态Ca、正辛醇醇溶态Ca和单层脂质体结合态Ca的质量分数和所占总量百分比都高于纯牛奶,KOW值、DMW值和生物可给性也高于纯牛奶。因此,在肠消化阶段,酸奶的补Ca效果也优于纯牛奶。
3 结 论
1)试验采用体外全仿生消化技术模拟纯牛奶和酸奶在人体胃、肠的消化过程,通过0.45 μm微孔滤膜和D101大孔树脂实现不同形态Ca的分离。
2)分别以正辛醇和单层脂质体模拟细胞膜,建立正辛醇吸收模型和单层脂质体吸收模型,模拟纯牛奶和酸奶中Ca在人体胃、肠中的吸收。
3)使用微波消解-HR-CS FAAS测定纯牛奶和酸奶中Ca分别为12.894和15.920 mg/g,酸奶中Ca质量分数高于纯牛奶。在酸奶胃、肠全仿生提取液中可溶态Ca、有机态Ca、正辛醇醇溶态Ca和单层脂质体结合态Ca的质量分数和所占总量百分比都高于纯牛奶,KOW值、DMW值和生物可给性也高于纯牛奶,表明酸奶的补Ca效果优于纯牛奶。
[1] 宋慧,陈尚龙,李超,等. 火焰原子吸收光谱法测定牛奶中不同化学形态的钙[J]. 食品科学,2012,33(22):278-281.Song Hui, Chen Shanglong, Li Chao, et al. Speciation analysis of calcium in milk by flame atomic absorption spectrophotometry[J]. Food Science, 2012, 33(22): 278-281.(in Chinese with English abstract)
[2] Pohl P, Stecka H, Jamroz P. Solid phase extraction with flame atomic absorption spectrometry for determination of traces of Ca, K, Mg and Na in quality control of white sugar[J]. Food Chemistry, 2012, 130(2):441-446.
[3] 姜波,姜国斌,刘长建,等. 微波消解-AAS法分析银杏叶中金属元素[J]. 光谱学与光谱分析,2010,30(3):812-815.Jiang Bo, Jiang Guobin, Liu Changjian, et al. Determination of metals inginkgo bilobaleaves by atomic absorption spectrometry with microwave digestion[J]. Spectroscopy and Spectral Analysis, 2010, 30(3): 812-815. (in Chinese with English abstract)
[4] Pohl P, Stelmach E, Szymczychamadeja A. Simplified sample treatment for the determination of total concentrations and chemical fractionation forms of Ca, Fe, Mg and Mn in soluble coffees[J]. Food Chemistry, 2014, 163(20): 31-36.
[5] Mao G H, Ren Y, Li Q, et al. Anti-tumor and immunomodulatory activity of selenium (Se) -polysaccharide from Se-enriched grifola frondosa[J]. International Journal of Biological Macromolecules, 2016, 82(1): 607-613.
[6] Barbosa U A, Peña-Vazquez E, Barciela-Alonso M C, et al.Simultaneous determination and speciation analysis of arsenic and chromium in iron supplements used for iron-deficiency anemia treatment by HPLC-ICP-MS[J]. Talanta, 2017,170(8): 523-529.
[7] Mahn A, Zamorano M, Barrientos H, et al. Optimization of a process to obtain selenium-enriched freeze-dried broccoli with high antioxidant properties[J]. LWT-Food Science and Technology, 2012, 47(2): 267-273.
[8] Dong J Z, Ding J, Yu P Z, et al. Composition and distribution of the main active components in selenium-enriched fruit bodies of cordyceps militaris, link[J]. Food Chemistry, 2013,137(1-4): 164-167.
[9] Zhang B, Zhou K, Zhang J, et al. Accumulation and species distribution of selenium in Se-enriched bacterial cells of the bifidobacterium animals[J]. Food Chemistry, 2009, 115(2):727-734.
[10] Li X, Xing M, Chen M, et al. Effects of selenium-lead interaction on the gene expression of inflammatory factors and selenoproteins in chicken neutrophils[J]. Ecotoxicology& Environmental Safety, 2017, 139(5): 447-453.
[11] 韩克光,甄守艳,范华,等. 钙螯合羊骨胶原多肽的制备及表征分析[J]. 农业工程学报,2015,31(21):301-307.Han Keguang, Zhen Shouyan, Fan Hua, et al. Preparation and characteristic analysis of calcium-chelated ossein peptide[J].Transactions of the Chinese Society of Agricultural Engineering(Transactions of the CSAE), 2015, 31(21): 301-307. (in Chinese with English abstract)
[12] Wu P, Bhattarai R R, Dhital S, et al. Invitro, digestion of pectin- and mango-enriched diets using a dynamic rat stomach-duodenum model[J]. Journal of Food Engineering,2017, 202(6): 65-78.
[13] Sun L, Liu G, Yang M, et al. Bioaccessibility of cadmium in fresh and cooked Agaricus blazei, Murill assessed by in vitro,biomimetic digestion system[J]. Food & Chemical Toxicology,2012, 50(5): 1729-1733.
[14] Li S X, Lin L X, Zheng F Y, et al. Metal bioavailability and risk assessment from edible brown alga Laminaria japonica,using biomimetic digestion and absorption system and determination by ICP-MS[J]. Journal of Agricultural & Food Chemistry, 2011, 59(3): 822-828.
[15] Lalanne M, Khoury H, Deroussent A, et al. Metabolism evaluation of biomimetic prodrugs by in vitro, models and mass spectrometry[J]. Int J Pharm, 2009, 379(2): 235-243.
[16] Wagh P, Parungao G, Viola R E, et al. A new technique to fabricate high-performance biologically inspired membranes for water treatment[J]. Separation & Purification Technology,2015, 156(2): 754-765.
[17] Szcześ A, Jurak M, Chibowski E. Stability of binary model membranes--prediction of the liposome stability by the langmuir monolayer study[J]. Journal of Colloid & Interface Science, 2012, 372(1): 212-218.
[18] 林路秀,李顺兴,郑凤英. 应用体外仿生模型分析海藻水煎液中微量金属的形态和生物可给性[J]. 分析化学,2010,38(6):823-827.Lin Luxiu, Li Shunxing, Zheng Fengying. Application of in vitro bionicsm odels for speciation analysis and bioavailability assessment of trace metals in marine algal soup[J]. Chinese Journal of Analytical Chemistry, 2010, 38(6): 823-827. (in Chinese with English abstract)
[19] Nobre T M, Pavinatto F J, Caseli L, et al. Interactions of bioactive molecules & nanomaterials with Langmuir monolayers as cell membrane models[J]. Thin Solid Films, 2015, 593(10):158-188.
[20] Peronico V C D, Raposo J L. Ultrasound-assisted extraction for the determination of Cu, Mn, Ca, and Mg in alternative oilseed crops using flame atomic absorption spectrometry[J].Food Chemistry, 2016, 196(4): 1287-1292.
[21] Ozbek N, Baysal A. A new approach for the determination of sulphur in food samples by high-resolution continuum source flame atomic absorption spectrometer[J]. Food Chemistry,2015, 168(2): 460-463.
[22] Paz-rodríguez B, Aboal-somoza M, Bermejo-barrera P.Application of high resolution-continuum source flame atomic absorption spectrometry (HR-CS FAAS): determination of trace elements in tea and tisanes[J]. Food Chemistry, 2015,170(3): 492-500.
[23] Baysal A, Akman S. A practical method for the determination of sulphur in coal samples by high-resolution continuum source flame atomic absorption spectrometry[J]. Talanta, 2011, 85(5):2662-2665.
[24] Brandao G C, Jesus R M D, Silva E G P D, et al. Use of slurry sampling for the direct determination of zinc in yogurt by high resolution-continuum source flame atomic absorption spectrometry[J]. Talanta, 2010, 81(4-5): 1357-1359.
[25] Gómez-Nieto B, Gismera M J, Sevilla M T, et al. Fast sequential multi-element determination of major and minor elements in environmental samples and drinking waters by high-resolution continuum source flame atomic absorption spectrometry[J]. Analytica Chimica Acta, 2015(1), 854: 13-19.
[26] Kowalewska Z, Laskowska H, Gzylewski M. Application of high-resolution continuum source flame atomic absorption spectrometry to reveal, evaluate and overcome certain spectral effects in Pb determination of unleaded gasoline[J].Spectrochimica Acta Part B Atomic Spectroscopy, 2017,132(6): 26-36.
[27] 张建萍,陈尚龙,刘恩岐,等. 微波消解-HR-CS AAS法测定几种调味品中的微量元素[J]. 现代食品科技,2013,29(6):1424-1427.Zhang Jianping, Chen Shanglong, Liu Enqi, et al. Determination of trace elements in some seasonings by microwave digestion-high resolution continuum source graphite furnace atomic absorption spectrophotometry[J]. Modern Food Science and Technology, 2013, 29(6): 1424-1427. (in Chinese with English abstract)
[28] 陈安徽,陈尚龙,巫永华,等. 黄精酵素口服液中钙、铁和锌的形态分析[J]. 现代食品科技,2016(1):272-277.Chen Anhui, Chen Shanglong, Wu Yonghua, et al. Speciation analysis of calcium, iron, and zinc in the oral liquid including polygonatum and enzymes[J]. Modern Food Science and Technology, 2016(1): 272-277. (in Chinese with English abstract)
[29] Oomen A G, Rompelberg C J, Bruil M A, et al. Development of an in vitro digestion model for estimating the bioaccessibility of soil contaminants[J]. Archives of Environmental Contamination& Toxicology, 2003, 44(3): 281-287.
[30] 李勇,陈尚龙,王书兰,等. 饮料酒中 Cd的测定方法研究[J]. 徐州工程学院学报(自然科学版),2012,27(4):16-19.Li Yong, Chen Shanglong, Wang Shulan, et al. Study on determination methods of cadmium content in alco-holic drink[J]. Journal of Xuzhou Institute of Technology(Natural Sciences Edition), 2012, 27(4): 16-19. (in Chinese with English abstract)

