化疗早期重度粒细胞下降与小细胞肺癌预后相关性分析
杨文娟 余 静 黄 朝 张俊红 谢丛华
肺癌是世界范围内最常见的恶性肿瘤。2015年,中国新发肺癌73.3万例,因肺癌死亡患者达到61万例,均居所有恶性肿瘤发病率和死亡率第一位[1]。小细胞肺癌约占所有肺癌的13%~20%,并且是恶性程度很高的肺癌亚型,未经治疗的小细胞肺癌患者的中位生存期仅2~4个月[2]。化疗是小细胞肺癌重要的治疗手段,尤其是以铂类和依托泊苷为基础的联合化疗方案,在局限期和广泛期小细胞肺癌均取得较好的治疗效果[3]。化疗相关的粒细胞减少是很常见的化疗毒副反应,经常会造成化疗的推迟和化疗药物剂量减量。然而,在结直肠癌[4]、乳腺癌[5]、胃癌[6]、卵巢癌[7]、非小细胞肺癌[8]及小细胞肺癌[9]等研究中发现严重的粒细胞减少伴随着更好的临床预后。近年来,关于非小细胞肺癌[10]、胰腺癌[11]及结肠癌[12]的研究提示化疗早期出现粒细胞下降同样也是预后较好的预测指标。本研究旨在探讨一线行顺铂和依托泊苷联合化疗的小细胞肺癌患者化疗早期重度粒细胞减少与化疗疗效及临床预后的相关性,进而为临床诊疗决策提供依据。
1 材料与方法
1.1 临床资料
收集2013年1月—2016年6月武汉大学中南医院放化疗科收治的82例行一线化疗的小细胞肺癌患者的临床资料,所有病人均经组织学或细胞学确诊为小细胞肺癌。随访资料包括性别、年龄、吸烟指数(每日吸烟支数×吸烟年数)、疾病分期、化疗周期数、胸部放疗、化疗期间粒细胞计数、近期化疗疗效、疾病进展时间(TTP)及总生存期(OS)。男性65例,女性17例,中位年龄60岁。39例为局限期患者,43例为广泛期患者。所有病人均至少行EP方案(依托泊苷+顺铂)化疗2周期。61例患者接受胸部放疗,其中39例行单纯放疗,22例行同步放化疗。31例患者接受预防性全脑放疗(PCI)。所有病人均预计可生存3个月以上、无化疗史、肝肾功能正常、无脑转移及ECOG评分0~2分。
1.2 治疗方案
本研究患者均行EP方案化疗,化疗方案具体为:顺铂,25 mg/m2,静滴,第1~3天;依托泊苷,100 mg/m2,静滴,第1~3天;21天1周期。同步化疗方案:顺铂,25 mg/m2,静滴,第1~3天、第22~24天;依托泊苷,100 mg/m2,静滴,第1~3天、第22~24天。胸部放疗剂量45~60 Gy,分割剂量1.8~2.0 Gy。预防性全脑放疗剂量30 Gy/10次。Ⅱ度及以上粒细胞或白细胞下降者,予以粒细胞集落刺激因子(G-CSF)治疗。Ⅳ度粒细胞或白细胞下降者,下一周期化疗减量20%。
1.3 剂量强度
剂量强度为每周化疗药物按体表面积每平方米的剂量。相对剂量强度为患者实际接受的化疗药物剂量强度与标准剂量强度之比。本研究相对剂量强度为依托泊苷和顺铂相对剂量强度的均值。
1.4 粒细胞减少的评估
化疗开始前一天及化疗结束后每周行血常规检查,同步放化疗期间每周行血常规检查。每周期化疗后记录至下一周期化疗前粒细胞最低水平,根据NCI血液系统不良反应评价标准进行分度,Ⅰ、Ⅱ、Ⅲ及Ⅳ度粒细胞减少分别定义为:粒细胞绝对值<2~1.5×109/L、<1.5~1×109/L、<1~0.5×109/L及<0.5×109/L。Ⅰ~Ⅱ度为轻度粒细胞下降,Ⅲ~Ⅳ度为重度粒细胞下降。
1.5 疗效评价及预后
两周期和四周期化疗后根据RECIST评价标准进行疗效评价,疗效评价结果包括:疾病进展(PD)、疾病稳定(SD)、部分缓解(PR)及完全缓解(CR)。客观有效率(ORR)定义为部分缓解及完全缓解患者所占比例。疾病控制率(DCR)定义为疾病稳定、部分缓解及完全缓解患者所占比例。疾病进展时间(TTP)自第一周期化疗开始日期,至疾病出现进展日期为止。总生存期(OS)自确诊日期开始,至死亡日期或最后随访日期为止。随访截止至2017年6月1日,随访率90%,中位随访时间14个月(2~56个月),截止随访日期累计死亡50例(61%)。
1.6 统计学方法
采用SPSS 22.0软件进行统计学分析。计量资料采用t检验,计数资料采用χ2检验。生存资料的单因素分析比较采用Kaplan-Meier法和Log-rank检验,多因素分析采用Cox风险比例模型。P<0.05为差异有统计学意义。
2 结果
2.1 化疗期间粒细胞减少情况及一般情况
82例患者中,33例(40.2%)于化疗2周期内出现Ⅲ~Ⅳ度粒细胞下降,13例(15.9%)于3周期后出现Ⅲ~Ⅳ度粒细胞下降,36例(43.9%)患者化疗期间内未出现Ⅲ~Ⅳ度粒细胞下降。根据患者重度粒细胞下降发生的时间分为两组,早发组(前两周期内出现Ⅲ~Ⅳ度粒细胞下降)33例(40.2%),非早发组(未出现或三周期以后出现Ⅲ~Ⅳ度粒细胞下降)49例(59.8%),两组患者一般情况无统计学差异(表1)。82例患者化疗药物剂量强度为0.84±0.17,早发组和非早发组分别为0.80±0.17、0.87±0.17,无统计学差异。
2.2 化疗有效率
早发组和非早发组化疗客观有效率分别为81.8%vs.75.5%(P=0.499),疾病控制率分别为97.0%vs.95.9%(P=1.000),均无统计学差异(表2)。

表1 早发组和非早发组患者一般情况

表2 早发组和非早发组近期疗效评价
2.3 预后
82例患者中位疾病进展时间8.2个月(95%CI:6.2~10.2),其中早发组和非早发组分别为10.4个月(95%CI:9.3~11.5)和6.9个月(95%CI:5.9~7.9)(P=0.001)(图1)。早期严重粒细胞下降组中位疾病进展时间明显延长。82例患者中位总生存时间为19.0个月(95%CI:15.1~22.8),其中早发组和非早发组分别为22.4个月(95%CI:17.7~27.1)和16.0个月(95%CI:13.1~18.9)(P=0.023)(图2),早期严重粒细胞下降组中位生存时间明显延长。
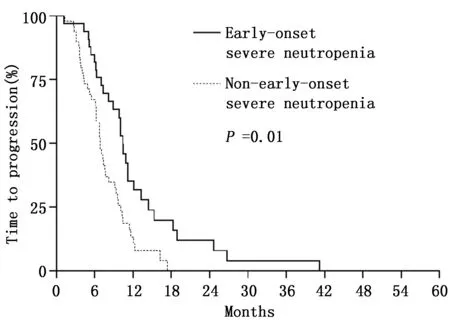
图1 早发组和非早发组疾病进展时间Kaplan-Meier曲线Figure 1 TTP of patients in early-onset and non-early-onset groups analyzed by Kaplan-Meier curves
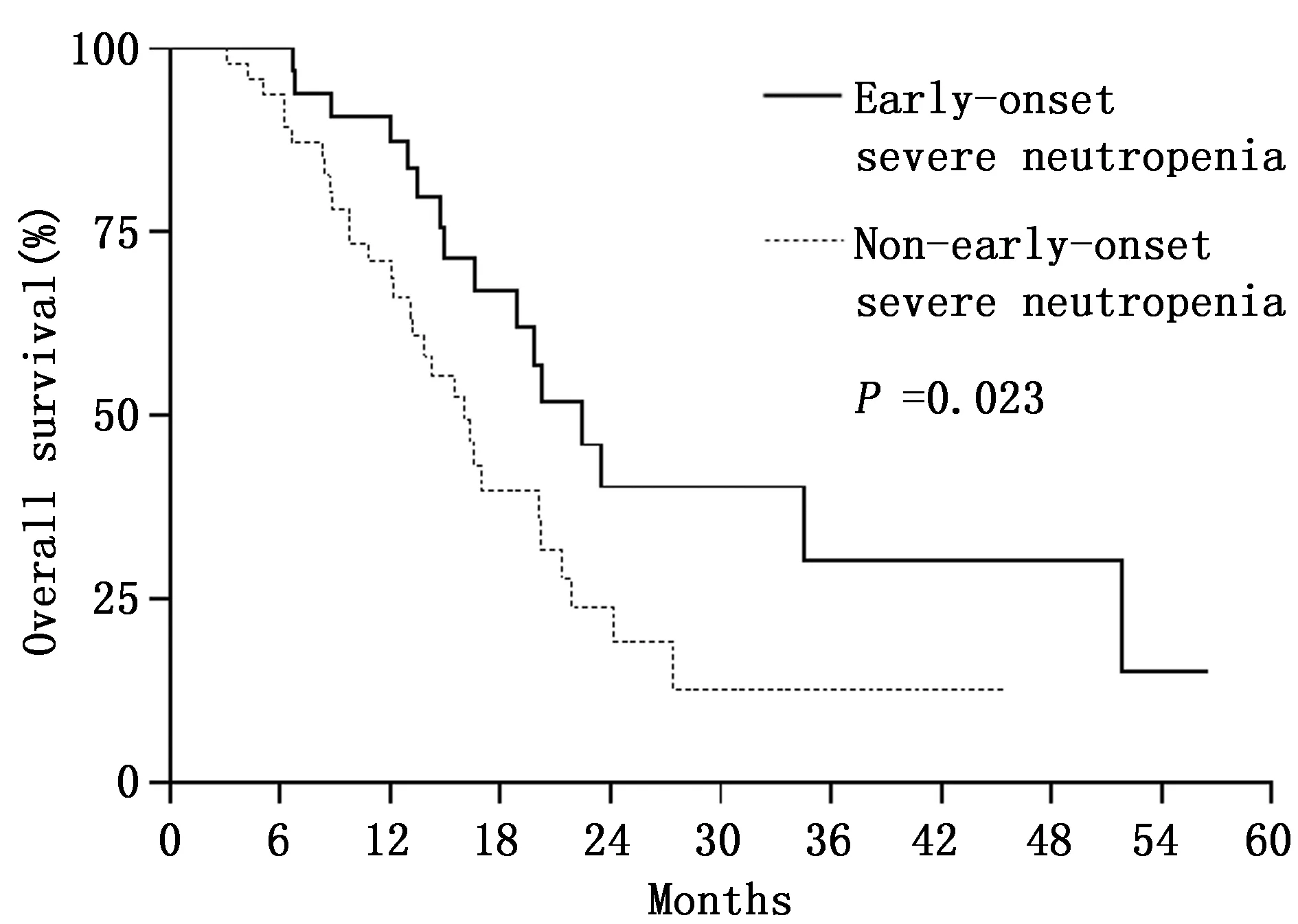
图2 早发组和非早发组总生存时间Kaplan-Meier曲线Figure 2 OS of patients in early-onset and non-early-onset groups analyzed by Kaplan-Meier curves
2.4 单因素及多因素生存分析
单因素生存分析纳入性别、年龄、吸烟指数、疾病分期、化疗周期数、近期化疗疗效、胸部放疗及早期重度粒细胞下降等因素,多因素分析纳入吸烟指数、化疗周期数、胸部放疗及早期重度粒细胞下降等因素(表3),单因素及多因素分析显示吸烟指数、化疗周期数、胸部放疗及早期重度粒细胞下降均是预测预后的独立因素,吸烟指数≤400、化疗周期数>4、胸部放疗及早期重度粒细胞下降提示预后较好。
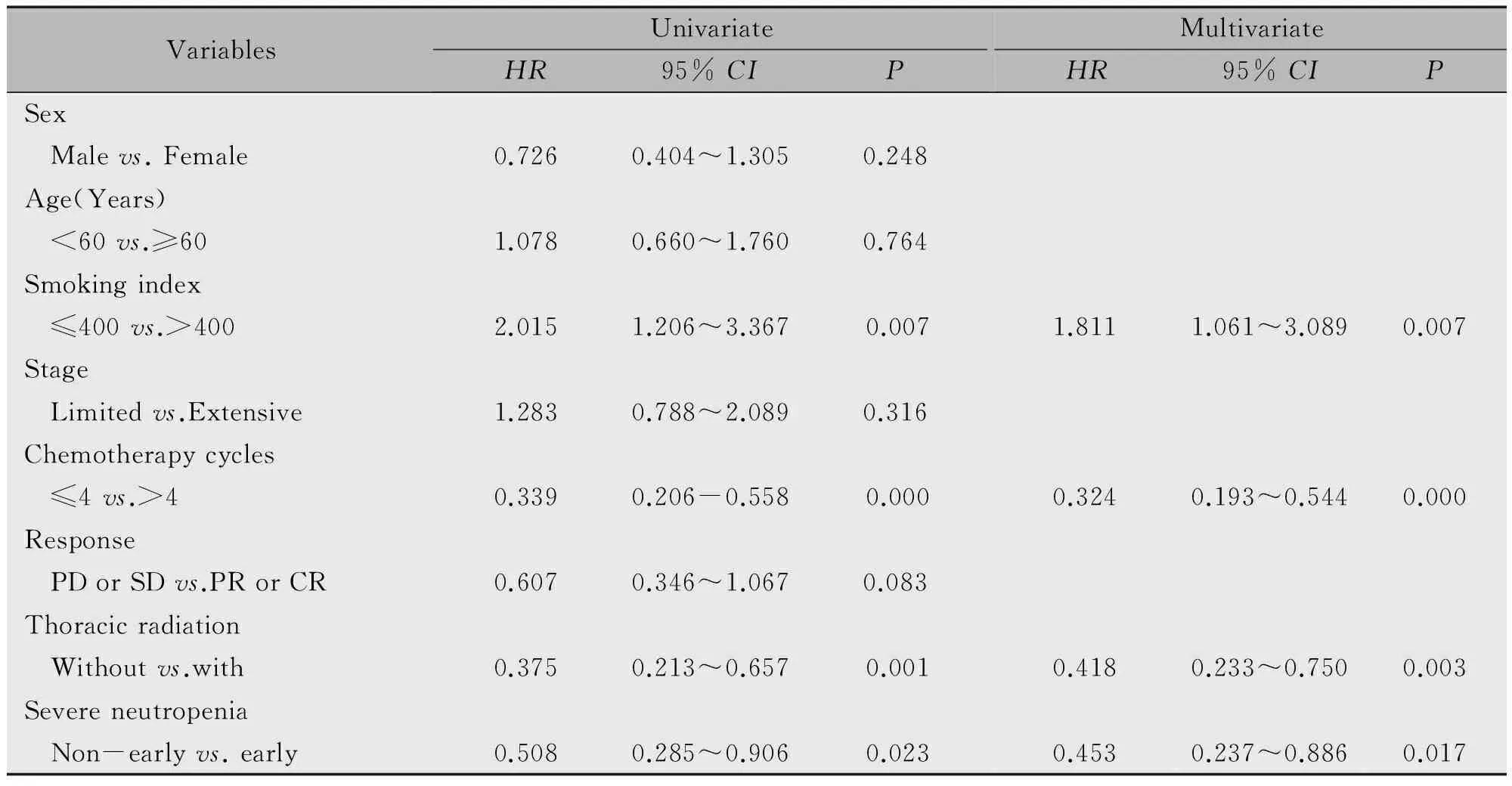
表3 小细胞肺癌总生存时间预后因素的单因素及多因素分析
3 讨论
在许多实体瘤,例如结直肠癌[4]、乳腺癌[5]、胃癌[6]、卵巢癌[7]、非小细胞肺癌[8]及小细胞肺癌[9]等研究中发现,化疗期间出现粒细胞减少者预后更好。在肺癌方面,最初由Di Maio等[8]对三项随机临床试验共1265例病人进行汇总分析,结果表明化疗期间发生粒细胞减少的病人拥有更长的生存时间。随后,Banerji等[9]纳入了173例小细胞肺癌患者的回顾性研究发现化疗期间Ⅲ-Ⅳ度粒细胞减少者较0~Ⅱ度粒细胞减少者拥有更好的预后。此外,近年来非小细胞肺癌[10]、胰腺癌[11]及结肠癌[12]等方面研究提示化疗期间粒细胞减少出现的时间同样与化疗预后相关,早期即出现粒细胞减少患者预后更好。Jiang等[10]纳入123例非小细胞肺癌患者的研究发现,早期出现粒细胞减少者(1~2周期)较晚期出现粒细胞减少者(3~6周期)拥有更长PFS及OS,且晚期出现粒细胞下降者与未出现粒细胞下降者预后无差别。本研究得出类似结果,以重度粒细胞减少发生时间来分组,早发组和非早发组中位OS分别为22.4个月(95%CI:17.7~27.1)和16.0个月(95%CI:13.1~18.9);且多因素生存分析显示早期重度粒细胞下降是独立预后因素。不同之处在于,既往研究多以粒细胞最低值发生时间来分组而不论其下降程度,本研究以重度粒细胞下降发生的时间来分组,进一步探讨重度粒细胞下降发生的时间与预后的关系。遗憾的是,本研究病例数有限,未能更细致的分组来探讨晚期重度粒细胞下降患者与未发生重度粒细胞下降患者预后的差别。
化疗导致的粒细胞减少并不是影响小细胞肺癌预后的直接因素,但它一定程度上反映了化疗药物的剂量和代谢过程,以及个体对化疗的敏感程度。首先,化疗药物的作用取决于其到达肿瘤部位的生物有效剂量,与其在体内的代谢过程密切相关。目前化疗药物的剂量主要依据体表面积(BSA)计算[13],没有考虑到个体间细胞毒药物代谢存在差异[14],因此可能会导致化疗药物剂量不足[15]。Gamelin等[16]开展的一项多中心随机对照临床试验结果表明,在结直肠癌患者中,通过监测血药浓度进行个体化氟脲嘧啶剂量调整,相比于通过体表面积计算药物剂量能够显著提高化疗客观有效率及患者预后。然而,监测药物在体内的代谢过程实施起来较为复杂,在临床上难以实现。因此,化疗导致的粒细胞减少有望成为间接反映细胞毒药物血药浓度的替代指标,尤其是如果能在两周期化疗内发现药物剂量不足,就能及时调整药物剂量,从而为患者带来更好预后。
再者,肿瘤细胞对化疗药物的反应还取决于机体对化疗的敏感程度。理论上,一个个体的所有细胞中都存在着类似的药代学和药效学特征[18],即肿瘤细胞和粒细胞对细胞毒药物具有相似的敏感性。本研究结果显示,在小细胞肺癌患者中,早期即出现重度粒细胞下降者拥有更长的TTP及OS,提示此类患者可能是对EP方案较为敏感的人群。另一方面,对化疗不敏感人群可能存在着原发性和获得性耐药[19-20]。未出现或非早期出现严重粒细胞下降者可能对EP方案化疗存在原发性耐药,甚至对其他细胞毒药物也不敏感从而伴随不好的预后。
值得注意的是,本研究早发组与非早发组化疗客观有效率及疾病控制率并无差别,可能与小细胞癌这种病理类型有关。在晚期非小细胞肺癌中有研究显示,严重化疗后白细胞减少伴随着更好的化疗客观缓解率及疾病控制率[21]。本研究对象为小细胞肺癌患者,相对于其他病理亚型对化疗较为敏感,尽管两组化疗剂量或对化疗敏感性存在差异,但并不足以影响化疗近期疗效。此外,单因素及多因素生存分析显示分期并不是影响预后的因素,这可能与病例数较少有关,而吸烟指数、化疗周期数及胸部放疗是独立的预后因素,这与既往研究基本一致[3,22-23]。
综上所述,一线接受EP方案化疗的小细胞肺癌患者中,化疗早期重度粒细胞下降是预后良好的预测因素。早期未出现严重粒细胞下降或许可以认为是化疗药物剂量不足或者肿瘤对化疗药物不敏感。因此,是否可以根据患者化疗早期粒细胞减少发生情况调整药物剂量从而为患者带来更好的预后,这有待于进一步的前瞻性研究去证实。
1 Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
2 van Meerbeeck JP,Fennell DA,De Ruysscher DKM.Small-cell lung cancer[J].Lancet,2011,378(9804):1741-1755.
3 Janne PA,Freidlin B,Saxman S,et al.Twenty-five years of clinical research for patients with limited-stage small cell lung carcinoma in North America[J].Cancer,2002,95(7):1528-1538.
4 Hamauchi S,Yamazaki K,Masuishi T,et al.Neutropenia as a predictive factor in metastatic colorectal cancer treated with TAS-102[J].Clin Colorectal Cancer,2017,16(1):51-57.
5 Han Y,Yu Z,Wen S,et al.Prognostic value of chemotherapy-induced neutropenia in early-stage breast cancer[J].Breast Cancer Res Treat,2012,131(2):483-490.
6 Liu RJ,Huang MZ,Zhao XY,et al.Neutropenia predicts better prognosis in patients with metastatic gastric cancer on a combined epirubicin,oxaliplatin and 5-fluorouracil regimen[J].Oncotarget,2015,6(36):39018-39027.
7 Tewari KS,Java JJ,Gatcliffe TA,et al.Chemotherapy-induced neutropenia as a biomarker of survival in advanced ovarian carcinoma:an exploratory study of the Gynecologic Oncology Group[J].Gynecol Oncol,2014,133(3):439-445.
8 Di Maio M,Gridelli C,Gallo C,et al.Chemotherapy-induced neutropenia and treatment efficacy in advanced non-small-cell lung cancer:a pooled analysis of three randomised trials[J].Lancet Oncol,2005,6(9):669-677.
9 Banerji U,Ashley S,Coward J,et al.The association of chemotherapy induced neutropenia on treatment outcomes in small cell lung cancer[J].Lung Cancer,2006,54(3):371-377.
10 Jang SH,Kim SY,Kim JH,et al.Timing of chemotherapy-induced neutropenia is a prognostic factor in patients with metastatic non-small-cell lung cancer:a retrospective analysis in gemcitabine-plus-platinum-treated patients[J].J Cancer Res Clin Oncol,2013,139(3):409-417.
11 Chen Y,Shi Y,Yan H,et al.Timing of chemotherapy-induced neutropenia:the prognostic factor in advanced pancreatic cancer patients treated with gemcitabine/gemcitabine-based chemotherapy[J].Oncotarget,2017,8(39):66593-66600.
12 Chen Y,Wang YR,Shi Y,et al.Timing of chemotherapy-induced neutropenia predicts prognosis in metastatic colon cancer patients:a retrospective study in mFOLFOX6-treated patients[J].BMC Cancer,2017,17:8.
13 Gurney H.How to calculate the dose of chemotherapy[J].Br J Cancer,2002,86(8):1297-1302.
14 Camps C,Sirera R,Iranzo V,et al.Gene expression and polymorphisms of DNA repair enzymes:cancer susceptibility and response to chemotherapy[J].Clin Lung Cancer,2007,8(6):369-375.
15 Gurney H.Dose calculation of anticancer drugs:A review of the current practice and introduction of an alternative[J].J Clin Oncol,1996,14(9):2590-2611.
16 Gamelin E,Delva R,Jacob J,et al.Individual fluorouracil dose adjustment based on pharmacokinetic follow-up compared with conventional dosage:results of a multicenter randomized trial of patients with metastatic colorectal cancer[J].J Clin Oncol,2008,26(13):2099-2105.
17 Capitain O,Asevoaia A,Boisdron-Celle M,et al.Individual fluorouracil dose adjustment in FOLFOX based on pharmacokinetic follow-up compared with conventional body-area-surface dosing:a phase II,proof-of-concept study[J].Clin Colorectal Cancer,2012,11(4):263-267.
18 Kvinnsland S.The leucocyte nadir,a predictor of chemotherapy efficacy?[J].Br J Cancer,1999,80(11):1681-1681.
19 Kathawala RJ,Gupta P,Ashby CR,et al.The modulation of ABC transporter-mediated multidrug resistance in cancer:a review of the past decade[J].Drug Resist Updat,2015,18:1-17.
20 Fraczek N,Bronisz I,Pietryka M,et al.An outline of main factors of drug resistance influencing cancer therapy[J].J Chemother,2016,28(6):457-464.
21 Huang CS,Liu L,Liu J,et al.Association of chemotherapy-induced leucopenia with treatment outcomes in advanced non-small-cell lung cancer cases receiving the NP regimen[J].Asian Pac J Cancer Prev,2012,13(9):4481-4485.
22 Ou SH,Ziogas A,Zell JA.Prognostic factors for survival in extensive stage small cell lung cancer(ED-SCLC):the importance of smoking history,socioeconomic and marital statuses,and ethnicity[J].J Thorac Oncol,2009,4(1):37-43.
23 Slotman BJ,van Tinteren H,Praag JO,et al.Use of thoracic radiotherapy for extensive stage small-cell lung cancer:a phase 3 randomised controlled trial[J].Lancet,2015,385(9962):36-42.

