miR-22靶向SIRT1促进人脂肪肝细胞中脂肪沉积的机制研究
郑晓筠, 黄浩辉, 何 杰, 李瑜元, 聂玉强, 杜艳蕾, 周永健
广州医科大学附属广州市第一人民医院 广州消化疾病中心,广东 广州 510180
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)已成为我国仅次于慢性病毒性肝炎的第二大肝病,呈持续升高态势[1]。二次打击学说是NAFLD发病机制的主要学说,强调脂质代谢紊乱所导致的肝细胞脂质沉积是其发病的关键环节[2]。近几年多次打击学说认为,基因多态性及基因受体等在NAFLD发生、发展中有重要作用,NAFLD认为是一种遗传代谢应激相关性疾病[3]。miRNA是一类内生的、长度为20~24个核苷酸的小RNA,miRNA是基因表达重要的转录后调控因子,其调节涉及肝脏中的脂质体内平衡、炎症等多种生物学过程[4]。最近研究[5]发现,miR-22与糖尿病、心血管疾病发病机制相关,但与脂肪肝等代谢性疾病关系的研究较为欠缺。沉默信息调节因子(sirtuin type 1, SIRT1)是依赖于烟酰胺腺嘌呤二核苷酸(NAD+),参与糖代谢、胰岛素分泌等多条代谢通路,对代谢综合征等发挥重要的作用,被证明与NAFLD的发生、发展相关[6]。因此,本文通过研究miR-22在L02人细胞脂肪肝模型中的变化,探讨其对NAFLD的作用及机制。
1 材料与方法
1.1细胞株正常肝细胞株L02购自北京北纳创联生物技术研究院,于质量浓度为100 g/L的胎牛血清的DMEM培养基、37 ℃和体积分数为5%的CO2条件下进行培养。
1.2试剂油酸(Oleic acid)、棕榈酸(Palmitic acid minimum 99%)、二甲基亚砜(DMSO)、油红O(Oil Red O)均购自Sigma公司;三酰甘油、谷丙转氨酶、谷草转氨酶试剂盒均购自南京建成生物工程研究所;Lipofectamine®2000购自上海英潍捷基贸易有限公司;Trizol提取RNA试剂盒购自Takara公司;染料法Hairpinit miRNAs定量和U6校准qRT-PCR试剂盒购自上海吉玛制药技术有限公司;miR-22 mimic和miR-22 inhibitor由广州市锐博生物科技有限公司合成;SIRT1人抗鼠抗体、羊抗鼠抗体购自美国Abcam公司。
1.3主要设备和材料倒置显微镜(OLYMPUS),NanoDrop2000超微量分光光度计(Thermo),荧光定量PCR仪 qTower2.2(德国耶拿)、S1000 PCR仪(Bio-rad)、酶标仪(BIOTEK)等。
1.4构建肝细胞脂肪变性模型将L02细胞接种于6孔板中,当细胞汇合率为70%~80%,每孔更换质量浓度为0.5 mmol/L软脂酸和油酸混合液(2∶1)FFA和质量浓度为100 g/L的FBS的DMEM培养液,于细胞培养箱内培养48 h成为细胞脂肪肝模型。
1.5实验分组L02细胞株培养后分为mimic NC组、miR-22 mimic组、inhibitor NC组和miR-22 inhibitor组。取对数生长期细胞,以每孔70%密度在6孔板铺同等数量细胞;于无菌EP管内,将5 μl Lipofectamine®2000与245 μl opti-MEM培养物在25 ℃混匀5 min,另一无菌EP管,10 μl miR-22 mimic/miR-22 inhibitor或转染对照物与245 μl opti-MEM培养物稀释,将两者混合在25 ℃放置15 min,以每孔500 μl加入相应的6孔板中;6 h后弃液,更换质量浓度为0.5 mmol/L的FFA和质量浓度为100 g/L的FBS的DMEM培养液,继续培养48 h。每组设置2个副孔,实验重复3次。
1.6油红O染色及油红含量测定用质量浓度为40 g/L的多聚甲醛溶液固定细胞10 min,质量浓度为5 g/L的油红O避光染色60 min,洗涤干净后在显微镜下观察脂滴情况;使用异丙醇脱色,吸入96孔板,每孔100 μl,在酶标仪中读取510 nm处的吸光度。
1.7甘油三脂及肝酶含量测定经胰酶消化细胞,细胞裂解后收集上清液,参照试剂盒说明书步骤测定细胞内TG、GPT、GOT的含量。
1.8miR-22的表达水平检测参照TaKaRa试剂说明书,用Trizol试剂提取上述各组细胞的RNA;按照Hairpin-it miRNAs定量试剂盒上说明书的反应体系及反应条件,在PCR仪上进行逆转录,再在荧光定量PCR仪进行扩增。把U6作为内参照,以2-ΔΔCt表示待测组中miR-22相对于对照组中表达水平的表达倍数,其中ΔΔCt=待测组样本的ΔCt-对照组样本ΔCt,ΔCt=目的miR-22 Ct值-内参U6 Ct值。
1.9生物信息学分析通过TargetScan、MiRanda、Mirdb靶基因数据库作生物信息学分析,预测miR-22的靶基因,结合文献筛选出预计与NAFLD相关的基因。TargetScan网址http://www.targetscan.org/vert-71/;MiRanda网址http://www.microrna.org/;Mirdb网址http://www.mirdb.org/miRDB。
1.10Westernblotting检测SIRT1蛋白表达细胞裂解后,蛋白定量;调节电压为110 V,SDS-PAGE电泳约2 h;调节恒流为350 mA湿转膜约1 h;BSA封闭1 h;一抗SIRT1人抗鼠抗体4 ℃摇床过夜孵育;二抗山羊抗兔抗体,常温孵育1 h;曝光、显影后,软件分析光密度值,以目的基因/β-actin带的密度比值表示目的基因蛋白表达水平。
1.11统计学分析使用IBM SPSS Statistics 19.0统计软件,以均数±标准差表示,符合正态分布的两组等方差数据间,采用两独立样本t检验,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1构建L02人脂肪肝细胞模型经油红O染色后,正常组的肝细胞略呈纺锤形,细胞边缘清晰,核膜完整,细胞内未见红色脂滴;模型组的脂肪变肝细胞略变圆,可见散在红色脂滴位于细胞膜的侧边缘,或呈环状位于胞内(见图1A)。细胞油红O染色及脱色后,模型组油红脱色含量与正常组比较显著增加,差异有统计学意义(P<0.01),说明模型组脂滴显著比正常组多(见图1B)。模型组中TG含量比正常组显著增加,AST/ALT显著增高,差异均有统计学意义(P<0.01),符合脂肪肝肝功能表现;ALT、AST差异无统计学意义,提示该构建脂肪肝模型方法未对细胞造成明显损伤,表明模型组构建脂肪肝模型成功,脂肪变明显(见图1C~1E)。
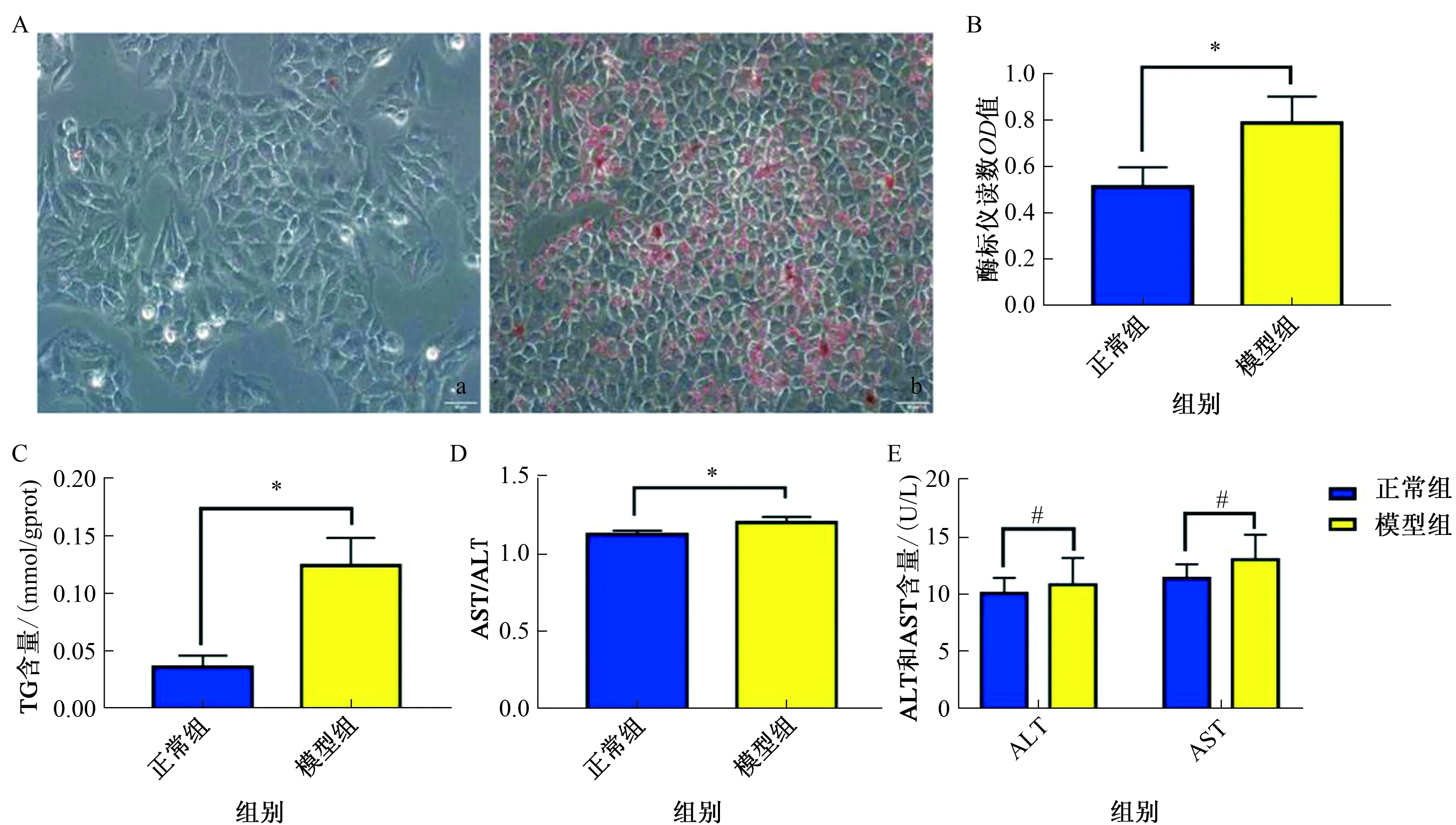
注:a:正常组正常细胞;b:模型组脂肪变细胞。*P<0.05,#P>0.05。
2.2脂肪变细胞模型miR-22表达显著增加成功建立脂肪细胞肝模型后,提取正常组和模型组细胞RNA,使用PCR检测miR-22的表达量。正常组miR-22 mRNA相对表达量为1.551±0.1525,模型组miR-22 mRNA相对表达量为2.221±0.1834,模型组miR-22 mRNA的表达量与正常组比较显著增加,差异有统计学意义(P=0.0126)(见图2)。

注:*P<0.05。图2 L02人肝正常细胞和脂肪变细胞miR-22 mRNA表达量Fig 2 The expression of miR-22 mRNA in L02 normal hepaticcells and steatosis cells
2.3miR-22促进人脂肪肝细胞的脂肪沉积分别转染miR-22 mimic和miR-22 inhibitor,过表达miR-22和抑制miR-22后再建立脂肪变性细胞模型,油红O染色可见,与mimic NC组相比,miR-22 mimic组脂滴显著增加,脂滴变大,胞内较多深染的脂滴呈抱团状;与inhibitor NC组相比,miR-22 inhibitor组脂滴相对减少,脂滴染色变浅,胞内未见明显深染的抱团脂滴(见图3A)。细胞油红O染色脱色后,miR-22 mimic组油红脱色含量比mimic NC组显著增加,差异有统计学意义(P=0.0034);miR-22 inhibitor组油红脱色含量与inhibitor NC组相比呈减少趋势(P=0.0847),miR-22 mimic组与miR-22 inhibitor组相比显著增加,差异有统计学意义(P<0.0001),说明过表达miR-22后诱导的脂肪肝细胞模型脂滴显著增加,抑制miR-22后诱导的脂肪肝细胞模型脂滴显著减少(见图3B)。miR-22 mimic组TG含量和AST/ALT与mimic NC组比较均显著增加,差异有统计学意义(P<0.05);miR-22 inhibitor组中TG含量比inhibitor NC组显著减少,差异有统计学意义(P=0.0445),AST/ALT值与inhibitor NC组相比呈减少趋势(P=0.8385)(见图3C~3E)。以上结果表明,过表达miR-22后诱导的人脂肪肝细胞脂肪沉积加重,抑制miR-22后诱导的人脂肪肝细胞脂肪沉积减轻。

注:*P<0.05,#P>0.05。
图3过表达miR-22和抑制miR-22及其对照组的肝脂肪变细胞模型相关检测结果A:油红O染色(200×);B:油红O染色脱色油红含量测定;C:TG含量;D:AST/ALT比值;E:ALT和AST含量
Fig3RelevanttestresultsoftransfectedmiR-22mimicandmiR-22inhibitorintoL02humansteatotichepatocytesanditscontrolgroupA: oil red O staining (200×); B: determination of oil red decolorization by oil red O staining; C: the content of TG; D: the ratio of AST/ALT; E: the content of ALT and AST
2.4脂肪变细胞模型SIRT1蛋白表达显著减少成功建立脂肪细胞肝模型后,检测正常组和模型组的SIRT1蛋白表达,灰度值扫描后统计分析。模型组脂肪肝细胞SIRT1蛋白表达量与正常组比较显著减少,差异有统计学意义(P=0.0249,见图4)。

注:*P<0.05。
图4正常组和模型组的SIRT1蛋白表达A:SIRT1 Western blotting曝光图像;B:SIRT1蛋白表达灰度值分析
Fig4TheexpressionsofSIRT1proteininL02humansteatotichepatocytemodelandcontrolgroupA: SIRT1 Western blotting exposure images; B: the gray value analysis of SIRT1 protein expression
2.5miR-22负调控SIRT1促进脂肪肝细胞脂肪沉积使用TargetScan、MiRanda、Mirdb预测miR-22的靶基因发现,SIRT1是miR-22的靶基因(见图5)。分别转染miR-22 mimic和miR-22 inhibitor,过表达miR-22和抑制miR-22后再建立脂肪变性细胞模型,Western blotting检测SIRT1蛋白表达,灰度值扫描后统计分析,在正常细胞和脂肪变肝细胞中,miR-22 mimic组SIRT1蛋白表达量比mimic NC组显著降低,差异均有显著统计学意义(P<0.05),结果显示,过表达miR-22后,SIRT1的表达量减少,提示miR-22负调控SIRT1。
在正常细胞中,miR-22 inhibitor组SIRT1蛋白表达量与inhibitor NC组相比呈增加趋势,差异无统计学意义(P=0.0801);在脂肪肝细胞中,miR-22 inhibitor组SIRT1蛋白表达量与inhibitor NC组比较呈增加趋势,差异无统计学意义(P=0.0674)(见图6A~6B),结果显示,抑制miR-22后,SIRT1的表达量呈增加趋势,与过表达miR-22时趋势相一致。

图5 TargetScan、Microrna、Mirdb网站预测SIRT1是miR-22的靶基因Fig 5 TargetScan, Microrna and Mirdb sites predicted that SIRT1 was the target gene of the miR-22

注:*P<0.05,#P>0.05。
图6过表达miR-22和抑制miR-22及其对照组的SIRT1蛋白表达A:SIRT1 Western blotting曝光图像;B:SIRT1蛋白表达的灰度值分析
Fig6TheexpressionofSIRT1proteinoftransfectedmiR-22mimicandmiR-22inhibitorintoL02humansteatotichepatocytesanditscontrolgroupA: SIRT1 Western blotting exposure images; B: the gray value analysis of SIRT1 protein expression
3 讨论
NAFLD发病机制尚未明确,近来不少研究[7]发现,miRNA与NAFLD进展有关,预计miRNA对NAFLD的筛查、疾病分期和监测疾病进展及疾病的治疗均有重要意义,但具体何种miRNA参与NAFLD的发生、发展机制及如何作用尚未完全了解。现有研究[8]提示,miR-22表达与肝脏肿瘤发生具有负相关性。SIRT1下调会使部分脂肪生成和糖异生相关基因的表达改变,如下调PPARα信号并降低脂肪酸β-氧化,且会诱导局部炎症、内质网应激及胰岛素抵抗,SIRT1通过参与脂质和碳水化合物代谢的调节在NAFLD的发展中起关键作用[9]。本研究通过体外实验,初步探讨肝细胞脂肪变时miR-22的表达变化及其促进脂肪沉积的机制,SIRT1是miR-22预测的靶基因,研究结果显示,miR-22在肝细胞脂肪变时表达显著增加,miR-22可能通过表达上调负调控SIRT1表达从而促进脂肪沉积。
本实验使用正常人肝细胞株L02脂肪变性细胞模型能较好地模拟NAFLD病变过程中的肝细胞脂质沉积,较广泛地应用在研究当中[10]。油红O染色及油红脱色含量测定能较好地检测细胞内脂滴变化情况,同时TG含量和AST/ALT能较好地反映脂肪肝变性的严重程度[11]。为进一步验证miR-22对肝细胞脂肪变的作用,过表达miR-22和抑制miR-22后建立脂肪变性细胞模型,结果提示,过表达miR-22检测结果均提示脂肪变程度显著加重,抑制miR-22后部分检测结果差异无统计学意义,考虑miR-22在细胞中原表达量较低,抑制后对脂肪沉积的作用较轻微,但总体趋势一致,说明miR-22参与脂肪肝的脂肪沉积。SIRT1在脂肪肝中表达变少,其结果与其他文献[12]报道一致,过表达miR-22后,SIRT1蛋白表达显著减少,靶基因预测结果考虑miR-22负调控SIRT1表达从而促进脂肪沉积,miR-22可能成为脂肪肝新的检测方向和治疗靶标。
本研究探讨并验证了miR-22在脂肪沉积过程中的作用,并初步探讨了miR-22表达上调负调控SIRT1促进脂肪沉积的机制。我们前期实验[13]已经在体内验证了FXR基因与NAFLD密切相关,同时有实验[8]表明,miR-22与FXR密切相关,但缺乏直接验证靶基因的实验,因此,进一步验证miR-22的靶基因,深入探讨miR-22上下游基因及与FXR相关通路促进NAFLD的机制。此外,细胞模型存在局限性,将在人体NAFLD组织或动物模型上进一步确定miR-22对NAFLD的作用。
[1] ZHOU Y J, LI Y Y, NIE Y Q, et al. Natural course of nonalcoholic fatty liver disease in southern China: a prospective cohort study [J]. J Dig Dis, 2012, 13(3): 153-160. DOI: 10.1111/j.1751-2980.2011.00571.x.
[2] LIM J S, MIETUS-SNYDER M, VALENTE A, et al. The role of fructose in the pathogenesis of NAFLD and the metabolic syndrome [J]. Nat Rev Gastroenterol Hepatol, 2010, 7(5): 251-264. DOI: 10.1038/nrgastro.2010.41.
[3] DEL B M, POLIMENI L, BARATTA F, et al. The role of nutraceuticals for the treatment of non-alcoholic fatty liver disease [J]. Br J Clin Pharmacol, 2017, 83(1): 88-95. DOI: 10.1111/bcp.12899.
[4] HE Z, HU C, JIA W. miRNAs in non-alcoholic fatty liver disease [J]. Front Med, 2016, 10(4): 389-396. DOI: 10.1007/s11684-016-0468-5.
[5] FIORE D, GIANFRILLI D, GIANNETTA E, et al. PDE5 inhibition ameliorates visceral adiposity targeting the miR-22/SIRT1 pathway: evidence from the CECSID trial [J]. J Clin Endocrinol Metab, 2016, 101(4): 1525-1534. DOI: 10.1210/jc.2015-4252.
[6] JIA L, LI W, LI J, et al. Lycium barbarum polysaccharide attenuates high-fat diet-induced hepatic steatosis by up-regulating SIRT1 expression and deacetylase activity [J]. Sci Rep, 2016, 6: 36209. DOI: 10.1038/srep36209.
[7] SZABO G, CSAK T. Role of microRNAs in NAFLD/NASH [J]. Dig Dis Sci, 2016, 61(5): 1314-1324. DOI: 10.1007/s10620-015-4002-4.
[8] YANG F, HU Y, LIU H X, et al. MiR-22-silenced cyclin A expression in colon and liver cancer cells is regulated by bile acid receptor [J]. J Biol Chem, 2015, 290(10): 6507-6515. DOI: 10.1074/jbc.M114.620369.
[9] NASSIR F, IBDAH J A. Sirtuins and nonalcoholic fatty liver disease [J]. World J Gastroenterol, 2016, 22(46): 10084-10092. DOI: 10.3748/wjg.v22.i46.10084.
[10] SUN L, ZHANG S, YU C, et al. Hydrogen sulfide reduces serum triglyceride by activating liver autophagy via the AMPK-mTOR pathway [J]. Am J Physiol Endocrinol Metab, 2015, 309(11): E925-E935. DOI: 10.1152/ajpendo.00294.2015.
[11] SAOKAEW S, KANCHANASUWAN S, APISARNTHANARAK P, et al. Clinical risk scoring for predicting non-alcoholic fatty liver disease in metabolic syndrome patients (NAFLD-MS score) [J]. Liver Int, 2017. DOI: 10.1111/liv.13413.
[12] LI Y, WONG K, GILES A, et al. Hepatic SIRT1 attenuates hepatic steatosis and controls energy balance in mice by inducing fibroblast growth factor 21 [J]. Gastroenterology, 2014, 146(2): 539-549.doi:10.3969/j.issn.1006-5709.2018.02.016
[13] 邱睿睿, 周永健, 聂玉强, 等. NAFLD发病中基因FXR对PPAR-α影响的实验研究[J]. 胃肠病学和肝病学杂志, 2016, 25(2): 159-163. DOI: 10.3969/j.issn.1006-5709.2016.02.011.
QIU R R, ZHOU Y J, NIE Y Q, et al. Experimental study of gene FXR for PPAR-α effects in the pathogenesis of NAFLD [J]. Chin J Gastroenterol Hepatol, 2016, 25(2): 159-163. DOI: 10.3969/j.issn.1006-5709.2016.02.011.

