花旗泽仁主要活性成分在大鼠尿液和粪便中的代谢研究
于鹏洋,李璐,赵聪,郑义,朱蕾,刘萍,韩东卫,葛鹏玲*
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.牡丹江医学院,黑龙江 牡丹江 157000; 3.牡丹江医学院附属红旗医院,黑龙江 牡丹江 157011; 4.中国人民解放军军事经济学院门诊部,湖北 武汉 430000)
中药复方口服后其真正发挥药效作用的物质既可能是原型药物,也可能是代谢产物[1]。方剂组方复杂,成分繁多,干扰因素较多,选取UPLC-Q-TOF-MS技术应用于不同生物样品中微量成分和代谢产物的鉴定,具有分析时间短,检测灵敏度高的优势。联合Metabolynx软件通过比对空白样品与含药样品,分析去除干扰离子来简化质谱图的解析,从而在复杂生物基质中快速检测出药物代谢产物,为阐明其作用机制及临床合理用药提供参考[2-3]。
花旗泽仁是临床上治疗2型糖尿病的经验方,本课题组前期工作已完成其主要药效学研究,为进一步完善花旗泽仁成药的评价,本文选择花旗泽仁主要活性成分人参皂苷Rb1、泽泻醇A-24-醋酸酯及9-HODE作为研究对象,采用UPLC-Q-TOF/MS技术分析完成花旗泽仁3种活性成分及其代谢产物通过尿液和粪便的排泄情况。
1 实验动物
清洁级Sprague-Dawley(SD)大鼠6只,雄性,3月龄,体质量(200±20)g,购于黑龙江中医药大学实验动物中心,动物合格证号:SCXK(黑)2013-004。实验动物适应性喂养一周,明暗周期12 h,房间温度在(20±2)℃,相对湿度50%左右,通风良好,勤换垫料,自由摄食和饮水。
2 实验方法
2.1 花旗泽仁标准混合液的制备
取花旗泽仁水煎液100 μL,置1.5 mL离心管中,12 000 rpm高速离心10 min,取上清液过0.22 μm微孔滤膜后经HPLC-MS/MS测定。结果表明,花旗泽仁提取物中主要活性成分的百分比如下:人参皂苷0.16%、泽泻醇A-24-醋酸酯0.004 5%、9-HODE 0.013%。花旗泽仁标准混合液按照主要活性成分百分比进行配置。精密称取适量人参皂苷Rb1、泽泻醇A-24-醋酸酯及9-HODE各标准品适量,配置如下浓度的标准混合药液:人参皂苷Rb1为96 mg/mL,泽泻醇A-24-醋酸酯2.7 mg/mL,9-HODE为7.8 mg/mL。4℃保存,使用前水浴加温至37℃。
2.2 储备液的配制
精密称取地西泮适量,置于25 mL容量瓶中,加甲醇溶解并稀释至刻度,制得浓度为200 μg/mL的储备液;分别精密称取人参皂苷Rb1、泽泻醇A-24-醋酸酯与9-HODE适量,置于10 mL容量瓶中,加甲醇溶解并稀释至刻度,制得浓度分别为400 μg/mL、40 μg/mL、400 μg/mL的储备液。所有储备液置于-20℃冰箱保存。
2.3 工作溶液的配制
精密移取人参皂苷Rb1和泽泻醇A-24-醋酸酯储备液适量,以甲醇配成浓度如下的混合工作溶液:人参皂苷Rb1:1、2、4、10、20、40、100、200 μg/mL;泽泻醇A-24-醋酸酯:0.02、0.04、0.1、0.2、0.4、1、2、4 μg/mL;精密移取9-HODE储备液适量,以甲醇配成浓度为0.2、1、2、10、20、100、200、400 μg/mL一系列工作溶液。
2.4 标准曲线尿液、粪便样品和质控(quality control,QC)样品的配制
上述浓度的系列混合工作溶液,用空白生物样品(尿液、粪便甲醇溶液)进行1:10稀释得到标准曲线样品,浓度范围如下:人参皂苷Rb1为0.1~20 μg/mL;泽泻醇A-24-醋酸酯为0.002~0.4 μg/mL;9-HODE为0.02~40 μg/mL。
QC样品同法稀释配制,浓度如下:人参皂苷Rb1为 0.2、2、16 μg/mL;泽泻醇A-24-醋酸酯为0.004、0.04、0.32 μg/mL;9-HODE为0.1、2、32 μg/mL。
2.5 色谱检测条件
色谱柱为C18柱(1.8 μm,100 mm×2.1 mm,Agilent Technologies,美国),流速0.3 ml/min;柱温40 ℃;进样体积10 μL;自动进样器温度4℃。流动相:A相为乙腈,B相为水(含0.1%甲酸)。
人参皂苷Rb1与泽泻醇A-24-醋酸酯洗脱方式为梯度洗脱,每个样品的分析周期为12 min。梯度洗脱程序见表1。
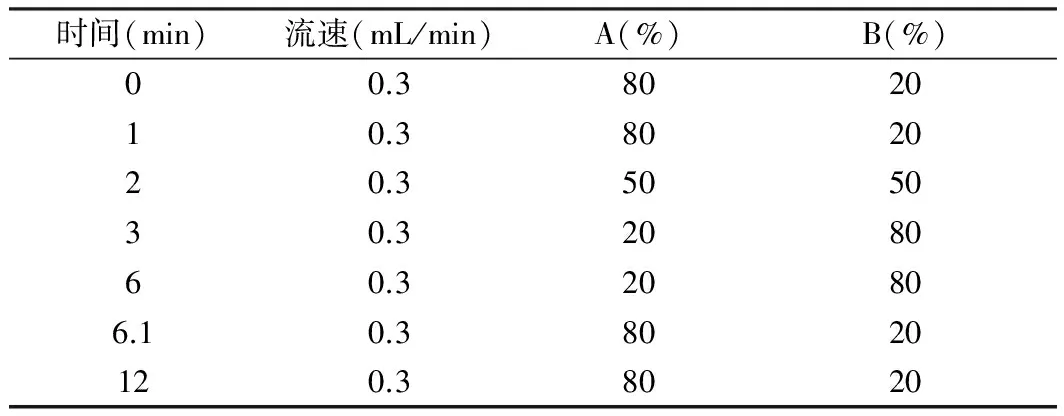
表1 流动相洗脱程序
9-HODE洗脱方法采用A:B为80:20的等度洗脱条件,流速为 0.3 mL/min;样品的分析周期为4 min。
2.6 质谱检测条件
采用ESI-离子源,雾化气与干燥气均为氮气;碰撞气为高纯氮气,各检测成分的质谱参数见表2;其他质谱参数优化后如下:离子源电压3 500 V、雾化器流速10 L/min、雾化器温度350 ℃、干燥气温度350 ℃、干燥气流速10 L/min、扫描频率2 amu/s、扫描范围100~1 300 amu、雾化器压力50 V、毛细管电压3 500 V。

表2 待测成分和内标物的质谱检测参数
注:Ginsenoside Rb1:人参皂苷Rb1;Alisol A 24-acetate:泽泻醇A-24-醋酸酯;9-HODE:9-羟基(10E,12E)十八碳二烯酸;Diazepam:地西泮
2.7 尿液及粪便样品的采集
取SD大鼠6只,雄性,给药前禁食12 h,自由饮水,灌胃给予花旗泽仁水煎液,剂量为花旗泽仁组1 mL/100 g体质量。于给药前及给药后12 h采集尿液、粪便样本,收集到的尿液6 000 rpm离心10 min,取上清液-80℃保存;收集到的粪便阴干后置于-80℃保存。
2.8 尿液、粪便样品预处理方法
取尿液100 μL,加入同体积的地西泮内标溶液(1 μg/mL)于12 000 rpm离心10 min,取上清液0.22 μm微孔滤膜过滤后进行HPLC-MS/MS分析,进样体积为10 μL。
取碾碎混匀的粪便1 mg,加甲醇3 mL溶解, 超声10 min,取上清液100 μL,加入同体积的地西泮内标溶液(1 μg/mL),0.22 μm微孔滤膜过滤后进行HPLC-MS/MS分析,进样体积为10 μL。
2.9 Metabolynx处理
将待测化合物可能的I相、II相代谢产物输入Metabolynx软件中,质谱数据检测误差范围设为<1×10-5,同时将质量亏损过滤应用于数据处理。采用两次UPLC串联Q-TOF/MS分析完成代谢产物的寻找与确认。首先,对经UPLC色谱分离的代谢产物进行分析,并运用Metabolynx软件寻找可能的代谢物。其次,采用与第一次相同的UPLC色谱条件,对已找寻到的可能代谢物进行MS/MS分析,以进一步确认代谢产物。本文中所有MS离子碎片都是在选择了产物分子离子峰后进行MS/MS分析的结果。
2.10 方法学验证
2.10.1 选择性
将6个不同个体的空白生物样本及添加标准品的生物样本(人参皂苷Rb1:1 μg/mL;泽泻醇A-24-醋酸酯:0.2 μg/mL;9-HODE:0.02 μg/mL;地西泮:0.5 μg/mL)按照上述方法处理生物样品后进行HPLC-MS/MS分析,比较不同空白生物样本和添加标准品的生物样本色谱图。观察待测组分和内标的出峰位置,空白生物样本中的内源性成分是否存在干扰。
2.10.2 线性范围和定量下限(lower limit of quantification,LLOQ)
以峰面积的比值y(待测组分/内标)为纵坐标,浓度x为横坐标,采用1/x加权最小二乘法进行线性回归,进行6条标准曲线的测定。LLOQ是标准曲线上的最低浓度点,其响应值应为空白生物基质干扰物响应值的5倍以上(S/N≥5),且精密度表示为相对标准偏差(relative standard deviation,RSD)应≤20%,准确度表示为偏倚(bias)应在±20%范围内。
2.10.3 基质效应和提取回收率
配制添加待测组分标准品的粪便样品(低、中、高QC浓度),按照样品前处理操作后测定响应值(峰面积3);将6个不同批次来源的空白生物样品待测组分测定响应值(峰面积2);用流动相配制相应浓度不含基质的纯样品溶液测定响应值(峰面积1)。绝对基质效应的计算值为峰面积2与峰面积1的比值;提取回收率的计算值为峰面积3与峰面积2的比值。同时考察内标地西泮的基质效应和提取回收率。尿液样本预处理方法不涉及提取过程,因此不考察提取回收率。
2.10.4 精密度和准确度
采用3个不同分析日的数据对测定方法的精密度和准确度进行验证,低、中、高3个质控(quality control,QC)浓度的标准生物样品在每个分析日内进行6次测定,求算每个分析日的日内精密度和准确度,以及3批共18个数据的日间精密度和准确度。并在样品测定的不同批次中,加入QC样品进行方法学质控。
2.10.5 样品稳定性
方法学验证过程中,对分析样品的稳定性进行考察,包括3次冻融循环后的稳定性,室温下25℃放置4 h的短期稳定性,-80℃冷冻条件下保存2周的长期稳定性,以及样品处理后置于自动进样器(4℃)12 h的稳定性,将低、中、高3个QC浓度的标准生物样品在上述条件下保存后,分析测定得到的样品浓度与新配制相应浓度的QC样品进行比较,以相对偏差(RE)表示。
3 结果与讨论
3.1 方法学验证
3.1.1 选择性
图1~图2显示待测组分和内标的出峰位置,空白生物样本中的内源性成分对人参皂苷Rb1与泽泻醇A-24-醋酸酯的测定不造成干扰。由于大鼠体内含有一定量的9-HODE,因此如图1A~图2A所示空白尿液及粪便中出现9-HODE色谱峰。图中显示在上述分析条件下,人参皂苷Rb1、泽泻醇A-24-醋酸酯、9-HODE和内标的保留时间具体如下:人参皂苷Rb1为6.2 min,泽泻醇A-24-醋酸酯为9.3 min,地西泮为1.8 min,9-HODE为2.5 min。
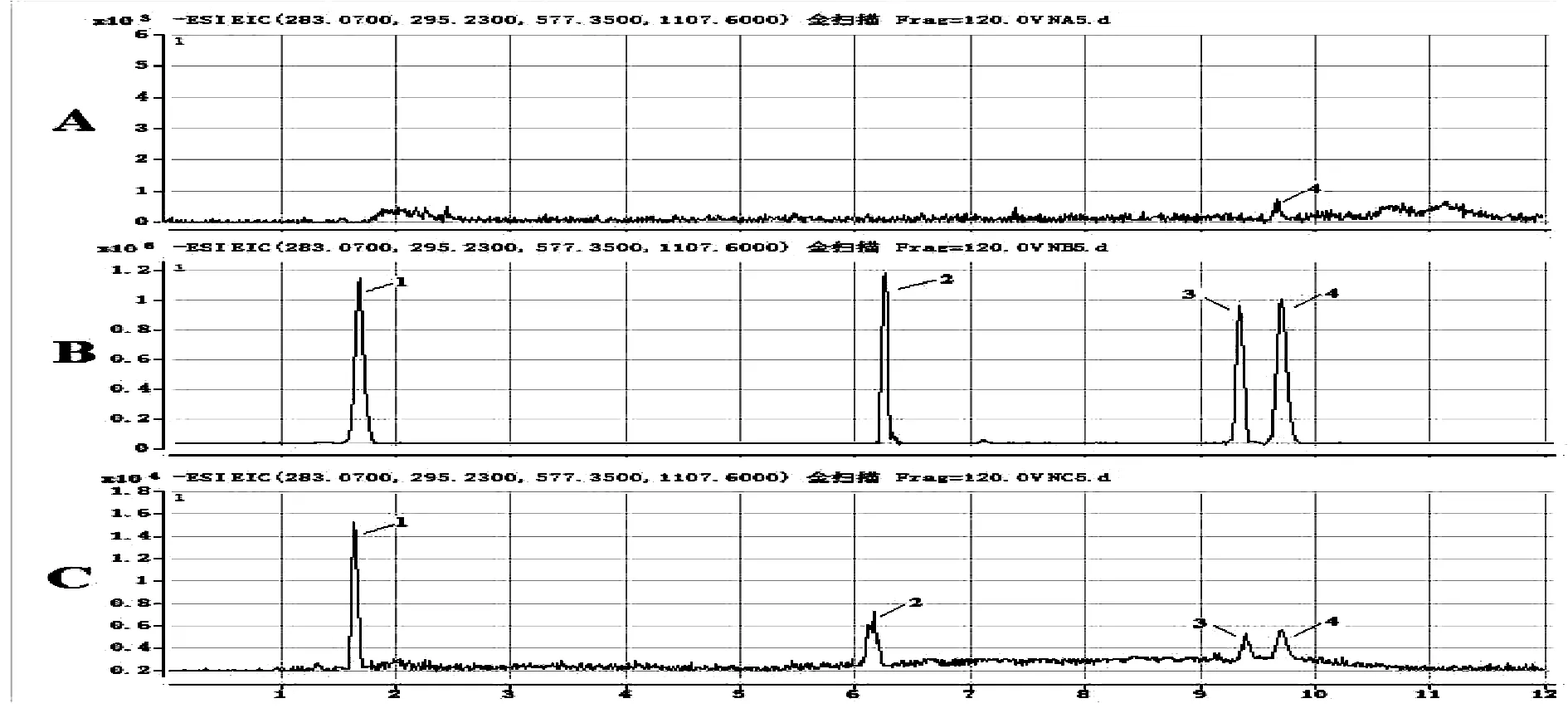
图1 地西泮(1)、人参皂苷Rb1(2)、泽泻醇A-24-醋酸酯(3)、9-HODE(4)的尿液样品色谱图注:空白尿液(A);空白尿液标准添加的待测组分和内标(B);给药2 h后的实测尿液样品(C)
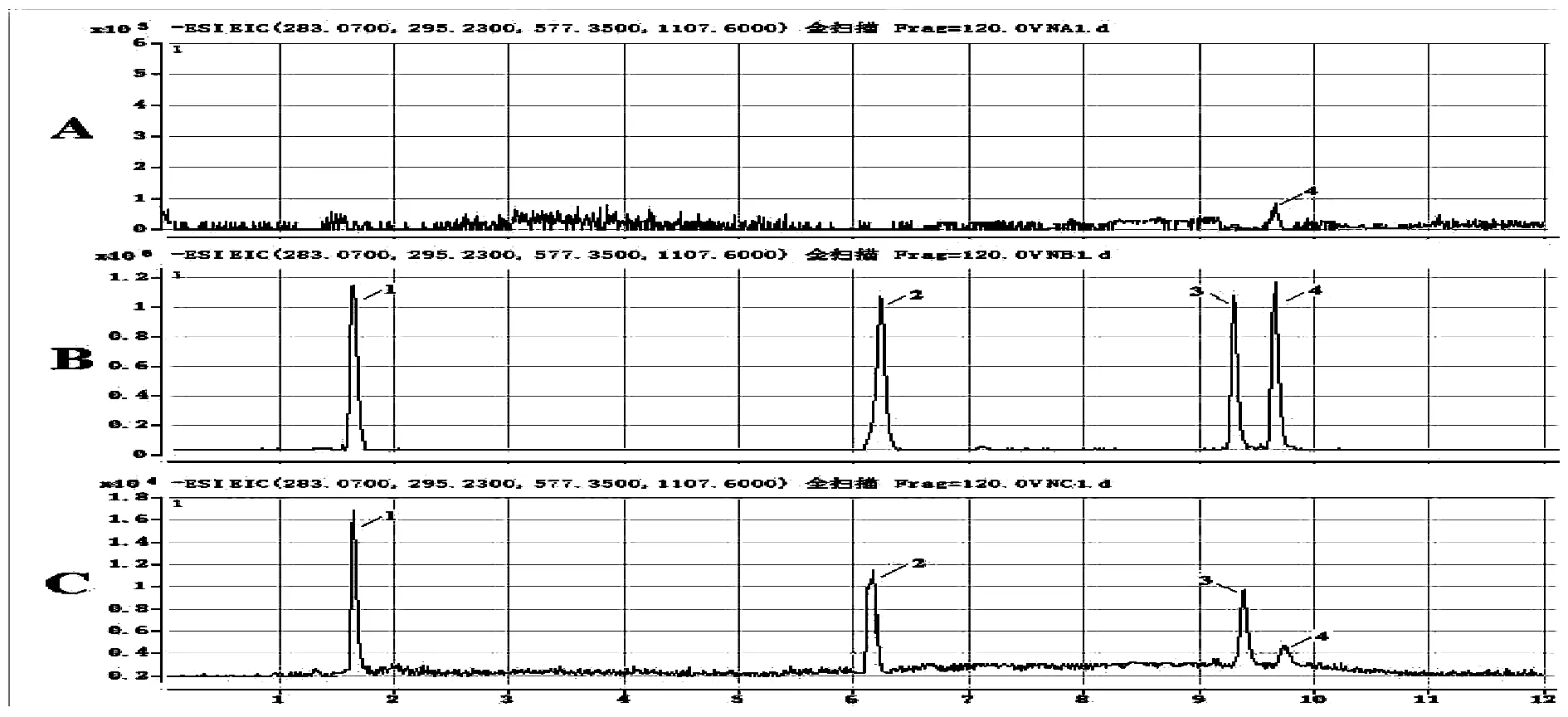
图2 地西泮(1)、人参皂苷Rb1(2)、泽泻醇A-24-醋酸酯(3)、9-HODE(4)的粪便样品色谱图注:空白粪便(A);空白粪便标准添加的待测组分和内标(B);给药2 h后的实测粪便样品(C)
3.1.2 线性范围与定量下限
2种生物样本共6条标准曲线在考察的下列浓度范围内均显示良好的线性关系,人参皂苷Rb1:0.05~10 μg/mL;泽泻醇A-24-醋酸酯:0.001~0.2 μg/mL;9-HODE:0.01~20 μg/mL。待测组分的平均回归方程见表3。
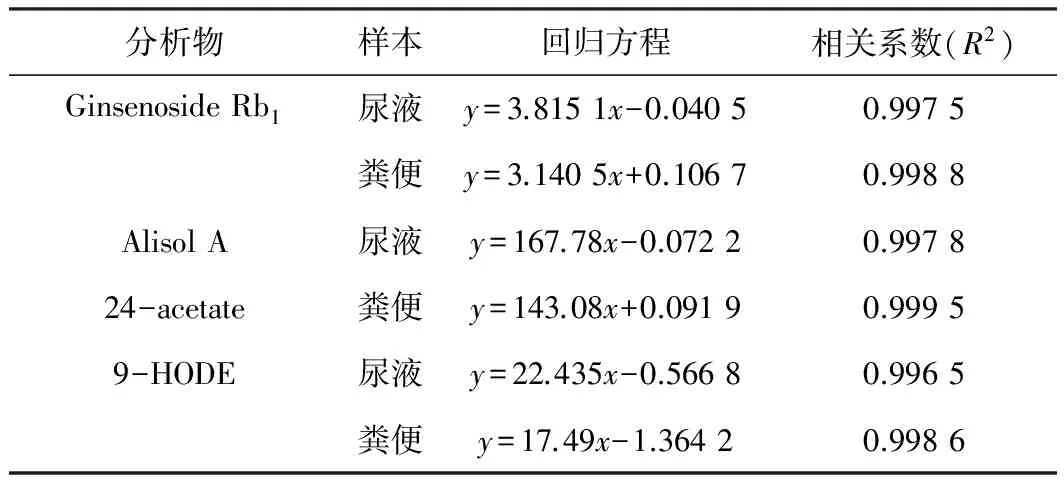
表3 待测组分在各样品中的平均回归方程和相关系数
注:Ginsenoside Rb1:人参皂苷Rb1;Alisol A 24-acetate:泽泻醇A-24-醋酸酯;9-HODE:9-羟基(10E,12E)十八碳二烯酸
用来源不同的空白样品新配LLOQ浓度点样品进行定量下限的考察。结果显示,信噪比(S/N)≥5,且精密度表示为RSD≤20%,准确度表示为bias在±20%范围内。LLOQ点的准确度和精密度均达到了要求,所得到的标准曲线线性良好。而其他待测组分未见明显的残留效应。
3.1.3 基质效应和提取回收率
表4列出了粪便样品低、中、高QC浓度的人参皂苷Rb1、泽泻醇A-24-醋酸酯和地西泮内标的基质效应和提取回收率考察结果。绝对基质效应分别为77.4%~82.5%、81.5%~87.0%及87.4%,在基质效应的程度基本一致,不随浓度发生变化,且RSD<20%,低、中、高QC浓度下不影响本分析方法的准确性和重现性。提取回收率均在80%以上,提取回收率良好,且精密度符合要求。人参皂苷Rb1、泽泻醇A-24-醋酸酯和地西泮内标在尿液中的基质效应结果见表5。在低、中、高QC浓度下基质效应均大于80%,三个浓度下基质效应的程度基本一致,且RSD<20%,变异程度较低,符合生物样品分析要求。表6中数据显示粪便在前述处理条件下,低、中、高QC浓度下9-HODE的提取回收率分别为89.2%、92.1%、90.1%,总体而言,提取回收率良好。

表4 待测组分在大鼠粪便中的基质效应和提取回收率(n=6)
注:Ginsenoside Rb1:人参皂苷Rb1;Alisol A 24-acetate:泽泻醇A-24-醋酸酯;Diazepam:地西泮

表5 待测组分在大鼠尿液中的基质效应(n=6)
注:Ginsenoside Rb1:人参皂苷Rb1;Alisol A 24-acetate:泽泻醇A-24-醋酸酯;Diazepam:地西泮

表6 9-HODE在大鼠粪便中的提取回收率(n=6)
3.1.4 精密度和准确度
如表7~8所示,2种生物样品中3种有效成分的日内与日间准确度(bias)均在±20%之间;日内与日间精密度(RSD)均小于20%,数据表明待测组分在大鼠尿液、粪便中的精密度和准确度均符合生物样品的分析要求。
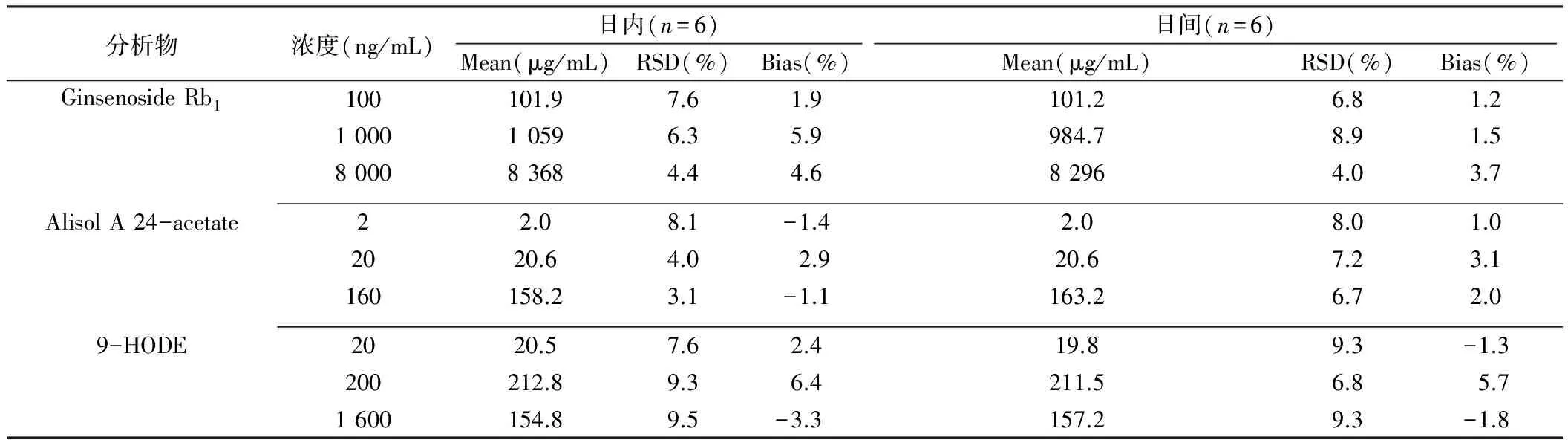
表7 待测组分在大鼠尿液中的精密度和准确度
注:Ginsenoside Rb1:人参皂苷Rb1;Alisol A 24-acetate:泽泻醇A-24-醋酸酯;9-HODE:9-羟基(10E,12E)十八碳二烯酸
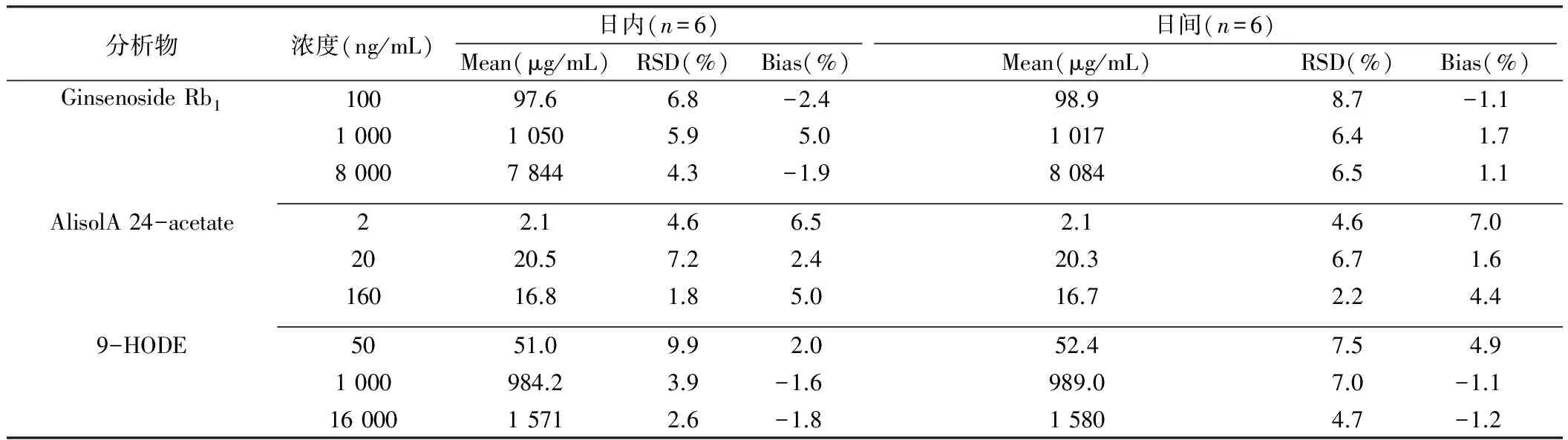
表8 待测组分在大鼠粪便中的精密度和准确度
注:Ginsenoside Rb1:人参皂苷Rb1;Alisol A 24-acetate:泽泻醇A-24-醋酸酯;9-HODE:9-羟基(10E,12E)十八碳二烯酸
3.1.5 样品稳定性
低、中、高三个QC浓度的标准尿液、粪便样品的3次冻融循环后的稳定性,室温下25℃放置4 h的短期稳定性,-80 ℃冷冻条件下保存2周的长期稳定性,以及样品处理后置于自动机进样器(4 ℃)中12 h的稳定性见表9~10。结果显示相对偏差均在±20%,未发现明显降解反应,表明待测组分在大鼠尿液、粪便中的稳定性符合生物样品的分析要求。

表9 待测组分在大鼠尿液中的稳定性
注:Ginsenoside Rb1:人参皂苷Rb1;Alisol A 24-acetate:泽泻醇A-24-醋酸酯;9-HODE:9-羟基(10E,12E)十八碳二烯酸
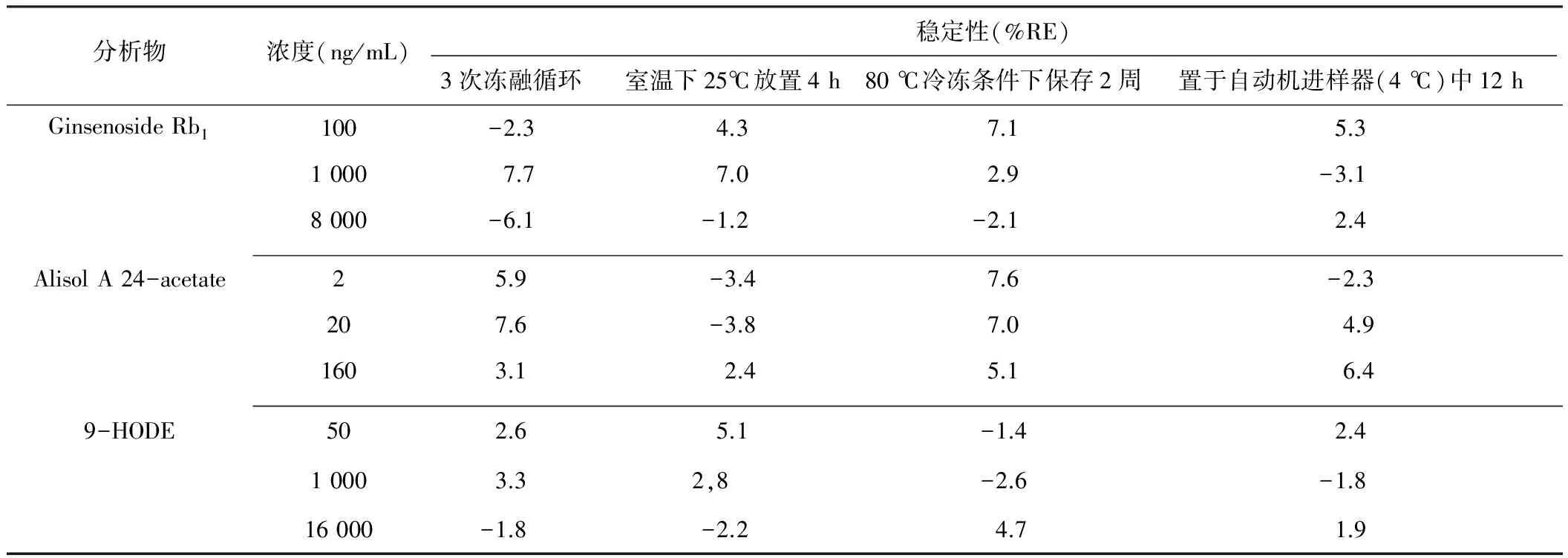
表10 待测组分在大鼠粪便中的稳定性
注:Ginsenoside Rb1:人参皂苷Rb1;Alisol A 24-acetate:泽泻醇A-24-醋酸酯;9-HODE:9-羟基(10E,12E)十八碳二烯酸
3.2 花旗泽仁中3种有效成分在尿液、粪便中的浓度
大鼠分别灌胃花旗泽仁标准混合液后,取尿液、粪便样品在上述检测条件下检测,3种有效成分均有响应,测定数据见表11。
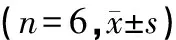
表11 待测组分在尿液、粪便中的浓度
3.3 代谢产物结构鉴定
本实验对大鼠灌胃花旗泽仁3种有效成分(人参皂苷Rb1、泽泻醇A-24-醋酸酯及9-HODE)混合药液后,收集的尿液、粪便样本,对其中存在的3种成分的代谢产物进行结构鉴定,共发现与人参皂苷Rb1相关的代谢产物13个,主要碎片离子见表12。此外,鉴定出泽泻醇A-24-醋酸酯及9-HODE的代谢产物各1个,主要碎片离子见表13和表14。
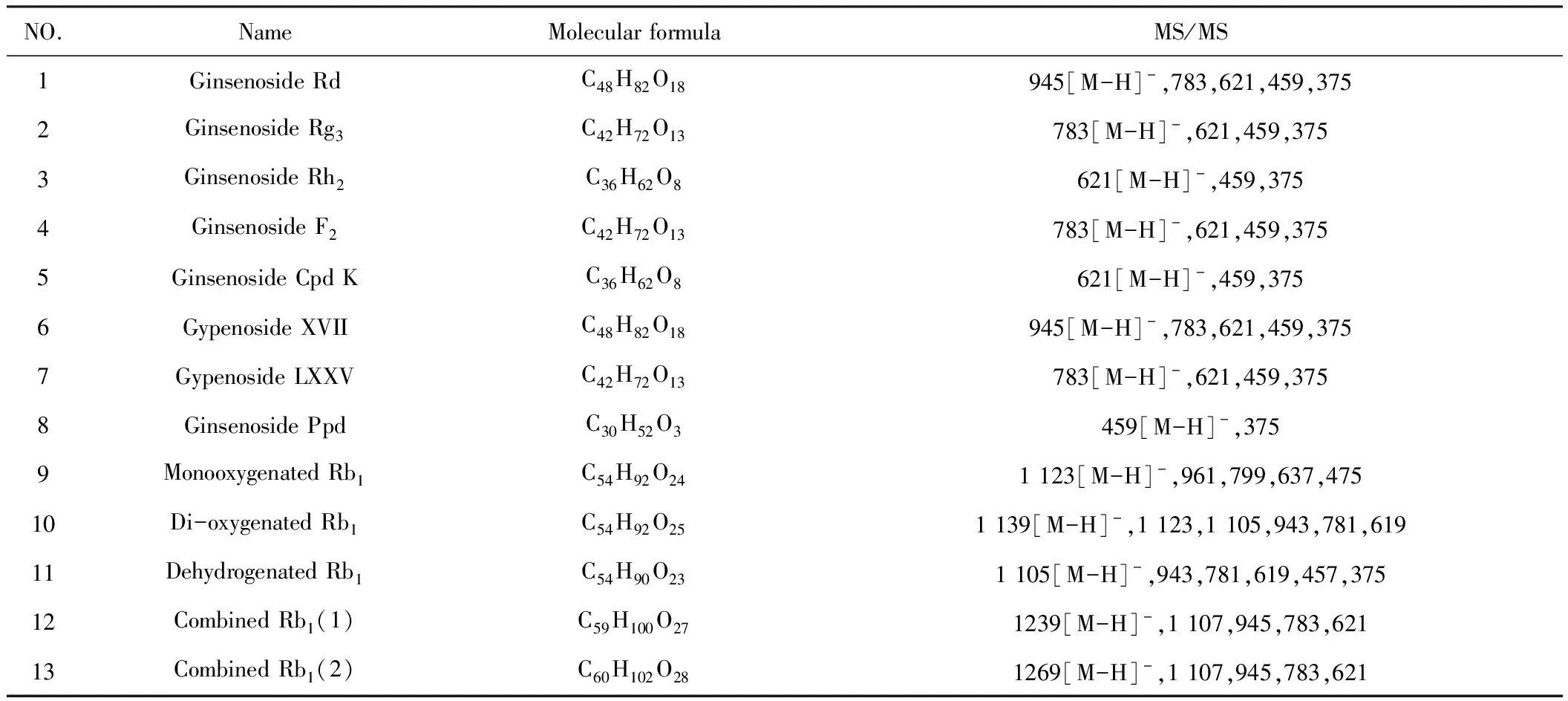
表12 人参皂苷Rb1相关的代谢产物主要碎片离子总表

表13 泽泻醇A-24-醋酸酯代谢产物主要碎片离子

表14 9-HODE代谢产物主要碎片离子
Ginsenoside Rb1在尿液中主要以原型药物为主,此外,还有少量Ginsenoside Rb1在体内发生水解、结合、氧化和脱氢反应,其中Ginsenoside Rd、Ginsenoside Rg3、Ginsenoside Rh2、Ginsenoside F2、Ginsenoside Cpd K、Gypenoside XVII、Gypenoside LXXV、Ginsenoside Ppd均为Ginsenoside Rb1的水解代谢产物,并随着取血时间的推移,代谢产物种类逐渐增多。Monooxygenated Rb1为Ginsenoside Rb1的氧化代谢产物,经过进一步氧化生成Di-oxygenated Rb1,即:Ginsenoside Rb1的过氧化代谢产物。Dehydrogenated Rb1为Ginsenoside Rb1在体内发生脱氢反应所得。Ginsenoside Rb1与五碳糖结合生成Combined Rb1(1),与葡萄糖结合则生成Combined Rb1(2)。主要代谢途径见图3。此外,还发现Alisol A 24-acetate及9-HODE代谢产物各一种,Alisol A为Alisol A 24-acetate的水解代谢产物,9-HODE在体内发生氧化反应生成9-oxoODE,Alisol A 24-acetate及9-HODE代谢途径见图4、图5。

图3 人参皂苷Rb1在大鼠体内代谢流程图

图4 泽泻醇A-24-醋酸酯在大鼠体内代谢流程图
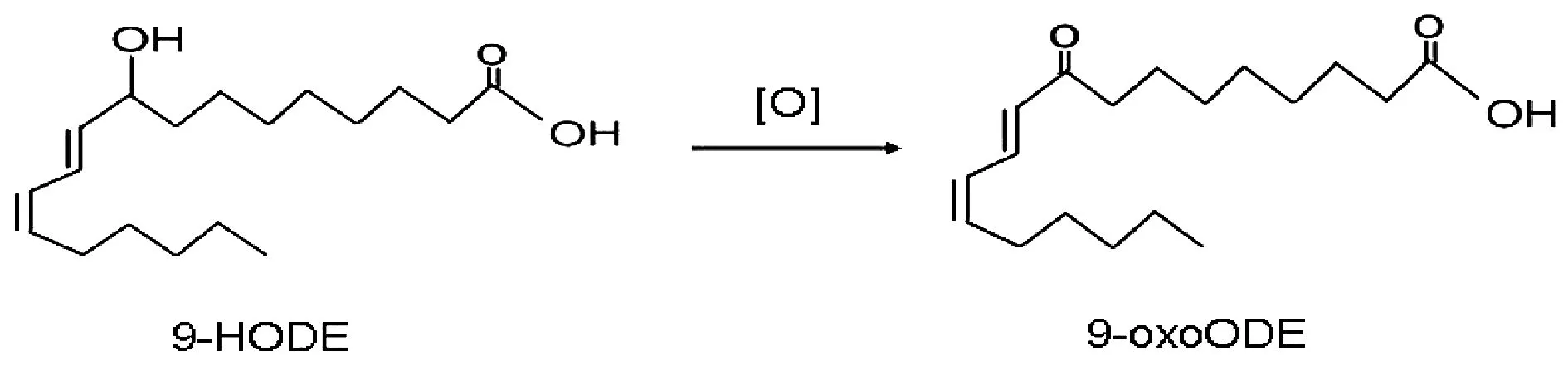
图5 9-HODE在大鼠体内代谢流程图
粪便中共发现Ginsenoside Rb1代谢产物5种,分别是Ginsenoside Rd、Ginsenoside F2、Ginsenoside Cpd K及Ginsenoside Ppd,推测其为进入体内后由胃肠道菌群代谢产生。此外还发现Alisol A 24-acetate代谢产物Alisol A,未检测到9-HODE代谢产物。
4 讨论
本部分实验研究在前期药代动力学研究的基础上,建立了灵敏、有效的HPLC-MS/MS方法测定大鼠尿液、粪便中3种有效成分的浓度,并进行方法学考察,选择性、准确度、精密度、基质效应和提取回收率及稳定性考察结果均符合样品检测要求[4]。结果表明,本方法准确、重复性好、可以用于大鼠尿液、粪便中3种有效成分及其代谢产物的浓度测定。
大鼠灌胃花旗泽仁标准混合液后,我们在尿液、粪便中均检测到了人参皂苷Rb1及其相关代谢产物,其中有大量人参皂苷Rb1原型由粪便排出体外,这可能与人参皂苷Rb1的极性较大,脂溶性较差,不利于其在胃肠道吸收有关。
此外,还有少量人参皂苷Rb1在体内发生水解、结合、氧化和脱氢反应。肠道菌群可以把含量较高的G-Rb1代谢转化为G-Rd,故G-Rd是皂苷代谢后被肠道吸收利用的重要形式之一[5]。研究表明,G-Rd具有广泛的生物活性,有显著的镇痛、抗肿瘤和抗辐射等方面的作用[6],也有文献报道人参二醇型皂苷G-Rd有一定的降血糖作用[7]3-4。C-K具有抗炎、抗过敏、抗肿瘤、神经损伤修复和保肝等作用,而且在神经系统及免疫系统方面也具有良好的调节作用[8]。此外,有研究证实人参皂苷C-K具有明显的降血糖作用[7]23-24。
我们在尿液、粪便中均检测到了Alisol A 24-acetate及其代谢产物,经结构鉴定Alisol A 24-acetate的代谢产物为Alisol A。Alisol A 24-acetate和Alisol A为四环三萜类化合物,是泽泻的主要活性成分[9]。有研究表明,泽泻中三萜类成分泽泻醇A及其醋酸酯,以及泽泻醇B、C的醋酸酯都能够降低血清中胆固醇水平,其中泽泻醇A-24-醋酸酯效果最佳。秦建国等[10]认为,从泽泻脂溶性成分提取的三萜类化合物泽泻醇A-24-醋酸酯的降血脂作用最强。许文等[11]通过用泽泻水、醇提物干预高脂饮食诱导的小鼠胰岛素抵抗模型,阐明泽泻三萜类成分具有较好的降糖作用,其中Alisol A 24-acetate和Alisol A均被证实能够明显地促进细胞葡萄糖的摄取,进而发挥降糖作用。因此我们推测花旗泽仁中的Alisol A 24-acetate及其一部分代谢产物Alisol A,共同发挥降糖、降血脂、降胆固醇的作用[12-13]。
薏苡仁通过激动过氧化物酶体增殖物激活受体(PPARs)而发挥降糖降脂作用,其主要活性成分9-羟基-(10E,12E)-十八碳二烯酸(9-HODE)是最强的PPARγ激动剂[14-15]。我们在尿液、粪便中检测到了9-HODE,且在尿液中检测到了相关代谢物9-oxoODE,代谢产物9-oxoODE可产生类似噻唑烷二酮类(列酮类)降血糖药的调节糖、脂代谢的作用。
综上所述,本研究通过分析有效成分及其代谢产物的排泄过程,探寻花旗泽仁在体内的排泄规律及药效物质基础。这些内容有助于完善花旗泽仁药代动力学研究,为花旗泽仁的合理用药提供依据。
[1] 李仪奎,吴健宇.小青龙汤药物血清对致敏大鼠腹腔肥大细胞脱颗粒以及组胺释放的影响[J].中国中西医结合杂志,2000,20(1):40-43.
[2] 罗芬,池玉梅,吴皓.中药代谢动力学研究概述[J].中国实验方剂学杂志,2011,17(14):284-288.
[3] 王瑶,季宇彬,陈明苍.中药与肠道菌群相互作用的研究进展[J].中国医药导报,2012,9(2):12-14.
[4] 韩东卫,朱蕾,张宇驰,等.基于UPLC/QTOF-MS技术观察花旗泽仁对SD大鼠体内尿液代谢组学的影响[J].中医药信息,2018,35(1):51-54.
[5] 张琛,赵钢.人参皂苷Rd的药理作用研究进展[J].中国新药杂志,2011,20(11):953-958.
[6] 周超群.人参皂苷Rd的生物合成制备及其生物活性研究[D].上海:复旦大学,2009:10-11.
[7] 李伟.人参皂苷Compound K对2型糖尿病的降血糖作用及肝糖异生信号转导通路调控[D].吉林:吉林大学,2012:3-4,23-24.
[8] 周伟.稀有人参皂苷compound K的制备和活性研究[D].上海:复旦大学,2008:5-7.
[9] 禹建春,叶红梅,林西西.泽泻的药理研究概况[J].海峡药学,2011,23(2):92-93.
[10] 秦建国,王亚红,梁晋普,等.泽泻萜类化合物对ApoE基因敲除动脉粥样硬化小鼠肝脏基底膜HSPG的调节作用[J].中华中医药学刊,2007,25(4):696-698.
[11] 许文,罗奋熔,赵万里.等.泽泻降糖活性提取物化学成分研究[J].中草药,2014,45(22):3238-3245.
[12] 郁相云,钟建华,张旭.泽泻降血脂药理作用及物质基础研究[J].中国中医药现代远程育,2010,8(11):250.
[13] 杨新波,黄正明.泽泻水提醇沉提取物对链脲佐菌素诱发糖尿病小鼠有治疗和保护作用[J].解放军药学学报,2002,18(6):336-338.
[14] YOKOI H,MIZUKAMI H,NAGATSU A,et al.Peroxisome prolifera-tor-activated receptor-ligands isolated from adlay seed(Coixlachryma-jobi L. var. ma-yuen STAPF.)[J].Biol Pharm Bull,2009,32(4):735-740.
[15] YOKOI H,MIZUKAMI H,NAGATSU A,et al.Hydroxy monounsat-urated fatty acids as agonists for peroxisome proliferator-activated receptors[J].Biol Pharm Bull,2010,33(5):854-861.

