利湿通痹汤及其拆方对高尿酸血症合并急性痛风性关节炎大鼠疗效机制研究
秦一鸣,杨帆,马双双,张懿鹏,张发艳
(山东中医药大学中医学院,山东 济南 250355)
高尿酸血症是因嘌呤代谢紊乱所引起的代谢性疾病。近年来其发病率逐年升高,已成为仅次于糖尿病的第二大代谢类疑难病[1-2]。痛风性关节炎为高尿酸血症最常见的并发症,也是患者就诊的最普遍原因。中医药治疗高尿酸血症与急性痛风性关节炎有显著优势,针对其病机的多角度方药筛选已引起广泛关注[3-4]。本研究将利湿通痹汤及其拆方应用于高尿酸血症合并GA大鼠模型,旨在探讨可能存在的中医证候特点和药理机制,为提高该病临床诊治水平提供理论参考。
1 材料与方法
1.1 实验动物
雄性Wistar大鼠42只,山东鲁抗医药股份有限公司提供,动物许可证编号:SCXK(鲁)20130001。
1.2 实验药物
利湿通痹汤(当归、红花、桃仁、川芎、防风、黄柏、苍术、独活、羌活、茵陈、泽泻)及其拆方——祛风通经方(独活、羌活、防风)、清热利湿方(黄柏、苍术、泽泻、茵陈)、活血化瘀方(当归、红花、桃仁、川芎)。所用药物购自安徽亳州浙皖中药饮片有限公司,加水煎煮两次后混匀,旋蒸浓缩至浓度为0.5 g/mL备用。
对照用药:吲哚美辛,山西云鹏制药,批号A141002;别嘌醇片,重庆青阳药业有限公司,批号141101。
1.3 试剂与仪器
腺嘌呤(批号X02J6M1)、尿酸钠晶体(批号BCBH7155V)、吐温80(批号Z12D5Y13);IL-1β ELISA检测试剂盒(批号20150601A)、尿酸检测试剂盒(批号L12O6G4230)(上海源叶生物科技有限公司);XOD测定试剂盒(批号20150917,南京建成生物工程研究所);酶标仪(美国Biotok公司,型号EL340i);低速离心机(安徽中科中佳科学仪器有限公司,型号SC-3612);旋转蒸发器(上海亚荣生化仪器厂,型号RE-52A);紫外可见分光光度计(上海元析仪器有限公司,型号UV-5500)。
1.4 模型制备
1.4.1 高尿酸血症模型制备
参照文献[5],采用腺嘌呤200 mg/(kg·d)和盐酸乙胺丁醇250 mg/(kg·d)灌胃,连续7 d。
1.4.2 GA模型制备
于高尿酸血症造模结束后,将1 g尿酸钠加入0.9%生理盐水40 ml中,再加入10 mL吐温80,加温搅拌,制成20 g/L的尿酸钠溶液。将各组大鼠以水合氯醛麻醉,除对照组外,用注射器于右侧踝关节内侧与胫骨呈45°穿刺入关节腔,注入尿酸钠溶液50 μL,伸屈、旋转运动10 min。注射后大鼠出现跛行及关节红肿发热,证明造模成功。对照组予以50 μL生理盐水关节腔内注射。
1.5 分组与给药
以60 kg体表面积用药量换算后剂量的6倍为给药剂量,将大鼠分为对照组、模型组、利湿通痹汤全方组(13.2 g/kg)、祛风通经组(3.9 g/kg)、清热利湿组(5.1 g/kg)、活血化瘀组(4.2 g/kg)、西药组(别嘌醇0.09 g/kg,吲哚美辛0.015 g/kg),每组6只,各组灌胃容积均为3 ml。适应性饲养3 d后,对照组、模型组给予生理盐水,各给药组予以相应药物(西药组给予别嘌醇)连续灌胃。7 d后,模型组与各给药组以腺嘌呤联合盐酸乙胺丁醇制备高尿酸血症模型,上午给药干预,下午给药造模,继续灌胃7 d。于高尿酸血症造模第6天,除对照组外,各组大鼠制备GA模型,同时西药组别嘌醇改作吲哚美辛灌胃,2 d后观察实验结果。
1.6 观察指标
1.6.1 关节周径测量
于GA造模后第24 h以缚线法测量右侧踝关节同一部位周径(取均值),评估其关节肿胀度。
1.6.2 血清生化指标测定
给药结束后,各组大鼠以水合氯醛麻醉,腹腔静脉采血,静置4 h,3 500 r/min离心15 min,取上清检测血尿酸值、XOD活力与IL-1β水平。
1.7 统计学处理
2 结果
2.1 利湿通痹汤及其拆方对高尿酸血症合并GA大鼠关节周径的影响
关节腔内注射尿酸钠后,各组大鼠关节均见明显肿胀,关节周径增大。模型组与对照组相比有显著差异(P<0.01),证明大鼠GA模型造模成功。在造模后第24 h,全方组、清热利湿组与活血化瘀组可降低大鼠关节周径(P<0.05,P<0.01)。结果见表1。
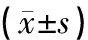
表1 对高尿酸血症合并GA大鼠关节周径的影响
注:与模型组相比,[1]P<0.05,[2]P<0.01
2.2 利湿通痹汤及其拆方对高尿酸血症合并GA大鼠血清UA、XOD的影响
与对照组相比,模型组大鼠血清UA值及XOD活力显著升高(P<0.01),证明大鼠高尿酸血症模型造模成功。与模型组相比,全方组、祛风通经组、清热利湿组与活血化瘀组可明显降低大鼠血清UA值;全方组、祛风通经组、清热利湿组可抑制血清XOD活力,差异具有统计学意义(P<0.05,P<0.01)。结果见表2。
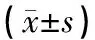
表2 对高尿酸血症合并GA大鼠血清UA值及XOD活力的影响
注:与模型组相比,[1]P<0.05,[2]P<0.01
2.3 利湿通痹汤及其拆方对高尿酸血症合并GA大鼠血清IL-1β水平的影响
制备GA大鼠模型2 d后,模型组大鼠血清IL-1β水平较正常组显著上升(P<0.01)。全方组、祛风通经组、清热利湿组与活血化瘀组均可抑制其血清IL-1β水平,差异具有统计学意义(P<0.05,P<0.01)。结果见表3。
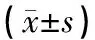
表3 对高尿酸血症合并GA大鼠血清IL-1β水平的影响
注:与模型组相比,[1]P<0.05,[2]P<0.01
3 讨论
作为人类嘌呤代谢的终产物,尿酸在体内的主要来源为核酸分解或机体内合成(约占人体总尿酸的80%)[6]。次黄嘌呤与黄嘌呤是体内产生尿酸的直接前体,次黄嘌呤在黄嘌呤氧化酶作用下被氧化为黄嘌呤,进一步转化为尿酸。因此XOD是体内核酸代谢的关键酶,XOD的活性直接影响体内尿酸水平[7]。尿酸盐可在血尿酸浓度过高时沉积于关节及关节周围,刺激局部组织释放大量炎症介质,引发GA。其中IL-1在诸多细胞因子中占据重要地位,而其在关节内的主要存在形式为IL-1β[8]。作为前炎症网链中的一级细胞因子,IL-1β是调节炎症的始动因素[5],由IL-1β介导的级联瀑布效应可造成广泛的细胞与组织损伤,反复的GA发作可最终导致关节内软骨基质与骨质的破坏性病变[9]。高尿酸血症与GA关系密切,有文献表明,5%~12%的高尿酸血症患者最终发展为痛风[10]。可见对于这一疾病,降低体内尿酸值、减轻关节炎症为其治疗核心。
“高尿酸血症”一词在中医古典文献中未有提及,有学者认为其隶属于“湿毒”范畴。而从临床表现看,GA则与“白虎历节”“痛风”“热痹”等相近[11]。一般认为,该病的起病在于过食肥甘厚味,日久损伤脾胃以致运化失司,湿邪停聚,郁而化热;或先天不足、年老体衰导致肝、脾、肾亏虚,无力运化水湿进而内生湿热。湿热阻滞既久,则经脉不得濡养而致痰瘀丛生。痰凝关节,瘀阻经脉,结为窠臼,终成痹阻。在本病的治疗上,向黎黎归纳统计了近10年间临床治疗痛风有效的的相关方药,发现其主要着眼于清热利湿、活血化瘀和祛风化湿[12]。故湿浊内蕴是高尿酸血症合并GA的病理基础,由此引发的病理产物及病理状态构成该病较为复杂的病机。从方剂学的角度探索其治疗原则、组方规律及作用机制,具有重要的研究价值。
实验结果显示,利湿通痹汤及其三组拆方对高尿酸血症合并GA大鼠模型均有不同程度的治疗作用,但在药理机制上各有侧重。清热利湿组血清IL-1β值、XOD活力均低于祛风通经组与活血化瘀组,说明清热利湿类药物具有较强的降低尿酸水平、抑制炎症反应作用,亦反证“湿热”为该模型主要的中医证候特点,与一些学者的观点相似[7,13]。活血化瘀组药物可降低血清UA及IL-1β值,但对XOD的抑制作用较弱,推测其可能是通过促进尿酸排泄等途径从而改善血尿酸浓度的。祛风通经组药物虽可显著降低模型大鼠血清尿酸及IL-1β水平,但不能改善临床症状(关节周径),提示临床治疗GA不能仅考虑炎症反应的控制,还应配伍其他治法。利湿通痹汤全方可明显降低模型大鼠血清尿酸及IL-1β值、抑制XOD活力,且较三组拆方为优,说明三组治法可产生较好的协同作用,临床上可同时应用以增强疗效。
综上所述,利湿通痹汤及其拆方对高尿酸血症合并GA有良好的治疗作用,其作用可能是通过降低血清IL-1β、UA水平及抑制XOD活力而实现的。本研究在临床资料及动物实验文献分析的基础上,将利湿通痹汤及其拆方应用于动物模型并观察相关指标的改变,以药物反证的形式归纳该模型的主要中医证候、病机特点,并探讨不同治法下的代表药物可能存在的药理机制,从方剂配伍角度为临床应用提供了一定程度上的理论依据。但关于本方治疗高尿酸血症合并GA的其他药理机制有待进一步探究。
[1] 齐新宇,董大立,熊辉,等.蠲痹历节清方治疗急性痛风性关节炎湿热证疗效观察[J].湖南中医药大学学报,2014,34(5):42-44.
[2] 向黎黎,熊辉,李腾龙,等.蠲痹历节清方治疗急性期湿热蕴结型痛风性关节炎31例[J].湖南中医杂志,2015,31(2):14-16.
[3] 陈光亮,周媛凤,张颖.治疗痛风和高尿酸血症药物研究进展[J].中国临床药理学与治疗学,2017,22(1):104-109.
[4] 杨博,晏和国,李建洪,等.从“脾虚湿阻”分期论治痛风[J].中医药信息,2018,35(1):79-81.
[5] 徐莎婷,荣誉,吴杨,等.当归拈痛汤及其拆方对急性痛风性关节炎大鼠血尿酸值、IL-1β、TNF-α、COX-2 的影响[J].湖南中医药大学学报,2013,33(9):44-47.
[6] 刘洋.壳寡糖对小鼠高尿酸血症动物模型的治疗作用研究[D].青岛:中国海洋大学,2009:1-60.
[7] 高碧珍,康洁,闵莉,等.不同中医治法对高尿酸血症合并高脂高糖大鼠模型黄嘌呤氧化酶及其mRNA表达的影响[J].中华中医药杂志,2010,25(11):1793-1795.
[8] LANDSBERG R,TAKEUCHI E,PUZAS J E.Different activation by cytokines of mitogen-activated protein kinases in bovinetemporoman dibular-joint disc cells [J]. Arch Oral Biol,1999,44(1):41.
[9] MYTHILYPRIYA R,SACHDANANDAM P S,Sachdanandam P.Ameliorating effect of Kalpaamruthaa,a Siddha preparation in adjuvant induced arthritis in rats with reference to changes in proinflammatory cytokines andacute phase proteins[J].Chem Biol Interact,2009,179(2-3):335-343.
[10] 蒋明,朱立平,林孝义.风湿病学[M].北京:科学出版社,1995:1470-1476.
[11] 谢志军,温成平,鲍海军,等.祛浊通痹方对高尿酸模型大鼠血尿酸及黄嘌呤氧化酶的影响[J].中华中医药杂志,2011,26(6):1398-1400.
[12] 向黎黎.中医药治疗痛风用药规律及证型特点的文献研究[D].长沙:湖南中医药大学,2015:1-37.
[13] 陆艳萍,舒荣,崔刘福.补肾健脾利湿法治疗高尿酸血症临床观察[J].中国中医基础医学杂志,2005,11(7):557.

