水培实验中不同粒径纳米TiO2对金鱼藻种子发芽和植株生长和生理的影响
文双喜,王毅力
1. 北京林业大学环境科学与工程学院,北京 100083 2. 贵阳学院生物与环境工程学院,贵阳 550005
纳米二氧化钛(TiO2-NPs)是一种人工金属氧化物纳米材料,因具有优异的吸收紫外线能力、高效的光催化效果、良好的抗光化学腐蚀能力及导电能力,而被大量应用在医疗、食品、化妆品、废水处理、能量储存、油漆及建筑材料等关系到国计民生的各行各业中[1-4],预计其全球年产量在2025年将达到2.5×106t[5]。据澳大利亚政府官方报告显示,在澳大利亚注册的含TiO2-NPs的防晒化妆品已经高达300多种[6],甚至人类在工作场所呼吸的空气中都会有纳米颗粒的存在[7]。
纳米材料在生产、消费和处置过程中不可避免地会通过污水厂尾水和工业废水排放、大气沉降、地表/地下径流等方式进入水体,影响水生生态系统[8]。近期研究表明,TiO2-NPs已经在城市污水处理厂的出水、污泥以及地表水体中均有检出。付佳露等[9]研究发现,长江口外取水点水样中的纳米颗粒形态的钛浓度达89.0 μg·L-1;刘志远等[10]报道,曲阳污水处理厂水体中的钛浓度达到768 μg·L-1;Kiser等[11]研究发现亚利桑那州生活污水厂中钛浓度在0.1~3.0 mg·L-1的范围内波动。
自然水体是经多种途径释放到环境介质中的纳米颗粒的最终受纳体,因此进入到天然湿地和人工湿地中的TiO2-NPs会在湿地生物、基质、水体之间进行迁移转化和归趋。已有的研究表明,植物是纳米材料进入环境及其在食物链中的向上传递和生物富集的重要通道之一[12]。因此,研究纳米材料对湿地植物的影响特征可以揭示该材料在环境中的归趋、生态毒理效应及其去除机制。金鱼藻是湿地中常见的植物,目前关于纳米材料对金鱼藻污染生态效应方面的文献还比较缺乏。因此,本研究选取金鱼藻作为研究对象,考察不同粒径TiO2-NPs对金鱼藻种子发芽、植株生长形态和生理特征的影响,同时研究金鱼藻植株对不同粒径TiO2-NPs的吸收、累积及TiO2-NPs进入植株后的分布特征。
1 材料与方法(Materials and methods)
1.1 实验材料
实验所用金鱼藻种子购自南京景香园有限公司,所用金鱼藻植株(展叶期,采于当年5月)采自圆明园九州景区池塘。SOD试剂盒购于南京建成生物工程研究所,培养植物所用1/4浓度的霍格兰氏植物培养液按照文献[13]中的方法配制。
4 nm、20 nm、50 nm的TiO2-NPs购于北京安特普纳科贸责任有限公司(含量:≥99.5%;锐钛矿∶金红石=71∶29),本研究中对3种粒径TiO2-NPs的TEM图像、各粒径不同浓度TiO2-NPs在25 ℃、pH=6.5±0.1的1/4浓度的霍格兰氏植物培养液中的Zeta电位值及XRD图谱(20 nm)进行了表征或观察。
主要仪器:带能谱仪的透射电镜(TEM-EDX, JEM-2100, JEOL, 日本);Reichert超薄切片机(Ultracut,米力光国际贸易有限公司,英国);X射线衍射仪(XRD, BruckerD-8 Diffractometer, 德国);Zeta电位分析仪(Zetasizer 2000, Malvern, 英国);光照培养箱(MGC-300B, 上海一恒科学仪器有限公司);电感耦合等离子体质谱(ICPS-1000IV, Shimadzu, 日本);气浴恒温振荡器(RH-8811,常州润华电器有限公司);7230型分光光度计(上海精密仪器仪表有限公司);立式高速冷冻离心机(GL-25MS, 匡贝实业有限公司)。
1.2 种子发芽试验
为了保证发芽试验的准确性,挑选形态丰满、品相良好的金鱼藻种子(百粒重0.0334 g)进行发芽试验,考察不同浓度的TiO2-NPs对金鱼藻种子的发芽影响。
种子和实验器材消毒灭菌,TiO2-NPs处理浓度分别为0、20、100、200、500、1 000、2 000 mg·L-1,按文献[14]中的方法进行种子暴露处理,按文献[15]中的方法进行发芽试验,每天(共6 d)记录种子发芽数,发芽结束测定种子发芽重量,所有发芽试验均设置3次重复。按照文献[16]中的公式计算金鱼藻种子的发芽指数、发芽率、发芽势及活力指数等发芽指标。
1.3 植株暴露培养
为了保证试验结果的可靠性,所有金鱼藻植株从圆明园取回后都先放入装有1/4浓度的霍格兰氏植物培养液的50 cm×40 cm×35 cm玻璃水族箱中25 ℃下驯化培养15 d。
取驯化后生长情况相当的金鱼藻植株放入装有含不同浓度TiO2-NPs的1/4浓度霍格兰氏植物培养液的1 000 mL烧杯中进行TiO2-NPs暴露培养。把装有植株的烧杯放入光照培养箱中培养,培养条件:白天/黑夜温度(26/22±1) ℃;光照/黑暗周期16 h/8 h;光照强度300 μE·m-2·s-1,培养时间为10 d。
TiO2-NPs的浓度梯度设置为0、1、10、100、200和500 mg·L-1,每个烧杯放入约10 g金鱼藻植株,每个浓度设置3次重复,每天记录植株生长情况。
1.4 植株生长指标的测定
每2天取1.3中经不同浓度TiO2-NPs溶液培养的金鱼藻样品进行丙二醛(MDA)、叶绿素含量测定。培养结束取样进行超氧化物歧化酶(SOD)活性测定,SOD活性和MDA含量取根进行测定。
其中,SOD酶活性按南京建成生物工程研究所的SOD试剂盒的说明书进行测定;MDA和叶绿素含量分别按照文献[17]和[18]中的方法进行测定。
1.5 TiO2-NPs在植株体内的分布与累积
培养结束,取1.3中经不同浓度TiO2-NPs溶液培养的金鱼藻植株按文献[19]中的方法进行TEM-EDX观察。另取适量样品按文献[20]中的方法利用ICP-MS测定样品中的Ti含量。同时,由于镁(Mg)是植物正常生长所必需的微量元素之一,是构成叶绿素的中心分子,有促进植物光合碳同化的作用,考虑到Mg含量和叶绿素之间的关系,在测定Ti含量的同时也测定样品中Mg的含量。
1.6 数据分析
本试验所有处理均设3次重复,以3个平行组数据计算平均值±标准差(Mean±SD),采用ANOVA(Analysis of variance, LSD检验法)对试验数据进行差异显著性分析(检验标准为P<0.05),采用origin8.0对数据进行绘图。
2 结果与讨论(Results and discussion)
2.1 TiO2-NPs表征结果
3种粒径TiO2-NPs的TEM图像、不同浓度TiO2-NPs在25 ℃、pH=6.5±0.1的1/4浓度的霍格兰氏植物培养液中的Zeta电位值及XRD图谱(20 nm)如图1所示。
图1a~c中的TEM图像显示各粒径的TiO2-NPs均呈圆形、椭圆形或长方形颗粒,平均粒径与商家所标基本吻合;TiO2-NPs(20 nm)的XRD图谱如图1d所示,在25.24°、37.7°、48.0°、55.04°、62.76°、70.22°和75.06°检测到了峰的存在,其中25.24°到48.0°之间的峰为区分特征峰,与粉体衍射标准卡联合委员会(JCPDS)数据库No.21-1272号卡片吻合,表明本试验所用TiO2-NPs的主要成分为锐钛矿,满足试验需求。从图1e中可以看出:各粒径不同浓度的TiO2-NPs在1/4浓度的霍格兰氏植物培养液中的Zeta电位整体数值范围在±10.0~±30.0之间,说明分散体系不太稳定[21],因此,在培养实验中需要每天定时对培养液进行搅动数次,保证TiO2-NPs颗粒在溶液中保持良好的分散状态。
2.2 TiO2-NPs对金鱼藻种子发芽的影响
不同粒径、不同浓度TiO2-NPs溶液处理后的金鱼藻种子发芽率及发芽重量见图2,主要发芽指数如表1所示。
从图2a中可以看到,3种粒径的TiO2-NPs处理均对金鱼藻种子的发芽有一定的抑制作用,且TiO2-NPs粒径越小、浓度越高抑制作用越明显。4 nm、20 nm和50 nm的TiO2-NPs对金鱼藻种子发芽的半数有效浓度(EC50)分别为1 180、1 520和1 810 mg·L-1,当浓度为2 000 mg·L-1时,3种粒径TiO2-NPs处理后金鱼藻种子的发芽率分别由空白处理的88.33%下降到27.67%(4 nm)、31.67%(20 nm)和39.67%(50 nm)。

图1 TiO2-NPs的TEM表征(a-4 nm;b-20 nm;c-50 nm)以及XRD图谱(d-20 nm)和25 ℃下不同浓度的TiO2-NPs在1/4浓度的霍格兰氏植物培养液中的Zeta电位Fig. 1 TEM images (a-4 nm; b-20 nm; c-50 nm) and physical properties of TiO2-NPs (d-20 nm) XRD patterns; (e) zeta potential vs. different TiO2-NPs concentrations in 25% strength Hoagland nutrient solution at 25 ℃
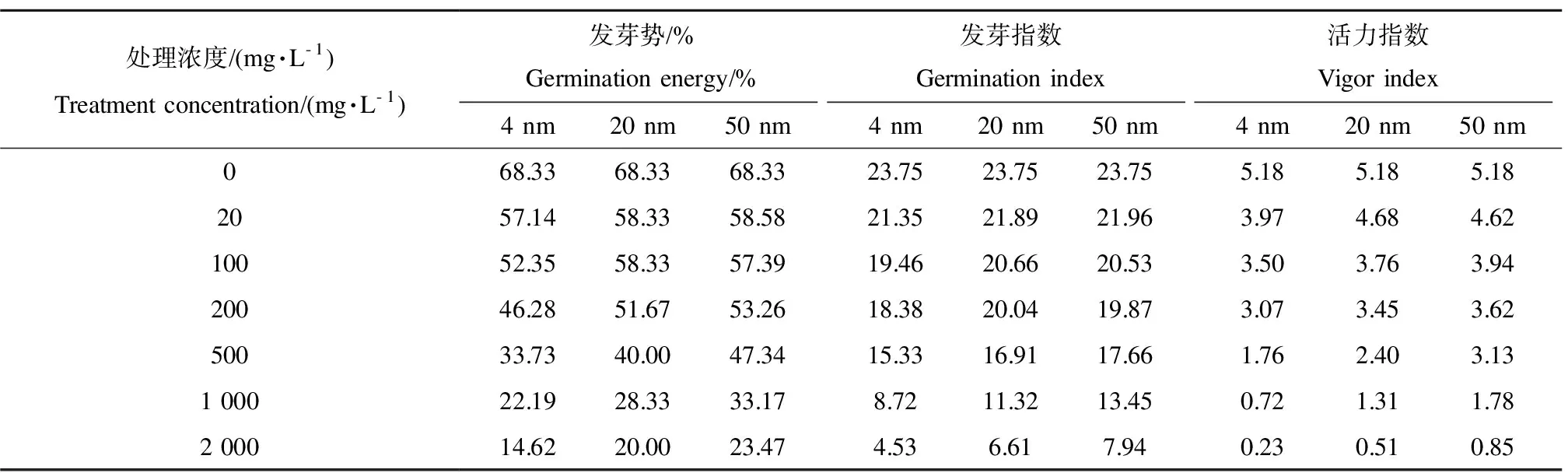
表1 TiO2-NPs处理对金鱼藻种子发芽的影响Table 1 The effects on the germination of Ceratophyllum demersum seeds treated with TiO2-NPs

图2 TiO2-NPs处理后金鱼藻种子的发芽率(a)和发芽重量(b)注:*代表不同处理与空白对照之间存在显著性差异(P<0.05)。Fig. 2 Germination rates (a) and seedling masses (b) of Ceratophyllum demersum seeds under TiO2-NPs treatmentNote: * indicates a significant difference between the treatment and the control groups (P<0.05).

图3 不同粒径的TiO2-NPs处理下金鱼藻植株的生长形态Fig. 3 Ceratophyllum demersum cultured under different TiO2-NPs sizes
从图2b中可以看出,TiO2-NPs处理后金鱼藻种子发芽幼苗重量的变化趋势基本与发芽率的变化趋势一致,当TiO2-NPs浓度为2 000 mg·L-1时,3种粒径TiO2-NPs处理的金鱼藻种子的发芽幼苗重量由空白处理的0.218 g分别下降到0.051 g(4 nm)、0.077 g(20 nm)和0.107 g(50 nm)。可能是因为高浓度的TiO2-NPs处理后进入金鱼藻种子的TiO2-NPs量增加,对金鱼藻种子的生理机能造成损伤,并且随着颗粒尺度变小,TiO2-NPs表面晶格破损程度更高,产生活性位点更多,形成超氧自由基及其他活性氧化物质(ROS)更多,氧化压力(OS)提高,导致种子内脂质过氧化,破坏种子细胞膜,因此对金鱼藻种子发芽产生更明显的抑制作用[22]。
由表1可以看出,各粒径TiO2-NPs处理后金鱼藻种子的各项发芽指标均有不同程度的下降,且TiO2-NPs粒径越小、浓度越高降低幅度越大,说明粒径越小、浓度越高,TiO2-NPs对金鱼藻种子发芽的抑制作用越强。导致这种现象的原因可能是粒径小的TiO2-NPs更加容易穿透金鱼藻种子的种皮进入到种子体内,从而对种子的发芽产生影响。常见的生物大分子和活性物质其粒径基本都处于纳米级,细胞当中的细胞膜上的孔径、核膜上的孔径和离子通道等通常也在纳米级别[23],当纳米材料的粒径小到一定的程度时,纳米颗粒就可以直接穿过细胞膜进入细胞,从而对细胞正常的新陈代谢产生影响。
2.3 TiO2-NPs对金鱼藻植株生长与生理的影响
2.3.1 植株生长形态
不同粒径的TiO2-NPs处理下金鱼藻植株的生长形态如图3所示。从图中可以看出,经过10 d的培养后,空白对照(0 mg·L-1)处理的金鱼藻植株整体生长状况良好,颜色呈青绿色;各粒径TiO2-NPs处理随着浓度的升高金鱼藻的生长均受到不同程度的抑制,表现为叶片失绿发黄、脱落,植株呈萎焉状,且TiO2-NPs的粒径越小,上述影响越明显。已有研究表明TiO2-NPs可以通过植物根部进入细胞,通过物理阻塞作用使植物细胞细胞壁孔径变小,从而影响植物细胞的正常生理功能,致使植物生长受到抑制[24]。

图4 不同浓度TiO2-NPs处理后金鱼藻植株叶绿素含量(a-4 nm; b-20 nm; c-50 nm)和Mg(d)含量的影响Fig. 4 Chlorophyll (a-4 nm; b-20 nm; c-50 nm) and Mg (d) content of Ceratophyllum demersum cultured under different TiO2-NPs concentrations
2.3.2 叶绿素与Mg含量
不同粒径、不同浓度的TiO2-NPs处理对金鱼藻植株叶绿素含量的影响结果如图4所示。培养10 d后,空白处理(0 mg·L-1)下的金鱼藻叶片的总叶绿素含量在10 d的培养期间基本稳定在同一浓度水平;而不同粒径TiO2-NPs处理下金鱼藻叶绿素含量均随处理浓度的升高而下降,且粒径越小下降幅度越大。在经过浓度为500 mg·L-1的不同粒径的TiO2-NPs暴露培养10 d后,金鱼藻叶片的总叶绿素含量从刚移栽的3.43 mg·g-1分别下降到1.01(4 nm)、1.16(20 nm)和1.86 mg·g-1(50 nm)。
从图4d中可以看出,随着暴露培养时间的延长和TiO2-NPs处理浓度的升高金鱼藻植株体内不同组织部位的Mg含量均出现不同程度的减少,整体变化趋势与叶片总叶绿素含量的变化趋势相仿。说明TiO2-NPs处理影响了金鱼藻植株对Mg的吸收,进而影响到植株叶绿素的合成。
2.3.3 SOD活性和MDA含量
各种酶活性的调节是植物自我保护的体现,SOD则是生物体内清除自由基保护细胞免受损伤的首要物质,它可阻止氧自由基对细胞造成的损害并修复受损细胞[25]。不同粒径、不同浓度的TiO2-NPs处理对金鱼藻植株SOD酶活性和MDA含量的影响结果如图5所示。从图5a中可知,当TiO2-NPs浓度低于100 mg·L-1时,各粒径TiO2-NPs处理后金鱼藻体内的SOD活性随TiO2-NPs浓度的升高不断增强,且TiO2-NPs的粒径越小金鱼藻植株体内的SOD活性越高,可能是因为TiO2-NPs更容易进入金鱼藻体内,从而对金鱼藻植株产生更强的毒害作用,致使对金鱼藻的氧化胁迫水平升高,表明3种粒径TiO2-NPs对金鱼藻都具有一定的毒害作用,金鱼藻体内SOD活性升高以清除纳米胁迫产生的ROS。4 nm和20 nm TiO2-NPs处理在浓度为100 mg·L-1时金鱼藻体内SOD活性达到最大值,分别为39.57 U·g-1FW(4 nm)和37.37 U·g-1FW(20 nm)。当TiO2-NPs浓度超过100 mg·L-1时,4 nm和20 nm TiO2-NPs处理的金鱼藻体内SOD活性随浓度升高而下降,而50 nm TiO2-NPs处理的金鱼藻体内SOD活性则随着浓度的升高继续上升,并在浓度为500 mg·L-1时达到最大值32.96 U·g-1FW,产生这种现象的原因可能是4 nm和20 nm的TiO2-NPs由于粒径更小,更加容易进入金鱼藻体内,当TiO2-NPs浓度超过100 mg·L-1时,由于大量的TiO2-NPs进入金鱼藻植株体内,对金鱼藻植株产生毒害作用,金鱼藻植株体内的抗氧化机制运作遭到抑制和破坏,因而SOD活性开始随着浓度的升高而持续下降。
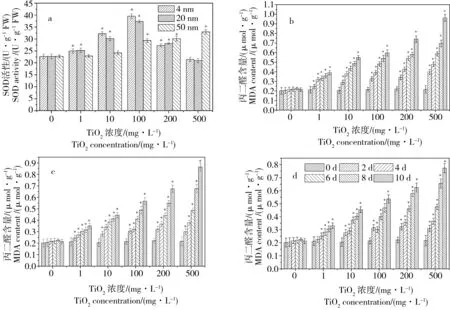
图5 不同浓度处理对金鱼藻体内超氧化物歧化酶(SOD)酶活性(a)和丙二醛(MDA)(b-4 nm; c-20 nm; d-50 nm)含量的影响Fig. 5 Superoxide dismutase (SOD) activity (a) and malondialdehyde (MDA) content (b-4 nm; c-20 nm; d-50 nm) of Ceratophyllum demersum

图6 500 mg·L-1 TiO2-NPs处理金鱼藻的TEM-EDX观察(a-4 nm; b-20 nm; d-50 nm)以及EDX扫描表明Ti的存在(f)Fig. 6 TEM analysis of TiO2-NPs distribution in Ceratophyllum demersum exposed to 500 mg L-1 of TiO2-NPs (a-4 nm; b-20 nm; d-50 nm) and EDX analysis of the bright zone showing the presence of Ti (f)
图5b~d表明了金鱼藻体内MDA含量与不同粒径、不同浓度TiO2-NPs暴露培养处理的关系,由图中可以看到,空白处理下的金鱼藻根系的MDA含量在整个培养期间(0~10 d)内都保持在一个稳定的水平,没有出现大幅波动;但当各粒径TiO2-NPs浓度为1~500 mg·L-1时,金鱼藻体内的MDA水平随着培养时间的推进而不断升高,随着TiO2-NPs浓度的升高而快速上升,并且粒径越小上升幅度越大。不同粒径TiO2-NPs在浓度为500 mg·L-1时金鱼藻体内的MDA含量由移栽时的0.25 μmol·g-1分别上升到0.97(4 nm)、0.85(20 nm)和0.75 μmol·g-1(50 nm),分别出现了高达388%、340%和300%的增长。这表明TiO2-NPs对金鱼藻有一定的毒害作用,能迫使金鱼藻植株体内脂质发生过氧化反应而产生大量MDA,且TiO2-NPs的粒径越小对金鱼藻的毒害作用越强。
2.4 TiO2-NPs颗粒在金鱼藻植株体内的分布
经500 mg·L-1不同粒径TiO2-NPs暴露培养10 d后,金鱼藻植株切片的TEM-EDX分析结果如图6所示。
从图中可以看出,3种粒径TiO2-NPs处理的金鱼藻植株中都发现了颗粒沉积物的存在,且粒径越小金鱼藻根中的沉积物越多。这些颗粒沉积物很有可能是被金鱼藻吸收转运进来的TiO2-NPs颗粒。为了确认这些沉积颗粒的成分,利用能谱分析仪对颗粒物沉积区域进行扫描,通过颗粒沉降物的EDX光电子能谱图(图6f)发现这些颗粒沉积物中含有很高含量的Ti元素,因此,这些沉积颗粒应该就是被金鱼藻吸收转运进入体内的TiO2-NPs颗粒。
纳米材料要进入植物体内必须通过植物细胞的细胞壁,资料显示一般植物的细胞壁上的孔径尺寸大约为5~20 nm[26],小于细胞壁孔径的纳米颗粒可以直接穿过细胞壁进入植物细胞体内,而大于细胞壁孔径的纳米颗粒则须通过内吞和主动运输等方式才能进入植物体内[27],因而本研究中4 nm的TiO2-NPs处理后金鱼藻体内观察到沉积颗粒物最多,20 nm的TiO2-NPs处理次之,50 nm的TiO2-NPs处理后金鱼藻内的颗粒沉积物最少。
2.5 Ti在金鱼藻体内的累积量
经过ICP-MS检测经不同粒径、不同浓度TiO2-NPs暴露培养后金鱼藻植株体内的Ti元素累积量,结果如图7所示。

图7 ICP-MS测定Ti在金鱼藻体内的累积量Fig. 7 ICP-MS observations of Ti accumulation in Ceratophyllum demersum
从图中可以看到,经不同粒径、不同浓度TiO2-NPs培养处理后的金鱼藻体内的Ti含量随着TiO2-NPs处理浓度的升高而不断上升,且TiO2-NPs的粒径越小上升幅度越大。3种粒径的TiO2-NPs在处理浓度为500 mg·L-1时金鱼藻体内的Ti含量由空白处理时的1.47 μg·g-1分别上升到996 μg·g-1(4 nm)、866 μg·g-1(20 nm)和529 μg·g-1(50 nm)。巴翠兰[20]研究发现20 nm的TiO2-NPs颗粒能进入黄瓜的根系,Ti元素在黄瓜根系内的累积量为960 μg·g-1左右。本研究证明4 nm、20 nm和50 nm的TiO2-NPs颗粒均能进入金鱼藻植株体内,但是粒径越大进入金鱼藻体内的难度越大,金鱼藻体内的Ti含量越低。

