水淹胁迫下三峡库区消落带适生狗牙根转录因子的转录组分析
李彦杰,杨俊年,刘仁华,周大祥,2,甘丽萍,吴应梅
(1.重庆三峡学院 生命科学与工程学院,重庆 万州 404100;2.重庆大学 生命科学学院,重庆市基因功能与调控重点实验室,重庆 400300)
【研究意义】三峡水库175 m蓄水完成后,使其上游形成长度约660 km,面积约10 000 km2,水位落差达30 m的周期性冬水夏陆消落带系统[1]。反季节性长期水淹环境破坏了消落带固有的生态系统,使得从三峡大坝到其上游的重庆江津地区因为消落区植被的退化及破坏而产生了如水土流失和环境污染加剧等众多问题[2-3]。【前人研究进展】为了恢复或重建消落带生态系统,学界在耐淹植物的筛选和选育等方面做了大量的工作,已经筛选出一些消落带适生植物,并从形态学、生理生化及分子水平初步研究了部分耐淹植物的抗性机制[4-6]。狗牙根(Cynodondactylon)为三峡库区消落带原生植物,表现出极强的耐淹能力和环境适应能力,如狗牙根通过茎节、根及分枝等生长对不同水淹环境环境作出响应[7]。水淹胁迫时,植物体内的活性氧自由基及酒精发酵产生的乙醇大量累积,从而可能对其细胞造成伤害[8-10]。研究表明,狗牙根在水淹环境下表现出较高的抗氧化组分水平及乙醇脱氢酶活性,可有效地降低水淹环境对其细胞伤害[11-12]。水淹生境下诱发植物形成通气组织及抗氧化水平上调等适应性机制均与抗逆基因的表达有关[13-14]。抗逆基因表达有赖于参与逆境调控的转录调控及TF表达,故研究水淹生境下狗牙根的TF表达特性对揭示植物耐水淹机制具有重要意义。【本研究切入点】本实验采取实地水淹处理,基于转录组分析研究水淹生境下狗牙根参与抗水淹响应的TF表达特性。【拟解决的关键问题】以期为狗牙根抗水淹分子机制的探索提供基础,并为后续的耐淹植物筛选及育种等提供参考。
1 材料与方法
1.1 供试材料
三峡库区消落带适生狗牙根取自重庆市万州区新田镇谭绍村的消落带适生植物筛选示范基地。取长势一致的当年生分蘖苗分别作水淹处理,水淹深度30 cm为处理组(A2),未水淹为对照组(A1)。处理组水淹15 d,狗牙根已发生明显的形态学变化,同时取A1和A2组狗牙根地下茎为样本,设置3个生物学重复。
1.2 测序样品的制备及测序
按照Takara RNAiso for Polysaccharide-rich Plant Tissue提供的操作流程提取样品的总RNA,并通过Nanodrop 分光光度计和琼脂糖凝胶电泳检测提取的总RNA的浓度和质量。提取的总RNA经过ploy (T)磁珠富集纯化mRNA,加Fragmentation Buffer随机打断mRNA,以随机引物和发转录酶合成cDNA第一链,然后加入缓冲液、dNTPs、RNaseH及DNA聚合酶合成cDNA第二链。纯化cDNA后作末端修复,末端加A并连接测序接头,电泳筛选一定大小的片段建库并基于Illumina HiSeq 4000 测序。
1.3 转录组数据分析
测序所得的raw reads经过去除低质量片段、短片段、接头污染以及未知碱基含量过高的片段后得到clean read,利用Trinity组装Unigene,并通过与Nr、Nt、Swissprot、KEGG、COG、Interpro和GO数据库比对注释Unigenes,未能注释的Unigene用ESTScan作CDS 预测。利用Hmmsearch 将Unigene的ORF比对到PlntfDB预测TF(TF)。基于RSEM计算A1和A2样品的TF表达水平,用PossionDis法检测差异表达TF,筛选标准为Fold Change≥ 2.00 和FDR≤0.001。
1.4 实时定量 PCR分析
挑选4个差异表达TF基因作实时定量 PCR分析验证。取测序植物样品按照康为世纪公司HiFiScript cDNA synthesis kit提供的流程提取RNA及反转录。选用GAPDH基因作为内参,扩增所用引物如表1,按照康为世纪公司Ultra SYBR Mix Kit提供流程,利用Bio-Rad CFX connect Q-PCR作实时定量 PCR分析。扩增反应程序为:95 ℃保持10 min; 95 ℃保持15 s,60 ℃保持1 min,设置40次循环。
2 结果与分析
2.1 测序结果及Unigene的功能注释
A1和A2共获得22.11 G的原始数据,经数据过滤及去冗余后共获得147 256条总Unigene,其中A1和A2的Unigene数目分别为128 031和83 363。将得到的总Unigene分别作Nr、Nt、Swissprot、KEGG、COG、Interpro和GO注释,7个数据库可注释总Unigene数目的72.84 %。按照NR、SwissProt、KEGG、COG的优先次序,选择Unigene的最佳比对片段作为其CDS。未注释的总Unigene基于ESTScan作CDS预测,Blast和ESTScan可分别预测94 849和8135条Unigene,将结果作为该Unigene的参考注释。
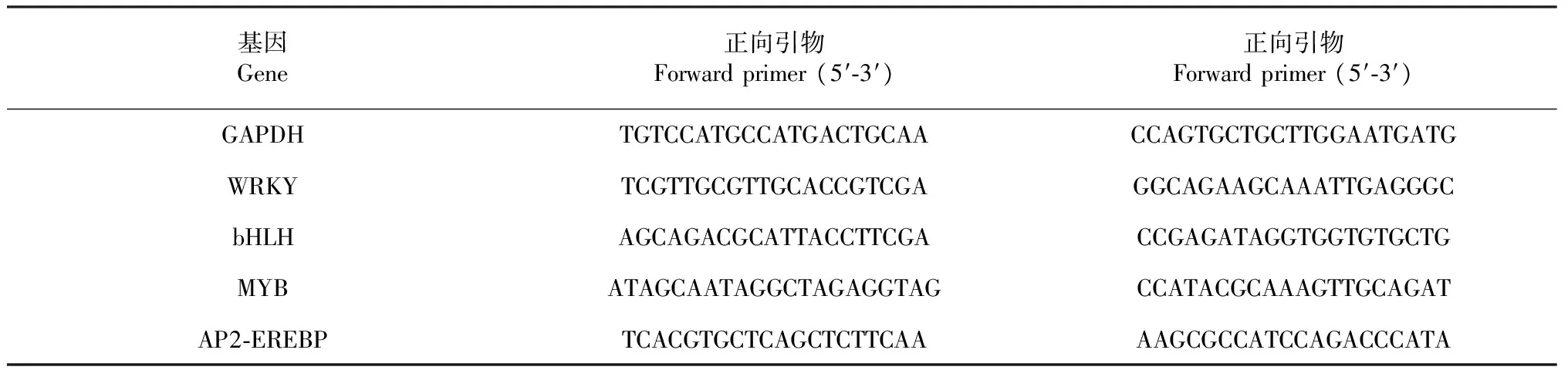
表1 实时定量 PCR 选用基因及其引物Table 1 Genes and primers for qRT-PCR
2.2 狗牙根响应水淹胁迫的TF家族及数目
对具有编码TF能力的总Unigene进行预测,并按照TF家族进行分类(图1)。预测结果显示,具有TF编码能力的Unigene属于62个TF家族,共2928条TF。预测数目较多的TF家族均与植物的抗逆有关,如MYB、MYB-related、bHLH、AP2-EREBP、NAC和WRKY等,这些家族可能参与狗牙根对水淹胁迫的形态学发育和生理代谢改变响应。
2.3 狗牙根响应水淹胁迫的TF表达水平变化
基于PossionDis法狗牙根在水淹生境下的差异表达TF基因,以log2FoldChange表示差异倍数,共筛选出属于54个家族的差异表达TF 785条,共27个家族的348条TF上调表达,34个家族的437条TF下调表达(表2)。其中,WRKY、bHLH、MYB、AP2-EREBP、MYB-related、Trihelix、NAC、MADS和TCP等9个家族是差异表达基因数量最多且表达量变化幅度最显著的TF家族,共包含430条差异表达TF,占总差异表达总TF的54.78 %,其中上调表达189条,下调表达241条。9个家族中,除TCP和Trihelix家族外,其他TF家族对狗牙根水淹胁迫的响应表达呈明显下调,而9个TF家族对狗牙根水淹胁迫的响应表达均呈明显上调(表3)。
2.4 实时定量PCR分析验证
分别从WRKY、bHLH、MYB和AP2-EREBP等4个TF家族挑选表达差异表达倍数较大的基因作实时定量PCR检测。以GAPDH为内参基因,用2△△Ct表示检测到的基因表达量,每个检测基因设置3次生物重复。后期数据处理中将转录组和荧光定量PCR检测到的某一个基因表达量变化分别用log2-ratio表示,其中log2-ratio=log2[处理组表达量/对照组表达量]。基于SPSS 22.0分析转录组和实时定量PCR检测的差异表达基因log2-ratio,结果显示尔逊相关系数为0.8748,P<0.012,表明转录组分析的差异基因表达情况较为可靠(图2)。
3 小结与讨论
缺氧和光线不足是深水淹对植物的主要胁迫作用,如缺氧环境会破坏植物体内氧化还原反应而导致活性氧自由基等在植物细胞内累积而引发膜脂过氧化反应,及诱发植物进行无氧代谢而导致乙醇等细胞毒害作用物质的产生。此外,深水淹生境下,由于氧气不足也会引起植物体内贮存物质的减少,而光照不足导致光合效率低下,使得植物体内碳水化合物等不能及时补充。植物对深水淹的适应性机制包括形成不定根和通气组织、下调代谢速率、提高弱光利用能力和上调还原性组分水平等。
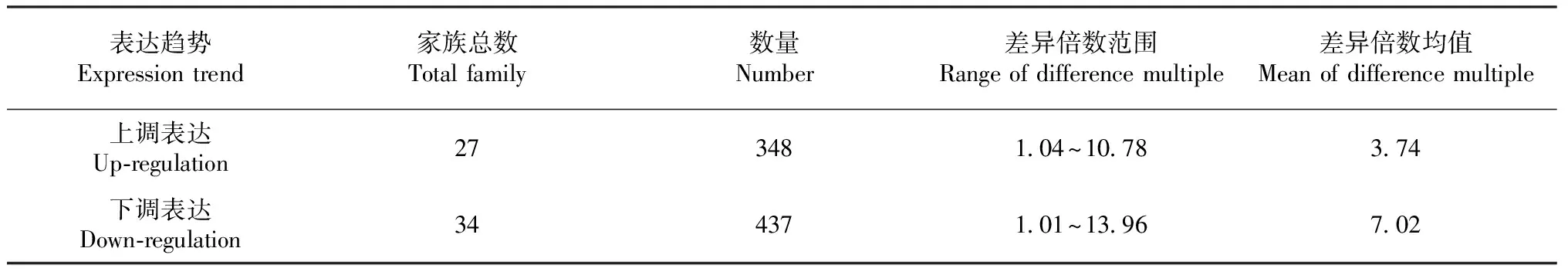
表2 狗牙根响应水淹胁迫的差异表达TF数量及变化范围Table 2 Number and range of differentially expressed TFs in response to flooding stress of bermudagrass
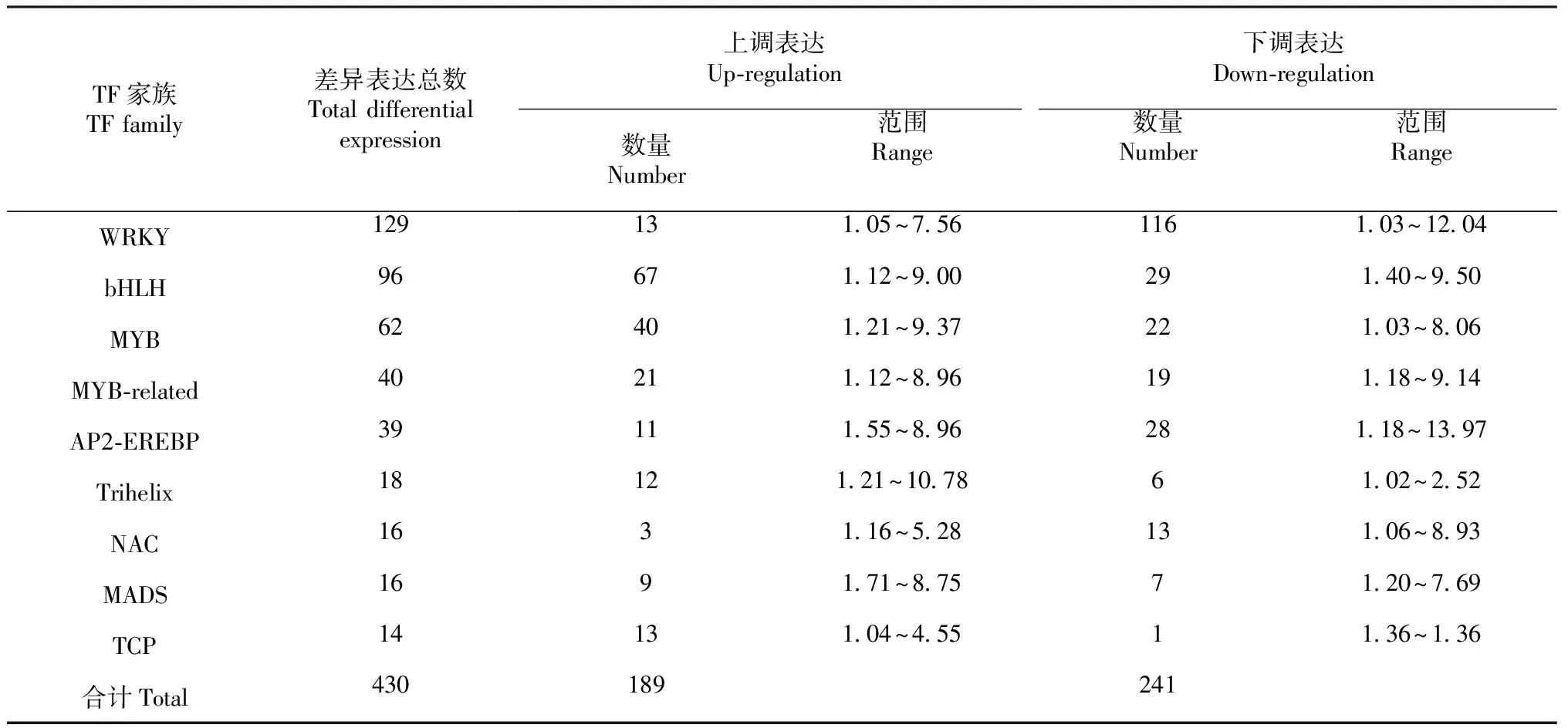
表3 9个数目最多的差异表达TF家族Table 3 Nine of the largest number of differentially expressed transcription factor families
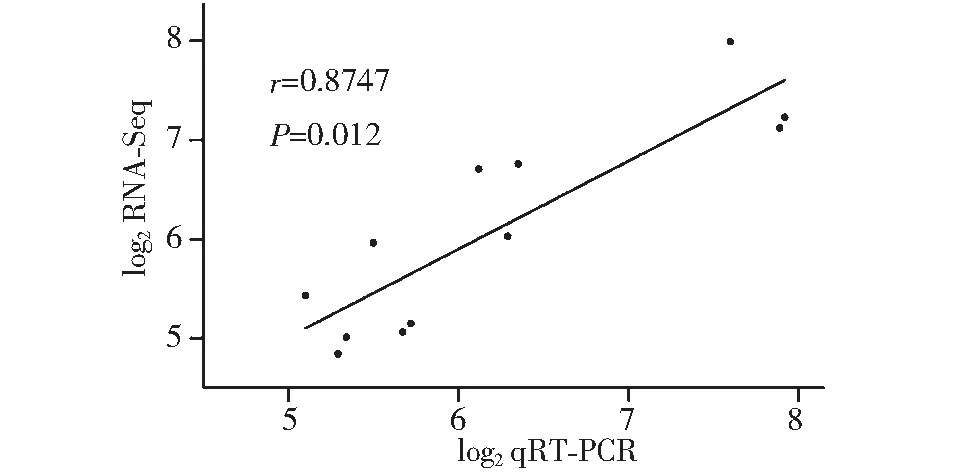
图2 差异表达基因的实时定量PCR分析验证Fig.2 Validation of DEGs by real-time qRT-PCR
TF在植物抗水淹胁迫应答中有着重要作用,已有研究表明,WRKY、bHLH、MYB、HSF、AP2-EREBP、MYB-related和NAC等家族的TF参与植物的抗逆响应,不同TF表达水平的变化与植物的胁迫耐受有关。本研究表明,水淹胁迫会诱导狗牙根多个家族的TF表达水平发生显著变化,相同TF家族中的不同TF表达上调或下调,这些TF的种类及表达水平的变化可能与狗牙根对水淹胁迫响应的形态发育及代谢改变等适应性机制有关。研究表明,WRKY、家族TF参与植物生长发育、损伤修复及水淹等非生物胁迫等[15]。本研究发现WRKYTF家族中有13条上调表达,116条下调表达,富集数量较多,显示该TF家族的不同成员在狗牙根抗水盐胁迫中可能同时调控多种抗逆基因表达。bHLH、MYB、AP2-EREBP、MYB-related和Trihelix等家族的TF也广泛参与植物的生长发育和逆境胁迫响应[16-17]。本研究发现这些TF家族均在狗牙根水淹胁迫中差异表达基因数目较多且表达量变化明显,这可能也与狗牙根对水淹胁迫的多种适应性机制有关。NAC、MADS和TCP等家族的转录TF主要与非生物胁迫中植物的通气组织形成和不定根发育等形态学改变有关,这种形态学改变可增加水淹等胁迫中细胞的获氧能力[18-20]。上述9个TF家族富集显著,显示这些TF可能参与水淹生境下狗牙根的通气组织形成及不定根的发育等形态学改变。
植物通过形态学及生理代谢等改变对水淹胁迫作出响应,该过程由多个基因组成,其调控与多个TF的家族成员有关。通过转录组测序分析研究了狗牙根对水淹胁迫的TF响应,为进一步了解狗牙根对水淹的适应性机制提供基础,也为植物的耐水淹研究提供基因资源。
[1]Wang J, Xiang W, Lu N. Landsliding triggered by reservoir operation:a general conceptual model with a case study at Three Gorges Reservoir[J]. Acta Geotechnica, 2014, 9(5):771-788.
[2]Bao Y, Tang Q, He X, et al. Soil erosion in the riparian zone of the Three Gorges Reservoir, China[J]. Hydrology Research, 2015, 46(2):212-221.
[3]马 骏,李昌晓,魏 虹,等. 三峡库区生态脆弱性评价[J]. 生态学报,2015,35(21):7117-7129.
[4]Liao J, Jiang M, Li L. Effects of simulated submergence on survival and recovery growth of three species in water fluctuation zone of the Three Gorges reservoir[J]. Acta Ecologica Sinica, 2010, 30(4):216-220.
[5]Zhang W, Liu J, Xia H, et al. Carbon dioxide exchange flux of bermudagrass[Cynodondactylon(linn.)pers.]from the water-level-fluctuate-zone of Three Gorges Reservoir, China[J]. Advances in Earth & Environmental Sciences, 2013, 189:931-939.
[6]Fan D Y, Xiong G M, Zhang A Y, et al. Effect of water-lever regulation on species selection for ecological restoration practice in the water-level fluctuation zone of Three Gorges Reservoir[J]. Abstracts in Anthropology, 2015, 39(4):416-432.
[7]Tan S, Zhu M, Zhang Q. Physiological responses of bermudagrass (Cynodondactylon) to submergence[J]. Acta Physiologiae Plantarum, 2010, 32(1):133-140.
[8]U BB, Yong C, Zou X L, et al. Ethanol content in plants ofBrassicanapusL. correlated with waterlogging tolerance index and regulated by lactate dehydrogenase and citrate synthase[J]. Acta Physiologiae Plantarum, 2016, 38(3):1-9.
[9]Xu X, Wang H, Qi X, et al. Waterlogging-induced increase in fermentation and related gene expression in the root of cucumber (CucumissativusL.)[J]. Scientia Horticulturae, 2014, 179:388-395.
[10]Yu M, Zhou Z, Deng X, et al. Physiological mechanism of programmed cell death aggravation and acceleration in wheat endosperm cells caused by waterlogging[J].Acta Physiologiae Plantarum, 2017, 39(1):1-5.
[11]Ye T, Shi H, Wang Y, et al. Contrasting Changes Caused by Drought and Submergence Stresses in Bermudagrass (Cynodondactylon)[J].Frontiers in Plant Science, 2015(6):951-956.
[12]张志永,程 丽,李春辉,等. 三峡水库淹没水深对消落带植物牛鞭草和狗牙根生长及抗氧化酶活性的影响[J]. 水生态学杂志,2016,37(3):49-55.
[13]Pramanik M, Shelley I J, Adhikary D, et al. Carbohydrate reserve and aerenchyma formation enhance submergence tolerance in rice[J]. Progressive Agriculture,2016, 27(3):256-264.
[14]Yamauchi T, Shimamura S, Nakazono M, et al. Aerenchyma formation in crop species:A review[J]. Field Crops Research, 2013, 152(10):8-16.
[15]Liyun L, Jianan S, Shuo Y, et al. Functional annotation of rice WRKY transcription factors based on their transcriptional features[J]. Hereditas, 2016, 38(2):126-136.
[16]Du H, Huang M, Zhang Z, et al. Genome-wide analysis of the AP2/ERF gene family in maize waterlogging stress response[J]. Euphytica, 2014, 198(1):115-126.
[17]Thirunavukkarasu N, Hossain F, Mohan S, et al. Genome-Wide Expression of Transcriptomes and Their Co-Expression Pattern in Subtropical Maize(ZeamaysL.) under Waterlogging Stress[J]. Plos One, 2013, 8(8):e70433.
[18]Hofmann N R. A NAC transcription factor for flooding:SHYG helps plants keep their leaves in the air[J]. Plant Cell, 2013, 25(12):4771-4771.
[19]Nicolas M, Cubas P. TCP factors:new kids on the signaling block[J]. Current Opinion in Plant Biology, 2016, 33:33-41.
[20]Ryan P R, Delhaize E, Watt M, et al. Plant roots:understanding structure and function in an ocean of complexity[J]. Annals of Botany, 2016, 118(4):555-559.

