灯盏花内生真菌分离及其产黄酮内生真菌的初步研究
杨梦莉,赖泳红,郭凤根,崔晓龙,王永霞,肖 炜,李治滢
(1.云南大学生命科学学院/云南省微生物研究所,云南 昆明 650091;2.中国医学科学院医学生物学研究所,云南 昆明 650118;3.云南大学省部共建云南生物资源保护与利用国家重点实验室,云南 昆明 650091;4.云南农业大学农学与生物技术学院,云南 昆明 650201)
【研究意义】灯盏花又名灯盏细辛[Erigeronbreviscapus(Vant.)Hand.-Mazz.],属菊科紫菀族飞蓬属多年生草本植物[1],主要分布于云南、贵州、广西、湖南、西藏等地。作为一种药用植物,它具有散寒解表、止痛舒络、除湿祛风等功效[2]。黄酮是灯盏花重要的药效成分之一[3],目前,临床上灯盏花主要用于治疗中风、治疗脑梗塞、心绞痛及冠心病等[4]。灯盏花是一种需求量大的重要药用植物,值得深入研究。【前人研究进展】内生菌能促进植物的生长、增加植株的抗逆性、产生多种代谢活性产物、增加宿主植物的他感作用等[5]。研究发现植物内生菌的代谢产物与植物的药用物质表现出一致性[6],因此,若能筛选出产活性物质的内生真菌,就能利用发酵技术生产有效的代谢物质。【本研究切入点】目前,关于灯盏花的研究大量集中在灯盏花的药理作用、HPLC测定及其生物学特性调查研究等方面,而对于灯盏花内生真菌多样性及其产黄酮真菌的筛选,只有国内李治滢[7]和何永美[8]等人曾做过相关研究。【拟解决的关键问题】本研究对灯盏花内生真菌进行分离、鉴定,以揭示其内生真菌的多样性,并对分离得到的内生真菌进行产黄酮内生真菌筛选,为探索灯盏花药效成分新的生产途径提供依据。
1 材料与方法
1.1 供试植物
灯盏花为一年生苗,由寻甸县灯盏花栽培基地提供。
1.2 分离培养基
PDA培养基,查氏培养基[9]。待倒平板时于培养基中加青霉素(80 U/mL)抑制细菌生长。
1.3 内生真菌的分离
取灯盏花新鲜健康植株,分别对根、茎、花、叶用自来水冲洗干净,用滤纸吸干水分,再用无菌水冲洗3遍,放入75 %酒精浸泡1~2 min,无菌水冲洗3遍,再用0.1 %升汞消毒,无菌水清洗3次。在无菌条件下,用灭过菌的手术剪将植株各器官剪成长宽0.5 cm×0.5 cm的小片,接种到真菌固体培养基上,置于28 ℃温箱培养4~10 d。待各植物组织切面长出菌落后挑取边缘部分,经纯化后即为灯盏花内生真菌。空白对照:将最后一次洗涤的灭菌水涂布于空白平板中,28 ℃培养,结果材料周围未见任何菌长出,证明所得菌株为内生菌[8,10]。
1.4 分类鉴定
对分离获得的灯盏花内生真菌进行插片法培养,根据显微形态特征的观察并分类鉴定[9-11]。
1.5 菌株液体发酵培养
采用PDA液体培养基进行发酵,将在平板上活化后的菌株接种于装有100 mL液体培养基的250 mL三角瓶内。发酵条件为28 ℃,150 r/min培养10 d。
1.6 标准曲线的绘制
称取10.0 mg干燥的无水芦丁,置于50 mL容量瓶中,加入70 %乙醇定容摇匀;量取25 mL于50 mL容量瓶中,利用蒸馏水定容到刻度,制成标准曲线。吸取0、2.5、5.0、7.5、10.0、12.5 mL。分别于25 mL容量瓶中加入30 %乙醇至12.5 mL;加入0.75 mL 5 %的NaNO2溶液,放置6 min;再加入0.75 mL 10 %Al(NO)3溶液,混匀放置6 min;最后加入1.0 mol/L的NaOH溶液10.0 mL,以30 %乙醇定容至刻度,放置15 min。在510 nm波长下测定吸光度,并以吸光度为横坐标,浓度为纵坐标绘制标准曲线[8,12]。回归得到方程:Y=23.229x+0.558(R2=0.9924)。
1.7 检测样品的制备
液体发酵培养物5000 r/min离心10 min,取沉淀,按固液比1︰20加入70 % 乙醇于水浴锅中进行超声破碎,并加入70 %乙醇定容至25 mL,制得检测样品。
1.8 产物鉴定
1.8.1 黄酮的显色反应检测 盐酸-镁粉反应:取待测样品,加入少量镁粉,加入浓盐酸4~5滴,置于沸水浴中加热2~4 min,若待测样品呈现红色到紫红色,表明此样品中含有黄酮类化合物。
1.8.2 分光光度计测定 将制备的样品取上清液用分光光度计在510 nm波长下测定吸光度值并计算出黄酮含量。
2 结果与分析
2.1 灯盏花内生真菌分离
由表1可知,40株内生真菌在灯盏花的分布部位的种群及数量有差异。根部位分布的内生真菌的种群及数量都占优势,为18株(占总数的45 %),叶10株(占总数25 %),其次是茎8株(占总数20 %),花4株(占总数10 %)。交链孢属(Alternariasp.)和镰孢霉属(Fusariumsp.)为灯盏花内生真菌优势种属,分别占总数的25 %、20 %。交链孢属(Alternariasp.)在灯盏花各个部位均有分布,而镰孢霉属(Fusariumsp.)只在根、茎、花中分布。此外镰孢霉属(Fusariumsp.)为根部和花部优势种群,分别占根部和花部内生真菌总数的27 %、50 %。毛霉属(Mucorsp.)为茎中优势菌群,占茎内生真菌总数的37 %。交链孢属(Alternariasp.)则是叶中优势菌群,占叶部内生真菌总数的40 %。
从表1还可看出,交链孢属(Alternariasp.)在灯盏花各部位均有分布,毛霉属(Mucorsp.)在根部和茎部分布。而头珠霉属(Syncephalissp.)、腐质霉属(Humicolasp.)、毛壳菌属(Chaetomiumsp.)、地霉属(Geotrichumsp.)、根霉属(Rhizopussp.)、毛霉属(Mucorsp.)只在根部分布。单格孢属(Monodictyssp.)只在茎部分离得到。无梗孢霉属(Trichocladiumsp.)、串珠霉属(Thielaviopsissp.)、痕格孢属(Sirosporiumsp.)、青霉属(Penlcilliumsp.)、单格孢属(Ulacladiumsp.)在叶部分布。梨孢属(Pyriculariasp.)仅仅分布在花上。
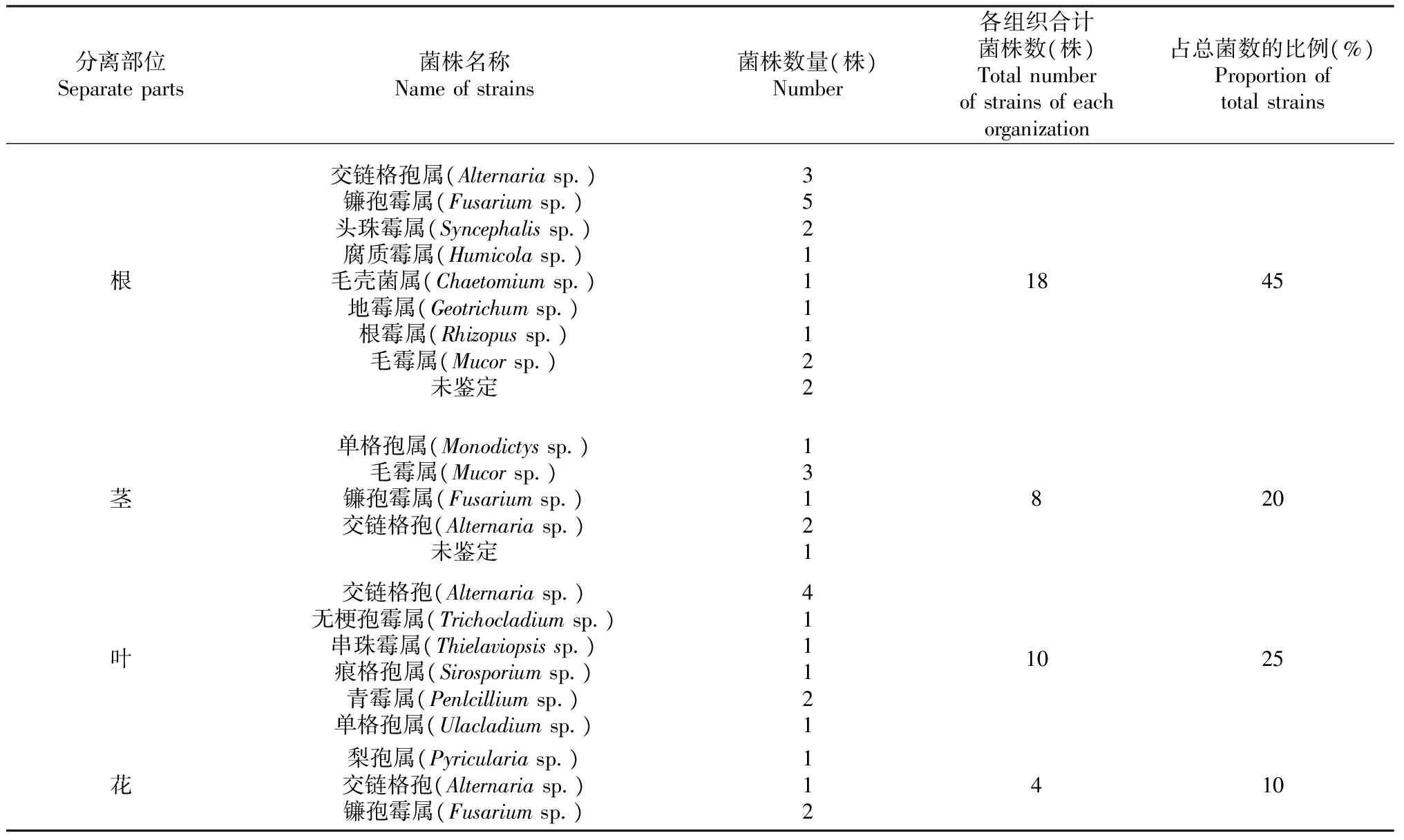
表1 灯盏花内生真菌种群数量分布Table 1 Distribution in number and species of endophytic fungi in Erigeron breviscapus
2.2 产黄酮类内生真菌筛选
从灯盏花植株中分离得到的40株内生真菌,用显色反应对分离得到的内生真菌进行产黄酮类化合物的初步筛选,检测发现7株能产黄酮类化合物。分别属于交链孢属(Alternariasp.)、镰孢霉属(Fusariumsp.)、痕格孢属(Sirosporiumsp.)。根据线性回归方程Y=23.229x+0.558(R2=0.9924),计算得到黄酮类化合物质量浓度 (表2)。
2.3 产黄酮内生真菌发酵
由表2可知,在根部中分离得到的内生真菌交链孢属(Alternariasp.)、镰孢霉属(Fusariumsp.)产黄酮类化合物,占总菌数比例的57 %,黄酮类化合物的质量浓度分别为2.625、2.231 mg/L。而叶部中交链孢属(Alternariasp.)、痕格孢属(Sirosporiumsp.)产黄酮,占总菌数比例的28 %,质量浓度分别为1.928、2.012 mg/L。花部中只有镰孢霉属(Fusariumsp.)产黄酮,占总菌数比例的14 %,而质量浓度仅为1.788 mg/L。根中黄酮类化合物质量浓度最高。
3 讨 论
本试验中,共分离得到灯盏花内生真菌40株,交链孢属(Alternariasp.)、镰孢霉属(Fusariumsp.)为优势菌群,与李治莹[7]早先的研究结果相似。其次,灯盏花各个部位内生真菌的种群数量均有差异。根中内生真菌的多样性最高,其次是叶。本研究的结果与何永美等人[8]的结果相似,植株内生真菌存在差异性可能原因是内生真菌的多样性与外界环境有关,包括土壤、气候、水、光照等,多样的环境更利于各种微生物的生存,根直接与土壤接触,根受到土壤菌群的影响更大,创造多样的环境,内生菌类群更丰富。
近年来,国内的研究已从多种药用植物中分离获得产生活性物质的内生真菌。表明内生真菌对药用植物的活性物质合成具有积极的作用,其产生的代谢产物与宿主的药用成分相一致性[13],因此,内生真菌的代谢物具有较高研究价值。目前,相继从银杏[14]、杜仲[15]等药用植物中发现可以产黄酮类化合物的内生真菌。本试验中,从40株内生真菌中筛选到了7株能产黄酮的菌株,根部中分离到的产黄酮的内生真菌较多且含量最高,其次是叶部和花部,在茎中未筛选到产黄酮的菌株,筛选出产黄酮类的内生真菌为医疗用药、生物防治、田间应用奠定了很好的基础。本实验中,采用常用方法进行内生真菌的分离,进行发酵培养产生代谢物质,然后利用分光光度计进行活性物质的测定。此方法只是进行产活性物质内生真菌的初步筛选,若进行精准筛选理想的活性菌株,方法技术还需进一步改进。

表2 产黄酮的灯盏花内生真菌分离结果Table 2 Results of flavones-forming endophytic fungi in Erigeron breviscapus
4 结 论
纯培养方法分离灯盏花根、茎、叶及花的内生真菌,共获得 14个属40株内生真菌,不同部位内生真菌的数量、分布和种群存有差异性,根中内生真菌的多样性最高,其次是叶。共筛选到7株内生真菌产黄酮类物质,初步鉴定结果为交链孢属(Alternariasp.)、镰孢霉属(Fusariumsp.)、痕格孢属(Sirosporiumsp.),根部中分离到的产黄酮的内生真菌较多且含量最高,其次是叶部和花部,在茎部中未筛选到产黄酮的菌株。
[1]中国科学院植物研究所.中国高等植物图鉴(第4册)[M].北京:科学出版社,1975.
[2]郭济贤,竺叶青,李 颖,等.中药灯盏细辛的生药鉴定及其与两种近缘植物对离体猪冠状动脉的作用[J].上海医科大学学报,1988,15(3):195-197.
[3]张 俭,肖逢连,阳小燕.灯盏花生物学特性及其药用功效[J].时珍国医国药,2007,18(12):25-27.
[4]谢淑英,朱凤珍,张 锐,等.灯盏花治疗心绞痛45例[J].辽宁中医杂志,1997,24(1):21.
[5]邹文欣,谭仁祥.植物内生菌研究新进展[J].植物学报,2001,43(9):881-892.
[6]李爱华,樊明涛,师俊玲.杜仲内生菌的分离及产PDG菌株的筛选[J].西北植物学报,2007,27(3):616-619.
[7]李治滢,杨丽源,周 斌,等.灯盏细辛内生真菌的研究:菌种分离及其分类鉴定[J].云南大学学报(自然科学版),2003,25(1):65-68.
[8]何永美,湛方栋,宣 灵,等.灯盏花产黄酮内生真菌筛选及产黄酮能力的初步研究[J].农业环境科学学报,2010,29(S):226-229.
[9]杨文博.微生物学实验[M].北京:化学工业出版社,2004.
[10]杨梦莉,郭凤根,赖泳红,等.岩白菜可培养内生细菌多样性分析[J].云南农业大学学报,2014,29(3):315-320.
[11]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979.
[12]黄惠芳,王丽萍,黄秋伟,等.超声提取广西白木香叶黄酮的工艺研究[J].西南农业学报,2016,29(10):2366-2370.
[13]任 安,高玉葆.植物内生真菌-一类应用前景广阔的资源微生物[J].微生物学报,2001,28(6):92-93.
[14]赵庆云,樊明涛,师俊玲.产黄酮银杏内生菌的分离与鉴定[J].西北农业学报, 2007,16(2):169-173.
[15]沈书庆,殷 虹,刘 芸,等.产杜仲黄酮内生真菌的初步研究[J].菌物研究,2008(1):233-244.

