不同作物根际土壤生物学性状及细菌多样性特征比较
姚华开,刘岳飞,张传进,吴人敏,杨尚东,2*
(1. 广西大学农学院,广西 南宁 530004;2. 广西壮族自治区农业科学院甘蔗研究所/广西甘蔗遗传改良重点实验室,广西 南宁 530007)
【研究意义】随着经济的发展,人们对高品质蔬菜数量的需求越来越高。规模逐年扩大的蔬菜生产中存在着种植模式单一、偏施化肥等弊端,导致菜园土壤连作障碍现象发生严重。同时受土地资源短缺、种植习惯、环境条件和经济利益驱动等条件制约,目前全国各地在同一地块上连续种植同科或同种作物的现象非常普遍[1],广西秋冬蔬菜主要以葫芦科、豆科、十字花科蔬菜作物为主,其中葫芦科作物设施生产中连作障碍危害尤为严重。因此,筛选对葫芦科作物具有促生效果的间套种作物,通过生物防治的手段,有效的减轻连作障碍的发生,对蔬菜的实际生产有着积极的推动意义。【前人研究进展】长期以来,国内外研究人员从土壤物理学、化学、生物学、植物营养学、土壤微生物学以及生态学等多学科入手,系统研究了作物连作障碍发生的原因。一般认为作物发生连作障碍的主要原因包括:①土壤理化性状劣化导致养分亏缺[2];②土壤微生物群落结构变化[3];③化感自毒作用[4]等。长期以来,研究人员通过施用生防菌调节土壤中微生物[4-5]、土壤消毒[6]以及嫁接[7]等技术措施减轻连作障碍的危害并取得了良好的效果。另外,研究还发现利用具有化感作用的十字花科、葱蒜类及禾本科植物与主栽作物进行轮作或间套作等方式优化种植制度,能有效减轻连作障碍对连作蔬菜的危害[8-10]。其中,蔬菜套作禾本科植物减轻连作障碍危害的机理在于提高了土壤有机质含量以及相关酶的活性,提高了作物对包括无机氮在内的营养成分的吸收与利用,并减少诸如枯萎病等土传病原菌的数量[11]。但由于玉米和毛竹等禾本科植物多为高杆作物,在间套种栽培中往往容易遮光,不利于矮杆作物的光合作用。土壤微生物在土壤功能的有效发挥和生态系统中充当着非常重要的角色,有关土壤中大多数的化学反应和C、N及P等的循环,土壤微生物都发挥了很重要的促进作用。此外,土壤微生物数量在一定程度上能反应出土壤的质地和健康状况[12-13]。【本研究切入点】广西秋冬菜生产主要以葫芦科、豆科及十字花科蔬菜作物为主,其中以葫芦科的瓜类蔬菜设施生产中连作障碍危害尤为严重,但目前相关研究较少。为此,筛选以豇豆为代表的豆科作物和以红薯为代表的旋花科作物,比较它们与葫芦科(黄瓜、瓠瓜和南瓜)作物根际土壤生物学性状及细菌多样性特征差异。【拟解决的关键问题】探究土壤生物学性状及细菌多样性能否作为筛选具有促生效果作物的鉴定指标,为进一步创建生物多样性丰富的葫芦科作物根际土壤微环境,构建连作障碍的生态防控技术体系提供理论依据与技术支撑。
1 材料与方法
1.1 供试材料
试验于2016年2月在广西钦州市钦北区镁源蔬菜专业合作社基地(北纬22°41′,东经108°56′)进行,供试土壤于2016年5月下旬采集自该基地。土壤样品分别为栽培管理条件相同的葫芦科作物(黄瓜、瓠瓜和南瓜)、豆科的豇豆与旋花科红薯的根际土壤,设置3次重复,未种植作物的土壤为对照。采集的土壤样品过2 mm筛后置于4 ℃保存,用于土壤生物学性状及细菌多样性的测定。土壤理化性状如表1所示。
1.2 试验方法
1.2.1 测定指标与方法 (1)土壤生物学特性分析。土壤微生物计数选取稀释平板法,微生物生物量C、N和P的测定,土壤中C、N及P循环相关酶β-葡糖苷酶、氨肽酶及磷酸酶活性均参考李振高等[14]的方法测定。
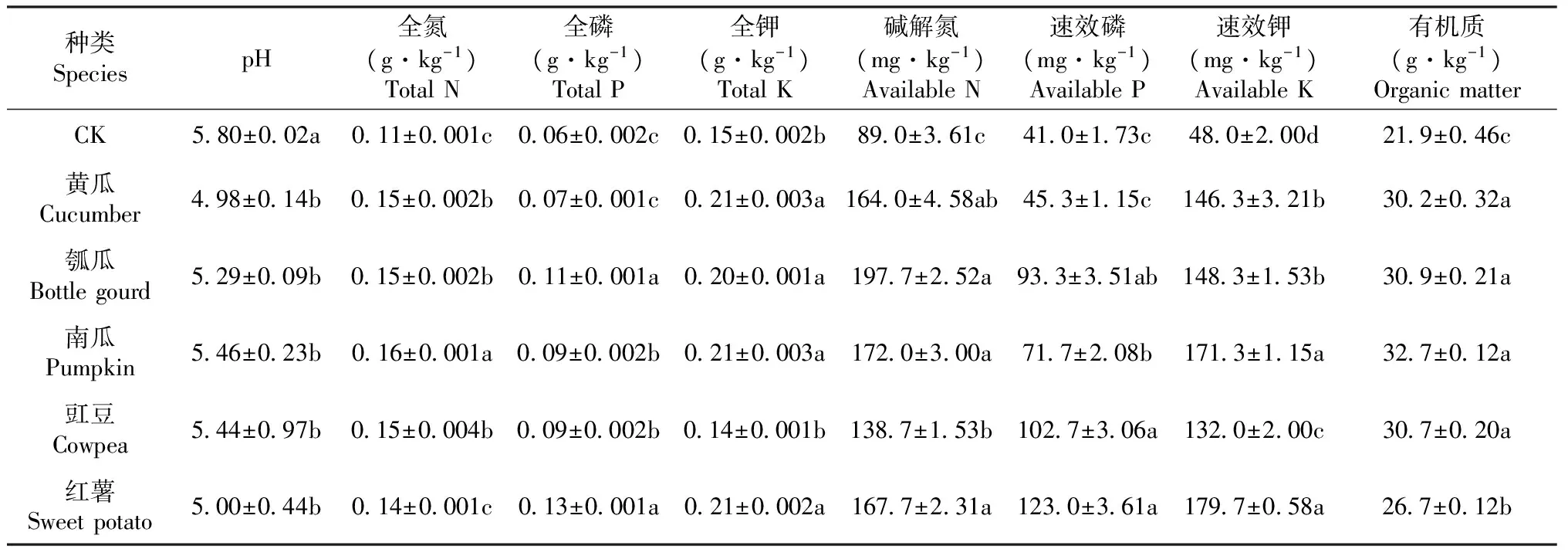
表1 不同作物根际土壤理化性状Table 1 Soil physical and chemical properties of different crops rhizosphere
注:同列数据后不同小写字母表示差异达显著水平(P<0.05),下同。
Note:Values followed by different lowercase letters in the same column are significantly different at 0.05 level. The same as below.
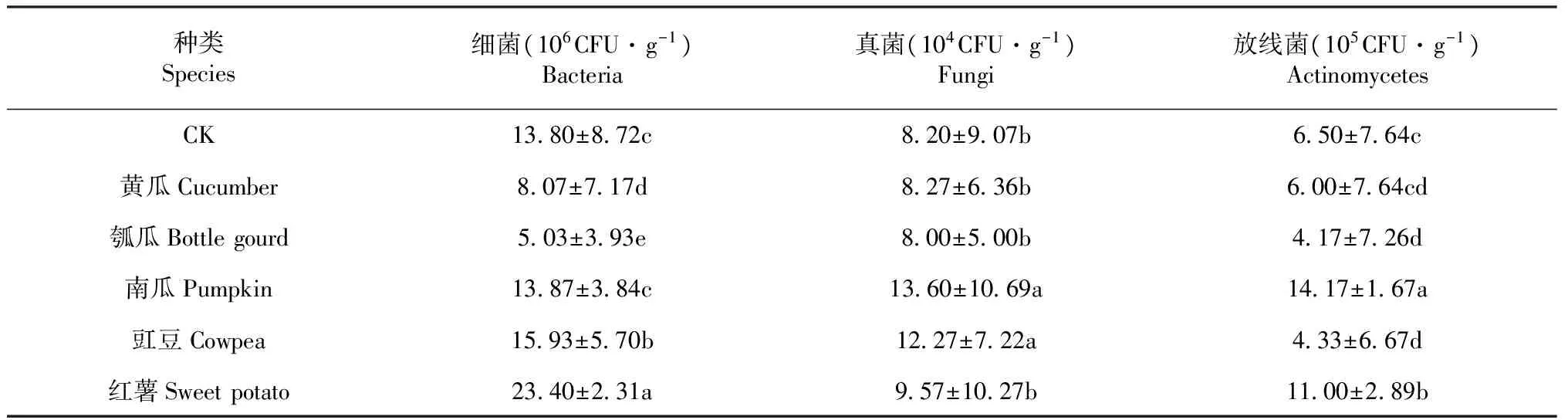
表2 不同作物根际土壤中可培养微生物数量Table 2 The number of microorganisms in rhizosphere soil of different crops
(2)土壤细菌群落结构分析。土壤微生物基因组总DNA提取参照赵久成[15]的方法,采用Bio-Rad公司DCode TM基因突变检测系统(DCode Universal Mutation Detection System, Bio-Rad)对PCR反应产物进行分离,并用扫描系统扫描成图像保存图片。然后对切下来的目的条带进行细菌16S rDNA片段的克隆和测序,最后的测序结果于NCBI(http://www. ncbi. nlm. nih. gov/)进行序列同源性比对与分析。
1.2.2 数据处理 试验数据采用Excel 2003和SPSS 19.0统计软件对试验数据进行统计分析,平均数据用“平均数±标准差(SD)”表示。DGGE图谱分析参照马宁宁和李天来的方法[16]进行。
2 结果与分析
2.1 不同作物根际土壤生物学性状特征
2.1.1 不同作物根际土壤可培养微生物数量 由表2可知,不同作物根际土壤中可培养细菌数量以红薯为最高,其次分别为豇豆>南瓜>对照>黄瓜>瓠瓜,而且各个作物根际土壤中可培养细菌数量间均存在显著差异;可培养真菌数量则呈现南瓜>豇豆>红薯>黄瓜>对照>瓠瓜的趋势,但红薯、黄瓜、瓠瓜和对照之间不存在显著差异;可培养放线菌数量呈现南瓜>红薯>对照>黄瓜>豇豆>瓠瓜的趋势。其中,可培养细菌、真菌和放线菌数量均以瓠瓜为最低,且3种葫芦科作物中,除南瓜外,黄瓜和瓠瓜根际土壤中可培养细菌、真菌和放线菌数量均显著低于相应的旋花科的红薯;黄瓜、瓠瓜根际土壤中可培养细菌和真菌数量亦显著低于豆科的豇豆。上述结果表明:不同科属作物根际土壤环境中的可培养微生物数量之间极易形成显著差异,但同科作物之间未必存在显著差异。
2.1.2 不同作物根际土壤微生物生物量C、N和P特征 由表3可知,与对照相比,除黄瓜和豇豆根际土壤的微生物生物量氮外,不同科属作物根际土壤微生物生物量C、N和P均显著高于对照,这表明栽植作物有助于提高根际土壤中的微生物生物量C、N和P水平。另一方面,葫芦科作物中,微生物生物量C以南瓜根际土壤为最高,但微生物生物量N和P却以瓠瓜根际土壤为最高。同时,微生物生物量P在3种葫芦科作物根际土壤之间虽呈现一定的差异,但其并不显著。与之相比,豆科的豇豆和旋花科的红薯根际土壤中微生物生物量C、N和P虽然不全高于葫芦科作物,甚至低于葫芦科作物根际土壤的相应数值,但微生物生物量P与葫芦科作物之间均存在显著差异。上述结果表明:栽培种植相同科的作物时,对根际土壤微环境影响的差异性不显著(如本试验的生物量P),相反,异科作物根际土壤之间极易形成土壤微生物生物量差异显著的根际微环境。
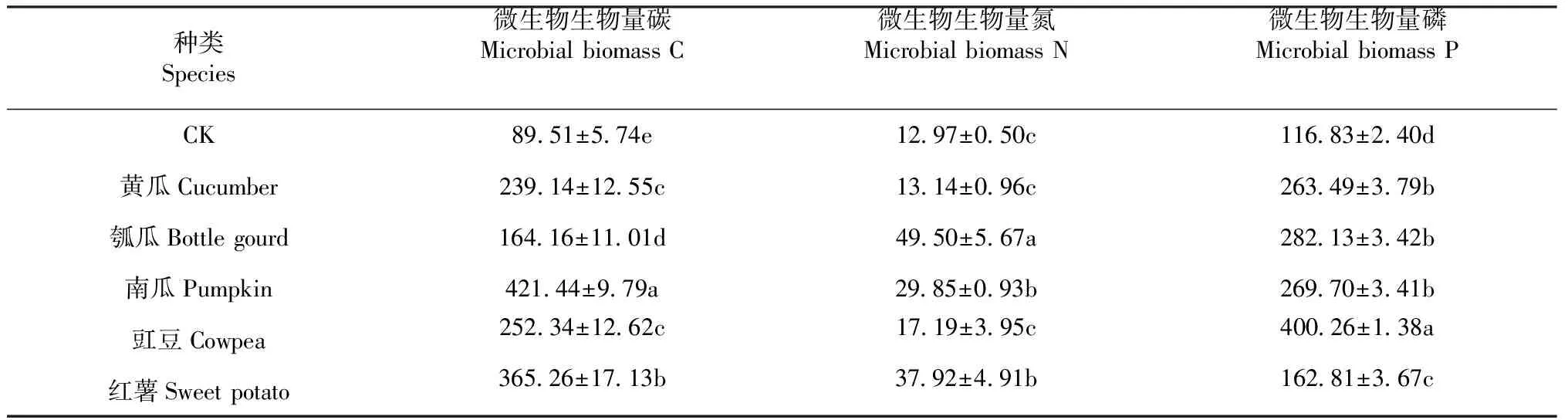
表3 不同作物根际土壤微生物生物量C、N和PTable 3 Soil microbial biomass C, N and P in rhizosphere soil of different crops (mg·kg-1)
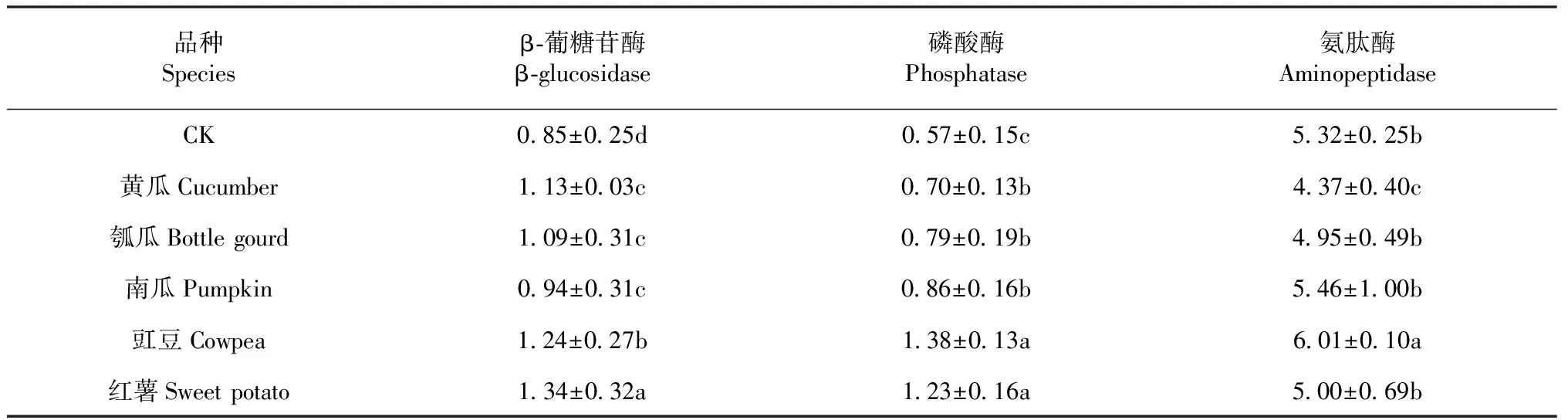
表4 不同作物根际土壤酶活性Table 4 Soil enzyme activities in rhizosphere soils of different crops (nmol /g·min, 30 ℃)
2.1.3 不同作物根际土壤酶活性 由表4可知,与对照相比,栽植作物均导致不同作物根际土壤的酶活性发生变化,其中与土壤碳循环相关的β-葡糖苷酶的表现为:红薯最高,其次为豇豆,对照最低,其中黄瓜、瓠瓜,南瓜的表现水平几乎一致,属于同一表现水平(P>0.05)。磷酸酶是催化土壤中与P相关的循环,变化趋势和β-葡萄糖苷酶一致。氨肽酶主要参与土壤中与N有关的循环,豆科植物由于有根瘤菌与其共生,在固氮方面能体现出一定的优势。氨肽酶的表现为:豇豆最高,明显高于其他处理,其次是红薯,南瓜和瓠瓜的表现一致。其中,同属于葫芦科作物的黄瓜与瓠瓜之间磷酸酶活性没有呈现显著差异,与旋花科的红薯之间表现出显著差异。
2.2 不同作物根际土壤细菌多样性特征
2.2.1 不同作物根际土壤微生物总DNA及16S rDNA基因扩增产物 提取的土壤微生物总DNA,取5 μl在1.0 %琼脂糖凝胶电泳中进行检测,以2000 bp的Marker做对照,由图1可知,提取出的DNA无杂带、拖带现象,质量良好,大小在2300 bp左右。此外,经测量得知其OD260/OD280值介于1.8和2.0,符合预期要求[17],可以进行下一步实验。
M:分子标注;A:CK;B:黄瓜;C:瓠瓜;D:南瓜;E:豇豆;F:红薯M:Marker; A:CK; B:Cucumber; C:Bottle gourd; D:Pumpkin; E:Cowpea; F:Sweet potato图1 根际土壤总DNA的琼脂糖电泳图谱Fig.1 Agarose gel electrophoresis of total DNA in rhizosphere soil
2.2.2 土壤细菌群落DGGE 图谱分析 选取变性凝胶梯度电泳(DGGE)技术分离出PCR产物,获得位置各异、数目不一的电泳条带(图2)。各个泳道条带数为11~35条不等。如表 5 所示,使用Quantity One软件对DGGE图谱进行数字化处理和分析,最后计算出多样性指数(H)、均匀度(E)及丰度(S),三者是表征土壤微生物多样性重要的数据指标。其中,对照的细菌多样性指数最小、丰度最低。黄瓜泳道的条带数最多,其余作物高低顺序依次表现为红薯>南瓜>豇豆>瓠瓜。但代表3种葫芦科作物的泳道中除了瓠瓜泳道中缺失的条带外,三者之间的共有条带较多,如:条带2、3、7、12和14均为黄瓜和南瓜的共有条带;在豇豆和红薯泳道中出现的条带1、8、11和13均分别为这2种作物各自拥有的特异条带。结果表明:同科作物根际土壤中容易形成细菌优势种群相同的根际微环境,而异科作物更有利于形成根际土壤细菌多样性更为丰富的根际微环境,从而更有利于作物的生长和防止病虫害的发生。
M:分子标注;A:CK;B:黄瓜;C:瓠瓜;D:南瓜;E:豇豆;F:红薯M:Marker; A:CK; B:Cucumber; C:Bottle gourd; D:Pumpkin; E:Cowpea; F:Sweet potato图2 根际土壤细菌PCR扩增产物的琼脂糖电泳图谱Fig.2 Agarose gel electrophoresis of PCR amplified products from rhizosphere soil
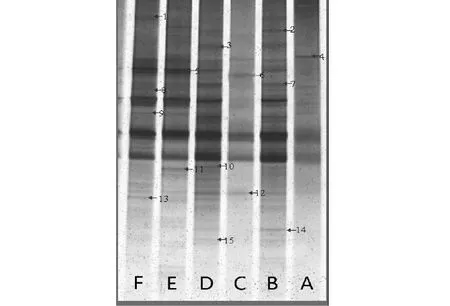
A:CK;B:黄瓜; C:瓠瓜; D:南瓜;E:豇豆; F:红薯A:CK; B:Cucumber; C:Bottle gourd; D:Pumpkin; E:Cowpea; F:Sweet potato图3 不同作物根际土壤细菌DGGE图谱Fig.3 DGGE profile of the soil bacteria in the rhizosphere soils of different crops under greenhouse conditions
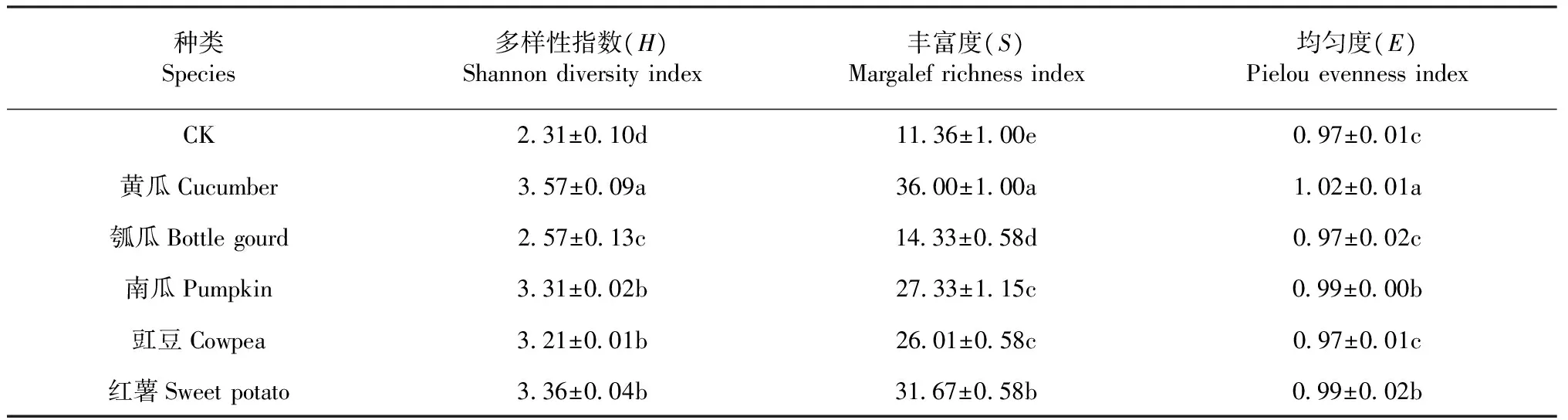
表5 不同作物根际土壤细菌多样性特征Table 5 Bacterial diversities in rhizosphere soil of different crops
2.2.3 细菌16S rDNA片段的序列分析 从DGGE胶中选取出来的特征条带如图3所示。通过进行割胶、PCR及测序等过程,获得15个条带的序列,将测序的结果提交至NCBI GenBank数据库中进行检索和同源性比对,结果如表6所示。所得序列与已知序列都在95 %的相似水平上,其中8条为不可培养的细菌。另外,条带4的测序序列与已发表的序列比对,最相似序列为假单胞菌属(Pseudomonassp.),其次,条带5、7、8、12和15的测序序列比对结果分别与反硝化产碱菌(Alcaligenaceaesp.)、嗜麦芽糖寡养单胞菌属(Stenotrophomonasmaltophiliasp.)、嗜热寡养单胞菌属(Stenotrophomonassp.)、黄单胞菌属(Xanthomonassp.)、木糖氧化无色杆菌(Achromobacterxylosoxidanssp.)及氢噬胞菌属(Hydrogenophagasp.)的相似度最高。
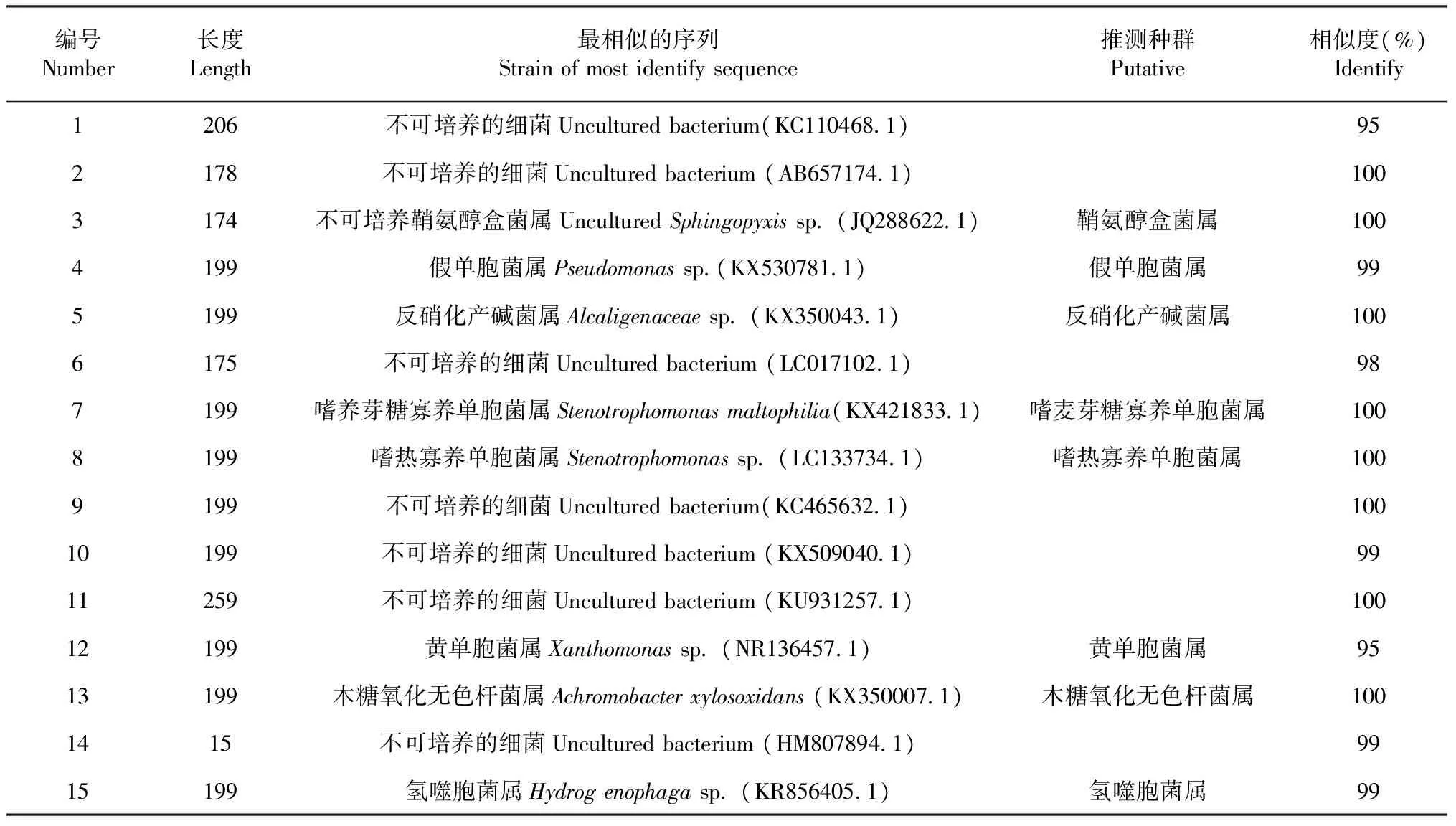
表6 土壤细菌的DGGE回收条带序列分析Table 6 Sequence analysis of DGGE recovery of soil bacteria
3 讨 论
3.1 不同作物根际生物学性状的比较
本研究发现不同作物根际土壤中可培养细菌、真菌和放线菌数量于不同作物根际土壤之间几乎都存在着显著差异,但同科作物之间部分科属虽然也存在显著差异,但同样存在着无显著差异现象。李晓慧等[18]的研究表明大豆、小麦和玉米3种不同作物根系的根际微生物种类存在显著的差异;丁莎莎[19]发现不同苎麻品种根际微生物数量差异明显,与相关学者的研究结果基本一致。这说明相同土壤和栽培管理条件下,栽植不同作物所形成的根际土壤微环境中,可培养微生物数量之间极易形成显著差异水平,但同科作物根际土壤之间却不一定能形成显著差异水平。
本研究结果表明同科作物根际土壤微生物生物量碳和氮虽然存在着显著差异,但微生物生物量磷没有呈现显著差异;与之相反,不同作物根际土壤之间的微生物生物量碳、氮和磷之间均呈显著差异,说明不同作物有助于形成根际土壤微生物生物量差异显著的根际微环境,与前人研究结果相似[20]。同样,从另一侧面反映了土壤微生物生物量可作为鉴定和筛选具有互补效果间套种作物组合的生物学指标之一。
本研究中,同科作物根际土壤的β-葡糖苷酶和磷酸酶活性之间均无显著差异,氨肽酶活性在同为葫芦科的瓠瓜与南瓜之间亦不存在显著差异;相同的酶活性水平下,可能导致作物对同种病害的抗性趋于一致或减弱,这一现象可能就是连作容易出现生长势变弱的根本原因之一;与之相反,异科作物根际之间,无论是β-葡糖苷酶、磷酸酶或氨肽酶活性,都容易形成差异显著的根际微环境,这与前人的研究基本一致[20-21],表明这3种涉及碳、氮和磷循环的酶活性不仅可有效地反映同科作物或异科作物根际土壤中氮和磷等元素的生物有效性,还可以根据不同作物根际土壤酶活性的差异水平,指示不同作物根际微环境的互补性。因此,β-葡糖苷酶、磷酸酶和氨肽酶活性可作为筛选与鉴定间套种作物之间有无互补效果的生物学指标。
3.2 不同作物科属根际土壤细菌多样性的比较
根据 DGGE 的分析原理,每一个条带大致代表土壤中微生物的一个优势种群,DGGE中每个泳道的条带的数量直接体现出微生物种群的数量,即丰度的大小。该种微生物数量的多少则体现在每个条带的亮度上[22],条带越亮,灰度越高,则表明该种微生物数量越多。本研究发现:同科作物根际土壤中容易形成优势细菌种群相同的根际微环境,而异科作物根际土壤中更有利于形成细菌多样性更为丰富的根际微环境。进一步克隆及测序结果表明:成功测序的15条带中,有8条测序序列为不可培养的细菌,占总数的一半以上。可知的优势细菌种群中,不可培养鞘氨醇盒菌属(UnculturedSphingopyxissp.)(条带3)、嗜麦芽糖寡养单胞菌属(Stenotrophomonasmaltophiliasp.)(条带7)和黄单胞菌属(Xanthomonassp.)(条带12)是瓜类蔬菜的共有优势细菌种属;而嗜热寡养单胞菌属(Stenotrophomonassp.)和木糖氧化无色杆菌属(Achromobacterxylosoxidansp.)则是红薯根际土壤中特异的优势细菌种属;不可培养的细菌种属(条带11)则是豇豆根际土壤中特异的优势细菌种属。
4 结 论
作物根际土壤中涉及碳、氮、磷循环的相关酶活性和细菌多样性指数,以及作物根际土壤中富集的优势细菌种属均适宜作为鉴定不同作物根际微环境之间是否具有互补效果的生物学指标;豇豆和红薯根际土壤生物学特性表明豇豆和红薯均具有改良葫芦科作物黄瓜、瓠瓜和南瓜根际土壤微环境的潜力。
[1]Huang L F, Song L X, Xia X J, et al. Plant-soil feedbacks and soil sickness:From mechanisms to application in agriculture[J]. Journal of Chemical Ecology, 2013, 39:232-242.
[2]Zewde T, Fininsa C, Sakhuja P K, et al. Association of white rot (Sclerotiumcepivorum) of garlic with enviromental factors and cultural practices in the North Shewa highlands of Ethiopia[J]. Crop Protection, 2007, 26:1566-1573.
[3]杨尚东,李荣坦,吴 俊,等. 番茄连作与轮作土壤生物学特性及细菌群落结构比较[J]. 生态环境学报, 2016, 25 (1):76-83.
[4]陈志谊,刘邮洲,乔俊卿,等. 利用芽孢杆菌生防菌防控土传病害引起的设施蔬菜连作障碍[J]. 中国蔬菜, 2012(15):29-30.
[5]蔡祖聪,张金波,黄新琦,等. 强还原土壤灭菌防控作物土传病的应用研究[J]. 土壤学报, 2015, 5(3):469-476.
[6]Hao Z P, Wang Q, Christie P, et al. Allelopathic potential of watermelon tissues and root exudates[J]. Scientia Horticulturae,2007,112:315-320.
[7]崔佳琦,魏丽娜,蔡柏岩. 接种摩西管柄囊对连作大豆异黄酮及脂肪酸含量的影响[J]. 农学学报, 2015, 5(4):31-35.
[8]刘业霞,姜 飞,张 宁,等. 嫁接辣椒对青枯病的抗性及其与渗透调节物质的关系[J]. 园艺学报, 2011, 38 (5):903-910.
[9]刘素慧,刘世琦,张自坤,等. 大蒜根系分泌物对同属作物的抑制作用[J]. 中国农业科学, 2011, 44(12):2625-2632.
[10]刘素慧,刘世琦,张自坤,等.EM对连作大蒜根际土壤微生物和酶活性的影响[J]. 植物营养与肥料学报, 2011, 17(3):718-723.
[11]李 威,程智慧,孟焕文,等. 轮作不同蔬菜对大棚番茄连作基质中微生物与酶及后茬番茄的影响[J]. 园艺学报, 2012, 39(1):73-80.
[12]张洁莹,宁堂原,冯宇鹏,等. 套作糯玉米对连作菜田土壤特性及产量的影响[J]. 中国农业科学, 2013, 46 (10):1994-2003.
[13]Karlen D L, Gardner J C, Rosek H J. A soil quality framework for evaluating the impact of CRP[J]. Journal of Production Agriculture, 1998, 11(1):56-60.
[14]李振高,骆永明,腾 应. 土壤与环境微生物研究方法[M]. 北京:科学出版社, 2008:322-333.
[15]赵久成. 嫁接对西瓜根际土壤微生物多样性及生物学性状的影响[D]. 南宁:广西大学硕士学位论文, 2014.
[16]马宁宁,李天来. 设施番茄长期连作土壤微生物群落结构及多样性分析[J]. 园艺学报, 2013, 40(2):255-264.
[17]徐晓宇,闵 航,刘 和,等. 土壤微生物总DNA提取方法的比较[J]. 农业生物技术学报, 2005, 13(3):377-381.
[18]李晓慧,韩晓增,王树起,等. 土壤微生物对不同作物根系活动的响应[J]. 农业系统科学与综合研究, 2010, 26 (2):156-159.
[19]丁莎莎. 不同苎麻品种根际营养及根际微生物的比较研究[D]. 长沙:湖南农业大学硕士学位论文, 2012.
[20]戴建军,宋朋慧,闫暮春,等. 不同种植方式对苗期大豆、玉米根际土壤酶活性及微生物量碳、氮的影响[J]. 东北农业大学学报, 2013, 44(2):17-22.
[21]罗 影. 不同种植模式对胡麻田土壤酶活性和土壤微生物群落结构及多样性的影响[D]. 兰州:甘肃农业大学硕士学位论文, 2016.
[22]顾美英,徐万里,茆 军,等. 新疆绿洲农田不同连作年限棉花根际土壤微生物群落多样性[J]. 生态学报, 2012, 32(10):3031-3034.

