广西部分地区猪群PEDV N基因克隆及序列分析
许瑞胜,何奇松,李春英,冯淑萍,易春华,韦达有,胡丽萍,黄胜斌,胡巧云,熊 毅,马 琳*
(1.广西动物疫病预防控制中心,广西 南宁 530001;2.钦州市动物疫病预防控制中心,广西 钦州 535000;3.桂林市动物疫病预防控制中心,广西 桂林 541002)
【研究意义】猪流行性腹泻(Porcine epidemic diarrhea, PED)可发生在各阶段猪,主要危害哺乳仔猪且具有较高的死亡率,是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus, PEDV)感染引起的一种急性传染性肠道疾病[1]。目前,我国共有26个省(市、自治区)报道过PED的发生和流行情况, PED已属我国严重的猪传染病之一[2]。由于PED的现场诊断困难,传染性较强,且治疗效果不佳,即使在一些免疫PEDV疫苗的猪场,该病也常有发生,并可导致育肥猪的急性死亡。因此,对PEDV流行毒株的N基因序列进行序列分析,对了解PEDV的流行及遗传变异情况及制定防控策略均具有重要意义。【前人研究进展】我国在1982年首次分离到PEDV[3],PEDV的N基因由1326个核苷酸组成,编码含有441个氨基酸的N蛋白[4]。N蛋白能促进复制体的形成和病毒的组装,N蛋白与磷脂及细胞膜的结合在病毒的合成过程中发挥重要作用;PEDV属于冠状病毒属,其N蛋白虽然在同属病毒之间的同源性不高,但在同种病毒之间保守性很高。在感染PEDV早期的猪群体内可以诱导机体产生较高水平的抗N蛋白抗体,因此N蛋白可以作为早期快速检测PEDV感染的一个重要指标[5]。研究表明,N蛋白具有较多功能,它既具有免疫原性,还能识别相应靶位点,诱导机体的T细胞及B细胞免疫反应,还参与病毒复制和转录[6-10]。【本研究切入点】近年来,由猪病毒腹泻引起的疾病在广西普遍发生且呈逐年上升趋势,而目前还没有一种非常有效的方法来防止并控制PDE的传染与发病。【拟解决关键问题】通过对临床样品进行检测,并分析其流行毒株遗传变异情况,以期为今后PEDV的深入研究及有效防控提供参考,为广西地区PEDV的临床诊断及疫苗的选择提供参考。
1 材料与方法
1.1 病料来源及阳性对照
2012-2016年从广西南宁市、贺州市、来宾市、桂平市、陆川县、贵港市、兴安县、象州县等7个市(县、地区)共25个猪场采集疑似感染PEDV的仔猪肠系膜淋巴结或肠样粪便样品共计506份。将采集的样品与灭菌PBS按1∶5的质量体积制成悬液,经反复冻融3次后,10 000 r/min于冷冻离心机离心5 min,取上清于-40或-80 ℃冰箱保存备用。阳性对照为猪传染性胃肠炎、猪流行性腹泻、猪轮状病毒(G型)三联活疫苗,购自哈尔滨维科生物技术开发公司。
1.2 主要试剂
核酸自动提取试剂盒、质粒提取试剂盒、大肠杆菌DH5α感受态细胞等购自天根生化科技(北京)有限公司,一步法提取试剂盒、DL2000 DNA Marker、胶回收试剂盒、PCR反应试剂、pMD18-T载体、限制性内切酶等购自宝生物工程(大连)有限公司。
1.3 引物设计与合成
下载GenBank数据库中已发表PEDV CV777株(登录号:AF353511)的N基因序列,利用Premier 5.0及Oligo 6.0软件设计1对特异性引物扩增PEDV的部分N基因,引物序列见表1,引物使用的浓度为25 pmol/μl。

表1 引物序列Table 1 Sequences of the primers
1.4 病毒总RNA的提取及RT-PCR扩增
取已处理好的病料上清液,参照核酸自动提取试剂盒(磁珠法)操作步骤提取病毒RNA,对提取的RNA进行反转录。反转录反应体系为25.0 μl:RNA模板15.0 μl,5×M-MLV RTase Reaction Buffer 5.0 μl,反转录通用引物(25 pmol/μl)2.0 μl,dNTPs(10 mmol/L)2.0 μl,Rnasin inhibitor(40 U/μl) 0.5 μl,M-MLV RTase (200 U/μl)0.5 μl。反转录程序为:42 ℃ 1 h,95 ℃ 5 min,反应结束即后获得cDNA。以获得的cDNA为模板,利用设计合成的特异性引物PEDV1/PEDV2进行PCR扩增。PCR反应体系为25.0 μl:10×PCR Buffer 2.5 μl, dNTP Mix(2.5 mmol/L)2.0 μl,引物PEDV1、PEDV2各0.5 μl,TaqDNA聚合酶(5 U/μl)0.2 μl,加ddH2O至25.0 μl。PCR反应程序为:95 ℃预变性5 min;95 ℃ 40 s,55 ℃ 40 s,72 ℃ 40 s,进行32个循环;最后72 ℃延伸8 min。1.0 %琼脂糖凝胶观察PCR检测结果。
1.5 PCR扩增产物的回收、克隆及鉴定
参照胶回收说明书对PCR产物的目的基因进行纯化回收,将其与载体pMD-18T连接,转化感受态细胞DH5α中,涂板,挑取白色菌落接种与LB培养基中进行培养,提取质粒后,对其进行酶切鉴定,将鉴定正确的阳性质粒送宝生物工程(大连)有限公司进行测序。
1.6 部分N基因序列分析
运用Lasergene DNASTAR 7.1 软件中的MegAlign程序将所测得的目的基因序列与GenBank已发表PEDVN基因参考序列进行核苷酸及其推导氨基酸同源性比较分析,并绘制遗传进化树。
2 结果与分析
2.1 病料中PEDV N基因的检测
应用一步法RT-PCR检测方法,对506份样品进行PEDV核酸检测,其中PEDV阳性数为184份,阳性率为36.36 %(表2)。PEDV 阳性样品的PCR产物电泳条带大小约485 bp,其中扩增的4份阳性样品电泳图见图1。

表2 PEDV临床样品检测Table 2 The results of PEDV detection

M:DL 2000 DNA Marker;1~4:阳性样品图1 阳性样品的RT-PCR电泳结果Fig.1 Electrophoretogram of positive samples amplified by RT-PCR
2.2 部分N基因的RT-PCR扩增与鉴定结果
被检测为PEDV阳性的样品,选取的样品进行N基因RT-PCR扩增。其中选取不同猪场的86份阳性样品进行N基因的RT-PCR扩增。用1.0 %的琼脂糖凝胶电泳检测扩增后产物。结果显示,片段扩增的长度大小和预期485 bp大小相符合(图2);用胶回收试剂盒对目的片段的DNA进行回收,以备后续克隆用。将重组质粒用HindⅢ和EcoR Ⅰ进行酶切鉴定后,获得约485 bp大小的目的条带(图3)。将酶切鉴定为阳性的质粒送宝生物工程(大连)有限公司进行测序,测序结果显示扩增的N基因为485 bp。
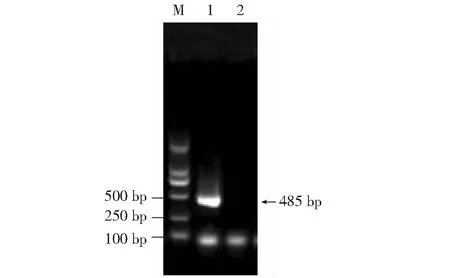
M:DL 2000 DNA Marker ; 1:N基因; 2:阴性对照图2 PEDV N基因扩增电泳结果Fig.2 The electrophoresis results of PEDV N gene amplification

M:DL 2000 DNA Marker ; 1:N基因图3 PEDV N基因的双酶切电泳结果Fig.3 Electrophoretogram of PEDV N gene digested by double enzyme

右上方为核苷酸序列同源性,1~21为参考毒株,22~42为部分广西毒株Nucleotide sequence homology was in the upper right of figure.1-21:reference strains;22-42:the part of strains in Guangxi 图4 部分N基因与参考毒株的核苷酸同源性比较Fig.4 Homology comparison on nucleotide of N gene among partial N gene fragment of PEDV and reference strains
2.3 N基因序列同源性分析结果
对86份阳性样品进行部分N基因测序,应用DNASTAR生物学信息软件对N基因的核苷酸及其推导氨基酸进行比较分析。结果显示,N基因与参考株一样没有核苷酸插入和缺失,只有核苷酸的突变。测序所得的86份样品的PEDVN基因的核苷酸同源性在94.2 %~100.0 %。部分广西毒株的N基因核苷酸同源性及与参考毒株的核苷酸同源性如图4所示。
2.4 部分N基因遗传进化树
用生物学信息软件DNAstar中Clustal W法,从GeneBank中下载经典的代表PEDV参考毒株与本研究的86株毒株的核苷酸绘制进化树图谱(图5)。进化树图谱显示,本研究86株毒株以及引用的参考毒株一起可以分为Cluster 1、Cluster 2、Cluster 3、Cluster 4共4个群,其中本研究的GP35-8、LC37-22、LC107-5、LC107-19和LC107-16等5株毒株分属Cluster 2群;而另外的81株毒株属于Cluster 3。
本研究毒株所属的Cluster 3毒株中与Cluster 1欧洲株CV777、韩国株SM98和中国株LZC经典毒株之间核苷酸同源性为94.6 %~96.9 %;与Cluster 2韩国株DR13、日本株83P-5、中国株CH/S和CH-XIURUMQI-2011参考毒株之间的核苷酸同源性为95.1 %~97.3 %;与Cluster 4中国株CH-GXWM-2011、CHGD-01和CH-GDQY-3-2011参考株之间的核苷酸同源性为94.4 %~98.1 %;与Cluster 3 DX、LJB-03、HuN、JS-2004-2、HB-HS、BJ2010和YT12-4参考株之间的核苷酸同源性为95.7 %~100.0 %。本研究所属于Cluster 2的5株毒株与Cluster 1欧洲株CV777、韩国株SM98和中国株LZC参考株之间核苷酸同源性为96.1 %~97.5 %;与Cluster 2韩国株DR13、日本株83P-5、中国株CH/S和CH-XIURUMQI-2011参考毒株之间的核苷酸同源性97.9 %~100.0 %;与Cluster 3 中国早期和近年毒株DX、LJB-03、HuN、JS-2004-2、HB-HS、BJ2010和YT12-4参考株之间的核苷酸同源性为95.3 %~96.9 %;与Cluster 4中国株CH-GXWM-2011、CHGD-01和CH-GDQY-3-2011参考株之间的核苷酸同源性为95.3 %~97.3 %。上述同源性比较结果见图4。
3 讨 论
本研究对近年来广西25个猪场的506份临床样品进行PEDV核酸检测,结果显示,PEDV的阳性数为184份,阳性率为36.36 %;与郭旋等[11]、卢冰霞等[12]、罗六龙等[13]、毛黎红等[14]报道基本一致,说明猪流行性腹泻病毒仍是引起我国及我区仔猪腹泻的一个主要病毒性病原。据有关数据统计分析显示,近年来流行性腹泻病毒在我国居高不下,腹泻病毒也是目前危害我国最严重的疾病之一,可导致新生仔猪成活率低,生长缓慢或停滞。虽然现有疫苗并不能提供充分的免疫保护,但接种疫苗仍是目前防控该病的最好措施。
猪流行性腹泻病毒N基因编码病毒的核衣壳蛋白,参与病毒在感染宿主内复制[15]。该蛋白有较强的抗原性,一方面诱导感染机体B细胞和T细胞进行细胞免疫反应,另一方面使宿主感染PEDV早期就能在机体内产生较高水平的抗体。吴玉璐等[16]对我国近年来部分猪场PEDV流行株的N蛋白抗原性就行分析,显示毒株之间的核苷酸和氨基酸的同源性分别为99.8 %~100.0 %和98.8 %~100.0 %,与参考株有较高的氨基酸同源性,其中与CH/S毒株亲缘关系较近,属于一个分支,说明当前流行株N蛋白和以前毒株N蛋白比较保守。Chen等[17]对中国部分省的32个猪场当前流行PEDV的N基因进行测序分析,结果显示N基因之间的同源性大于95.0 %,和其他中国参考株同源性为95.6 %~99.7 %。毒株彼此之间同源性为100 %的毒株与至弱的参考毒株CV777、DR13和83P-5的核苷酸同源性为95.9 %~100.0 %。32株中有12株属于1群,其中包括参考株CH/S、83P-5;14株属于3群,包括五株中国参考株LJB/03、JS-2004-2、DX、BJ2010和HB/HS。6株(CH/GXQZ/2011、CH/GXWP/2011、CH/ZJHZ/2011、CH/HLJHH/2011)等属于4群,和其他中国株有基因差异,也许代表着PEDV新的基因型。
86份样品部分N基因测序分析显示,N基因与参考毒株都没有核苷酸插入和缺失,只有核苷酸的点突变。86株PEDVN基因的核苷酸同源性在94.2 %~100.0 %;其与参考株之间的核苷酸同源性在94.1 %~100.0 %。LC107-16、LC107-19与参考毒株83P-5的同源性为100.0 %。PEDV可以分为4个群,其中欧洲株CV777、韩国株SM98、中国株LZC属于Cluster 1;韩国株DR13、日本株83P-5、中国株CH/S、CH-XIURUMQI-2011,以及包括本研究的GP35-8、LC37-22、LC107-5、LC107-19和LC107-16 五株毒株属于Cluster 2;中国株CH-GXWM-2011、CHGD-01和CH-GDQY-3-2011等属于Cluster 4;本研究的其他81株毒株及中国株DX、LJB-03、HuN、JS-2004-2、HB-HS等属于Cluster 3。说明本研究的大部分毒株和我国国内早期和近年的毒株DX、LJB-03、JS-2004-2、BJ2010等亲缘关系比较近,PEDV在流行传播的过程中N基因比较保守。该病是目前危害我国养猪业较为严重的疾病之一,其在广西地区的猪群感染和发病必须引起高度重视。

图5 N基因遗传进化树Fig.5 Phylogenetic tree of N gene
4 结 论
PEDV是引起广西地区规模化猪场新生仔猪腹泻的主要病原,广西地区的PEDV可分为2个群且其N基因仍然保守。
[1]Timoney J F,Gillespie J H,Scott F W,et al. Microbiology and infectious disease of domestic animals[M]. Ithaca:Cornell University Press,1988.
[2]孔园园,范京惠,左玉柱,等. 猪流行性腹泻病毒S基因的研究进展[J]. 猪业科学,2016,11(33):102-105.
[3]宣 华,邢德冲. 应用猪胎肠单层细胞培养猪流行性腹泻病毒的研究[J].中国人民解放军兽医大学学报,1984,3(4):202-208.
[4]孙东波,冯 力,时洪艳,等. 猪流行性腹泻病毒分子生物学研究进展[J].动物医学进展,2006, 27(10):11-14.
[5]Rodak L,Valicek L,Smid B,et al. Z. An ELISA optimized for porcine epidemic diarrhoea virus detection in faeces[J]. Veterinary Microbiology,2005,105(1):9-17.
[6]Van der Meer Y,Snijder E J,Dobbe J C,et al. Localization of mouse hepatitis virus nonstructural proteins and RNA synthesis indicates a role for late endosomes in viral replication[J]. Journal of Virology,1999,73:7641-7657.
[7]Denison M R,Spaan W J,Van der Meer Y,et al. The putative helicase of the coronavirus mouse atitis virus is processed from the replicase gene polyprotein and localizes in complexes that are active in viral RNA synthesis[J]. Journal of Virology,1999,73(8):6862-6871.
[8]Ndifuna A,Waters A K,Zhou M,et al. Recombinant nucleocapsid protein is potentially an inexpensive,effective serodiagnostic reagent for infectious bronchitis virus[J]. Journal of Virology,1998,70(1):37-44.
[9]Seah J N,Yu L,Kwang J. Localization of linear B-cell epitopes on infectious bronchitis virus nucleocapsid protein[J]. Veterinary Microbiology,2000,75(1):11-16.
[10]Mackay I M,Arden K E,Nitsche A. Survey and summary real-time PCR in virology[J]. Nucleic Acids Research,2002,30(6):1292-1305.
[11]郭 旋,陈 静,刘 欢,等.广西仔猪腹泻病毒病原流行病学调查[J]. 南方农业学报,2013,44(1):155-160.
[12]卢冰霞,秦毅斌,何 颖,等. 2011-2014年广西猪流行性腹泻病毒检测及其M基因的序列分析[J].中国畜牧兽医,2015,42(3):549-557.
[13]罗六龙,黄冬妮,黄良宗,等.广东省猪流行性腹泻病毒S1基因的克隆与序列分析[J]. 中国兽医杂志,2016,52(3):19-21.
[14]毛黎红,张双翔,周碧君,等. 6株猪流行性腹泻病毒贵州株S基因序列分析[J].中国畜牧兽医,2017,44(6):1621-1629.
[15]Lee H K,Yeo S G. Cloning and sequence analysis of the nucleocapsid gene of Porcine epidemic diarrhea virus Chinju99[J]. Virus Genes,2003,26(2):207-212.
[16]吴玉璐,朱建平,杨 莘,等. 猪流行性腹泻病毒N基因的表达及抗原性分析[J]. 中国预防兽医学报,2013,35(4):299-303.
[17]Chen J F,Liu X Z,Lang H W,et al. Genetic variation of nucleocapsid genes of porcine epidemic diarrhea virus field strains in China[J]. Archives of Virology,2013,158(6):1397-1401.

