硫化氢促进缺磷条件下水稻根系细胞壁磷的再利用①
朱春权,朱晓芳,沈仁芳*
硫化氢促进缺磷条件下水稻根系细胞壁磷的再利用①
朱春权1,2,朱晓芳1,沈仁芳1*
(1 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),南京 210008;2 中国科学院大学,北京 100049)
在缺磷条件下,外源添加10 nmol/L H2S供体NaHS可以显著提高水稻体内的有效磷含量。进一步研究发现,H2S主要通过提高水稻根系细胞壁中的果胶含量和果胶甲酯酶的活性来增加水稻细胞壁磷的释放,从而确保水稻在缺磷条件下的存活。添加H2S的清除剂亚牛磺酸后进一步验证了H2S对水稻根系细胞壁磷再利用的调控作用。同时,测定3个负责水稻体内磷转运的磷转运子基因的表达,结果显示H2S主要通过上调磷转运子6和8基因的表达来提高水稻体内磷从根部往地上部的转运。
信号分子;H2S;细胞壁;果胶;果胶甲酯酶;磷转运基因
磷是植物生长发育过程中的重要营养元素,它在植物中的含量约为0.5 ~ 5 g/kg干重。其中有机磷占植物体内全磷含量的85%,无机磷占全磷含量的15%。磷是植物细胞结构如细胞膜、核酸以及能量物质ATP等的重要组成成分[1]。并且,磷参与植物体内的众多生理生化反应,比如光合作用、呼吸作用以及信号转导等[2-3]。植物只有吸收充足的磷,才能正常生长发育,并且提高抵御外界胁迫如寒冷、干旱等的能力。
然而,世界上约有67% 的土壤处于缺磷状态[4],我国也约有2/3面积的耕地处于缺磷状态[5]。虽然土壤中的总磷含量很高,但其中的可利用磷含量却很少能超过10 μmol/L[6],远低于植物植物体内5 ~ 20 mmol/L的磷含量[3]。造成土壤缺磷的原因主要在于:在酸性的红壤中,土壤中的磷易与Fe3+和Al3+等离子形成复合物,而在碱性的石灰质土壤中,磷又易与Ca2+和Mn2+等离子形成难溶物;同时,在土壤中存在的微生物会将土壤中的磷转化成有机态的磷,难以被植物最直接利用;而且土壤中的黏粒对磷也存在着强烈的吸附作用[1,3,7]。
在农业生产上,主要通过增加磷肥施用量或者改变磷肥施加方式来提高作物对磷肥的吸收[8-9]。在长期的进化过程中,植物本身也形成了一系列应对缺磷的措施。根系构型的改变被认为是植物主要的耐缺磷机制之一。在缺磷条件下,植物根冠比上升[10],主根伸长受到抑制[11],侧根及根毛的长度和密度增加[12],一些特殊的植物如白羽扇豆形成大量排根[13],并且侧根的空间位置改变,主要向含磷量较高的浅层地面生长[14],从而增加植物对外界磷的吸收。并且,由于82% 的高等植物会和丛枝菌根等真菌进行共生,因此在缺磷条件下,菌根真菌菌丝的伸长也是植物提高外界磷吸收的途径之一[15]。除此之外,植物还会通过向根系分泌氢离子或者有机酸[16-17],同时促进根际解磷菌的繁殖[18-19],来提高根际周围土壤中被土壤黏粒包裹的磷的释放,从而增加植物根际的可利用磷含量,供植物吸收利用。
植物的细胞壁是植物抵御外界胁迫的第一道屏障。它在植物抵御铝毒、镉毒中发挥重要作用[20-21]。比如Xiong等[22]研究发现,在镉胁迫下,植物通过增加根系细胞壁对镉的吸附,从而减少镉往地上部的运输,缓解植物镉毒。近期研究发现,植物细胞壁在帮助植物抵抗低磷胁迫中也发挥重要作用。在水稻根系中,约一半的总磷存在根系细胞壁中,且在低磷条件下,这部分的磷会通过细胞壁果胶的调节作用而被释放出来,从而供水稻再利用。同时,缺磷条件下,水稻根系细胞壁的果胶含量与水稻体内有效磷的含量呈显著正相关,说明缺磷时水稻根系细胞壁中的果胶含量越高,其对体内细胞壁磷的再利用能力越强[23]。
最近的研究发现,硫化氢(H2S)是植物体内重要的信号分子[24-25]。H2S在植物体内广泛参与各种生理反应,比如植物气孔的闭合的调节[26],缓解植物硼毒引起的根伸长抑制[27],缓解镉在植物体内的积累以及造成的氧化损害[28],降低干旱渗透胁迫[29]以及提高植物耐盐[30]等。本次试验主要研究缺磷条件下,H2S信号分子通过调控水稻根系细胞壁磷的释放来提高水稻体内有效磷的含量。
1 材料与方法
1.1 植物培养与试验设计
挑选无病虫害的水稻种子,在10%(/)的次氯酸钠(NaClO)溶液中浸泡10 min,用蒸馏水彻底冲洗3遍,将种子放入垫有湿润滤纸的小培养皿中在黑暗条件下催芽24 h(30℃);第2天将培养皿中的种子放在塑料网上,在含有0.5 mmol/L氯化钙(CaCl2)的溶液中(pH 5.5)继续萌发2 d(30℃);接着将CaCl2溶液彻底换成正常的木村营养液,放在含有正常光照的培养间继续培养。
为了解析新型信号分子硫化氢(H2S)调控缺磷条件下水稻体内磷的再利用的机制,设置以下试验:将水稻幼苗在正常条件下培养14 d后,选取长势一致的水稻幼苗移入1.5 L的培养罐中,每个罐子中培养10棵。在+P(磷含量180 μmol/L)和–P(磷含量0 μmol/L) 两个处理组下分别添加0(作为对照)、10、50和100 nmol/L的NaHS溶液,处理24 h后,将营养液完全换掉,继续在这两个处理(+P和–P)条件下培养6 d。营养液的最终pH为5.5,并且加5 mmol/L的MES缓冲液固定溶液pH。期间每隔3 d换一次营养液。预备试验显示,无论在加磷还是缺磷条件下,10 nmol/L NaHS处理24 h后水稻体内有效磷含量均达到最高值,因此选择该NaHS浓度(10 nmol/L)和处理时间(24 h)做进一步的研究,分别设置以下处理:+P、–P、+P+S (S代表NaHS)、和–P+S。其余培养条件同上。
为进一步验证新型信号分子硫化氢(H2S)参与调控水稻细胞壁磷的再利用,设置亚牛磺酸(hypotaurine)添加试验,包括以下4个处理:+P、–P、+P+HT (HT代表亚牛磺酸)、和–P+HT。亚牛磺酸在营养液中的最终浓度为300 μmol/L。处理7 d后收集水稻的根部和地上部进行检测。营养液的最终pH为5.5,并且加5 mmol/L的MES缓冲液固定溶液pH。期间每隔3 d换一次营养液。
1.2 测定项目与方法
1.2.1 有效磷含量的测定 首先,将处理后的水稻样品在蒸馏水下冲洗3次,吸干水分后分别称重,记录鲜重。然后,将植物样品在研钵中用液氮研磨,粉碎后加入0.8 ml的5 mmol/L硫酸溶液,继续研磨后加入8 ml蒸馏水,将研磨后的匀浆倒入10 ml的离心管;室温静置2 h后,在4 000 r/min下离心5 min;取出400 μl的上清液加入到1.5 ml的离心管中用钼锑抗比色法进行测定[31]。
1.2.2 细胞壁的提取与组分分离 细胞壁的提取:首先,将水稻根在蒸馏水下冲洗3遍后,纸巾擦干;然后,在研钵中用液氮进行研磨,粉碎后用75% 的乙醇将样品倒入10 ml的离心管中,在冰上间断混匀,20 min后在4 000 r/min转速下离心10 min(4℃),倒掉上清液,依次加入丙酮、1∶1的甲醇和氯仿混合液以及甲醇,每次均在冰上间断混匀20 min,然后离心,弃上清。加入甲醇离心弃上清后,将剩余的细胞壁粗提物用冷冻干燥仪冷冻干燥,4℃冰箱保存备用[32]。
果胶的提取:称取约2 mg的细胞壁置于1.5 ml的离心管,加入1 ml蒸馏水,在100℃的水浴锅中煮1 h;然后,在13 200 r/min条件下离心10 min;吸取上清液放入5 ml的离心管中。重复在100℃下煮3次,弃去残渣。将5 ml离心管中的液体用蒸馏水定容至3 ml即为提取的果胶[33]。
1.2.3 果胶含量的测定 果胶的含量通过测定糖醛酸的含量来指示。具体的方法如下:吸取200 μl的果胶提取液于1.5 ml离心管中;再加入1 ml含有12.5 mmol/L Na2B4O7·10H2O的浓硫酸;然后将离心管放在沸水中水浴5 min,取出离心管,在冷水中冷却;往冷却的离心管中加入20 μl浓度为0.15% 的间羟基联苯 3-羟基联苯溶液,在室温下催化反应20 min,混匀后在520 nm的波长下进行比色。用不同浓度的半乳糖醛酸制作标曲[34]。
1.2.4 细胞壁磷的测定 称取约2 mg的粗提细胞壁,将其放入1.5 ml的离心管中,往离心管中加入1 ml 2 mol/L的盐酸;然后,在涡旋振荡仪上进行振荡,放入振荡器中振荡24 h;取出离心管,在13 200 r/min下离心5 min,取上清在电感耦合等离子体原子发射光谱仪上测定磷含量[23]。
1.2.5 果胶甲酯酶酶活的测定 在冰上称取约5 mg的细胞壁粗提物,加入0.5 ml的1 mol/L NaCl溶液,在冰上间隔地用涡旋振荡仪振荡1 h;然后,在15 000 r/min下离心10 min(4℃),取上清测定果胶甲酯酶活性。具体方法为:取50 μl提取的上清加入1.5 ml离心管,往离心管中分别加入100 μl含有0.64 mg/ml果胶的200 mmol/L PBS 缓冲液和10 μl酒精氧化酶溶液;在30℃条件下反应10 min后,加入200 μl含有5 mg/ml 4-氨基-5-肼基-1,2,4-三唑-3-硫醇的0.5 mol/L 氢氧化钠溶液;继续在30℃下保持30 min,然后加入640 μl蒸馏水后在550 nm波长下比色。用不同浓度的甲醇作标曲[35]。
1.2.6 硫化氢(H2S)含量的测定 将水稻根在蒸馏水中洗净,称取鲜重;在液氮下研磨后加入5 ml含有0.1 mmol/L EDTA以及0.2 mmol/L抗坏血酸的磷酸缓冲液(pH 6.8;50 mmol/L);然后,将匀浆液装入含有100 mmol/L磷酸缓冲液(pH 7.4)、10 mmol/L L-半胱氨酸和2 mmol/L磷酸吡哆醛的测试管中,在室温下静置30 min;接着,加入0.3 ml 5 mmol/L的溶解在3.5 mmol/L硫酸中的二甲基-p-苯二胺,再加入0.3 ml 50 mmol/L的溶解在100 mmol/L硫酸中的硫酸铁铵;反应15 min后在667 nm波长下进行比色。用硫化钠做标准曲线,最后值换算成nmol/g FW[36]。
1.2.7 基因表达的测定 收集处理后的水稻根系,在研钵中用液氮彻底研磨,用TRIZOL (Invitrogen, Inc., CA, USA)提取根系的总RNA。提取后的RNA在nanodrop上测定含量以及质量,在1% 的琼脂糖介质下进行电泳检测其完整性。然后,用PrimeScript RT 试剂盒 (Takara Bio, Inc., Japan)进行反转录,反转录体系中含有1 μg的总RNA。实时荧光定量PCR的体系为10 μl,包含:1 μl稀释10倍的cDNA,0.6 μl的正向和反向引物,5 μl的SYBR Premix ExTaq(Takara Bio, Inc., Japan)和2.8 μl的灭菌水。反应的引物序列如下:2(正向引物: 5′-GACGAGACCG CCCAAGAAG-3′,反向引物: 5′-TTTTCAGTCACTC ACGTCGAGAC-3′),6(正向引物: 5′-TATAA CTGATCGATCGAGACCAGAG-3′;反向引物:5′-TG GATAGCCAGGCCAGTTATATATC-3′),8(正向引物:5′-AGAAGGCAAAAGAAATGTGTGTTAAAT- 3′,反向引物: 5′-AAAATGTATTCGTGCCAAATTGCT- 3′)。每个样品做3个机械重复以及3个生物学重复。以基因作为内参基因(正向引物: 5′-AAGTTCTG GGAAGTGGTT-3′,反向引物: 5′-CTCCCAATGAGT GACAAA-3′),用2-ΔΔCT方法进行基因相对表达量的计算[37-38]。
2 结果与分析
2.1 H2S对水稻体内有效磷含量的影响
由图1可见,在添加10 nmol/L的NaHS后,水稻根系和地上部的有效磷含量均显著增加(图1),说明10 nmol/L的NaHS对水稻磷吸收和体内再利用试验来说是一个合适的处理浓度。并且在完全缺磷的营养液中,10 nmol/L NaHS可以提高水稻体内有效磷的含量,说明在缺磷条件下,H2S会通过促进水稻体内磷的再利用,从而提高体内的有效磷含量。
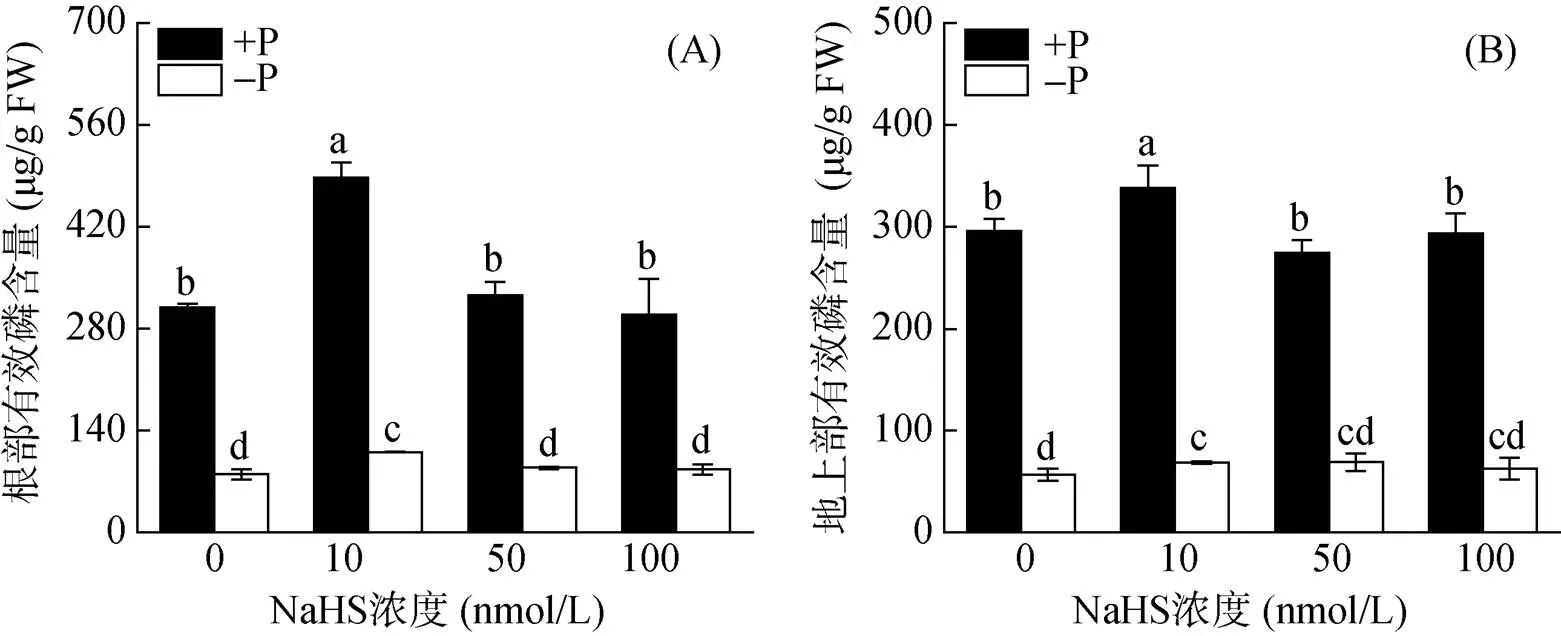
(图中不同小写字母表示处理间差异在P<0.05水平显著,下同)
2.2 水稻体内H2S含量
鉴于10 nmol/L的NaHS可以显著地提高缺磷条件下水稻根部和地上部的有效磷含量,因此在后续的试验中选择该浓度做进一步的研究。用NaHS预处理水稻1 d以后,水稻根系H2S含量显著增加(图2),暗示确实是H2S促进了缺磷条件下水稻体内有效磷含量的增加。
2.3 水稻体内细胞壁磷含量、果胶含量和果胶甲酯酶活性
前人研究发现,水稻根中约有50% 的总磷储存在根系的细胞壁中[23],据此推测在缺磷条件下,H2S调控促进了水稻根系细胞壁磷的再利用。结果显示,在用NaHS预处理后,缺磷条件下,水稻根系细胞壁中的磷含量显著减少(图3A),且伴随细胞壁果胶含量的上升(图3B)以及果胶甲酯酶活性的上升(图3C),表明H2S确实可以通过提高水稻细胞壁内果胶的含量以及酸化程度来促进细胞壁磷的释放,从而提高体内的有效磷含量。
2.4 水稻体内磷转运相关基因的表达
水稻体内有众多的磷转运子参与水稻对外界磷的吸收以及体内磷的转运。前人研究发现,磷转运子OsPT2、OsPT6以及OsPT8主要参与水稻体内磷的转运[37-38],因此在本次试验中,主要测定了这3个磷转运子基因在添加NaHS后的表达变化。结果显示,在缺磷1 d后,26以及8基因的表达均显著上升,并且在缺磷条件下,10 nmol/L NaHS预处理的水稻根中6和8基因的表达量显著高于单纯缺磷处理(图4),表明H2S主要通过调节6和8基因的表达来增加其有效磷从根部往地上部的运输。

图2 水稻根中H2S含量

图3 水稻根系细胞壁的磷含量(A)、果胶含量(B)以及果胶甲酯酶的活性(C)
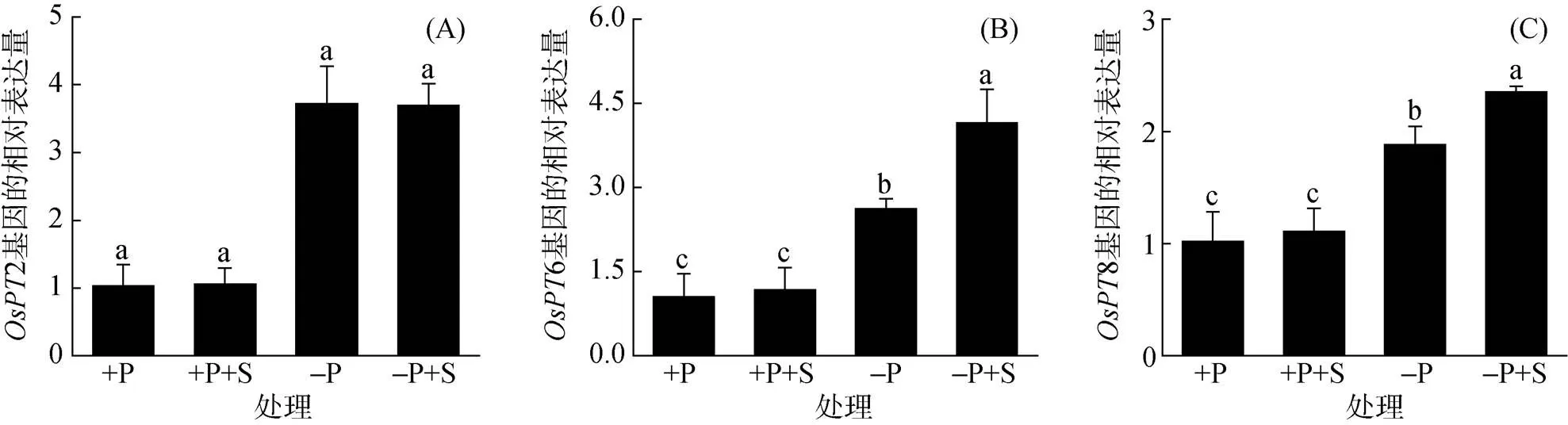
图4 水稻根中OsPT2(A)、OsPT6(B)和OsPT8(C)基因的表达
2.5 H2S清除剂对水稻有效磷以及细胞壁磷含量及组分变化的影响
为进一步确认H2S在缺磷条件下对水稻细胞壁磷再利用的调节作用,试验在营养液中外源添加了H2S的清除剂亚牛磺酸。结果显示,在缺磷条件下,当水稻的营养液中存在亚牛磺酸后,其根部和地上部的有效磷含量均显著下降(图5),并且伴随着果胶含量的下降和果胶甲酯酶活性的下降以及根部细胞壁磷含量的上升(图6)。以上试验结果进一步验证了H2S在水稻缺磷条件下,通过改变水稻根系细胞壁组分来提高细胞壁磷的再利用,以提高水稻体内有效磷的含量使其正常生长。
3 讨论
信号分子H2S在植物的众多抗逆反应中发挥重要作用。比如对苜蓿()抵抗镉毒的研究中发现,在含镉的溶液中添加H2S的供体NaHS后,苜蓿体内的镉含量明显减少,并且伴随着氧化损伤的降低,说明H2S不仅可以减少植物对重金属镉的吸收,还能通过调节抗氧化系统来减少由于重金属胁迫造成的氧化损伤。进一步的研究发现,H2S还能刺激根系NO含量的增加,说明H2S在调控植物抵御重金属胁迫的过程中还与信号分子NO密切相关[28]。最近,有学者在玉米抵抗高温胁迫的研究中发现,H2S在NO的下游发挥作用,帮助玉米抵抗高温胁迫引起的各种损伤[36]。在本试验中,当外源添加10 nmol/L的H2S供体NaHS后,在缺磷条件下,水稻根部和地上部的有效磷含量显著增加(图1),并且伴随着水稻体内H2S含量的上升,表明H2S信号分子通过调控水稻体内磷的再利用来增加水稻体内有效磷含量。

图5 添加亚牛磺酸后水稻根部(A)和地上部(B)有效磷含量

图6 添加亚牛磺酸后水稻根系细胞壁磷含量(A)、果胶含量(B)以及果胶甲酯酶的活性(C)
水稻根系细胞壁在水稻增加外部磷吸收以及提高体内磷的再利用过程中起重要作用。Ae等[39]报道低磷条件下的花生,其细胞壁多糖具有活化磷的能力。随后,Ae等[40]通过比较缺磷土壤上的多种作物发现,植物吸收磷的多少主要取决于植物根系细胞壁对外界难溶态磷的溶解作用,称为“contact reaction”。因此,相对于高粱以及大豆,花生具有较高的耐缺磷性的原因主要在于它的根系细胞壁对难溶态磷的活化与再利用能力更高,是高粱和大豆的两倍。Zhu等[23]的研究发现,在缺磷条件下Nip体内的有效磷含量显著高于Kas,其主要原因是Nip水稻根系中的果胶含量显著高于Kas,从而提高了其对细胞壁磷的再利用。并且在含FePO4的溶液中分别外源添加果胶和水,一段时间后测定溶液中的PO3– 4含量,发现添加果胶的溶液中PO3– 4的含量显著高于单纯添加水的溶液中,由此说明果胶可以通过吸附与PO3– 4结合的阳离子(比如Fe3+),从而促使PO3– 4离子的释放,进而增加水稻细胞壁中磷的释放。最近的研究发现,信号分子NO以及植物激素乙烯,均可以通过提高水稻根系细胞壁中果胶的含量以及果胶甲酯酶的活性来提高细胞壁磷的释放,从而增加缺磷条件下水稻体内的有效磷含量[41-42]。植物细胞壁中的果胶主要在高尔基体中形成,此时形成的果胶因为高度的甲酯化而带有少量的负电荷,因此与阳离子的结合能力较弱[43]。高度甲酯化的果胶经过分泌进入细胞壁后,在果胶甲酯酶的催化下脱去甲酯,暴露出其中的羧基(—COO–—),从而增加对细胞壁中与磷结合的阳离子(如FePO4中的Fe3+)的吸收,促使其中的PO3– 4释放出来,供植物进一步利用。本次试验结果发现,在缺磷条件下外源添加H2S的供体NaHS后,水稻根系中的细胞壁磷含量显著下降,并且伴随着果胶含量的上升和果胶甲酯酶活性的增加(图3),说明H2S通过提高细胞壁磷的释放来增加体内的有效磷含量。H2S清除剂亚牛磺酸的添加试验进一步证明,H2S确实可以通过增加细胞壁中果胶含量以及提高细胞壁果胶甲酯酶的活性来提高对细胞壁磷的释放(图6)。
水稻体内的磷转运子不仅负责水稻根系对外界磷的吸收,还与水稻体内磷的转运密切相关。前人的研究发现,水稻体内磷转运子OsPT2、OsPT6以及OsPT8主要负责水稻体内磷的转运[37-38]。对2和6基因的研究发现,当在水稻中敲除2或6基因后,水稻根部向地上部磷的运输显著减少,说明这两个基因转录翻译的磷转运蛋白负责水稻体内磷从根系往地上部的运输[38]。当敲除8基因后,无论在低磷还是高磷条件下,水稻体内的磷含量以及植物生长均显著减少和降低,并且伴随着在花序中磷含量的增加和在空籽粒中磷含量的减少,暗示8在调控水稻体内磷平衡过程中起重要作用[37]。在本次试验中发现,在缺磷条件下,在营养液中添加H2S的供体NaHS后,水稻根中6和8基因的表达均显著高于单纯的缺磷条件(图4),说明H2S通过调控这两个基因的表达来促使水稻体内磷从根部往地上部的运输以及调节体内磷的平衡。
4 结论
缺磷条件下,信号分子H2S通过增加水稻细胞壁中果胶的含量以及果胶甲酯酶的活性来促进水稻细胞壁磷的释放,从而增加水稻体内的有效磷含量;并且通过调控磷转运子6和8基因的表达来促进水稻体内磷的运输以及调节水稻体内磷的平衡。
[1] Marschner, H. Mineral Nutrition of Higher Plants (2nded.)[M]. London: 1995
[2] Vance C P, Uhde-Stone C, Allan D L. Phosphorus acquisition and use: Critical adaptations by plants for securing a nonrenewable resource[J]. New Phytologist, 2003, 157(3): 423–447
[3] Raghothama, K. Phosphate acquisition[J]. Annual Review of Plant Biology, 1999, 50(1): 665–693
[4] Gong Y, Guo Z, He L, et al. Identification of maize genotypes with high tolerance or sensitivity to phosphorus deficiency[J]. Journal of Plant Nutrition, 2011, 34(9): 1290–1302
[5] 李继云, 李振声. 有效利用土壤营养元素的作物育种新技术研究[J]. 中国科学: B辑, 1995, 25(1): 41–48
[6] Bieleski, R. Phosphate pools, phosphate transport, and phosphate availability[J]. Annual Review of Plant Physiology, 1973, 24(1): 225–252
[7] Tiessen H. Phosphorus in the global environment, in The ecophysiology of plant-phosphorus interactions[M]. Netherlands: Springer, 2008: 1–7
[8] 江尚焘, 王火焰, 周健民, 等. 磷肥施用对水稻生长和磷素吸收的影响[J]. 土壤, 2016. 48(6): 1085–1091
[9] 王火焰, 周健民. 根区施肥——提高肥料养分利用率和减少面源污染的关键和必需措施[J]. 土壤, 2013, 45(5): 785–790
[10] Forde B, Lorenzo H. The nutritional control of root development[J]. Plant and Soil, 2001, 232(1/2): 51–68
[11] Ericsson T. Growth and shoot: root ratio of seedlings in relation to nutrient availability, in Nutrient uptake and cycling in forest ecosystems[M]. Netherlands: Springer, 1995: 205–214
[12] Steingrobe B, Schmid H, Claassen N. Root production and root mortality of winter barley and its implication with regard to phosphate acquisition[J]. Plant and Soil, 2001, 237(2): 239–248
[13] Keerthisinghe G, Hocking P, Ryan P, et al. Effect of phosphorus supply on the formation and function of proteoid roots of white lupin (L.)[J]. Plant, Cell & Environment, 1998, 21(5): 467–478
[14] Lynch J P, Brown K M. Topsoil foraging–an architectural adaptation of plants to low phosphorus Availability[J]. Plant and Soil, 2001, 237(2): 225–237
[15] Brundrett M C. Coevolution of roots and mycorrhizas of land plants[J]. New Phytologist, 2002, 154(2): 275–304
[16] Hinsinger P. Bioavailability of soil inorganic P in the rhizosphere as affected by root-induced chemical changes: A review[J]. Plant and Soil, 2001, 237(2): 173–195
[17] Ae N, Arihara J, Okada K, et al. Phosphorus uptake by pigeon pea and its role in cropping systems of the Indian subcontinent[J]. Science, 1990, 248(4954): 477–480
[18] 孙婷婷, 陈晏, 樊剑波, 等. 土壤悬液培养法研究长期施肥下花生根际解磷菌溶磷特性[J]. 土壤学报, 2017, 54(1): 227–236
[19] 梅新兰, 闪安琪, 蒋益, 等. 适应玉米的溶磷细菌筛选及其对玉米生长的影响[J]. 土壤学报, 2016, 53(2): 502– 509
[20] Zhu X F, Lei G J, Wang Z W, et al. Coordination between apoplastic and symplastic detoxification confers plant aluminum resistance[J]. Plant Physiology, 2013, 162(4): 1947–1955
[21] Zhu X F, Wang Z W, Dong F, et al. Exogenous auxin alleviates cadmium toxicity inby stimulating synthesis of hemicellulose 1 and increasing the cadmium fixation capacity of root cell walls[J]. Journal of Hazardous Materials, 2013, 263: 398–403
[22] Xiong J, An L, Lu H, et al. Exogenous nitric oxide enhances cadmium tolerance of rice by increasing pectin and hemicellulose contents in root cell wall[J]. Planta, 2009, 230(4): 755–765
[23] Zhu X F, Wang Z W, Wan J X, et al. Pectin enhances rice () root phosphorus remobilization[J]. Journal of Experimental Botany, 2015, 66(3): 1017–1024
[24] García-Mata C, Lamattina L. Hydrogen sulphide, a novel gasotransmitter involved in guard cell signalling[J]. New Phytologist, 2010, 188(4): 977–984
[25] Lisjak M, Srivastava N, Teklic T, et al. A novel hydrogen sulfide donor causes stomatal opening and reduces nitric oxide accumulation. Plant Physiology and Biochemistry, 2010, 48(12): 931–935
[26] García-Mata C, Lamattina L. Hydrogen sulphide, a novel gasotransmitter involved in guard cell signalling[J]. New Phytologist, 2010, 188(4): 977–984
[27] Wang B L, Shi L, Li Y X , et al. Boron toxicity is alleviated by hydrogen sulfide in cucumber (L.) seedlings[J]. Planta, 2010, 231(6): 1301–1309
[28] Li L, Wang Y, Shen W. Roles of hydrogen sulfide and nitric oxide in the alleviation of cadmium-induced oxidative damage in alfalfa seedling roots[J]. Biometals, 2012, 25(3): 617–631
[29] Zhang H, Ye Y K, Wang S H, et al. Hydrogen sulfide counteracts chlorophyll loss in sweetpotato seedling leaves and alleviates oxidative damage against osmotic stress[J]. Plant Growth Regulation, 2009, 58(3): 243–250
[30] Zhu J K. Plant salt tolerance[J]. Trends in Plant Science, 2001, 6(2): 66–71
[31] Zheng L, Huang F, Narsai R, et al. Physiological and transcriptome analysis of iron and phosphorus interaction in rice seedlings[J]. Plant Physiology, 2009,151(1): 262– 274
[32] Zhong H, Lauchli A. Changes of cell wall composition and polymer size in primary roots of cotton seedlings under high salinity[J]. Journal of Experimental Botany, 1993, 44(4): 773–778
[33] Yang J L, Zhu X F, Peng Y X, et al. Cell wall hemicellulose contributes significantly to aluminum adsorption and root growth in Arabidopsis[J]. Plant Physiology, 2011, 155(4): 1885–1892
[34] Blumenkrantz N, Asboe-Hansen G. New method for quantitative determination of uronic acids[J]. Analytical Biochemistry, 1973, 54(2): 484–489
[35] Zhu X F, Shi Y Z, Lei G J, et al. XTH31, encoding an in vitro XEH/XET-active enzyme, regulates aluminum sensitivity by modulating in vivo XET action, cell wall xyloglucan content, and aluminum binding capacity in Arabidopsis[J]. The Plant Cell, 2012, 24(11): 4731–4747
[36] Li Z G, Yang S Z, Long W B, et al. Hydrogen sulphide may be a novel downstream signal molecule in nitric oxide-induced heat tolerance of maize (L.) seedlings[J]. Plant, Cell & Environment, 2013, 36(8): 1564–1572
[37] Jia H, Ren H, Gu M, et al. The phosphate transporter gene OsPht1; 8 is involved in phosphate homeostasis in rice[J]. Plant Physiology, 2011, 156(3): 1164–1175
[38] Ai P, Sun S, Zhao J, et al. Two rice phosphate transporters, OsPht1; 2 and OsPht1; 6, have different functions and kinetic properties in uptake and translocation[J]. The Plant Journal, 2009, 57(5): 798–809
[39] Ae N, Otani T, Makino T, et al. Role of cell wall of groundnut roots in solubilizing sparingly soluble phosphorus in soil[J]. Plant and Soil, 1996, 186(2): 197–204
[40] Ae N, Shen R F. Root cell-wall properties are proposed to contribute to phosphorus (P) mobilization by groundnut and pigeonpea[J]. Plant and Soil, 2002, 245(1): 95–103
[41] Zhu X F, Zhu C Q, Zhao X S, et al. Ethylene is involved in root phosphorus remobilization in rice () by regulating cell-wall pectin and enhancing phosphate translocation to shoots[J]. Annals of Botany, 2016, 118(4): 645–653
[42] Zhu C Q, Zhu X F, Hu A Y, et al. Differential effects of nitrogen forms on cell wall phosphorus remobilization are mediated by nitric oxide, pectin content and phosphate transporter expression[J]. Plant Physiology, 2016, 171(2): 1407
[43] Micheli F. Pectin methylesterases: Cell wall enzymes with important roles in plant physiology[J]. Trends in Plant Science, 2001, 6(9): 414–419
Hydrogen Sulfide Promote Rice () Cell Wall P Remobilization Under P Starvation Condition
ZHU Chunquan1,2, ZHU Xiaofang1, SHEN Renfang1*
(1 State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China; 2 University of Chinese Academy of Sciences, Beijing 100049, China)
Exogenous addition of 10 nmol/L H2S donor NaHS significantly increased available P content in rice under P starvation condition. Further study demonstrated that H2S positively stimulated the increase of pectin content, accompanied with the enhancement of pectin methylesterase (PME) activity, then increased the cell wall P release, finally helped rice to survive underno P condition. What’s more, the addition of H2S scavenger hypotaurine (HP) further emphasized the important roles of H2S in rice root cell wall P release. In addition, H2S stimulated the expressions of phosphate transporter genes6and8 which are involved in the transport of soluble P from root to shoot.
Signal molecular; H2S; Cell wall; Pectin; Pectin methylesterase (PME); Phosphate transporter gene
国家重点基础研究发展计划(973计划)项目(2014CB441000)和中国科学院战略性先导科技专项(XDB15030302,XDB15030202)资助。
(rfshen@issas.ac.cn)
朱春权(1987—),男,浙江嘉兴人,博士研究生,研究方向为缺磷条件下植物根系细胞壁磷的再利用。E-mail:cqzhu@issas.ac.cn
10.13758/j.cnki.tr.2018.01.007
Q945.12
A

