人工发酵剂混合发酵对香肠安全品质指标变化的影响
李 佳,刘忠义 ,陈 虞 ,罗鑫坪,杨 慧 ,李 平
(1.湘潭大学化工学院,湖南湘潭 411105;2.广西高校北部湾特色海产品资源开发与高值化利用重点实验室(钦州学院),广西钦州 535000)
现在国家出台各种安全标准和安全体系(如HACCP)用于监督食品行业的食品安全问题,但每年依然有许多关于食物中毒和食源性疾病散发的报道,发展新技术来控制食品中有害菌的生长是解决这些问题的方法之一。发酵香肠是将绞碎的肉加入一定比例腌制剂,经腌制和发酵后,得到成熟的、具有独特风味的高营养肉制品。我国发酵肉制品历史悠久,传统自然发酵香肠的微生物主要来源于原材料及加工环境,这种情况下的微生物种类复杂不一,除了所需的有益于香肠发酵的微生物以外,还有很多是产生有害作用的杂菌,这导致产品品质不稳定,易引发腐败变质且货架期不长[1]。
亚硝酸盐是肉制品加工业中广泛使用的防腐剂,它的来源受环境的影响,主要有温度、空气、日光、微生物等,现实加工过程中主要来源于人工添加,在人体内日益富集的亚硝酸盐会引起食物中毒甚至对人体有致癌危害[2]。因此,在不影响发色、风味情况下,寻找一种不添加亚硝酸盐且风味与安全性俱佳的方法至关重要。有研究表明,经过人工驯化的乳酸菌产生的乳酸菌菌素能降解亚硝酸盐,从而阻止亚硝胺的生成,提高产品的安全性[3]。还有关于混合菌种在鱼肉制品安全性的研究报道,证实混合菌种发酵有利于保证和改善发酵鱼肉的卫生品质,混合菌种主要由乳酸菌和酵母组成,并验证了这些菌种的组成比例[4-7]。然而,这些研究很少涉及接种发酵对肉制品亚硝酸盐含量及水分活度的影响,同时所用菌种都是实验室扩大培养,而现在生产上大量使用直用型菌种,所以也有必要研究直用型菌种对香肠等肉制品的安全品质的影响。
在前期的研究中,依据文献报道和试验,验证了在香肠中添加质量分数0.08%(W/W)乳酸菌和质量分数0.04%酵母进行混合发酵,可以得到风味品质俱佳的发酵香肠。基于乳酸菌在生产安全优质食品中所起重要作用的生物学机理,研究混合菌种对香肠安全性的影响,以期利用混合菌种发酵加强其安全性和延长其贮藏期。
1 材料与方法
1.1 材料与仪器
(1)原料。新鲜猪肉,湘潭大学购物中心提供,屠宰后1~3 h,于-2~4℃条件下冷藏的新鲜猪前腿肉;腌制剂包括食盐、味精、胡椒粉、姜粉、五香粉、白砂糖、红曲粉、磷酸盐、酱油、黄酒,均由湘潭大学购物中心提供;乳酸菌发酵剂,由北京川秀科技有限公司提供;酵母,安琪酵母股份有限公司提供;肠衣,谭氏百盛电子商务有限公司提供。
(2)试剂。组胺、腐胺、酪胺、精胺、亚精胺标准品,Sigma化学试剂公司提供;1,7-二氨基庚烷、丹衡酰氯,Applichen公司提供;醋酸铵、甲醇、丙酮、乙腈,为色谱纯,西陇科学股份有限公司提供;亚硝酸钠、对氨基苯磺酸、盐酸萘乙二胺分析纯,天津市科密欧化学试剂有限公司提供;MRS培养基、PCA培养基、孟加拉红培养基、VRBA、BGLB肉汤,生化试剂,上海盛思生化科技有限公司提供。
(3)仪器。PTX-FA-110型电子分析天平,上海精密科学仪器有限公司产品;PHS-3BW型数显酸度计,上海般特仪器制造有限公司产品;Cary60型紫外分光光度计,安捷伦科技有限公司产品;HH-4型恒温水浴锅,上海申生科技有限公司产品;半微量定氮器,上海昕沪实验设备有限公司产品;酸式滴定管,铭泰科教仪器设备有限公司产品;LC-20A型高效液相色谱,日本岛津公司产品;TG18G型高速台式离心机,湖南凯达科学仪器公司产品;FN 101-2型电热鼓风干燥箱,长沙仪器仪表厂产品;YXQ-SG46-280S型手提式灭菌锅,上海医用仪器有限公司产品;SCW-CJ-1F型垂直流洁净工作台,苏州市长春电子仪器厂产品;SPX-250B-D型恒温培养箱,上海跃进医疗器械厂产品。
1.2 试验方法
试验过程中发现12 h以后感官上味道已经太酸,并且微生物表现出大量增长的趋势,所以分析时间选择在12 h以内。
1.2.1 发酵香肠的制备工艺
根据香肠基本配方略作修改[8],主要操作如下:①绞肉:新鲜猪肉分肥、瘦肉清洗干净后,分别绞碎成肉糜;②腌制剂:2.0%食盐(以肉总量百分比计)、0.2%味精、0.3%胡椒粉、0.2%姜粉、0.2%五香粉、2.4%白砂糖、0.1%红曲粉、0.1%磷酸盐、0.8%酱油、2.4%黄酒;③腌制:瘦肉中加入准备好的腌制剂,在2℃冷藏柜腌制18 h;④灌肠:将瘦肥肉按照5∶3比例混合,发酵剂组中加入0.08%(以肉总量百分比计)的乳酸菌和0.04%的酵母菌后灌肠,对照组则不添加混合发酵剂,由于发酵12 h后感官上太酸并结合微生物的数量变化,故将2组在32±1℃下发酵12 h;⑤干燥:将发酵完毕的香肠移入70℃的烘烤室加热2 h。分别在0,3,6,9,12 h取样对微生物、pH值、水分活度、亚硝酸盐、挥发性盐基氮、生物胺进行测定。
1.2.2 pH值的测定
取5.0 g样品加入20 mL去离子水(pH值为7.0)匀浆并振荡30 min,然后再用数显酸度计测定pH值[7]。
1.2.3 水分活度测定方法
根据GB/T 23490—2009肉与肉制品水分活度测定(方法二)。
1.2.4 亚硝酸盐测定方法
根据GB 5009.33—2010食品中亚硝酸盐与硝酸盐的测定(方法二)。
1.2.5 挥发性盐基氮测定方法
根据GB/T 5009.44—2003肉与肉制品卫生标准的分析方法(半微量定氮法)。
1.2.6 生物胺测定方法
根据文献[7]中的生物胺检测方法进行测定。
(1) 样品预处理。取2.0 g样品置于50 mL洁净透明的离心管,加入10 mL现配置的浓度为0.4 mol/L高氯酸,用漩涡混合器混合均匀,静置数分钟后于转速 3 000 r/min下离心15 min,过滤并收集上清液于25 mL容量瓶中,离心管中的沉淀物按上述提取方法重复提取,合并提取液,加入质量分数为100 mg/L的1,7二氨基庚烷溶液(内标) 20 μL,用0.4 mol/L高氯酸定容至刻度。
(2) 样品衍生。衍生方法参见文献[7]。取1.0 mL样品处理液或生物胺混标液,加入浓度为2.0 mol/L的氢氧化钠溶液200 μL调节pH值至11,加入300 μL配置好的饱和碳酸氢钠和2.0 mL的10 mg/mL的丹磺酰氯,于40℃的条件下反应45 min,反应完毕加入25%的浓氨水100 μL,避光静置30 min;用乙腈定容至5 mL,振荡混匀,用0.22 μm有机相针式滤膜过滤后,供液相色谱使用。
(3)标准曲线的绘制。分别移取0.5 mL生物胺标准系列溶液,同样品处理方法后,经HPLC分析,以峰面积内标法定量,根据生物胺质量浓度为横坐标、生物胺与内标峰面积比为纵坐标制作标准曲线,得到回归方程及其相关系数R2。样品处理后根据标准曲线得到样品中生物胺的含量。
(4) 色谱条件。色谱柱为C18反相色谱柱;流动相:A为0.1 mol/L乙酸铵,B为乙腈;柱温40℃;进样量为20μL;流速为1mL/min,检测波长为254nm。
1.2.7 乳酸菌、菌落总数、大肠菌群、酵母菌和霉菌的测定
分别按照GB 4789.35—2016食品微生物学检验乳酸菌检验、GB 4789.2—2010食品菌落总数测定、GB4789.3—2010食品大肠菌群计数(方法二)、GB 4789.15—2010食品霉菌和酵母计数(方法二)执行。
1.2.8 数据处理
每个数据重复处理3次。用SPSS statistix 16.0软件One-way ANOVA程序进行均值计算及均值之间的差异性比较,数值以均值±标准差表示,p<0.05即表示差异显著。采用正版Origin 8.5软件作图。
2 结果与讨论
2.1 发酵过程中微生物变化
2.1.1 发酵过程中乳酸菌、酵母菌数量的变化
乳酸菌代谢碳水化合物产生乳酸,降低肉制品的酸度,抑制病原微生物的生长,减少腐败,并且有利于风味物质的形成。
发酵过程中发酵剂组与对照组乳酸菌变化趋势见图1。

图1 发酵过程中发酵剂组与对照组乳酸菌变化趋势
由图1可知,发酵前3 h发酵剂组乳酸菌处于停滞期,从而乳酸菌数量增长比较平缓,而后开始快速增长,数量从发酵3 h的5.11±0.08 lg CFU/g达到发酵9 h的5.93±0.35 lg CFU/g,9 h后乳酸菌数量增长速度趋于平缓,这是由于发酵过程中Aw值的降低和乳酸菌自身产生的乳酸对自身的繁殖也有一定的抑制;而对照组的乳酸菌经过前3 h发酵后也开始大量繁殖,香肠中的厌氧环境使得原料中本身存在的乳酸菌在营养充足的环境中历经一个自然筛选富集过程,数量也得到大量的增长。
接种的乳酸菌能在发酵前期快速生长繁殖为优势菌,逐渐耗尽肉肠中残存的氧,形成一个厌氧环境,在发酵前期抑制其他微生物的生长繁殖。
发酵过程中发酵剂组与对照组酵母菌变化趋势见图2。
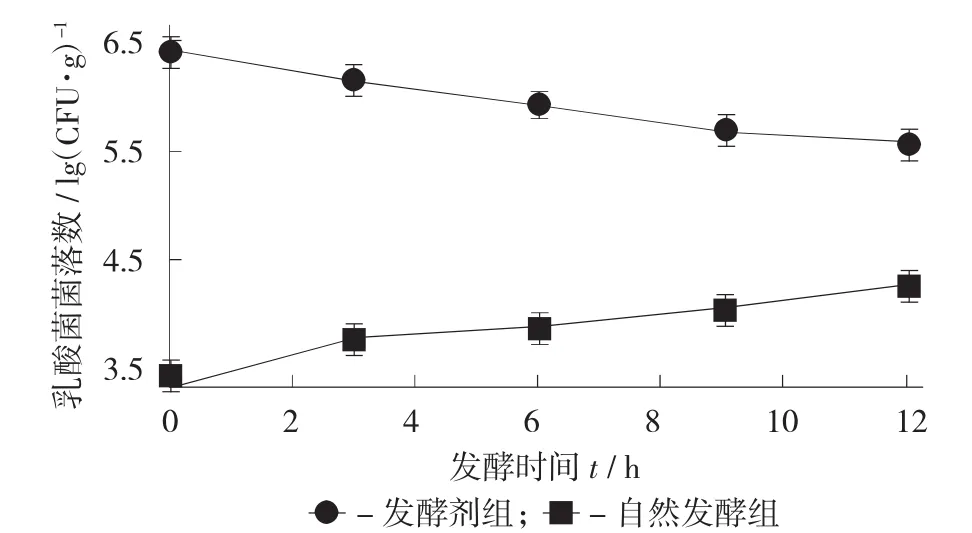
图2 发酵过程中发酵剂组与对照组酵母菌变化趋势
由图2可知,发酵剂组酵母菌数量从发酵开始一直处于下降趋势,其数量从开始的6.39±0.03 lg CFU/g降至发酵结束时的5.61±0.02 lg CFU/g,而对照组却处于增长的趋势,由于前期水分含量高,营养充足,使得在前3 h增速最快,随后增长速率变缓,从最初3.50±0.02 lg CFU/g增加到发酵结束时的4.37±0.03 lg CFU/g。发酵剂组中酵母菌的生长趋势可能与优势菌乳酸菌拮抗作用有关,乳酸菌对酵母菌的抑制作用主要表现在乳酸菌产生的化合物,如苯乳酸、4-羟基-苯乳酸、环肽抑制了酵母菌的生长[9]。
2.1.2 发酵过程中大肠菌群、菌落总数变化
大肠菌群是国内外通用的食品污染指示菌之一,食品中检出大肠菌群,提示加工贮藏环境卫生条件需要改进,以及具有被致病菌污染的可能性。
发酵过程中发酵剂组与对照组大肠菌群的变化趋势见图3。

图3 发酵过程中发酵剂组与对照组大肠菌群的变化趋势
由图3可知,发酵剂组和对照组的大肠菌群含量均呈增加趋势,发酵前6 h 2组含量无显著性差异(p>0.05),6 h开始,对照组大肠菌群增加速度显著快于发酵剂组,并在发酵结束时对照组大肠菌群含量超出发酵剂组1个对数周期以上。随着发酵时间的延长,对照组中腐败菌大量繁殖,对产品本身的品质产生不利的作用,使产品颜色暗淡。上述结果表明,接种了混合菌种的发酵过程很显著地抑制了大肠菌群的生长繁殖,增强了产品的品质和抵抗杂菌的污染。
菌落总数是评估食品清洁度的微生物指标,反映食品在生产过程中是否符合卫生要求。
发酵过程中发酵剂组与对照组菌落总数的变化趋势见图4。

图4 发酵过程中发酵剂组与对照组菌落总数的变化趋势
由图4可知,对照组的菌落总数在9 h之前增长速率大于发酵剂组,发酵剂组从发酵初始的6.12±0.02 lg CFU/g增加到发酵结束的7.45±0.06 lg CFU/g,而对照组由于随着内源微生物大量繁殖,从发酵初始阶段的4.44±0.06 lg CFU/g增长到9 h时6.55±0.22 lg CFU/g,在9 h之后2组无显著性差异(p>0.05)。由此可知,在相同卫生标准情况下,添加混合菌种发酵能抑制杂菌的增长。有研究者指出乳酸菌产生的细菌素在抑菌中可能同样扮演了重要角色,特别是在那些微酸化的肉制品中[3]。
显然,人工接种乳酸菌和酵母菌,在一定的发酵时间内,抑制了其他微生物的生长繁殖,尤其是抑制了大肠菌群的生长繁殖,降低了发酵香肠的pH值,这与发酵香肠的亚硝酸盐、TVB-N及生物胺等有害物质的含量降低是明显相关的。
2.2 发酵过程中pH值、水分活度的变化
发酵过程中pH值随时间变化趋势见图5,发酵过程中Aw值随时间变化趋势见图6。

图5 发酵过程中pH值随时间变化趋势

图6 发酵过程中Aw值随时间变化趋势
绝大多数腐败细菌最适生长pH值一般是中性或者略微偏碱性,偏离最适生长pH值不利于细菌生 长[10]。由图5可知,在发酵过程前3 h发酵剂组和对照组pH值均略有上升,分别升到5.97±0.02及6.01±0.02,发酵剂组在3 h后开始下降,对照组pH值在3 h后继续上升,在发酵9 h后开始略有下降,至发酵结束时分别降至5.71±0.02与6.00±0.03,整个发酵过程中发酵剂组的pH值下降幅度较对照组大(p≤0.05)。在其他一些肉类发酵研究中[7-8],pH值从发酵一开始就下降,而试验中发酵前期pH值略微上升,可能是由于原料的差异、菌种的差异和其他因素的不同,也可能是发酵初始蛋白质代谢高于糖类代谢,产生的碱性物质使得pH值略上升,且发酵前期乳酸菌处于适应期,使得产酸效果不明显的原因。发酵3 h后,发酵剂组乳酸菌大量繁殖产酸,使得pH值开始下降,对照组发酵后期pH值也缓慢下降,说明对照组存在自然乳酸菌发酵,但其需要经过一个自然筛选富集的过程,因此在发酵9 h后香肠的pH值才开始下降,且其下降速度要低于发酵剂组。
水分活度与微生物生长密切相关,低水分活度可抑制微生物生长。由图6可知,发酵过程中,对照组水分活度略低于发酵剂组,都在适合微生物生长的范围内,且二者之间没有显著差别。有研究表明,发酵过程中pH值与水分活度具有一定的线性关系[6],而本试验中分析得到pH值(Y) 与水分活度(X) 线性关系较差 (Y=49.71X-38.94,R2=0.768),可能与发酵菌种及发酵条件有关。
2.3 发酵过程亚硝酸盐、挥发性盐基氮的变化
发酵过程中发酵剂组与对照组亚硝酸盐变化趋势见图7。

图7 发酵过程中发酵剂组与对照组亚硝酸盐变化趋势
由图7可知,发酵前6 h发酵剂组和对照组香肠的亚硝酸盐含量差异不显著(p>0.05),到6 h发酵剂组及对照组分别达到0.71±0 mg/kg和0.69±0.11 mg/kg,6 h后对照组亚硝酸盐含量增长速度越来越大,并且始终大于发酵剂组,发酵12 h后,发酵剂组亚硝酸盐含量达到1.57±0 mg/kg,远低于亚硝酸盐在肉制品中的最终残留量不得超过30 mg/kg的标准[11],而对照组则为2.26±0 mg/kg,显然,接种混合发酵剂对降低亚硝酸盐含量具有明显的效果。有文献表示[4-5,7],发酵过程中,以乳酸菌为优势菌种的厌氧环境中,有害微生物生长受到抑制,从而减少硝酸盐转化为亚硝酸盐。另外有文献指出,乳酸菌对亚硝酸盐的降解与pH值有一定的关系,pH值>4.5时,乳酸菌对亚硝酸盐降解以酶降解为主,并且其降解能力与pH值呈现负相关[12],这与本试验具有一定的相似性,随着pH值的变化,发酵剂组亚硝酸盐呈现先降低后缓慢增加再快速增加的趋势。
发酵过程中发酵剂组与对照组TVB-N含量变化趋势见图8。
挥发性盐基氮反映的是食品中蛋白质的降解程度,产生氨用胺类等碱性含氮物质,是评价肉制品新鲜度的常用指标,过量会导致人体中毒[4-5]。由图8可知,整个发酵进程中对照组TVB-N含量始终高于发酵剂组,发酵6 h后发酵剂组TVB-N含量略有降低,而对照组TVB-N含量一直处于上升中,发酵至12 h后,发酵剂组TVB-N含量为2.59±0.06 mg/100 g,远低于国家标准鲜畜肉中TVB-N含量最低限量15 mg/100 g(GB 2707—2016),而对照组TVB-N含量却达到了6.70±0.22 mg/100 g,说明混合菌种发酵能有效减少有害物质的产生,这可能是由于发酵剂组在9 h内优势菌乳酸菌极大抑制了腐败菌的生长,部分胺类挥发和酸性环境对降解出的碱性物质有一定的中和[13]。有文献表示[14],胺类能进入细胞内与糖代谢中产生的有机酸反应生成氨基酸,故可能是由于乳酸菌代谢旺盛而使发酵剂组TVB-N含量在发酵后期开始下降,导致TVB-N含量较对照组更早开始减少。

图8 发酵过程中发酵剂组与对照组TVB-N含量变化趋势
此外,图2表明发酵剂组的酵母菌数始终高于对照组,酵母菌的存在与产品的风味有关,能为产品带来期望的香气和风味[1]。与图8的结果对照,证实酵母菌确实大幅度降低了TVB-N含量,这显然有利于改善发酵香肠的风味。
2.4 发酵过程中生物胺的变化
生物胺能与亚硝酸盐生成致癌物N-亚硝胺,同时被认为是食品腐败的标志[15]。
发酵过程发酵剂组与对照组生物胺变化见表1。
由表1可知,发酵前6 h发酵剂组PU、HI,TY,SD含量增加,随后开始减少,发酵前3 h,SM含量增加后开始减少,并且发酵结束时PU,TY含量接近于初始发酵含量。而在对照组中,5种生物胺全都呈现增加的趋势,到发酵结束,HI,TY,SD,SM含量达到发酵剂组的数倍;并且在发酵过程中,发酵剂组5种生物胺含量与对照组具有显著差异性(p<0.05)。胺的形成依赖于具有脱羧酶活性细菌的数量,优势菌发酵剂能抑制有氨基酸脱羧酶阳性细菌的生长[16]。另外,pH值是影响氨基酸脱羧酶活性的重要因素[17],有研究已证实香肠中生物胺的产生和由乳酸发酵造成pH值的降低之间具有相关性[17],发酵剂组中pH值的降低,使具有氨基酸脱羧酶活性的微生物生长得到抑制,从而有效地降低生物胺的积累。到发酵12 h以后,发酵剂组5种生物胺含量为11.80±0.18 mg/100 g,而对照组生物胺含量达到32.27±0.23 mg/100 g,根据试验可以得出,添加混合发酵剂相对传统发酵可以使5种生物胺总量减少63.4%,从而使得产品具有更高的安全性。

表1 发酵过程发酵剂组与对照组生物胺变化/mg·(100 g)-1
3 结论
试验证明,选择接种乳酸菌和酵母菌混合发酵香肠,能加速乳酸菌群等益生菌的生长繁殖,很大程度上抑制腐败菌的生长。混合菌种发酵过程中亚硝酸盐、TVB-N、生物胺含量均低于不添加发酵剂的自然发酵过程,说明混合菌种发酵能有效减少有害物质的产生,改善产品的质量和安全性,保障质量稳定。乳酸菌作为抑菌剂的优势是避免了致癌物亚硝酸盐在肉类加工中的普遍使用,可以减少亚硝酸盐对身体的危害。
参考文献:
[1]曹利群.发酵肉制品中微生物的作用 [J].肉类研究,2008(7):27-29.
[2]张慧,王东,林春艳.亚硝酸盐在肉制品中的危害及红曲色素的研究进展 [J].中国畜牧兽医文摘,2014(8):182.
[3]陈其钢,温明显.利用乳酸菌生产传统发酵食品研究进展 [J].农产品加工(学刊),2013(18):50-53.
[4]Liu Zhongyi,Li Zhonghai,Zhang Miaoling,et al.Effect of fermentation with mixed starter cultures on biogenic amines in bighead carp surimi[J].International Journal of Food Science&Technology,2010,45 (5):930-936.
[5]Liu Zhongyi,Li Zhonghai,Zhong Pengpeng,et al.Improvement of the quality and abatement of the biogenic amines of grass carp muscles by fermentation using mixed cultures[J].Journal of the Science of Food&Agriculture,2010(4):586-589.
[6]Hu Y,Xia W,Ge C.Effect of mixed starter cultures fermentation on the characteristics of silver carp sausages[J].World Journal of Microbiology and Biotechnology,2007,23 (7):1 021-1 031.
[7]谢诚,刘忠义,周宇峰,等.混合菌种发酵对草鱼肉微生物和生物胺变化的影响 [J].西北农林科技大学学报(自然科学版),2010(3):167-172.
[8]夏文水.食品工艺学 [M].北京:中国轻工业出版社,2013:319-322.
[9]Dennis P,Bayrock W.Michael ingledew inhibition of yeasty by lacteria in continuous culture:nutrient depletion and/or acid toxicity[J].Journal of Industrial Microbiology&Biotechnology,2004 (4):362-368.
[10]朱迎春,杜智慧,马俪珍,等.发酵剂对发酵香肠微生物及理化特性的影响 [J].现代食品科技,2015,31(9):198-204.
[11]王德宝,王佩霞,赵丽华,等.复合发酵剂对羊肉发酵香肠亚硝酸盐残留量和品质的影响 [J].食品工业科技,2015,36(8):206-209.
[12]谢诚,刘忠义,周宇峰,等.混合菌种发酵对草鱼肉微生物和生物胺变化的影响 [J].西北农林科技大学学报(自然科学版),2010(3):167-172.
[13]苏肖晶,李文涛,陈萍,等.高效降解亚硝酸盐乳酸菌冻干剂的制备及其降解特性研究 [J].农产品加工(学刊),2014(7):16-18.
[14]窦晓明,孙高英,张佳程.酸奶中挥发性盐基氮的菌株效应分析 [J].食品科技,2009(5):37-39.
[15]Mart n-S Nchez A M,Chaves-l Pez C, Sendra E,et al.Lipolysis,proteolysis and sensory characteristics of a Spanish fermented dry-cured meat product(salchichón)with oregano essential oil used as surface mold inhibitor[J].Meat Science,2011 (1):35-44.
[16]王长远,王云光,于长青,等.产生物胺乳酸菌的检测及产生物胺量的测定 [J].农产品加工(学刊),2010(1):22-25.
[17]王翔,卢士玲,徐幸莲,等.发酵肉制品中生物胺的形成及影响因素研究进展 [J].食品与发酵工业,2010(11):133-136.◇

