精喹禾灵降解菌株Bacillus subtilis H的分离鉴定及降解特性
侯 颖,李静泉,尤晓颜,王维宇,裴 韬,孙军杰 (内蒙古大学生态与环境学院,内蒙古自治区环境污染控制与废物资源化重点实验室,内蒙古 呼和浩特 000;河南科技大学食品与生物工程学院,河南 洛阳4703)
精喹禾灵,化学名称(R)-2-[4-(6-氯喹喔啉-2-基氧)苯氧基]丙酸乙酯,属芳氧苯氧丙酸类,内吸传导型选择性茎叶处理除草剂,其作用机制是抑制禾本科植物分生组织的细胞脂肪酸合成[1].随着精喹禾灵毒理研究的开展,越来越多的报道显示,精喹禾灵对植物、动物及人类安全产生了严重影响.有研究表明:精喹禾灵对植物具有一定的遗传毒性和基因毒性[2-3];对动物除具有急性毒性以外[4-5],还具有较强的慢性毒性和生殖毒性,如精喹禾灵可引起斑马鱼心脏畸形[5],诱导人淤胆型和肝细胞混合型的肝损伤[6],对大鼠睾丸生精细胞具有损伤作用等[7-8].因此,精喹禾灵在加拿大等国家被限定残留量[9],欧盟甚至禁止其使用[10],但在我国精喹禾灵仍被广泛生产和使用.
土壤微生物对精喹禾灵在土壤环境中的降解发挥着重要作用[11],土壤中微生物越多,精喹禾灵在土壤中降解越快[12],因此利用微生物降解进行精喹禾灵污染的环境修复成为一种非常有效的手段.近年来,已有多种能够降解精喹禾灵的微生物菌株从土壤中分离出来,如 Pseudomonas sp. L1[13]、Bacillus pumilis[14]、Rhodococcus sp.J-3[15]、Rhodococcus sp. JT-3[16]和 Ochrobactrum sp. QE-9[17].此外,在关于其他芳氧苯氧丙酸类除草剂微生物降解的报道中,菌株 Pseudomonas azotoformans QDZ-1[18]、Rhodococcus sp. T1[19]、Acinetobacter sp. DL-2[20]和Rhodococcus ruber JPL-2[21]等对精喹禾灵也有一定的降解能力.本研究以精喹禾灵为唯一碳源,从长期受精喹禾灵污染的土壤中筛选到 1株精喹禾灵降解菌Bacillus subtilis H,并详细研究了该菌株对精喹禾灵的降解特性和降解机制,这是首次关于枯草芽孢杆菌降解精喹禾灵的研究.
关于利用 Bacillus subtilis进行环境污染生物修复的报道已有很多,如Bacillus subtilis能够修复石油污染[22]、降解农药 DDT[23]等.Bacillus subtilis在土壤中广泛存在,生长速度快,抗逆性强并可以分泌多种酶,这些特性使其成为修复环境污染的理想微生物.提过的精喹禾灵样品,于常温常压下挥发至干,加入1mL色谱纯甲醇溶解剩余物,并用0.22µm有机滤膜过滤后利用 HPLC检测.液相色谱条件:4.6mm×250mm C18反相色谱柱;流动相为80%甲醇,流速为 1mL/min,上样量为 10µL,柱温为30℃ .Waters 2487紫外检测器,检测波长为235nm.
1 材料与方法
1.1 土样
江苏省某农药厂长期受精喹禾灵污染的土壤.
1.2 培养基与试剂
LB 培养基(g/L):酵母粉 5.0,胰蛋白胨 10.0,NaCl 10.0,pH值自然.
无机盐培养基(MSM,g/L):NH4NO31.0,KH2PO40.5, K2HPO41.5,NaCl 1.0, MgSO4·7H2O 0.1,pH 7.0.
富集培养基:无机盐培养基中添加 20mg/L酵母汁作为生长因子.
精喹禾灵(94.2%)原药由安徽华星化工有限公司赠送.
1.3 精喹禾灵的检测及降解产物的鉴定
高效液相色谱(HPLC)检测:取 5mL培养液,用10%HCl调节培养液pH值至2.0后,加入等体积二氯甲烷,剧烈震荡 1min,静置 10min,去水相,加无水硫酸钠去除有机相中残余水分.取1mL抽
精喹禾灵降解产物的鉴定采用 UPLC-MS.色谱系统:Waters ACQUITY UPLC M-Class.色谱柱:Acquity BEH C18(2.1mm×50mm,1.7pm);柱温30℃;进样量 5µL;流动相:乙腈-0.1%甲酸(体积比70:30);流速0.2mL/min.
质谱系统:Waters XEVO-TQS micro.离子源ESI,毛细管电压5.0kV,离子源温度120℃,脱溶剂气温度 500℃,锥孔反吹气流量 50L/h,脱溶剂气流量800L/h,锥孔压力30kV,碰撞能量20eV,检测器为XDRTM,m/z扫描范围为50~600,正离子扫描模式.
1.4 精喹禾灵降解菌的富集与分离
在100mL含50mg/L精喹禾灵的富集培养基中加入10g土样,于30℃,180r/min培养7d.按1.3所述方法测定富集液有降解效果后,吸取 10mL富集液转移至新鲜富集培养基中,连续富集.待富集液降解效果稳定后,采用稀释平板法,将稀释后的富集液涂布于含200mg/L精喹禾灵的LB固体培养基上,30℃培养48h后,凡是菌落周围有透明圈的菌株即为要分离的精喹禾灵降解菌.对分离到的菌落形态不同的精喹禾灵降解菌进行划线纯化后,挑取其单菌落接种于含100mg/L精喹禾灵的无机盐培养基中,30℃,180r/min培养,24h后取样测定培养基中精喹禾灵的残留量,选取降解效果最好的菌株H作为进一步研究对象.
1.5 菌株H的初步鉴定
参照《常见细菌系统鉴定手册》[24]对菌株H进行菌落、菌体形态观察和生理生化试验.
菌株 16S rRNA基因序列分析:采用菌落PCR技术扩增降解菌株16S rRNA基因序列.引物为细菌 16S rRNA 基因通用引物 27f:5’-AGAGTTTGATCCTGGCTCAG-3’(Escherichia coli bases 8to 27)和 1492r:5’-TACCTTGTTAC-GACTT-3’(Escherichia coli bases 1507to 1492).扩增反应体系:10×TaqDNA聚合酶反应缓冲液5µL,dNTP(20mmol/µL) 4µL,引物(25pmol/µL)各2µL,Mg2+(25mmol/µL) 4µL,菌体少量,TaqDNA聚合酶(5U/µL) 0.5µL,加灭菌双蒸水至 50µL;反应条件:95℃变性 5min,95 ℃ 30s,55 ℃ 30s,72℃1.5min,30个循环;最后72℃延伸10min.PCR产物经 0.75%的琼脂糖凝胶电泳检测后送往南京金斯瑞生物科技有限公司进行测序.将测定的菌株16S rDNA序列,在NCBI数据库中进行在线比对分析,并在 Ribosomal Database Project(RDP)数据库中下载与降解菌株16S rRNA基因序列同源的序列,最后,采用 MEGA6.0软件构建降解菌株16S rDNA系统发育树.
1.6 菌株H对精喹禾灵的降解
将菌株H在液体LB培养基中进行活化培养12h后,5000r/min离心5min收集菌体,用灭菌的 MSM 培养基洗涤一次后,制成 OD600nm=1.0的种子液.将种子液按 5%接种量接种到含100mg/L精喹禾灵的MSM中,于37℃、180r/min摇床培养,每隔24h取样一次,利用HPLC测定培养液中精喹禾灵的含量,同时采用稀释平板法测定培养液中菌株 H的数量,确定菌株H对精喹禾灵的降解能力及利用精喹禾灵的生长情况.另外,在不同温度(20、25、30、37、42℃)、不同初始 pH 值(5、6、7、8、9、10)、不同精喹禾灵初始浓度(25、50、100、200mg/L)、不同接种量(0.5%、1%、5%和10%)以及添加各种金属离子(0.5mmol/L)条件下测定菌株H对精喹禾灵的降解特性.
2 结果与讨论
2.1 精喹禾灵降解菌的分离与鉴定
利用以精喹禾灵为唯一碳源的富集培养基,从采集的土样中分离到一株精喹禾灵降解菌,命名为菌株 H.该菌株在含精喹禾灵的 LB固体培养基上能形成明显的水解圈(图 1a),其菌落呈污白色,扁平,不透明,边缘不整齐(图 1a).对其菌体进行简单染色后,在显微镜下观察,发现其菌体为长杆状,有芽孢,无荚膜(图1b).生理生化试验结果表明:菌株H的接触酶试验、淀粉水解试验、硝酸盐还原试验、酯酶试验和明胶液化试验均为阳性,V-P试验为阴性.
利用细菌 16S rRNA基因通用引物 27f和1492r对菌株H的16S rRNA基因进行PCR扩增和测序后,将其基因序列提交GenBank,获得其登录号为MF574323.通过BLAST比对,表明菌株H的16S rRNA基因与Bacillus subtilis strain Bs_TC6的16S rRNA基因(登录号:KY575578)相似度最高,达到 100%.利用 RDP数据库的Sequence Match分析和MEGA 6.0构建其系统发育树,如图2所示.结果表明:菌株H与枯草芽孢杆菌模式菌株DSM10(登陆号:AJ276351)位于同一分支,说明二者亲缘关系最近.综合菌株H的形态特征、生理生化特性,将菌株H确定为枯草芽孢杆菌(Bacillus subtilis).2.2 菌株H以精喹禾灵为唯一碳源的降解曲线及降解产物鉴定

图1 菌株H菌落与菌体形态(1000×)Fig.1 Morphology of colony and cell of strain H (1000×)
将菌株 H种子液按 5%接种量接种到含100mg/L精喹禾灵的无机盐培养基中后,定时取样测定精喹禾灵的浓度,并在接种0h和96h利用平板菌落计数法测定培养基中活菌数量,结果如图3所示.由图3可以看出,菌株H具有很强的降解精喹禾灵的能力,在24h即可将100mg/L精喹禾灵降解 70%左右,之后降解速度开始降低,72h以后即可将 100mg/L的精喹禾灵降解 98.94%.菌株 H对精喹禾灵的降解动力学方程为y=111.0868e-0.0505x(r=0.9436,P<0.05).与已报道的其他种属细菌相比,枯草芽孢杆菌H的降解能力较强,如已报道的Pseudomonas属细菌需要4~9d才能将 50mg/L的精喹禾灵降解 90%以上[11].此外枯草芽孢杆菌还具有生长速度快、易培养、对环境适应力强、对人畜安全等特点,使其在环境污染物的生物处理和修复中更具有优势.枯草芽孢杆菌平板菌落计数结果表明,在接种0h和96h后培养液中菌株H的活菌细胞数分别为4.5×107和3.7×108cfu/mL,这说明菌株H能以精喹禾灵为唯一碳源进行生长.

图2 菌株H的系统发育树Fig.2 Phylogenetic tree of strain H
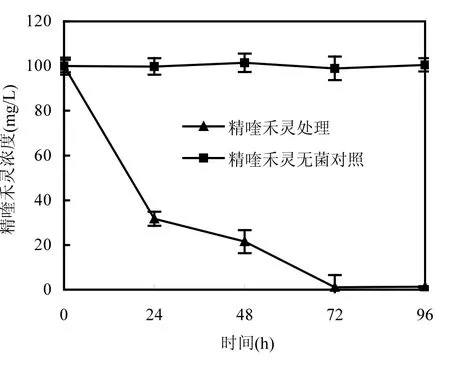
图3 菌株H对精喹禾灵的降解曲线Fig.3 Degradation of quizalofop-p-ethyl by strain H
利用HPLC分析发现,未接种菌株H的对照培养基中仅有一个精喹禾灵的特征峰,其保留时间为13.365min(图4a);而在接种菌株H的培养基中除了有精喹禾灵的特征峰外,还有一个特征峰,其保留时间为 3.678min,并且其浓度随着精喹禾灵浓度的降低而升高,推测其为精喹禾灵的代谢产物(图4b).收集该产物,对其进行UPLC-MS鉴定,发现其 m/z=345,并且该物质可产生m/z=91、121、272和299的碎片离子(图4d),结合精喹禾灵的 UPLC-MS图谱和碎片离子情况(图 4c),推测该代谢产物为精喹禾灵酸.进一步研究表明,菌株H不能降解精喹禾灵酸,即菌株H是通过断裂精喹禾灵分子中丙酸和乙醇之间的酯键使其降解的,这与菌株H酯酶试验为阳性相吻合.关于微生物降解芳氧苯氧丙酸类除草剂的报道中,大多数菌株是通过分泌酯酶使除草剂酯键断裂形成相应的酸[17-21];而此类除草剂完全矿化往往需要多种微生物的共同作用[16,25],因此还需进一步分离和筛选完全降解精喹禾灵的菌株.
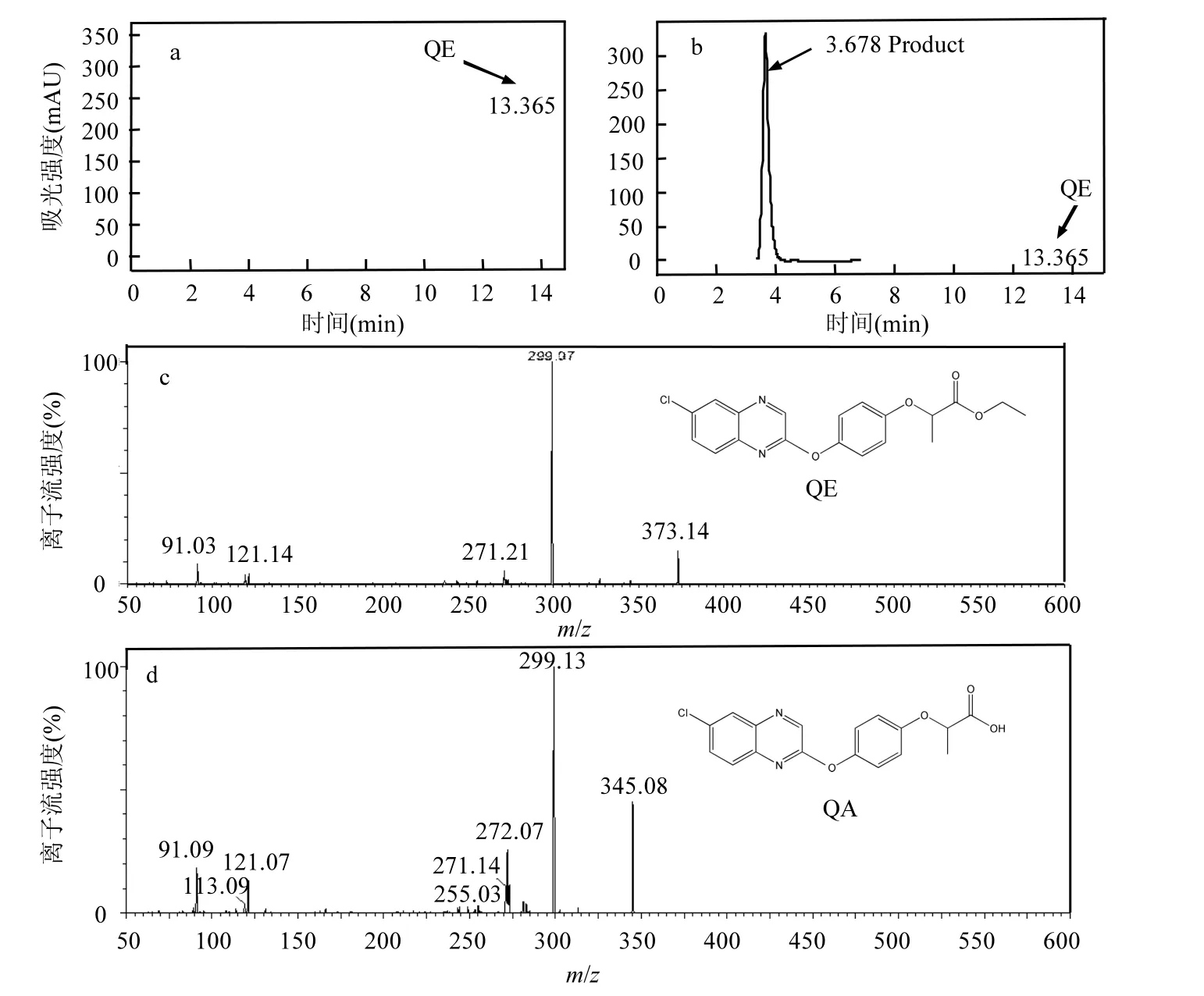
图4 精喹禾灵及其降解产物的高效液相色谱和质谱Fig.4 High performance liquid chromatography and mass spectrometry of quizalofop-p-ethyl and its degradation product
2.3 温度和初始pH值对菌株H降解精喹禾灵的影响

图5 温度对菌株H降解精喹禾灵的影响Fig.5 Effect of temperature on degradation of quizalofop-p-ethyl by strain H
温度和 pH值不仅是影响微生物生长的重要环境因素,也是影响微生物降解污染物酶促反应的重要环境条件.温度对菌株 H降解精喹禾灵的影响结果如图5所示,菌株H在30~42℃范围内对精喹禾灵的降解率均达到 95%以上,而当温度范围在20~25℃范围内时,菌株H对精喹禾灵的降解能力较低,但72h时仍然可以达到80%以上的降解率.出现上述现象的原因可能是菌株 H为芽孢菌,无论是其菌体还是其产生的降解酶都比较耐热,所以即使在 42℃时仍然有很高的降解能力.而当温度处在20~25℃范围内,菌株 H的生长和酶促反应反而受到一定的抑制.pH值对菌株H降解精喹禾灵的影响如图6所示,菌株H在pH 6.0~9.0范围内对精喹禾灵的降解效果没有太大的变化,其降解率均在 90%以上,说明菌株 H可以适应大多数自然环境下的酸碱度而发挥降解功能.

图6 初始pH值对菌株H降解精喹禾灵的影响Fig.6 Effect of initial pH value on degradation of quizalofop-p-ethyl by strain H
2.4 精喹禾灵初始浓度对菌株H降解能力的影响
在无机盐培养基中分别加入初始浓度为25、50、100、200mg/L的精喹禾灵,按5%接种量接入菌株H种子液,定时取样,测定菌株H在不同底物浓度下的降解能力,结果如图7所示.由图7可以看出,虽然随着底物浓度的升高,精喹禾灵所需要的降解时间不断延长,但对菌株 H总的降解能力影响不大,即使精喹禾灵初始浓度为 200mg/L,其在72h内的降解率仍然达90%以上,这说明菌株H对高浓度的精喹禾灵有较强的耐受力.
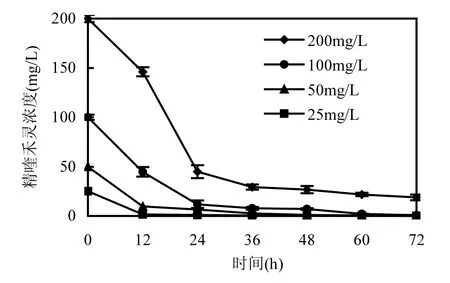
图7 精喹禾灵初始浓度对菌株H降解能力的影响Fig.7 Effect of initial quizalofop-p-ethyl concentration on degradation of quizalofop-p-ethyl by strain H
2.5 接种量对菌株H降解精喹禾灵的影响
在含有 100mg/L精喹禾灵的无机盐培养基中,分别接入0.5%、1%、5%和10%的菌株H 种子液,然后定时取样,测定精喹禾灵在不同接种量条件下的降解情况.结果如图8所示,接种量对精喹禾灵的降解速率有较大影响,随着接种量的增加,精喹禾灵的降解速率明显增大;但即使在接种量较低时(0.5%和1%),72h内精喹禾灵的降解率仍然达98%以上,该结果进一步表明菌株H对精喹禾灵有很强的降解能力.

图8 接种量对菌株H降解精喹禾灵的影响Fig.8 Effect of inoculum size on degradation of quizalofop-p-ethyl by strain H
2.6 金属离子对菌株H降解精喹禾灵的影响

图9 金属离子对菌株H降解精喹禾灵的影响Fig.9 Effect of metal ions on degradation of quizalofop-p-ethyl by strain H
菌株 H主要是利用其产生的酶对精喹禾灵进行降解,很多金属离子对酶的活性有影响,因此,对常见金属离子对菌株 H降解精喹禾灵的影响进行了研究.由图9可以看出,Co2+对菌株H降解精喹禾灵有强烈的抑制作用,在其影响下菌株 H在72h内对精喹禾灵的降解率仅有20%,其原因可能是Co2+对菌株H的生长以及其产生的酶有强烈的抑制作用.其次Mn2+对菌株H降解精喹禾灵有轻微抑制作用,而其它金属离子对菌株H降解精喹禾灵的促进和抑制作用均不明显.
3 结论
3.1 从采集的土样中分离出一株精喹禾灵高效降解菌株H,经生理生化和16S rRNA基因序列分析将其鉴定为枯草芽孢杆菌(Bacillus subtilis).
3.2 菌株 H 能以精喹禾灵为唯一碳源生长,在37℃,pH8.0条件下,72h内可将100mg/L的精喹禾灵降解98%.
3.3 菌株 H 在温度为 30~42℃和 pH6~10范围内均可有效降解精喹禾灵;在精喹禾灵浓度≤200mg/L时,其浓度对菌株 H的降解能力影响不大;菌株H降解能力较强,即使低接种量(0.5%)仍然可以很好的降解精喹禾灵.
3.4 Co2+对菌株H降解精喹禾灵有明显的抑制作用,Mn2+对菌株H降解精喹禾灵有轻微抑制作用.
3.5 菌株H降解精喹禾灵的产物为精喹禾灵酸,即菌株 H降解精喹禾灵的机制是其分泌酯酶使精喹禾灵分子中丙酸和乙醇之间的酯键断裂.
参考文献:
[1]Mantzos N, Karakitsou A, Nikolaki S, et al. Dissipation and transport of quizalofop-p-ethyl herbicide in sunflower cultivation under field conditions [J]. Environmental Science and Pollution Research, 2016,23(4):3481-3490.
[2]Mustafa Y, Arikan E S. Genotoxicity testing of quizalofop-P-ethyl herbicide using the Allium cepa anaphase-telophase chromosome aberration assay [J]. Caryologia, 2008,61(1):45-52.
[3]Doganlar Z B. Quizalofop-p-ethyl-induced phytotoxicity and genotoxicity in Lemna minor and Lemna gibba [J]. Journal of Environmental Science and Health, Part A: Toxic/Hazardous Substances and Environmental Engineering, 2012,47(11):1631-1643.
[4]赵小会,程翠利,周春姣,等.10%精喹禾灵乳油对斑马鱼的急性毒性试验 [J]. 广州化工, 2016,44(16):108-110.
[5]朱丽珍.两种芳氧苯氧基丙酸酯类除草剂对斑马鱼毒性效应及作用机制研究 [D]. 北京:中国农业大学, 2016.
[6]Elefsiniotis I S, Liatsos G D, Stamelakis D, et al. Mixed Cholestatic/Hepatocellular liver injury induced by the herbicide quizalofop-p-ethyl [J]. Environmental Health Perspectives,2007,115(10):1479-1481.
[7]陈日萍,陈 彤,俞少勇,等.芳氧苯氧丙酸类除草剂对大鼠睾丸生精细胞的损伤作用 [J]. 浙江省医学科学院学报, 2006,4:22-25.
[8]陈日萍,高 明,蔡冬苗,等.精喹禾灵亚慢性经口暴露对雄性大鼠的生殖毒性研究 [J]. 毒理学杂志, 2011,25(3):208-211.
[9]中国质量新闻网.加拿大确定乙基精喹禾灵等农残最大残留限量 [EB/OL]. http://www.cqn.com.cn/news/zjpd/spaq/1133795.html, 2016-03-22.
[10]邹荣仟,吴德杰,吴 林,等.精喹禾灵乳油在越橘果实及土壤中的残留动态 [J]. 吉林农业大学学报, 2009,31(5):652-655.
[11]汤富彬.精喹禾灵的土壤微生物降解 [D]. 杭州:浙江大学, 2002.
[12]王晓环,王德飘,康 頔,等.影响精喹禾灵在土壤中降解的因素研究 [J]. 辽宁化工, 2016,(5):540-543.
[13]吕 欣,彭霞薇,呼 庆,等.利用DGGE-菌落原位杂交法分离土壤中精喹禾灵降解菌 [J]. 环境科学, 2013,34(1):263-270.
[14]周丽兴,万树青,陈泽鹏,等.短小芽孢杆菌(Bacillus pumilis)对精喹禾灵的降解特性 [J]. 农药, 2006,45(9):627-629.
[15]李梦雅,李 杰,戴 纯,等.一株高效精喹禾灵降解菌的筛选、鉴定及降解特性研究 [J]. 基因组学与应用生物学, 2017,(2):686-692.
[16]Zhang H, Li M, Li J, et al. A key esterase required for the mineralization of quizalofop-p-ethyl by a natural consortium of Rhodococcus sp JT-3and Brevundimonas sp JT-9 [J]. Journal of Hazardous Materials, 2017,327:1-10.
[17]Zhang H, Li M, Dai C, et al. Characterization of EstQE, a new member of esterase family VIII from the quizalofop-P-ethyldegrading bacterium Ochrobactrum sp QE-9 [J]. Journal of Molecular Catalysis B Enzymatic, 2016,133:167-175.
[18]Nie Z J, Hang B J, Cai S, et al. Degradation of cyhalofop-butyl(CyB) by Pseudomonas azotoformans strain QDZ-1, and cloning of a novel gene encoding CyB-hydrolyzing esterase [J]. Journal of Agricultural and Food Chemistry, 2011,59:6040-6046.
[19]Hou Y, Tao J, Shen W J, et al. Isolation of the fenoxaprop-ethyl (FE)-degrading bacterium Rhodococcus sp. T1, and cloning of FE hydrolase gene feh [J]. FEMS Microbiology Letters, 2011,323(2):196-203.
[20]Dong W L, Sheng J, Shi K, et al. Biodegradation of fenoxaprop-P-ethyl (FE) by Acinetobacter sp. strain DL-2and cloning of FE hydrolase gene afeH [J]. Bioresource Technology, 2015,186:114-121.
[21]Liu H M, Lou X, Ge Z J, et al. Isolation of an aryloxyphenoxy propanoate (AOPP) herbicide-degrading strain Rhodococcus ruber JPL-2and the cloning of a novel carboxylesterase gene (feh)[J]. Brazilian Journal of Microbiology, 2015,46(2):425-432.
[22]Bezza F A, Chirwa E M N. Production and applications of lipopeptide biosurfactant for bioremediation and oil recovery by Bacillus subtilis CN2 [J]. Biochemical Engineering Journal, 2015,101:168-178.
[23]Sariwati A, Purnomo A S, Kamei I. Abilities of co-cultures of brown-rot fungus Fomitopsis pinicola and Bacillus subtilis on biodegradation of DDT [J]. Current Microbiology, 2017,(4):1-8.
[24]东秀珠,蔡妙英.常见细菌系统鉴定手册 [M]. 北京:科学出版社, 2001.
[25]Dong W L, Hou Y, Xi X D, et al. Biodegradation of fenoxaprop- ethyl by an enriched consortium and its proposed metabolic pathway [J].International Biodeterioration & Biodegradation, 2015,97:159-167.

