藏猪和长白猪对口蹄疫疫苗免疫应答特性的比较
卢建均 ,杨霄 *,万小平 *,吕学斌 ,王泽洲 ,高荣 **
(1.生物资源与生态环境教育部重点实验室,四川省动物疫病预防与食品安全重点实验室,四川大学生命科学学院,四川 成都 610064;2.四川省畜牧科学研究院,四川 成都 610066;3.四川省动物疫病预防控制中心,四川 成都 610041)
目前国内外关于藏猪免疫遗传特性的系统研究并不多见,本试验用猪口蹄疫O型灭活苗免疫藏猪和长白猪,采集不同时期的前腔静脉血,通过检测免疫细胞数量变化、猪口蹄疫O型病毒特异性抗体水平以及免疫应答相关基因表达的变化情况,深入了解免疫后藏猪和长白猪免疫应答特性的差异。
1 材料与方法
1.1 试剂 猪口蹄疫O型灭活苗(OZK,93+OS,99株),改良型RPMI1640淋巴细胞分离液:比重为1.113±0.002,猪口蹄疫O型病毒ELISA特异性抗体检测试剂盒,荧光定量PCR试剂So-fast evagreen supermix。
1.2 试验猪 随机选取8日龄、体重均约2kg的健康藏猪和长白猪各5头,分别设为藏猪试验组和长白猪试验组,两组猪均肌肉注射2头份猪口蹄疫O型灭活苗(试验前进行了常见病原和抗体检测,结果均为阴性)。在免疫疫苗前(记为第0d)和免疫后6、8、12周和16周分别采集猪前腔静脉血于抗凝管中,用于血液免疫细胞计数,并对抗猪口蹄疫O型病毒特异性抗体、免疫基因表达水平进行分析。
1.3 试验方法
1.3.1 血液免疫细胞计数 按期在无菌状态下采集藏猪和长白猪的新鲜前腔静脉抗凝血1mL,用血细胞自动计数仪进行血常规检测。
1.3.2 分离血清 取新鲜的前腔静脉抗凝血1 mL,5 000 r/min室温下离心5 min,收集上层淡黄色血浆,-20℃保存备用。
1.3.3 淋巴细胞的分离与培养 参照猪淋巴细胞分离液使用说明,从新鲜采集的前腔静脉抗凝血中分离免疫细胞,用RPMI1640培养液(含青霉素100U/mL,链霉素100μg/mL和10%胎牛血清)悬浮。将细胞悬液稀释至5×106/mL,置于细胞培养板上,在37℃ CO2培养箱中培养48h。
1.3.4 间接ELISA法检测血清中的特异性抗体 参照试剂盒说明书进行。
1.3.5 淋巴细胞总RNA提取和cDNA制备 取培养48h的藏猪和长白猪淋巴细胞,1500r/min离心5min,收集细胞,加入Trizol试剂裂解细胞。参照Trizol试剂使用说明书提取总RNA,并按M-MLV逆转录酶操作指南,以Oligo(dT)和随机引物反转录合成cDNA。
1.3.6 荧光定量引物设计 根据GenBank中报道的猪 β-actin、TRL4、TLR7、TLR9、CCR7、CD62L、CD4、IL-6、IL-10基因的cDNA序列,设计合成了9对扩增引物(表1)。
1.3.7 荧光定量PCR 免疫相关基因的定量PCR表达分析用Bio-Rad CFX96荧光定量PCR仪进行。以藏猪和长白猪不同时期的淋巴细胞cDNA为模板,用上述引物扩增。定量PCR扩增参数为:95℃30s,95℃ 2s,60℃ 2s,共45个循环。溶解曲线参数为:65~95℃,每5s上升0.5℃。以β-actin作为内参基因,采用ΔCt法分析实时荧光定量PCR数据,比较同一目的基因不同时期的相对表达水平。

表1 定量PCR扩增引物
2 结果
2.1 血液中免疫细胞数量的变化 对抗凝血常规免疫细胞分析,结果显示:免疫后6~12周,藏猪组的白细胞数量显著高于长白猪组(P<0.05);免疫后6~16周,藏猪组的红细胞数量和血红蛋白含量明显高于长白猪组,且呈上升趋势(P<0.05),而长白猪组的红细胞数量无显著变化(P>0.05)。
2.2 血清特异性抗体含量的变化 用间接ELISA法检测猪口蹄疫O型病毒特异性抗体水平,结果如图1所示。
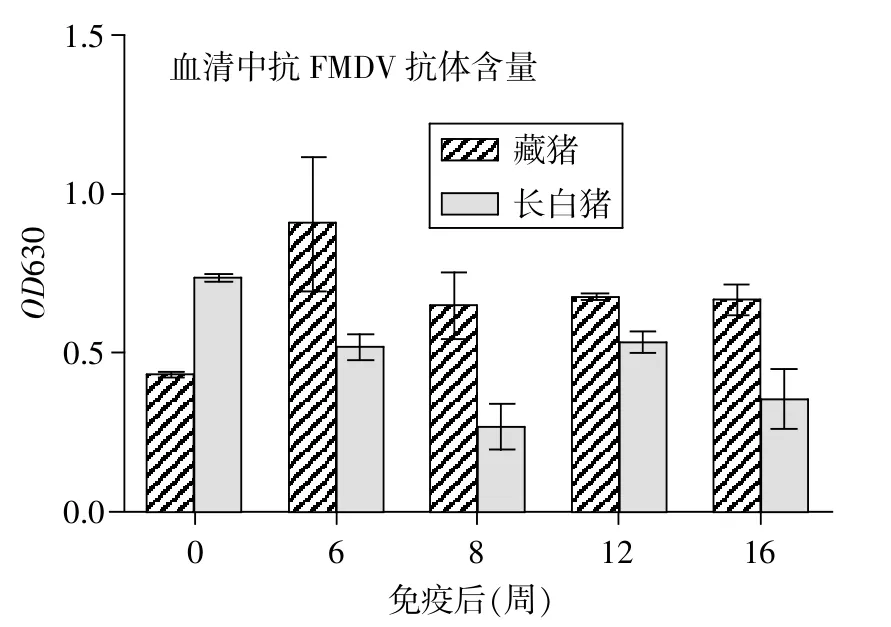
图1 血清中猪口蹄疫O型病毒特异性抗体的变化情况
在藏猪免疫后6~16周,其特异性抗体水平明显高于长白猪(P<0.05);第6周,血清中猪口蹄疫O型病毒的特异性抗体水平最高;之后8~16周,特异性抗体保持在一个相对稳定的水平,但均明显高于免疫前。
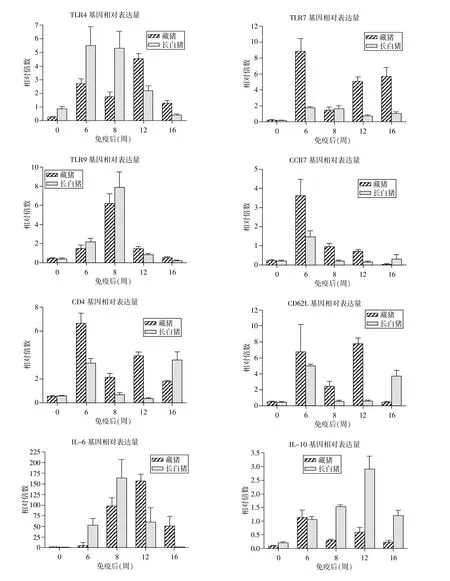
图2 RT-PCR检测不同时期免疫基因的表达情况
2.3 免疫应答基因表达水平的变化 从图2免疫相关基因表达水平的定量分析结果可以看出,藏猪与长白猪的8个基因的表达水平在免疫后均明显增高(P<0.05)。
藏猪 TLR4、CD4、CD62L 和 IL-10 基因在 6~16周期间均表现为先下降后上升再下降(P<0.05);CCR7基因的表达量在免疫后6~16周显著降低;TLR7的表达量在免疫后6~8周降低,而在8~16周显著升高,这与TLR9基因表达的变化趋势正好相反(P<0.05)。免疫后6~12周,藏猪IL-6基因的表达量显著升高(P<0.05),长白猪的TLR9和 IL-6在免疫后6~8周表达量升高,而在8~16周显著降低(P<0.05)。长白猪CCR7、CD4和CD62L基因的表达量在免疫后6~12周降低,而IL-10基因的表达量明显上升(P<0.05),TLR4基因在免疫后 6~16周表达量降低(P<0.05),TLR7在免疫后的6~16周表达量无显著变化。
免疫后 8~16周,藏猪的 TLR4、TLR9和IL-6基因表达水平显著高于长白猪(P<0.05),6~8 周低于长白猪。免疫后6~12周,藏猪的CCR7、CD4和CD62L基因表达水平显著高于长白猪(P<0.05)。免疫后8~16周,长白猪的IL-10基因表达水平显著高于藏猪(P<0.05)。而另一个特点是,免疫后除第8周,藏猪TLR7基因的表达水平均明显高于长白猪(P<0.05)。
3 结论与分析
3.1 从ELISA结果分析可知,在猪口蹄疫O型病毒疫苗刺激下藏猪更易从自身B淋巴细胞分泌特异性抗体,并迅速在体内维持相对稳定的抗体水平。藏猪在抗FMDV的体液免疫反应方面明显优于长白猪。免疫后两个试验组猪的8种与免疫相关的mRNA含量均显著高于免疫前水平,表明肌注FMDV灭活疫苗有效地诱发了两组猪的抗FMDV免疫反应。
3.2 Toll样受体(TLR)是模式识别受体的一类,识别与宿主不同的病原体分子。TLRs是Ⅰ型跨膜蛋白,能够识别侵入体内的微生物进而激活免疫细胞的应答反应,被认为在先天性免疫系统中起关键作用[1-2]。TLR4和TLR9能够促进树突状细胞的成熟,被认为在先天免疫和诱导适应性免疫中有重要作用[3-4]。免疫FMDV灭活疫苗后,两个试验组的TLR4和TLR9表达水平较免疫前明显提高,说明两组中的FMDV灭活疫苗均诱发了较强的免疫防御应答。免疫后藏猪TLR7的表达明显高于长白猪,表明藏猪较长白猪对O型FMDV有更好的固有识别能力。此外,藏猪免疫FMDV灭活疫苗后,白细胞水平也显著高于长白猪。以上结果均说明藏猪的先天免疫应答能力如免疫识别等优于长白猪。
3.3 CD4作为辅助性T细胞表面特异性抗原,它识别MHCⅡ分子,激活下游细胞因子的转录和分泌,调节获得性免疫应答[5]。CCR7是一种趋化因子,确保淋巴细胞到达外周淋巴组织的正确位置。CD62L(L-选择素)是一种淋巴细胞归巢受体,参与淋巴细胞向外周淋巴组织迁移的粘附作用。它们共表达决定了淋巴细胞向外周淋巴组织迁移的能力[6]。此外,有研究表明CD4、CCR7和CD62还与机体的免疫记忆有关[7]。免疫后6~12周,藏猪CD4、CCR7和CD62L基因的表达水平显著高于长白猪,提示免疫后期藏猪的免疫调节增强效应和免疫记忆能力都优于长白猪。
3.4 IL-6是主要由单核巨噬细胞、T细胞及纤维细胞等合成的多肽,在B细胞参与的免疫反应和CD4 Th细胞分化中有重要作用。在正常生理状态下,甲状腺上皮细胞(TEC)仅产生少量IL-6,但在病理情况下,IL-6的表达会异常升高。IL-10是一类重要的抗炎免疫调节因子,它能够抑制促炎因子如IFN-γ、IL-2、IL-3、TNF-α和GM-CSF的产生,负反馈调节免疫系统[8]。在免疫后8~16周,长白猪IL-10的表达水平明显高于藏猪(P<0.05)。长白猪IL-10高表达引起的免疫应答负反馈调节作用,可能是导致其体液免疫水平及免疫细胞数量低于藏猪的原因。
本研究初步表明:藏猪对FMDV灭活疫苗的先天免疫、体液免疫、细胞免疫、免疫记忆、免疫调节等各项指标均优于长白猪。因此,藏猪对FMDV感染的抵抗能力要强于长白猪。
参考文献:
[1]Akira S,Takeda K,Kaisho T.Toll-like receptors:critical proteins linking innate and acquired immunity[J].Nat Immunol,2001,2(8):675-680.
[2]Imler J L,Hoffmann J A.Toll receptors in innate immunity[J].Trends Cell Biol,2001,11(7):304-311.
[3]Kawai T,Akira S.The role of pattern-recognition receptors in innate immunity:update on Toll-like receptors[J].Nat Immunol,2010,11(5):373-384.
[4]Kawai T,Akira S.Toll-like receptors and their crosstalk with otherinnate receptors in infection and immunity[J].Immunity,2011,34(5):637-650.
[5]Yu Yongmao,Rabinowitz R,Michael S,et al.Correlation between the expression of CD4 and the level of CD4 mRNA in human B-cell lines[J].Cell Immunol,2002,215(1):78-86.
[6]Totte P,Duperray C,Dedieu L.CD62L defines a subset of pathogen-specific bovine CD4 with central memory cell characteristics[J].Dev and Comp Immunol,2010,34(2):177-182.
[7]Unsoeld H,Pircher H.Complex memory T-cell phenotypes revealed by coexpression of CD62L and CCR7[J].J Virol,2005,79(7):4510-4513.
[8]Mocellin S,Panelli Mc,Wang E,et al.The dual role of IL-10[J].Trends Immunol,2003,24(1):36-43.

