海藻酸盐纤维的生物活性和应用功效
秦益民
(1. 嘉兴学院 材料与纺织工程学院, 浙江 嘉兴 314001;2. 海藻活性物质国家重点实验室, 山东 青岛 266400)
海藻酸盐纤维是以海藻酸为原料,通过湿法纺丝制成的一种生物基纤维材料[1]。生产过程中海藻酸钠、钾、铵等水溶性化合物溶于水形成纺丝溶液,通过喷丝孔进入氯化钙或其他二价金属离子组成的凝固浴后,形成不溶于水的海藻酸盐纤维,经过牵伸、水洗、干燥等工艺得到具有纯天然特性以及良好可加工性的纤维材料[2-4]。海藻酸盐纤维制品与含钠离子的体液接触后可转换成水溶性海藻酸钠,其制品在与体液接触后形成的水凝胶在吸收大量液体的同时具有优良的保湿性能,在医用卫生领域应用广泛,对创面护理有特殊的疗效[5-6]。
作为一种源自海洋生物的医用材料,海藻酸盐纤维具有高吸湿性,同时具有一系列独特的生物活性,为人体提供各种理化保护功能,具有止血、抑菌、促愈等功效[7-8]。本文结合国内外海藻酸生物高分子、海藻酸盐纤维及其在医用敷料领域的最新研究成果,系统介绍了海藻酸盐纤维的生物活性,对推广其在医疗卫生领域的应用有重要价值。
1 海藻酸盐纤维的生物相容性
海藻酸是褐藻类植物结构的重要组成部分,在与钙、钠、钾、镁等金属离子结合成盐后存在于细胞壁和细胞外基质中。作为一种天然高分子材料,海藻酸盐在食品及医药卫生领域具有良好的使用安全性。海藻酸钠在1938年被收入美国药典,1963年被收入英国药典,是一种具有“公认安全物质”称号的食品添加剂,世界卫生组织(WHO)和联合国粮农组织(FAO)标准规定按体重每天可摄取的海藻酸钠为50 mg/(kg·d)。药物动力学实验结果表明,小鼠腹腔注射海藻酸钠的半数致死量为(1 013±308) mg/(kg·d)。目前超纯交联海藻酸钠制备的体内植入剂已在国外市场销售[9]。
图1示出了海藻酸的化学结构,其中甘露糖醛酸(M)和古罗糖醛酸(G)是具有同分异构体结构的共聚单体。海藻酸的多糖结构和亲水特性决定了其具有良好的生物相容性。Blair等[10]在对海藻酸盐纤维、氧化纤维素纤维、胶原等止血材料的研究中发现,植入肠系膜中的海藻酸盐纤维不引起肠梗阻,植入6周后对伤口部位进行组织学检查发现,海藻酸盐纤维在伤口部位有钙的沉积及纤维化反应。Lansdown等[11]把海藻酸盐纤维植入老鼠的皮下组织,并评价了其生物可降解性以及引起局部组织反应的性能。植入24 h、7 d、28 d以及12周后的测试结果显示海藻酸盐纤维无明显的降解。尽管植入开始时有一定的异物反应,海藻酸盐纤维逐渐被一层血管化、含成纤细胞的薄膜覆盖,但最终结果表明在老鼠实验中植入体内的海藻酸盐无毒性。其他研究也证明了海藻酸盐良好的生物相容性[12]。
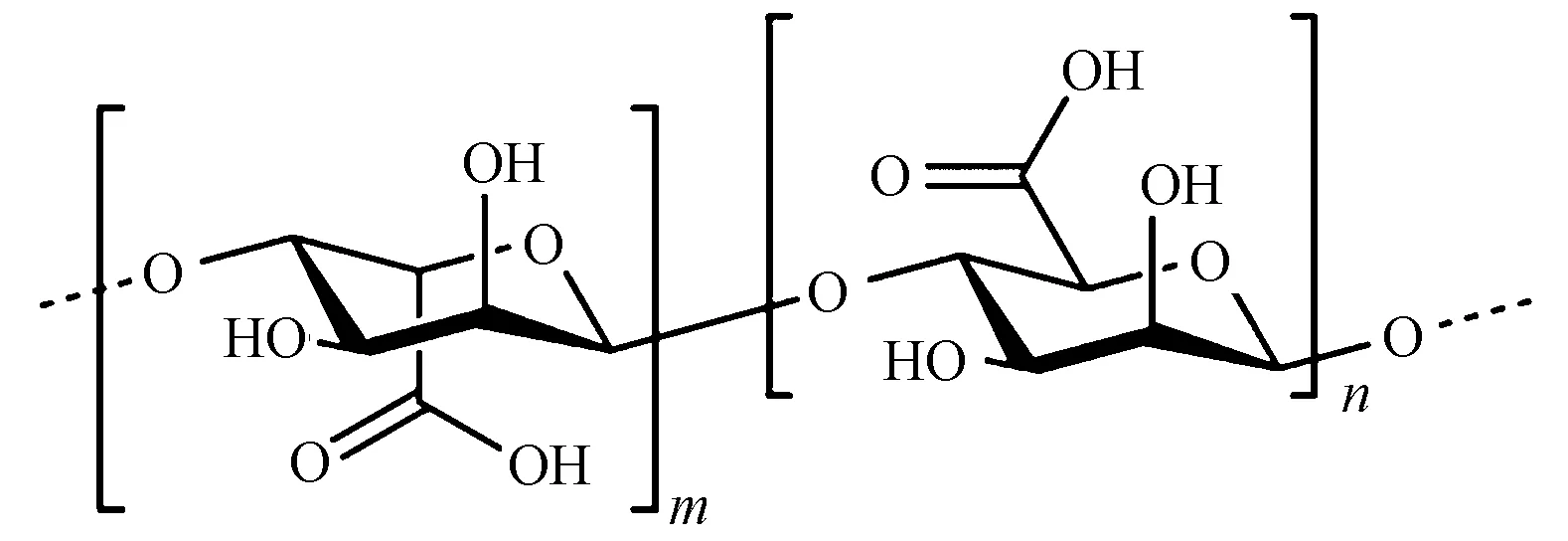
图1 海藻酸的化学结构Fig.1 Chemical structure of alginic acid
2 海藻酸盐纤维的细胞活性
作为一种植物细胞中提取出的天然高分子,海藻酸与各种细胞有特殊的亲和力并能影响细胞活性。Skjak-Braek等[13]发现海藻酸中的M链段与脂多糖一样与巨噬细胞有1个结合部位,可与膜蛋白产生作用,对单核白细胞有趋化作用。Pueyo等[14]的研究结果显示用海藻酸和聚赖氨酸包埋单核白细胞,其微胶囊可活化白细胞产生巨噬细胞。Otterlei等[15]比较了用海藻酸刺激人体单核白细胞产生的3种细胞因子:肿瘤坏死因子-α(TNF-α),白细胞介素-1和白细胞介素-6。结果显示高M含量的海藻酸刺激生成的细胞因子活性是高G含量海藻酸的近10倍,由此可见M链段是刺激细胞产生活性的主要成分。其他研究也显示,M链段中的β-1-4-糖苷键在刺激细胞因子及抗肿瘤活性中起主要作用,该β-1-4-糖苷键在C-6氧化纤维素的D-葡萄糖醛酸中同样存在,并且也具有刺激肿瘤坏死因子-α的活性[16]。
Skjak-Braek等[13]报道了含有β-1-4-糖苷键的聚合物在动物实验中具有刺激细胞因子、保护宿主动物免受金黄色葡萄球菌和大肠杆菌感染的性能,而在用C-5差向异构酶把高M含量转换成高G含量后,海藻酸失去了诱导肿瘤坏死因子-α的性能。Zimmerman等[17]、Klock[18]比较了含不同M和G的海藻酸在电泳和透析纯化后促进有丝分裂的活性发现,纯化后的海藻酸失去了促进有丝分裂的活性,因此认为,海藻酸的活性可能源于其低聚物含量,低聚物在纯化过程中的流失使海藻酸活性消失。
3 海藻酸盐纤维的离子交换性能
作为一种高分子羧酸,海藻酸与各种金属离子结合后形成的高分子盐具有特殊的离子交换特性。在纤维制备过程中,通过凝固浴中的离子交换在纤维上负载各种金属离子,然后在使用过程中可释放出锌、铜、银等对人体无毒性、有保健功效的微量金属离子[19-21]。
海藻酸盐纤维的化学结构和体液中钠离子、蛋白质等成分在离子交换过程中具有重要作用。表1示出3种含不同M/G单体的海藻酸钙纤维在与A溶液接触后释放钙离子的性能。其中A溶液是英国药典规定的模仿体液中钙和钠离子质量浓度的水溶液,含有 2.5 mmol 氯化钙和142.0 mmol氯化钠。在相同的测试条件下,高G含量海藻酸盐纤维接触液中含有317.5 mg/L钙离子,而高M含量海藻酸盐纤维接触液中钙离子质量浓度达到560 mg/L,接近高G含量海藻酸盐纤维的2倍,说明高M含量海藻酸盐纤维在与含钠离子的溶液接触后更易发生离子交换[22-24]。Doyle等[25]的研究结果显示,海藻酸盐纤维释放出的钙离子对人体成纤细胞有刺激作用,对伤口愈合有重要的促进作用。

表1 3种海藻酸钙纤维的离子交换性能Tab.1 Ion-exchange properties of three types of calcium alginate fibers
海藻酸对各种金属离子的离子交换系数大小顺序为Pb2+>Cu2+>Cd2+>Ba2+>Sr2+>Ca2+>Co2+=Ni2+=Zn2+>Mn2+,其中铜离子与海藻酸有很强的结合力[26]。海藻酸和海藻酸钙纤维对铜离子均有较好的吸附性能[27],24 h后的平衡吸附量分别为68.6和81.7 mg/g。海藻酸盐纤维对铜离子的吸附作用在临床上有特殊的意义,其在使用过程中可在创面上局部富集对伤口愈合有促进作用的铜离子,有效促进伤口愈合。研究显示,铜离子是人体生理和代谢过程中的重要元素,在诱导血管内皮生长因子、血管生成、皮肤细胞外蛋白的表达和稳定过程中起关键作用[28]。由于体液中铜离子的含量约为1 mg/L,对于患有糖尿病足溃疡、褥疮、静脉溃疡等创面血液循环不良的病人,局部铜含量较低可延缓伤口愈合,而在创面补充铜离子可以促进血管生成和皮肤再生。
4 海藻酸盐纤维的止血性能
Segal等[29]研究显示,海藻酸盐纤维的止血性能主要源于纤维释放出的钙离子对血小板的激化作用以及产生的凝血效应。由于海藻酸盐纤维的吸湿性高,其凝血效应高于其他创面用卫生材料:钙离子在激化血小板后释放出纤维蛋白链,形成的血栓具有良好的止血功效,在纤维中加入一定量的锌离子可强化其凝血作用和对血小板的激化功效,有效提高纤维的止血性能。图2示出37 ℃下海藻酸锌纤维放置在不同浓度的蛋白质水溶液中锌离子浓度的变化。可以看出:放置0.5 h后,在1.0%、2.9%和5.0%蛋白质水溶液中的锌离子质量浓度分别为92、347和626 mg/L,24 h后3种溶液中的锌离子质量浓度分别上升至170、1 384和1 924 mg/L,说明蛋白质分子对锌离子的螯合作用促进了其从纤维上的释放[30]。
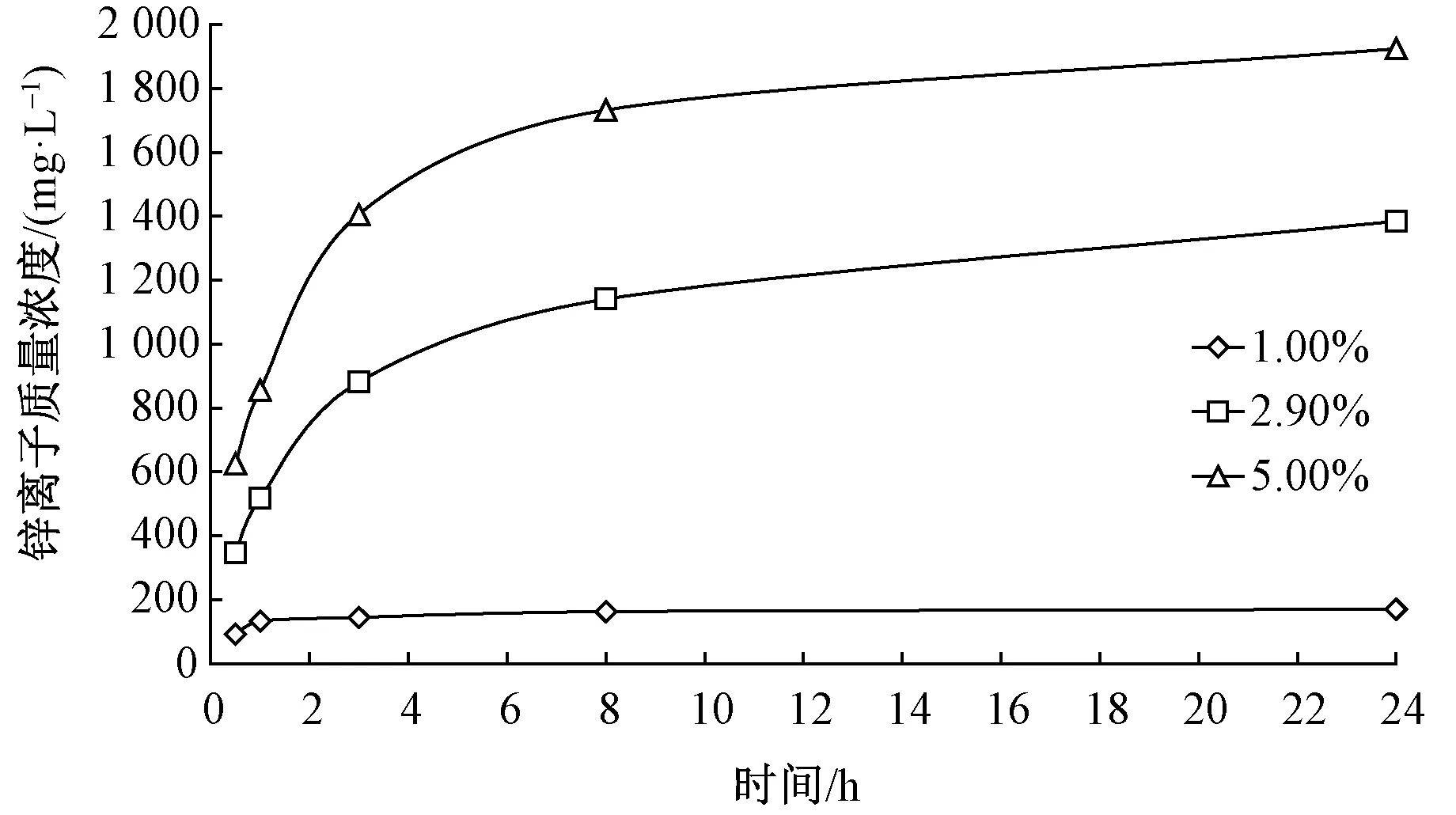
图2 海藻酸锌纤维与蛋白质溶液接触后锌离子质量浓度的变化Fig.2 Zinc ion mass concentration in contact solution when zinc alginate fibers are placed in contact with protein solution
海藻酸盐纤维和医用敷料的止血性能已在大量临床实验中得到证实。Groves等[31]在供皮区伤口上应用海藻酸盐敷料后的5 min内就观察到良好的止血效果。Matthew等[32]发现用海藻酸盐敷料填充2 mm深的口腔伤口时,其止血功效优于普通手术纱布。在临床实验中发现,海藻酸盐敷料与普通纱布相比,手术中的流血量分别为(98.8±9.9)、(139.4±9.6) mL,使用普通纱布手术后的血液流失量为(158.4±17.3) mL,而使用海藻酸盐敷料血液流失量为(96.6±11.7) mL[33]。
5 海藻酸盐纤维的抑菌功效
海藻酸盐纤维独特的理化性能赋予其特殊的抑菌功效。临床使用过程中纤维吸湿后高度溶胀,纤维之间的空间受挤压后可固定住伤口渗出液中的细菌,从而抑制其活性和繁殖能力,降低临床伤口感染风险[34]。Bowler等[35]将海藻酸盐敷料与含有细菌的溶液接触后发现,海藻酸盐敷料可通过凝胶膨胀抑制细菌增长。
海藻酸盐纤维与巨噬细胞之间的相互作用对其抑菌功能也有重要影响,巨噬细胞在与纤维接触后,释放出的肿瘤坏死因子(TNF-α,又称恶病质素)对肿瘤细胞和受感染的正常细胞有毒性,对炎症反应有调节作用[36-37]。高M含量海藻酸盐纤维对巨噬细胞的刺激作用是其在感染及有恶臭的伤口上产生作用的主要原因[38]。
6 海藻酸盐纤维的促愈性能
以海藻酸盐纤维为原料制备的功能性医用敷料可为创面提供湿润的愈合环境,通过纤维的吸湿膨胀在创面上形成低黏性、凝胶状接触层,以此作为基质为细胞迁移和血管生成提供理想的环境[39-41]。湿润的环境有利于生长因子、生长促进剂等细胞因子在炎症、修复等阶段中的促进愈合作用,纤维上释放出的钙离子有助于细胞向创面迁移,从而促进伤口的愈合[42-43]。Lansdown等[44]的研究结果证实了钙离子在创面周边、成熟的角质细胞、皮脂腺细胞中的含量最高,由此可推断钙离子在创面愈合中的作用。
Sayag等[45]以92位有压疮的患者为对象比较了海藻酸盐敷料与传统敷料的疗效。在2组患者中,使用海藻酸盐敷料的有74%的患者伤口面积缩小40%,而传统敷料组只有42%的患者面积缩小40%;海藻酸盐敷料达到此疗效的平均时间为4周,而传统敷料为8周。说明海藻酸盐医用敷料在吸收伤口渗出液、保护创面及提供湿润愈合环境的同时,具有促进伤口愈合的药理作用。
Attwood[46]在有107位病人参与的临床实验中比较了海藻酸盐敷料和传统纱布在供皮区伤口上的应用。研究发现,使用传统纱布的平均愈合时间为10 d,而使用海藻酸盐敷料的平均愈合时间下降到 7 d,表明海藻酸盐敷料在促进伤口愈合方面具有优良功效。
7 海藻酸盐纤维的美白功效
海藻酸盐纤维对铜离子超强的吸附性能对皮肤美白具有特殊的应用价值。皮肤中的黑色素由黑色素细胞通过酪氨酸酶的催化,经过一系列代谢过程将酪氨酸转化后而生成。图3示出在酪氨酸酶催化下黑色素的形成过程。
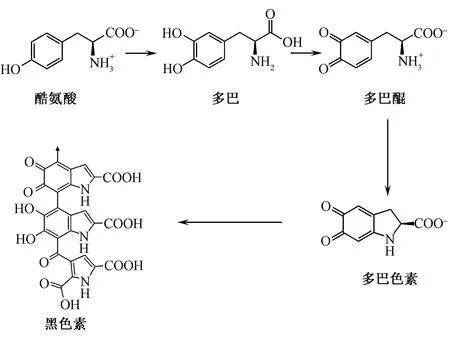
图3 酪氨酸酶催化下黑色素的形成过程Fig.3 Formation of melanin throughcatalysis of tyrosinase
酪氨酸酶是一种含铜酶,在与海藻酸盐纤维接触后,其结构中的铜离子被海藻酸盐吸附后失去催化活性,因此,可抑制其催化酪氨酸产生黑色素。以海藻酸盐纤维为原料制备的功能性面膜材料通过抑制酪氨酸酶的催化作用而具有优良的美白功效。
8 结束语
海藻酸是一种具有特殊化学结构和生物活性的海洋生物高分子,通过湿法纺丝制备的海藻酸盐纤维具有纤维材料的特性以及海藻酸盐的生物活性,在与人体接触过程中可产生独特的保健和美容功效,具有吸附和释放金属离子、止血、抑菌、促进伤口愈合、美白等作用,在医疗卫生、保健、美容纺织材料中有很高的应用价值和广阔的市场前景。以海藻酸盐纤维为原料制备的医用敷料已在伤口护理领域展现出重要的应用价值,可有效促进慢性创面愈合。海藻酸盐纤维的保湿、美白、排毒等功能特性在面膜等护肤产品中也具有巨大的应用前景。
FZXB
参考文献:
[1] QIN Y. Alginate fibres: an overview of the production processes and applications in wound management [J]. Polymer International, 2008, 57(2): 171-180.
[2] SPEAKMAN J B, CHAMBERLAIN N H. The production of rayon from alginic acid [J]. Journal of the Society of Dyers and Colourists, 2010, 60(10): 264-272.
[3] CHAMBERLAIN N H, JOHNSON A, SPEAKMAN J B. Some properties of alginate rayons [J]. Journal of the Society of Dyers and Colourists, 2010, 61(1): 13-20.
[4] DUDGEON M J, THOMAS R S, WOODWARD F N. The preparation and properties of some inorganic alginate fibres [J]. Journal of the Society of Dyers and Colourists, 2010, 70(6): 230-237.
[5] QIN Y. Gel swelling properties of alginate fibers [J]. Journal of Applied Polymer Science, 2004, 91(3):1641-1645.
[6] THOMAS S. Alginate dressings in surgery and wound management-part 1 [J]. Journal of Wound Care, 2000, 9(2): 56-60.
[7] THOMAS S. Alginate dressings in surgery and wound management-part 2 [J]. Journal of Wound Care, 2000, 9(3): 115-119.
[8] THOMAS S. Alginate dressings in surgery and wound management-part 3 [J]. Journal of Wound Care, 2000, 9(4): 163-166.
[9] 秦益民,刘洪武,李可昌,等. 海藻酸[M].北京:中国轻工业出版社,2008:107.
QIN Yimin, LIU Hongwu, LI Kechang, et al. Algina-te [M]. Beijing: China Light Industry Press, 2008:107.
[10] BLAIR S D, BACKHOUSE C M, HARPER R, et al. Comparison of absorbable materials for surgical haemostatis [J]. British Journal of Surgery, 1988, 75(10): 969-971.
[11] LANSDOWN A B, PAYNE M J. An evaluation of the local reaction and biodegradation of calcium sodium alginate (kaltostat) following subcutaneous implantation in the rat [J]. Journal of the Royal College of Surgeons of Edinburgh, 1994, 39(5): 284-288.
[12] SUZUKI Y, NISHIMURA Y, TANIHARA M, et al. Evaluation of a novel alginate gel dressing: cytotoxicity to fibroblasts in vitro and foreign-body reaction in pig skin in vivo [J]. Journal of Biomedical Materials Research, 1998, 39(2): 317-322.
[13] SKJAK-BRAEK G, ESPEVIK T. Application of alginate gels in biotechnology and biomedicine [J]. Carbohydrates in Europe, 1996, 14: 19-25.
[14] PUEYO M E, DARQUY S, CAPRON F, et al. In vitro activation of human macrophages by alginate-polylysine microcapsules [J]. Journal of Biomaterials Science Polymer Edition, 1993, 5(3): 197-203.
[15] OTTERLEI M, OSTGAARD K, SKJAK-BRAEK G. Induction of cytokine production from human monocytes stimulated with alginate [J]. Journal of Immunotherapy, 1991, 10: 286-291.
[16] OTTERLEI M, SUNDAN A, SKJAK-BRAEK G, et al. Similar mechanisms of action of defined polysaccharides and lipopolysaccharides: characterization of binding and tumor necrosis factor alpha induction [J]. Infection Immunology, 1993, 61(5): 1917-1925.
[17] ZIMMERMANN U, KLOCK G, FEDERLIN K, et al. Production of mitogen-contamination free alginates with variable ratios of mannuronic acid to guluronic acid by free flow electrophoresis [J]. Electrophoresis, 1992, 13: 269-274.
[18] KLOCK G, FRANK H, HOUBEN R, et al. Production of purified alginates suitable for use in immunoisolated transplantation [J]. Applied Microbiology and Biotechnology, 1994, 40(5): 638-643.
[19] HAUG A, MYKLESTAD S, LARSEN B, et al. Correlation between chemical structure and physical properties of alginates [J]. Acta Chemica Scandinavica, 1967, 21: 768-778.
[20] SMIDSROD O, HAUG A. Dependence upon the gel-sol state of the ion-exchange properties of alginates [J]. Acta Chemica Scandinavica, 1972, 26: 2063-2074.
[21] SMIDSROD O, HAUG A, WHITTINGTON S G. The molecular basis for some physical properties of polyuronides [J]. Acta Chemica Scandinavica, 1972,26: 2563-2564.
[22] QIN Y. The ion exchange properties of alginate fibers [J]. Textile Research Journal, 2005,75(2):165-168.
[23] QIN Y. The characterization of alginate wound dressings with different fiber and textile structures [J]. Journal of Applied Polymer Science, 2006,100(3): 2516-2520.
[24] QIN Y. The gel swelling properties of alginate fibers and their application in wound management [J]. Polymers for Advanced Technologies, 2008, 19(1): 6-14.
[25] DOYLE J W, ROTH T P, SMITH R M, et al. Effects of calcium alginate on cellular wound healing processes modelled in vitro [J]. Journal of Biomedical Materials Research, 1996, 32(4): 561-568.
[26] SMIDSROD O, HAUG A. Dependence upon the gel-sol state of the ion-exchange properties of algina-tes [J]. Acta Chemica Scandinavica, 1972, 26: 2063-2074.
[27] 莫岚,陈洁,宋静,等.海藻酸纤维对铜离子的吸附性能[J].合成纤维,2009,38(2):34-36.
MO Lan, CHEN Jie, SONG Jing, et al. Absorption of copper ions by alginate fiber [J]. Synthetic Fiber Journal, 2009,38(2):34-36.
[28] BORKOW G, GABBAY J, ZATCOFF R C. Could chronic wounds not heal due to too low local copper levels? [J]. Med Hypotheses, 2008, 70(3): 610-613.
[29] SEGAL H C, HUNT B J, GILDING K. The effects of alginate and non-alginate wound dressings on blood coagulation and platelet activation [J]. Journal of Biomaterials Applications, 1998, 12(3): 249-257.
[30] 秦益民,陈洁. 海藻酸纤维吸附及释放锌离子的性能[J].纺织学报,2011,32(1):16-19.
QIN Yimin, CHEN Jie. Absorption and release of zinc ions by alginate fibers [J]. Journal of Textile Research, 2011,32(1):16-19.
[31] GROVES A R, LAWRENCE J C. Alginate dressing as a donor site haemostat [J]. Annals of the Royal College of Surgeons of England, 1986,68: 27-28.
[32] MATTHEW I R, BROWNE R M, FRAME J W, et al. Kaltostat in dental practice [J]. Oral Surgery Oral Medicine Oral Pathology, 1994, 77(5): 456-460.
[33] DAVIES M S, FLANNERY M C, MCCOLLUM C N. Calcium alginate as haemostatic swabs in hip fracture surgery [J]. Journal of the Royal College of Surgeons of Edinburgh, 1997, 42(1): 31-32.
[34] WILLIAMS C. Alginate wound dressings [J]. British Journal of Nursing, 1999, 8(5): 313-317.
[35] BOWLER P G, JONES S A, DAVIES B J, et al. Infection control properties of some wound dress-ings [J]. Journal of Wound Care, 1999, 8(10): 499-502.
[36] KAWAGUCHI H, HIZUTA A, TANAKA N. Role of endotoxin in wound healing impairment [J]. Research Communications in Molecular Pathology and Pharmacology, 1995, 89(3): 317-327.
[37] RAPALA K T, VAHA-KREULA M O, HEINO J J. Tumour necrosis factor-alpha inhibits collagen synthesis in human and rat granulation tissue fibroblasts [J]. Experimentia, 1996, 51(1): 70-74.
[38] THOMAS S. Current Practices in the Management of Fungating Lesions and Radiation Damaged Skin [M]. Australia: Surgical Materials Testing Laboratory, 1992:102.
[39] LEE K Y, MOONEY D J. Alginate: properties and biomedical applications [J]. Progress in Polymer Science,2012, 37(1): 106-126.
[40] SMELCEROVIC A, KNEZEVIC-JUGOVIC Z, PETRONIJEVIC Z. Microbial polysaccharides and their derivatives as current and prospective pharmaceu-ticals [J]. Current Pharmaceutical Design,2008, 14(29): 3168-3195.
[41] KAMMERLANDER G, EBERLEIN T. An assessment of the wound healing properties of Algisite M dress-ings [J]. Nurs Times, 2003, 99(42): 54-56.
[42] SUZUKI Y, TANIHARA M, NISHIMURA Y, et al. In vivo evaluation of a novel alginate dressing [J]. Journal of Biomedical Materials Research Part A,1999, 48(4): 522-527.
[43] 秦益民,宁宁,刘春娟,等. 海藻酸盐医用敷料的临床应用[M].北京:知识出版社,2017:23.
QIN Yimin, NING Ning, LIU Chunjuan, et al. Clinical Applications of Alginate Wound Dressings [M]. Beijing: Knowledge Press, 2017:23.
[44] LANSDOWN A B G, SAMPSON B, ROWE A. Sequential changes in trace metal, metallothionein and calmodulin concentrations in healing skin wounds [J]. Journal of Anatomy, 1999, 195: 375-386.
[45] SAYAG J, MEAUME S, BOHBOT S. Healing properties of calcium alginate dressings [J]. Journal of Wound Care, 1996, 5(8): 357-362.
[46] ATTWOOD A I. Calcium alginate dressing accelerate split graft donor site healing [J]. British Journal of Plastic Surgery, 1989, 42: 373-379.

