一步电沉积GQD/Ni-Al LDHs复合膜材料用于高效催化甲醇氧化
张萌芽 涂乔逸 朱 倩 陈 剑
(南昌航空大学环境与化学工程学院 江西省持久性污染物控制与资源循环利用重点实验室,江西 南昌 330063)
1 前言

碳纳米结构在环境,能源和生物医学领域有着广泛的应用前景。作为最近出现的碳基材料,石墨烯量子点(GQDs)是小于100nm的石墨烯片[17]。当2D石墨烯片转换成0DGQDs[18],由于其电导率高,比表面积大,毒性低[19],可调谐光致发光和在各种溶剂中分散性优异等特殊优点,GQD受到越来越多的关注[20]。
采用一步电沉积法将GQDs与Ni-AlLDHs同时沉积在玻碳电极(GCE)上,制备了一种新型修饰电极,GQDs/Ni-Al LDHs复合材料同时具有GQDs高的电导率和Ni-Al LDHs良好的电催化性能,因此将GQDs/Ni-Al LDHs复合材料修饰电极用于催化MeOH氧化。
2 实验部分
2.1 实验试剂
本实验中所用的所有化学试剂都为分析纯。纳米氧化铝(麦克林);硫酸(西陇化工股份有限公司);铁氰化钾(西陇化工股份有限公司);亚铁氰化钾(上海青析化工科技有限公司);硝酸钾(西陇化工股份有限公司);硝酸镍(西陇化工股份有限公司);硝酸铝(西陇化工股份有限公司);甲醇(西陇化工股份有限公司);氯化钾(西陇化工股份有限公司);石墨烯量子点(江苏先锋纳米材料科技有限公司)。
2.2 Ni-Al LDHs电极的制备
室温下,准确量取配好的0.024M Ni(NO3)2·6H2O、0.008 M Al(NO3)3·9H2O、0.2M HNO3混合溶液50ml,在电化学工作站上,采用三电极体系,饱和甘汞电极为参比电极,碳棒为对电极,使用循环伏安法沉积,扫描范围为0~-1.2V,扫描速度为50mV/s。沉积结束后用去离子水冲洗干净后备用。命名为Ni-Al LDHs电极。
2.3 GQDs电极的制备
室温下,准确量取配好的0.2M HNO3混合溶液50ml,搅拌状态下加入石墨烯量子点。使用循环伏安法沉积,扫描范围为0~-1.2V,扫描速度为50mV/s。沉积结束后用去离子水冲洗干净后备用,命名为GQDs电极。
2.4 GQDs/Ni-Al LDHs的制备
室温下,准确量取配好的0.024M Ni(NO3)2·6H2O、0.008 M Al(NO3)3·9H2O、0.2 M HNO3混合溶液50ml,搅拌状态下加入GQDs。使用循环伏安法沉积,扫描范围为0~-1.2V,扫描速度为50mV/s。沉积结束后用去离子水冲洗干净后备用,命名为GQDs/Ni-Al LDHs电极。
2.5 GQDs/Ni-Al LDHs材料的表征
材料的微观结构采用美国FEI公司的Nova Nann SEM 450型场发射扫描电子显微镜(FESEM)观察,加速电压为15kV。样品得到的方法为:在电极上电沉积材料后取下电极头直接于显微镜处观察。材料的红外光谱在德国Bruker的Vector22型傅里叶变换红外光谱仪上测得,用KBr压片。样品的得到方法为:在导电玻璃片上电沉积材料然后刮下的到粉末,在进行压片。
2.6 电化学测试
材料交流阻抗(EIS)测试在辰华CHI660C电化学工作站上完成,采用标准的三电极体系,不同材料的电极用做工作电极,饱和甘汞电极作为参比电极,碳棒作为对电极,支持电解质溶液是5mM K3[Fe(CN)6],5mM K4Fe(CN)6·3H2O,0.1M KCl的均匀混合溶液,设置频率范围为0.1Hz~100kHz。
2.7 修饰电极对MeOH的催化
沉积了Ni-Al LDHs或者GQDs/Ni-Al LDHs的修饰电极先在0.2M KOH溶液中使用循环伏安法扫描(扫描范围0~1V)直到出现稳定的循环伏安曲线,然后在原KOH溶液中加入一定量的5M MeOH溶液,以扫描范围0~1V,用循环伏安进行扫描,记录峰电流。
3 结果与讨论
3.1 材料的制作过程
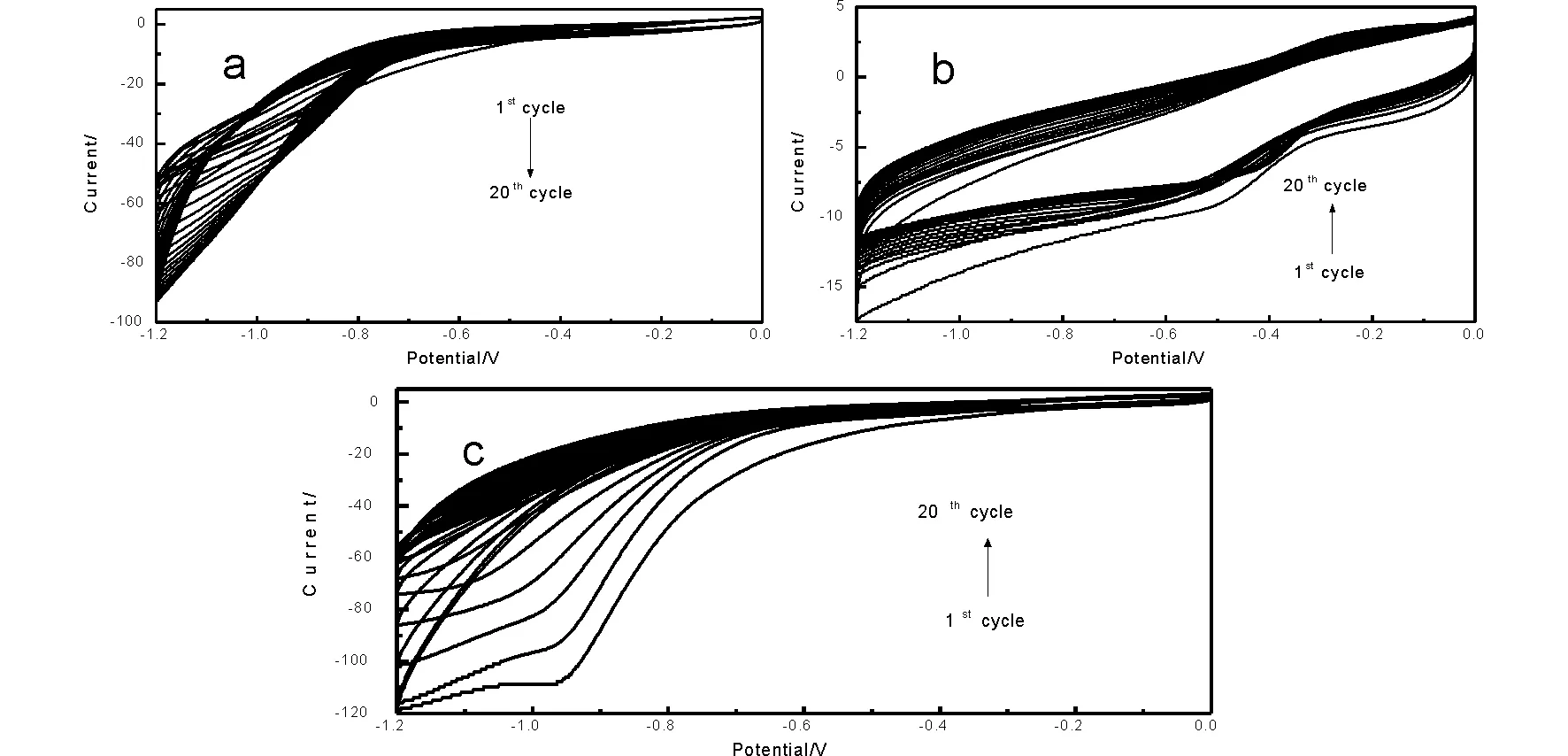
图1-1 玻碳电极在包含有0.024MNi(NO3)2·6H2O+0.008MAl(NO3)3·9H2O(a),GQDs(b)和0.024MNi(NO3)2·6H2O+0.008MAl(NO3)3·9H2O+GQDs(c)的0.2MKNO3溶液中的CV图
为了研究Ni-Al LDHs和加入GQDs后电沉积的过程,我们采用循环伏安法。
以KNO3为支持电解质分别沉积Ni-Al LDHs(a)、GQDs、(b)GQDs/Ni-Al LDHs(c),电沉积电压扫描范围为-1.2V~0V,根据之前的报道,形成水滑石的过程如下:
NO3-+H2O+2e→NO2-+2OH-
(1-X)Ni2++xAl3++2OH-+xNO3-+mH2O→
[Ni1-xAlx(OH)2]x+(NO3)x·mH2O
电沉积图如图1-1所示,清楚的看到,水滑石沉积(a)在-1.2~0之间几乎看不到有明显的氧化还原峰,随着电极表面材料增多,导电性下降,很快趋于稳定,而在加入了量子点之后(c)在-1附近,有很明显的还原峰出现,尤其前几圈,这是因为GQDs在很大程度上提高的材料的导电性,使沉积过程均匀进行,直至后来随着电极表面材料的增多,越来越厚的材料使得电极导电性下降而使沉积趋于稳定,且GQDs同样条件下单独沉积的图(b)也证明了-1V附近并非GQDs自身的还原峰,而是因为GQDs良好的导电性而提高了Ni-Al LDHs沉积时电子转移速率,从而使沉积更为均匀,更容易生成Ni-Al LDHs,这在以下SEM图和交流阻抗图中也有体现。
3.2 材料的表征及分析
(1)形貌分析

图1-2 Ni-Al LDHs的SEM图(a)、 GQDs/Ni-Al LDHs的SEM图(b)

图1-3 Ni-Al LDHs的EDS图

图1-4 GQDs/Ni-Al LDHs的EDS图
图1-2中(a)、(b)分别是Ni-Al LDHs和GQDs/Ni-Al LDHs电极表面材料形貌图(场发射扫描电镜图),可以明显的观察到,Ni-Al LDHs的SEM图中材料像激起的浪花一样,流淌的部分平整,翻起的地方卷曲,这就使得整个材料分布并不均匀,而GQDs/Ni-Al LDHs的SEM图中可以看到GQDs/Ni-Al LDHs材料像整齐堆叠起来的石碓一样,分布均匀,密实紧致,图1-3、1-4中EDS数据可以看出,GQDs/Ni-Al LDHs材料的Ni、Al含量更多,可能是GQDs增加了溶液导电性,促进了Ni-Al LDHs电沉积过程。
(2)红外分析

图1-5 Ni-Al LDHs(a)和GQDs/Ni-Al LDHs(b)材料的红外光谱图
通过红外测试可以判断材料中的官能团,图1-5显示的是分别是Ni-Al LDHs(a)和GQDs/Ni-Al LDHs(b)材料的红外光谱图,两个图较为相似,因为GQDs的含量很小,各个吸收峰主要是Ni-Al LDHs的,特征键O-H伸缩振动的吸收峰又宽又强,位于3325cm-1左右,在1325cm-1处的吸收峰可归属为层间阴离子NO3-的伸缩振动,而1625处的红外吸收峰可归属于水滑石层间自由水的羟基峰。
3.3 修饰电极在KOH溶液中的电化学行为
图1-6(a)显示出扫速为50mV/s时GCE,GQDs/GCE,Ni-Al LDHs/GCE和GQDs/Ni-Al LDHs/GCE在0.1M KOH溶液中的CV响应,GCE,GQDs/GCE没有任何的氧化还原峰出现,GQDs/GCE,Ni-Al LDHs/GCE在0.4~0.6之间均有一对针对Ni2+/Ni3+峰形明显的氧化还原峰出现,而且Ni-Al LDHs/GCE在0.1MKOH溶液中的氧化峰电流比GQDs/GCE高了2倍,这可能是因为加入了GQDs使Ni-Al LDHs更容易形成。图1-6(b)显示出GQDs/Ni-Al LDHs/GCE在0.1M KOH溶液中分别以5,10,20,40,60,80,100,200,300mV/s(从内到外)的扫速扫循环伏安得到的CV图,可以清晰地看到,随着扫速的增加,氧化还原峰之间的距离不断增大,内部插图为峰电流与扫速平方根的线性,可以看到,在扫速为5~300mV/s之间峰电流与扫速平方根呈线性,R2=0.990,证明这是一个受表面控制的电化学过程。

图1-6 (a)GCE(枚红色曲线),GQDs/GCE(紫色曲线),Ni-Al LDHs/GCE(红色曲线)和GQDs/Ni-Al LDHs/GCE(蓝色曲线)以扫速为50mV/s在0.1M KOH溶液中的CV图(b)GQDs/Ni-Al LDHs在0.1M KOH溶液中分别以5,10,20,40,60,80,100,200,300mV/s(从内到外)的扫速得到的CV图,内部插图为峰电流与扫速平方根的线性图
3.4 修饰电极的阻抗分析

图1-7 GCE(黄色曲线),Ni-Al LDHs(枚红色曲线)和GQDs/Ni-Al LDHs(紫色曲线)在5mMFe(CN)63-/4-氧化还原电对和0.1 MKCl溶液中的CV图(a)以及尼奎斯特图(b)
GCE,Ni-Al LDHs和GQDs/Ni-Al LDHs电极在包含有0.1M KCl,5mM Fe(CN)63-/4-中性溶液中用Fe(CN)63-/4-氧化还原电对检测,得到的循环伏安曲线如图1-7(a)所示,相对裸玻碳电极,沉积Ni-Al LDHs和GQDs/Ni-Al LDHs电极的氧化还原峰电流均有所减小,尤其单纯的Ni-Al LDHs,氧化还原峰几乎消失,而加了GQDs之后氧化还原峰都有了很大的提高,这个结果表明电子转移速率被电极材料也就是Ni-Al LDHs所牵制,证明Ni-Al LDHs导电性很差,GQDs能提高材料的导电性,从加入GQDs使得GQDs/Ni-Al LDHs电极的氧化还原峰都有很大的提高就能印证。
电化学交流阻抗图谱进一步对电极表面界面特征进行表征,Ni-Al LDHs和GQDs/Ni-Al LDHs电极的尼奎斯特图都是典型的EIS图谱,包括高频下的半圆和低频下的斜线,高频区为界面电荷转移力学控制的半圆弧,低频区为扩散控制的直线。如图1-7(b)所示,根据圆弧半径越大电阻越大的结论可以知道Ni-Al LDHs的电阻最大,而加了GQDs之后,复合电极电阻明显减小,证明GQDs可以提高复合材料的导电性。
3.5 修饰电极上MeOH的催化氧化研究
(1)修饰电极电极催化甲醇氧化及空白的对比研究
Ni基材料可以形成Ni(OH)2/NiOOH氧化还原电对,电催化特性优异,被广泛用于构建MeOH传感器,不同电极上电催化MeOH氧化通过CV来对比研究的,图1-8呈现出不同的电极在0.1M KOH中含有和不含有0.1M MeOH,扫速为30mV/s时的CV响应,如图1-8所示,赤裸的GCE(a)加入MeOH与否均无氧化还原峰出现,GQDs修饰的GCE(b)响应非常有限,MeOH的氧化需要较高的正电势,这就导致电极反应动力学的降低,相比而言,Ni-Al LDHs修饰的电极(c)有一对较为明显的氧化还原峰,(c)中Ni-Al LDHs修饰的电极在0.1M KOH中扫速为30mV/s的CV图(蓝色曲线)包含氧化峰电压为0.43V的氧化反应和还原峰电压为0.5V的还原反应。氧化反应的峰对应Ni(OH)2氧化为NiOOH,还原反应的峰对应NiOOH还原为Ni(OH)2,对应的氧化还原反应如下:

图1-8 (a)GCE,(b)GQDs/GCE,(c)Ni-Al LDHs和(d)GQDs/Ni-Al LDHs在0.1M KOH溶液中含有(红色曲线)不含有(蓝色曲线)0.1M MeOH,扫速为30mV/s的CV图
Ni(OH)2+OH-←→NiOOH+H2O+e-
(1)
(c)中Ni-Al LDHs修饰的电极在含有0.1M MeOH的0.1M KOH溶液中以30mV/s扫速得到的CV图(红色曲线)中氧化电流是MeOH氧化反应产生的,还原电流虽然也能看到,但是峰却比不含0.1M MeOH的0.1MKOH(蓝色曲线)中的峰要低很多,还原峰的减小是因为MeOH会消耗一部分NiOOH,反应如下:
NiOOH+MeOH←→Ni(OH)2+products
(2)
加入MeOH后,MeOH被还原,当电势到0.45V时,氧化峰电流明显开始升高,阴极电流几乎消失,因为Ni-Al LDHs能直接催化MeOH氧化,而对于GQDs/Ni-Al LDHs修饰的纳米复合电极(d),加入MeOH后,氧化电流增加的更高,MeOH开始氧化的电压更小,复合材料电催化能力的提高,可能归功于GQDs良好的导电性和Ni-Al LDHs良好催化效果间的协同效应,这种一步电沉积的方法使复合电极催化MeOH氧化具有更多的催化活性位点,更高负载量和更高效的电子转移通道。
(2)不同修饰电极催化MeOH氧化的对比研究

图1-9 GCE(枚红色曲线),GQDs/GCE(紫色曲线),Ni-Al LDHs(红色曲线)和GQDs/Ni-Al LDHs(蓝色曲线)(a)在含有0.1M MeOH的0.1M KOH溶液中的CV图,扫速为30mV/s
GQDs/Ni-Al LDHs复合材料修饰的GCE通过CV来研究其电化学行为,图1-9展示出GCE,GQDs/GCE,Ni-Al LDHs/GCE和GQDs/Ni-Al LDHs/GCE在含有0.1M MeOH的0.1M KOH中以50mV/s的CV响应,观察可知,GCE没有氧化还原峰电流出现,说明GCE在观察的电压范围内没有电化学反应,然而,Ni-Al LDHs/GCE和GQDs/Ni-Al LDHs/GCE都能观察到一对明显的氧化还原峰,GQDs/Ni-Al LDHs/GCE氧化还原峰电流明显比Ni-Al LDHs/GCE高,这是因为GQDs为催化剂Ni-Al LDHs提供了更高效的电子转移通道,也提高了材料的比表面积。
(3)GQDs/Ni-Al LDHs电极计时电流研究
双电位阶越计时电流也是GQDs/Ni-Al LDHs复合材料修饰电极的一种电化学表征方法,在不含有MeOH的KOH溶液中和含有不同浓度MeOH的KOH溶液中的双电位阶越计时电流设置的电压阶分别为:第一阶越电压为600mV,第二阶越电压为300mVvs.SCE,如图1-10所示,可以观察到,计时电流的电流变化和在循环伏安中观察到的值具有很好的一致性,随着MeOH浓度的增加,电流也相应地增加,这个结果也支持了Ni-Al LDHs可以催化MeOH的结论。在不含有MeOH的空白溶液里,GQDs/Ni-Al LDHs修饰电极计时电流前后两个电阶的计时电流几乎是对称的,在有限的Ni(Ⅱ)/Ni(Ⅲ)位点表面,氧化还原消耗的电荷几乎相同,如图A中a`,加了MeOH以后,计时电流前半段的电荷值远远大于后半段如图A中e`,当电压越至300mV时,电流几乎小到微不足道。

图1-10 GQDs/Ni-Al LDHs修饰电极在不含有(a)和含有(b)0.01M(c)0.05M(d)0.1M(e)0.2M MeOH的0.1MKOH溶液中的计时电流图,第一、第二阶越电压为600mV和300mVvs.SCE。内部插图(A)电荷量vs.时间,(a`)和(e`)是由计时电流中(a)和(e)派生的。插图(B)IC/ILvs.t1/2是由计时电流中(a)和(e)求得的。(C)I(μA)vs.t-1/2是由计时电流中(a)得到的。
在MeOH和还原位点GQDs/Ni-Al LDHs之间的化学反应速率常数根据之前报道过的文献,可以通过计时电流数据算出。
IC/IL=γ1/2[π1/2erf(γ1/2)+exp(-γ)γ-1/2]
(3)
IC:有MeOH时GQDs/Ni-Al LDHs复合电极上的催化电流;
IL:无MeOH时的限制电流;
γ=kCot是误差函数的参数(Co是MeOH的体积浓度,t是经过的时间,k为催化速率常数);
γ超过2的情况下,误差函数近似等于1,则:
IC/IL=γ1/2π1/2=π1/2(kCot)1/2
(4)
k为催化速率常数(cm3mol-1s-1);
Co是MeOH的浓度(mol·cm-3);
t是经过的时间(s)。
根据IC/IL与t1/2的斜线图,k值若给定MeOH浓度是可以计算得到的,图中插图(B)中斜线所示,线性方程为:
Y=-69.17+55.32X,R2=0.997。GQDs/Ni-Al LDHs在不含有和含有0.2MMeOH,平均k值为4.4×104cm3mol-1s-1
图中插图C可知GQDs/Ni-Al LDHs在MeOH中静电流与t-1/2呈线性,线性方程为:
Y=-19.38+923.54X,R2=0.991,证明这个过程是由扩散引起的。
4 结论
实验表明Ni-Al LDHs和GQDs之间的协同作用能显著提高GQDs/Ni-Al LDHs复合材料催化MeOH氧化的效率,这个廉价易得的GQDs/Ni-Al LDHs膜材料可以作为甲醇燃料电池的阳极材料,拓宽燃料电池的应用,改善贵金属催化剂昂贵、存储有限造成燃料电池大规模商业应用受阻的现状。
[1]Barakat NAM,Motlak M.CoxNiy-decorated graphene as novel,stable and supereffective non-precious electro-catalyst for methanol oxidation.Applied Catalysis B:Environmental 2014;154-155:221-31.
[2]Lin Y,Ruiyi L,Zaijun L,Junkang L,Yinjun F,Guangli W,et al.Three-dimensional activated reduced graphene oxide nanocup/nickel aluminum layered double hydroxides composite with super high electrochemical and capacitance performances.Electrochimica Acta 2013;95:146-54.
[3]Azizi SN,Ghasemi S,Chiani E.Nickel/mesoporous silica(SBA-15)modified electrode:An effective porous material for electrooxidation of methanol.Electrochimica Acta 2013;88:463-72
[4]Zheng J-N,Li S-S,Ma X,Chen F-Y,Wang A-J,Chen J-R,et al.Green synthesis of core-shell gold-palladium@palladium nanocrystals dispersed on graphene with enhanced catalytic activity toward oxygen reduction and methanol oxidation in alkaline media.Journal of Power Sources 2014;262:270-8.
[5]Awasthi R,Singh RN.Graphene-supported Pd-Ru nanoparticles with superior methanol electrooxidation activity.Carbon 2013;51:282-9.
[6]You H,Zhang F,Liu Z,Fang J.Free-Standing Pt-Au Hollow Nanourchins with Enhanced Activity and Stability for Catalytic Methanol Oxidation.ACS Catalysis 2014;4:2829-35.
[7]Kim S-M,Jo Y-G,Lee S-Y.The composition-controlled synthesis of Pt-Ag bimetallic nanochains for catalytic methanol oxidation.Electrochimica Acta 2015;174:1244-52.
[8]Wu H,Li H,Zhai Y,Xu X,Jin Y.Facile synthesis of free-standing Pd-based nanomembranes with enhanced catalytic performance for methanol/ethanol oxidation.Advanced materials2012;24:1594-7.
[9]Li S-S,Lv J-J,Hu Y-Y,Zheng J-N,Chen J-R,Wang A-J,et al.Facile synthesis of porous Pt-Pd nanospheres supported on reduced graphene oxide nanosheets for enhanced methanol electrooxidation.Journal of Power Sources 2014;247:213-8.
[10]Ghasem Karim-Nezhad SP,Ali Pashazadeh.Ni/Al LDH Nanoparticles Modified Carbon Paste Electrode:Application to Electro-Catalytic Oxidation of Methanol.Anal Bioanal Electrochem 2012;Vol.4:399-416.
[11]Zhao B,Liu J,Zhou L,Long D,Feng K,Sun X,etal.Probing the electronic structure of M-graphene oxide(M=Ni,Co,NiCo)catalysts for hydrolytic dehydrogenation of ammonia borane.Applied Surface Science 2016;362:79-85.
[12]Xili Tong YQ,Xiangyun Guo,Oussama Moutanabbir,Xianyu Ao,Eckhard Pippel,Lianbing Zhang,Mato Knez.Enhanced Catalytic Activity for Methanol Electrooxidation of Uniformly Dispersed Nickel Oxide Nanoparticles—Carbon Nanotube Hybrid Materials.small 2012;8:3390-5.
[13]Ding R,Qi L,Jia M,Wang H.Sodium dodecyl sulfate-assisted hydrothermal synthesis of mesoporous nickel cobaltite nanoparticles with enhanced catalytic activity for methanol electrooxidation.Journal of Power Sources 2014;251:287-95.
[14]Yinling Wang HJ,Wei Peng,Lin Liu,Feng Gao,Maoguo Li.Gold nanoparticle-coated Ni/Al layered double hydroxides on glassy carbon electrode for enhanced methanol electro-oxidation.international journal of hydrogen energy 2012;37:9324-9.
[15]Cai X,Shen X,Ma L,Ji Z,Xu C,Yuan A.Solvothermal synthesis of NiCo-layered double hydroxide nanosheets decorated on RGO sheets for high performance supercapacitor.Chemical Engineering Journal 2015;268:251-9.
[16]Yinling Wang.Dandan Zhang WP,Lin Liu,Maoguo Li.Electrocatalytic oxidation of methanol at Ni-Al layered double hydroxide film modified electrode in alkaline medium.Electrochimica Acta 2011;56:5754-8.
[17]Dong Y,Li G,Zhou N,Wang R,Chi Y,Chen G.Graphene quantum dot as a green and facile sensor for free chlorine in drinking water.AnalChem 2012;84:8378-82.
[18]Deng L,Liu L,Zhu C,Li D,Dong S.Hybrid gold nanocube@silica@graphene-quantum-dot superstructures:synthesis and specific cell surface protein imaging applications.Chem Comm 2013;49:2503-5.
[19]Chakraborti H,Sinha S,Ghosh S,Pal SK.Interfacing water soluble nanomaterials with fluorescence chemosensing:Graphene quantum dot to detect Hg2+ in 100% aqueous solution.Materials Letters 2013;97:78-80.
[20]Mondal S,Rana U,Malik S.Graphene Quantum Dots doped Polyaniline Nanofiber as High Performance Supercapacitor Electrode Materials.Chemical communications 2012;0:1-3.

