精子顶体相关基因SPACA7的转录活性研究
张菁华,周永翠,唐爱发*
(1.中山大学中山医学院,广州 510275;2.深圳市第二人民医院转化医学研究院,深圳 518037)
本实验室前期研究中,采用Affymetrix公司的小鼠全基因组表达谱芯片筛选出一批睾丸特异性表达新基因,其中一个睾丸特异性基因是SPACA7(原命名为T279),小鼠不同组织、器官、细胞系的高通量基因表达模式显示,SPACA7仅在睾丸组织中特异表达[1]。SPACA7属于精子顶体结合蛋白家族成员,该蛋白家族成员只有SPACA3和SPACA5具有较高的氨基酸同源性,其它成员同源性不高。有报道表明,在小鼠雄性生殖细胞发生过程中有超过50%的基因组基因发生表达,但是仅仅只有4%的基因组基因发生转录。基因转录调控对于该基因的时空表达以及表达强度等至关重要,本文旨在通过分析SPACA7 16对启动子的转录活性,筛选SPACA7的有效启动子,为日后研究SPACA7的基因转录调控做基础。
资料与方法
一、研究对象及试剂
1.研究对象:人肾上皮细胞293T(购自美国模式培养物集存库ATCC,CRL-3216)。
2.主要试剂:pGL3-basic、Renilla质粒和Dual-Luciferase Reporter Assay System购自美国Promega公司;逆转录试剂盒、高保真DNA聚合酶primer STAR、DNA聚合酶ExTaq以及相关PCR试剂购自日本TakaRa公司;RNA提取试剂盒、DNA提取试剂盒、凝胶回收试剂盒和质粒小量提取试剂盒购自美国QIAGEN公司;限制性内切酶XhoⅠ、HindⅢ 和T4DNA连接酶购自美国New England Biolabs公司;无内毒素质粒大量抽提试剂盒和Lipofectamine 2000脂质体转染试剂购自美国Invitrogen公司;胎牛血清及培养基购自美国Gibco公司。
3.主要仪器:PCR仪(ABI Veriti,美国)、凝胶成像系统(Bio-Rad GelDoc,美国)、酶标仪(THERMO FISHER Multiskan FC,美国)。
二、实验方法
1.SPACA7基因启动子序列获取及引物设计和合成:使用Promoter 2.0和Neural Network Promoter Prediction对SPACA7基因启动子进行分析,在NCBI的GeneBank中查找,获取人类SPACA7基因转录起始位点上游2000 bp与下游84 bp序列。利用Primer Premier 5.0软件设计16对启动子引物(表1),上游引物含XhoⅠ酶切位点和保护碱基,下游引物含HindⅢ 酶切位点和保护碱基。

表1 PCR引物序列
2.细胞培养:293T细胞培养于含10%胎牛血清、1%青霉素和链霉素的DMEM培养基中,在含5% CO2的37℃培养箱中培养,每两天进行传代培养。
3.人肾上皮细胞293T基因组DNA提取:待接种于T25培养瓶的293T细胞生长至对数生长期、80%左右融合度时,弃去培养基,1×PBS清洗3次,用细胞刮刮下细胞,收集于离心管中,参照QIAGEN基因组DNA提取试剂盒说明书提取293T细胞基因组DNA。
4. PCR扩增SPACA7启动子序列和pGL3-basic表达载体构建:以上述提取的基因组DNA为模板,采用高保真DNA聚合酶扩增相应的DNA片段。PCR反应程序如下:98℃预变性3 min;98℃变性10 s,55℃退火15 s,72℃延伸30 s至2 min,30个循环;72℃延伸7 min;4℃+∞。PCR产物通过1%琼脂糖凝胶电泳检测,并进行凝胶回收。XhoⅠ和HindⅢ 双酶酶切胶回收产物和pGL3-basic载体。上述酶切产物进行琼脂糖凝胶电泳和凝胶回收纯化,将纯化回收的不同长度的启动子片段与载体大片段进行连接反应。连接产物转化大肠杆菌DH5α感受态细胞,提取质粒,测序进行鉴定。
5.细胞转染及荧光素酶活性检测:经测序鉴定成功的质粒菌种进行无内毒素大量质粒抽提,转染前用无血清DMEM培养基稀释各质粒浓度至1 μg/μl,将重组质粒与内参pRL-TK同时转染细胞,pGL3-SPACA7和Renilla的用量分别为1 μg/孔和0.02 μg/孔,转染试剂为2 μg/孔。转染12 h后,给细胞换新鲜的培养基,24 h后收集细胞,吸掉培养基后用1×PBS清洗三次,然后加入100 μl裂解液室温下轻缓晃动15 min,收集细胞裂解液,按照Dual-Luciferase Reporter Assay System说明书,使用Thermo VARIOSCAN FLASH 3001多功能酶标仪测定荧光素酶活性。每次实验设置3个复孔,同一转染实验重复3次,取其平均值。
三、统计分析
独立实验重复至少三次;数据由SPSS软件(SPSS Inc,Chicago,IL)处理。
结 果
一、SPACA7基因的筛选和鉴定
我们采用人全基因组芯片与胚胎睾丸探针和成人睾丸探针差异杂交筛选出一个在成人睾丸中高表达的SPACA7基因。采用小鼠和人同源基因比较分析,我们找到了相应的小鼠同源基因,我们研究发现小鼠Spaca7基因的芯片杂交信号校正值在4、9、18、35、54日龄和6月龄小鼠睾丸中分别为0.9、0.2、3.9、659.8、726.3和793.6,可见Spaca7基因在18日龄之前小鼠睾丸组织中基本不表达,在18日龄之后才开始表达,并随日龄的增加表达逐渐增强(图1A)。
为了验证上述GeneChip结果,我们对4、6、9、11、15、19、24、31、36、40和54天小鼠的睾丸组织进行RT-PCR分析,结果显示Spaca7转录本仅在出生后15 d的睾丸组织中开始检测到,且随着日龄的增加其表达逐渐增强(图1B)。RT-PCR分析结果与上述不同日龄小鼠睾丸的芯片分析结果有细微的差别,但在整体上都反映出Spaca7基因的表达呈现年龄依赖性特征。由此可见,Spaca7基因在小鼠睾丸组织中的表达具有时间依赖性,幼年期不表达,成年期高表达,提示Spaca7基因主要在成年期小鼠睾丸组织中发挥作用。
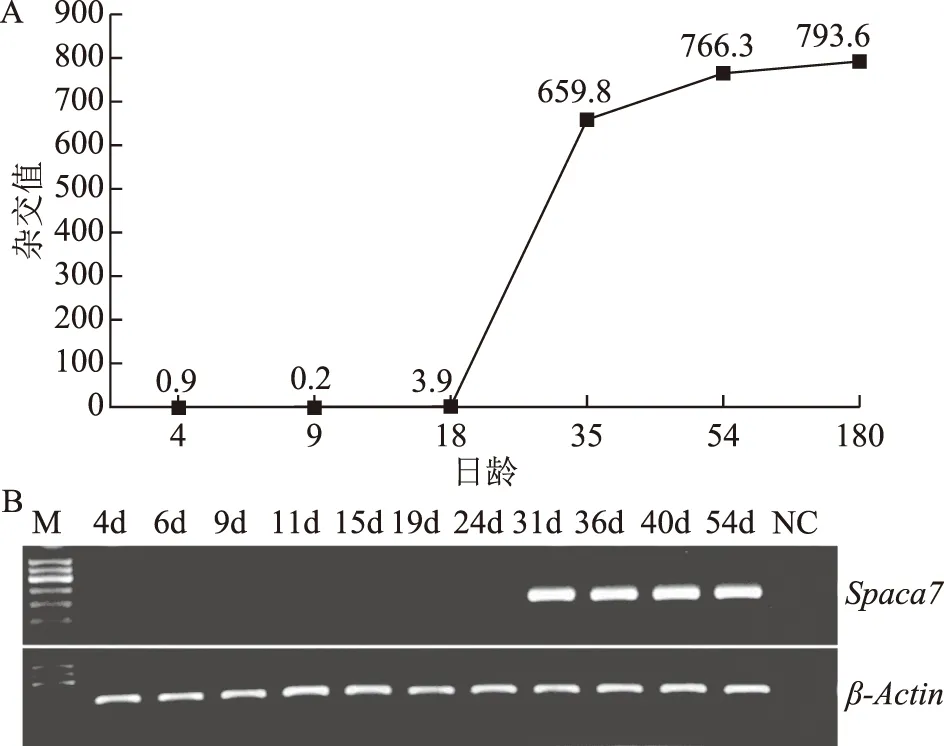
A:小鼠Spaca7基因在不同日龄小鼠睾丸中的GeneChip杂交值;B:RT-PCR分析Spaca7基因在不同日龄小鼠睾丸中的表达特征;d:日龄;NC:阴性对照图1 小鼠Spaca7基因的GeneChip和RT-PCR分析
二、SPACA7基因的生物信息学分析
人SPACA7基因(GeneBank登录号:NM_145248)定位于染色体13q34位点,其cDNA长度773 bp,在32~619 bp之间有一阅读框,含有588 bp的完整开放阅读框,编码一个由195个氨基酸组成、分子量为21.48 KDa的蛋白质,等电点4.65,32~34处为起始密码子ATG,617~619处为终止密码子TGA,SPACA7蛋白在1~19位氨基酸处有跨膜区。将SPACA7 cDNA序列输入数据库进行不同物种序列BLAST比对发现小鼠睾丸有同源基因Spaca7(GenBank登录号:NM_024279),其定位于染色体8A2位点,其cDNA长度761 bp,开放阅读框549 bp,编码一个182个氨基酸,分子量为19.94 KDa的蛋白质,等电点4.56,58~60 bp处为起始密码子ATG,604~606 bp处为终止密码子TAG。人和小鼠SPACA7基因的核苷酸序列达到64.5%的同源性,其编码的蛋白氨基酸序列比对相同率达到45%(图2),说明SPACA7是一个人-鼠同源基因。
三、SPACA7启动子的克隆与鉴定
以293T细胞基因组DNA为模板,表一所列引物,进行PCR扩增,得到一系列大小不同的特异性条带(图3)。将PCR产物纯化之后酶切、连接,得到重组质粒,测序结果与NCBI记录信息一致。

图2 SPACA7基因核苷酸序列在人和小鼠中的同源性比较
图3 SPACA7启动子克隆PCR产物
四、双荧光素酶检测结果
将构建成功的pGL3-SPACA7重组质粒转染到293T细胞中,收集细胞并对细胞裂解液进行双荧光素酶报告基因检测,结果显示,转染了pGL3-Basic空载质粒(VEC)的阴性对照组比其它的重组质粒转染组荧光活性都要低,说明各重组质粒转染到293T细胞后均表现出了启动子活性。通过比较16个不同长度启动子与空载体的相对荧光素酶活性,其中以pGL3-SPACA7-F2(-1 500 bp~+84 bp)启动子活性最强(图4)。
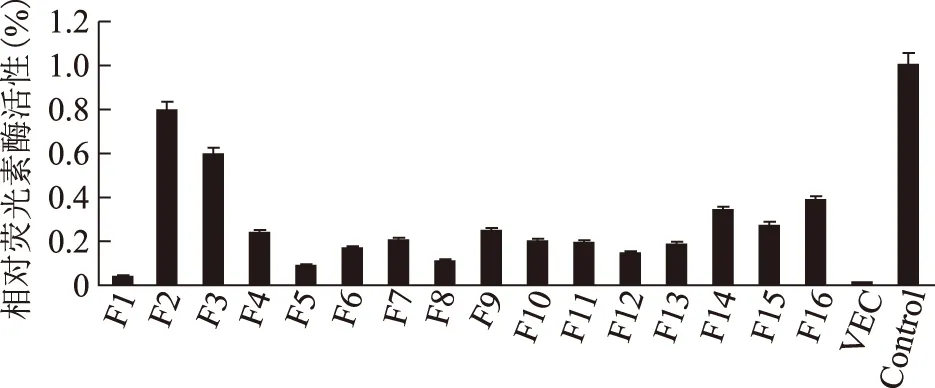
图4 荧光素酶检测结果
讨 论
迄今为止,各国科学家采用基因芯片和生物信息学分析等技术,推测哺乳动物精子发生过程中表达的睾丸特异性基因达2 300多个[2],它们参与生物发育过程的各个阶段,如染色质包装(Prm1[3]、Prm2[4]、Prm3[5]、Tnp1[6]、Tnp2[6]、H1FNT[7]),精子尾部形成(Tektin-t[8]、Vdac3[9]、Sepp1[10]、Akap4[11]、Spag6[12]、MEIGI[13]),能量代谢(Gapds[14]、sAC[15]、SLO3[16]、PRSS21[17]),顶体形成(Agfg1[18]、Gopc[19]、CD59b[20]、GBA2[21]、SPATA16[22]),透明带结合和信号传导(Tenr[23]、Clgn[24]、Catsper1-4[25])等重要过程,因此研究睾丸特异性表达基因具有重要意义。
我们利用启动子截短实验获得了SPACA7不同长度系列启动子16个,对其进行了荧光素酶活性检测,发现在-1 500 bp至+84 bp区域具有较强转录活性,而-2 000 bp至+84 bp区域启动子转录活性较低,说明在-2 000 bp至-1 500 bp区域启动子上可能存在一段增强子,促进SPACA7基因的表达,而与该增强子相互作用的反式作用因子还需进一步实验。
SPACA7在人类、小鼠、黑猩猩、猕猴中有同源物,但是这些蛋白没有保守的结构域,并且其功能尚不明确。已知SPACA家族成员具有相似的表达定位,因此研究SPACA的转录表达具有重要意义。生物信息学分析发现SPACA7的启动子上具有AP1、USF、GATA-1、MZF1、SRY和RUNX1等转录因子结合位点,其中SOX基因家族主要在减数分裂后的生殖细胞中特异表达,在圆形精子中表达量最高。SOX基因家族成员是否参与SPACA7的基因表达调控还需进一步的实验证实,这里我们鉴定到了具有高转录活性的SPACA7启动子对其表达调控的研究具有重要意义。
【参考文献】
[1] 周永翠. 三个新的精子发生相关基因在人和小鼠睾丸中的表达特征[D]. 汕头大学,2009.
[2] Guo X,Shen J,Xia Z,et al. Proteomic analysis of proteins involved in spermiogenesis in mouse[J]. J Proteome Res,2010,9: 1246-1256.
[3] Ravel C,Chantot-Bastaraud S,EI Houate B,et al. Mutations in the protamine 1 gene associated with male infertility[J]. Mol Hum Reprod,2007,13: 461-464.
[4] Cho C,Jung-Ha H,Willis WD,et al. Protamine 2 deficiency leads to sperm DNA damage and embryo death in mice[J]. Biol Reprod,2003,69: 211-217.
[5] Grzmil P,Boinska D,Kleene KC,et al. Prm3,the fourth gene in the mouse protamine gene cluster,encodes a conserved acidic protein ahat affects sperm motility[J]. Biol Reprod,2008,78: 958-967.
[6] Shirley CR,Hayashi S,Mounsey S,et al. Abnormalities and reduced reproductive potential of sperm from Tnp1-and Tnp2-null double mutant mice[J]. Biol Reprod,2004,71: 1220-1229.
[7] Tanaka H,Iguchi N,Isotani A,et al. Hanp1/H1t2,a novel histone H1-like protein involved in nuclear formation and sperm fertility[J]. Mol Cell Biol,2005,25: 7107-7119.
[8] Tanaka H,Iguchi N,Toyama Y,et al. Mice deficient in the axonemal protein Tektin-t exhibit male infertility and immotile-cilium syndrome due to impaired inner arm dynein function[J]. Mol Cell Biol,2004,24: 7958-7964.
[9] Kwon WS,Park YJ,Mohamed eI-SA,et al. Voltage-dependent anion channels are a key factor of male fertility[J]. Fertil Steril,2013,99: 354-361.
[10] Renko K,Werner M,Renner-Muller I,et al. Hepatic selenoprotein P(Sepp) expression restores selenium transport and prevents infertility and motor-incoordination in Sepp-knockout mice[J]. Biochem J,2008,409: 741-749.
[11] Miki K,Willis WD,Brown PR,et al. Targeted disruption of the Akap4 gene causes defects in sperm flagellum and motility[J]. Dev Biol,2002,248: 331-342.
[12] Sapiro R,KostetskⅡ I,Olds-Clarke P,et al. Male infertility,impaired sperm motility,and hydrocephalus in mice deficient in sperm-associated antigen 6[J]. Mol Cell Biol,2002,22: 6298-6305.
[13] Salzberg Y,Eldar T,Karminsky OD,et al. Meig1 deficiency causes a severe defect in mouse spermatogenesis[J]. Dev Biol,2010,338: 158-167.
[14] Miki K,Qu W,Goulding EH,et al. Glyceraldehyde 3-phosphate dehydrogenase-S,a sperm-specific glycolytic enzyme,is required for sperm motility and male fertility[J]. Proc Natl Acad Sci USA,2004,101: 16501-16506.
[15] Xie F,Garcia MA,Carlson AE,et al. Soluble adenylyl cyclase(sAC) is indispensable for sperm function and fertilization[J]. Dev Biol,2006,296: 353-362.
[16] Santi CM,Martinez-Lopez P,de la Vega-Beltran JL,et al. The SLO3 sperm-specific potassium channel plays a vital role in male fertility[J]. FEBS Lett,2010,584: 1041-1046.
[17] Netzel-Arnett S,Bugge TH,Hess RA,et al. The glycosylphosphatidylinositol-anchored serine protease PRSS21(testisin) imparts murine epididymal sperm cell maturation and fertilizing ability[J]. Biol Reprod,2009,81: 921-932.
[18] Kang-Decker N,Mantchev GT,Juneja SC,et al. Lack of acrosome formation in Hrb-deficient mice[J]. Science,2001,294: 1531-1533.
[19] Yao R,Ito C,Natsume Y,et al. Lack of acrosome formation in mice lacking a Golgi protein,GOPC[J]. Proc Natl Acad Sci U S A,2002,99: 11211-11216.
[20] Donev RM,Sivasankar B,Mizuno M,et al. The mouse complement regulator CD59b is significantly expressed only in testis and plays roles in sperm acrosome activation and motility[J]. Mol Immunol,2008,45: 534-542.
[21] Yildiz Y,Matern H,Thompson B,et al. Mutation of beta-glucosidase 2 causes glycolipid storage disease and impaired male fertility[J]. J Clin Invest,2006,116: 2985-2994.
[22] Dam AH,Koscinski I,Kremer JA,et al. Homozygous mutation in SPATA16 is associated with male infertility in human globozoospermia[J]. Am J Hum Genet,2007,81: 813-820.
[23] Connolly CM,Dearth AT,Braun RE. Disruption of murine Tenr results in teratospermia and male infertility[J]. Dev Biol,2005,278: 13-21.
[24] Inoue N,Yamaguchi R,Ikawa M,et al. Sperm-egg interaction and gene manipulated animals[J]. Soc Reprod Fertil Suppl,2007,65: 363-371.
[25] Xing YY,Huang LS,Brenig B,et al. Radiation hybrid mapping of seven porcine calcium channel genes(CATSPER1-4 and CNGA1-3) associated with male fertility[J]. Anim Genet,2008,39: 573-574.

