利用鼠胚实验对新建人类辅助生殖实验室进行质量控制分析
屈春凤,莫凤明,蒋军松,韦福庆,韦海燕
(广西河池市人民医院生殖医学科,河池 547000)
体外受精-胚胎移植(IVF-ET)是一项有效治疗不孕不育的人类辅助生殖技术(ART),而IVF实验室好比一座加工厂,对IVF结局有着极为重要的影响[1]。相对于体内,体外培养的配子/胚胎脱离了母体自身保护,不具备任何保护屏障,对体外微环境的变化非常敏感,有可能会影响其发育潜能。因此,在辅助生殖全过程中需要有严格的实验室质量控制系统与质量保障系统为配子和胚胎的生长发育提供一个相对稳定的场所。那么,对于新建IVF实验室在启用前,更应该全方位地监督和检测各个环节,以建立稳定、可靠的培养体系,保证胚胎的质量。鼠胚实验(mouse embryo assay,MEA)是目前最常用于实验室培养液、耗材及设备质量控制的生物检测方法,适用于新建或新启动周期的IVF实验室质量控制[2]。我院IVF胚胎实验室于2016年初建成,启用前对其进行了为期1个月的“热处理”[3]后,自6月至11月,在新实验室环境下,我们利用昆明系小白鼠行体内外受精及胚胎培养实验进行质控评估,为开展人类胚胎体外培养提供可靠的实验依据及质量保障。现将实验情况报道如下。
一、材料与方法
1. 实验动物:6周龄雌性昆明系小白鼠、8周龄以上雄性昆明系小白鼠,均购自广西医科大学实验动物中心,在控光(白天光照12 h,夜间黑暗12 h)、控温(20~25℃)条件下适应性喂养一周后方用于实验。
2. 试剂与设备:取胚胎处理液G-MOPS、洗精受精液G-IVF、卵裂胚培养液G1、囊胚培养液G2、人血清白蛋白HAS、石蜡油,均为瑞典Vitrolife 公司产品;Labotect CO2培养箱(德国);K-SYSTEMS三气培养箱(丹麦);NIKON 解剖显微镜、NIKON 倒置显微镜(日本);K-SYSTEMS IVF工作站(丹麦);Labotect CO2浓度检测仪(德国)等。
3. 小鼠超排卵[4]:将注射用血促性素(PMSG)和注射用绒促性素(HCG,均购自杭州动物药品厂)配制成100 U/ml的溶液,分装保存于-20℃。培养液均于使用前一天下午配制好后置于37℃、含6%CO2浓度培养箱过夜平衡,G-MOPS置于37℃恒温箱平衡。雌鼠腹腔内注射PMSG 10 U/只,48 h后再腹腔内注射HCG 10 U/只。
4. 体外受精实验:(1)卵母细胞的采集:HCG后15~16 h采用颈椎脱臼法处死雌鼠,无菌条件下取出输卵管,于G-MOPS+10%HAS中冲洗3次,用1 ml注射器于体视镜下轻轻刺破输卵管膨大部使卵子团释放出来,将其收集并转移至G-IVF受精液中,于37℃、含6%CO2浓度培养箱中培养待授精。(2)精子的采集与获能:采用颈椎脱臼法处死雄鼠,无菌条件下取出附睾尾,于G-MOPS+10%HAS中冲洗3次,用眼科镊轻轻挤出精子,收集精子悬液加入装有G-IVF液的试管底部,置于37℃、含6%CO2浓度培养箱中上游并获能30~60 min。(3)体外受精与培养:收集获能后上层精子于另一试管中,显微镜下观察其活力及浓度,取适量精子悬液加入含有卵子团的G-IVF液中,使其终浓度约为1.5×106/ml,置于37℃、含6%CO2浓度培养箱中培养,授精4 h后将卵子移至另一含G-IVF液受精皿中继续培养。
5. 体内受精实验:HCG后将雌雄小鼠按1∶1合笼,次日早上观察雌鼠是否见阴栓。观察到阴栓的雌鼠以颈椎脱臼法处死,无菌条件下取出输卵管,于G-MOPS+10%HAS中冲洗3次,用1 ml注射器于体视镜下轻轻刺破输卵管膨大部使合子释放出,将其收集并转移至G-IVF受精液中,于37℃、含6%CO2浓度培养箱中培养。
6. 原核及卵裂期胚胎的观察与培养(图1):D0:下午原核观察;D1:上午2细胞期胚胎观察,并将其转至已过夜平衡的卵裂胚培养液中继续培养;D2:上午4细胞期胚胎观察,下午8细胞期胚胎观察,并转至已过夜平衡的囊胚培养液中继续培养;D3:上午桑椹期胚胎观察;D4:上午早期囊胚观察;D5~D6:上午囊胚观察。
7. 数据分析:采用统计学软件SPSS 19.0进行数据分析,计数资料采用χ2检验,检验水准α=0.05。P<0.05为差异有统计学意义。
二、结果
1. 体外受精实验结果:共进行了25个体外受精周期实验,总获卵1 023个,其中原核受精胚共823个,受精率为80.4%,卵裂率为95.1%,2-细胞囊胚形成率为77.1%(表1)。
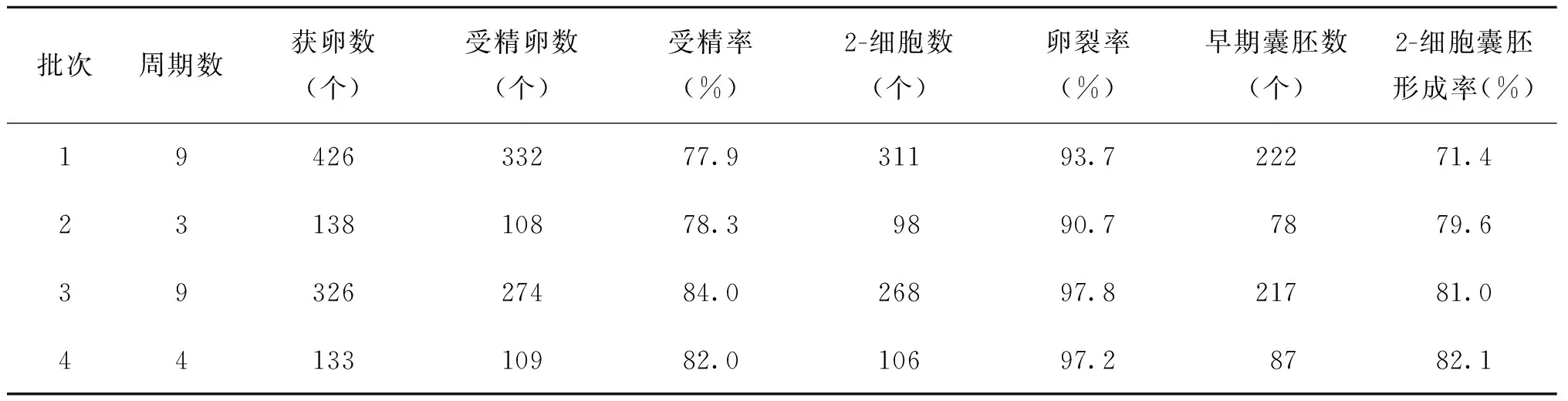
表1 昆明系小白鼠体外受精及胚胎培养实验结果
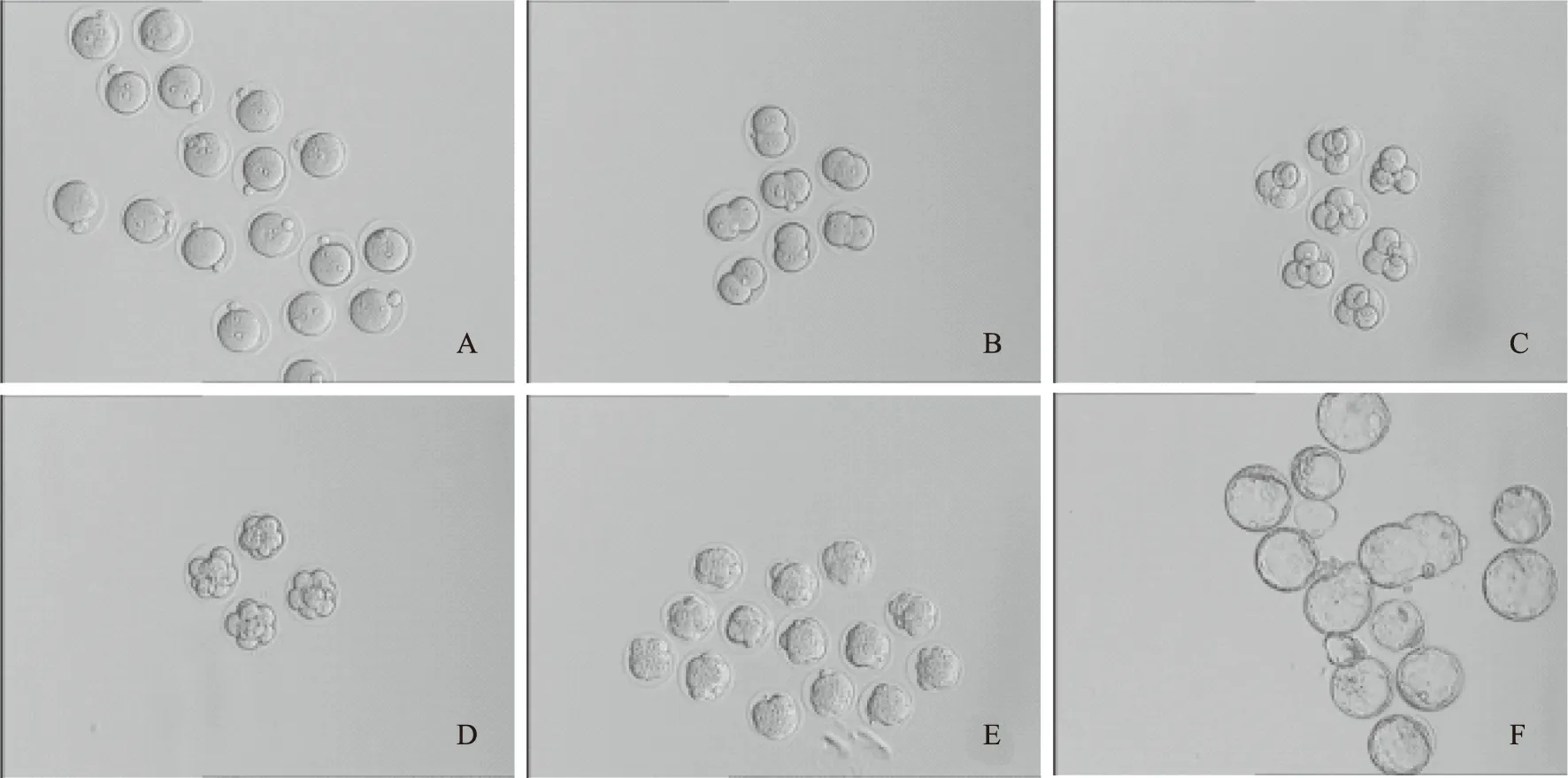
A:合子;B:2-细胞胚胎;C:4-细胞胚胎;D:8-细胞胚胎;E:桑葚胚;F:囊胚图1 不同发育阶段的小鼠胚胎(×10)
2.体内受精实验结果:共进行了17个体内受精周期实验,共获卵642个,其中原核受精胚513个,受精率79.9%,卵裂率为97.1%,2-细胞囊胚形成率为80.9%(表2)。
3.两组实验小鼠胚胎体外培养结果比较:体内受精组与体外受精组相比,其受精率、卵裂率及2-细胞囊胚形成率两组间差异均无统计学意义(P>0.05)(表3)。
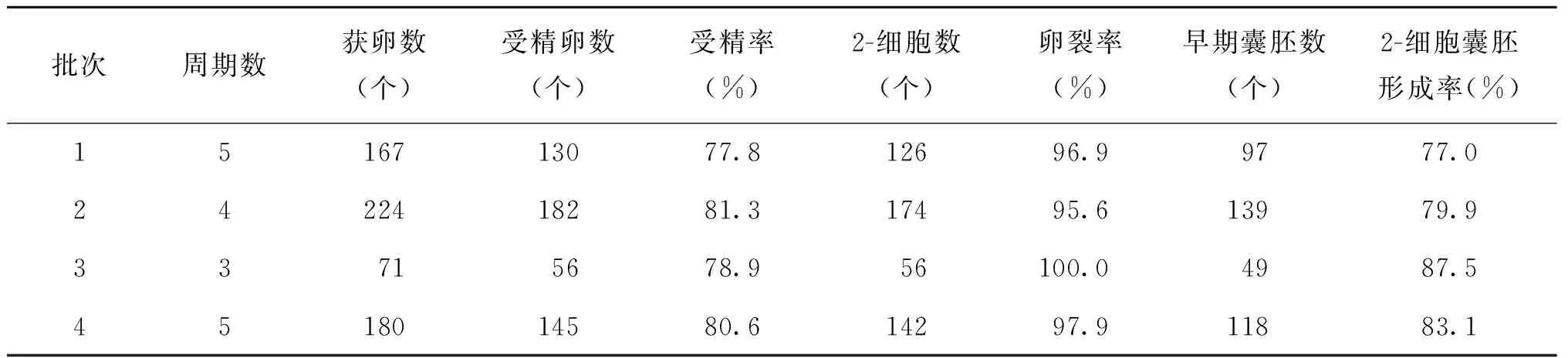
表2 昆明系小白鼠体内受精及胚胎培养实验结果
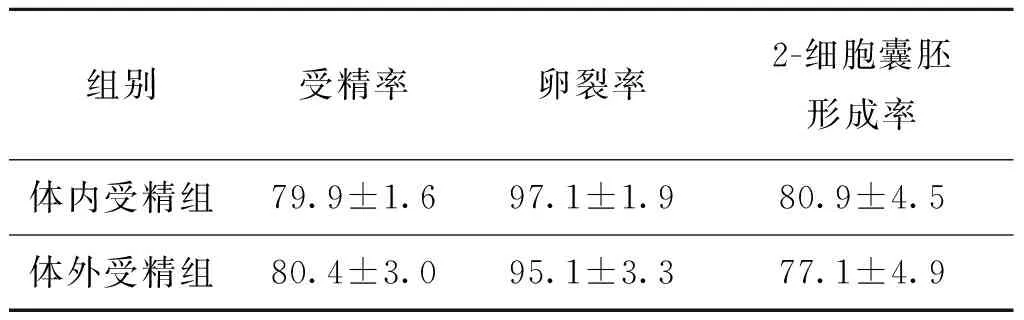
表3 两组实验小鼠胚胎体外培养结果比较(%)
三、讨论
辅助生殖技术与其他学科最大的区别在于其对胚胎实验室的依赖性和协同性。因此,胚胎实验室是ART实施的重要支撑点,是保证ART成功的重要核心条件。实验室的质量控制系统不仅能确保结果的稳定性,而且还可追踪实验室操作事件[5]。胚胎体外受精与培养是一种人工模拟输卵管、子宫环境的过程,所有直接或间接接触配子和胚胎的用品及环境,如温度、湿度、CO2浓度、pH、渗透压、离子浓度、尘埃、挥发性有机物(VOC)等均有可能存在危害胚胎的因素[6-7]。目前,MEA是评估IVF实验室培养体系最为广泛应用的方法,不仅能够反映胚胎的发育潜能,同时还能监测胚胎实验室整体的培养环境条件及操作技能,如空气质量、温湿度、培养液、耗材、培养箱、气体以及技术人员操作水平等[8-9]。
本研究利用昆明系小白鼠行体内、体外受精两种方法进行实验,对本中心新建的辅助生殖实验室培养环境、培养系统及技术员操作水平进行了全面的质量控制。我们的实验结果表明,无论是小鼠体内或体外获得的原核受精胚,皆能在体外培养发育至囊胚阶段,胚胎发育状况良好,且受精率(79.9% vs. 80.4%)、卵裂率(97.1% vs. 95.1%)、2-细胞囊胚形成率(80.9% vs. 77.1%)相比较,两组间差异无统计学意义(P>0.05),其囊胚率比国内文献报道[10-11]的偏低,但各项指标均符合人类辅助生殖实验室质控标准[2,12-13]。以上结果说明本实验室培养体系以及技术人员的操作水平已合格,能够继续开展人类IVF技术项目。
在整个实验过程中,会有多种因素影响到胚胎的生长发育。从表1、表2可见,前两个批次周期的受精率和囊胚形成率低,波动较大。分析其原因可能是:(1)实验初期,技术人员操作技术不够熟练,体外操作时间过长,导致培养液温度、渗透压等改变,进而影响了后续胚胎发育;(2)热台温度设置时欠考虑培养皿热传导和热丢失,造成温度波动,可能导致了胚胎不可逆的损伤。温度对卵子的影响是显而易见的,温度的变化会影响卵子内部一些结构的变化,其主要影响纺锤体的形态。有学者通过对加温装置的改进发现,若微滴内温度保持在37℃,在更多的卵子内会观察到纺锤体的存在,并且可显著提高受精率和怀孕率;(3) 观察的时间和次数增加,导致卵子和胚胎体外曝光的时间延长。相关的研究发现,辅助生殖中光照影响早期胚胎发育[14]。针对发现的问题,我们及时地进行了纠正,随着操作技术的不断娴熟,后续实验的受精率、卵裂率及囊胚形成率也在提高。但在实验中我们发现,同批次小鼠,同样的培养环境,同样批号的试剂、促排药物等,同样的操作技术,其实验结果也会出现波动,考虑到胚胎体外受精及培养受诸多因素的影响,其可能与精子及卵子的质量有关,或者与雌鼠的发情周期有关[15],随着周龄增长雌雄小鼠的配子质量亦会下降,尤其是雌鼠对促排的效果明显降低,因此在实验中,我们尽量使用适龄的雌雄小鼠进行实验,以期达到理想的效果。
通过鼠胚实验,我们技术人员的操作水平及熟练程度得到了很大的锻炼和提高,但在保证实验室规章制度以及操作章程符合要求的情况下,一些细微之处也不容忽视。在实验中我们注意到,培养箱的打开时间和次数也会影响到囊胚形成率,这与相关研究[16]一致。因此,在今后工作中,需谨慎对待每一项操作规程,不断总结经验,提升技术,保证人类IVF技术实施的可靠性与稳定性。
总之,对于新建或新启动周期的IVF实验室,为了保证培养环境及培养系统的可靠性,利用鼠胚实验对影响配子受精及胚胎发育的因素进行质量控制是有必要的。
【参考文献】
[1] Sun H,Chartier D,Leblanc N,et al. Intracellular calcium changes and tachycardia-induced cont ractile dysfunction in canine atrial myocytes [J].Cardiovasc Res,2001,49:751-761.
[2] 黄国宁,刘东云,韩伟.辅助生殖技术实验室的建设及其质量控制[J].中国实用妇科与产科杂志,2010,26:755-758.
[3] 李媛.人类辅助生殖实验技术[M].北京:科学出版社,2008:48-49.
[4] 孙青原,陈大元,译.小鼠胚胎操作实验手册[M].北京:化学工业出版社,2006:124-125.
[5] Gardner DK,Reed L,Linck D,et al. Quality control in human in vitro fertilization[J].Semin Reprod Med,2005,23:319-324.
[6] 黄国宁,孙海翔. 体外受精-胚胎移植实验室技术[M].北京:人民卫生出版社,2012:15-37.
[7] 靳镭,任新玲.实验室因素对胚胎发育和后代的影响[J].生殖医学杂志,2017,26:403-408.
[8] Stamatkin CW,Roussev RG,Stout M,et al. Preimplantation factor(PIF) correlates with early mammalian embryo development-bovine and murine models[J].Reprod Biol Endocrinol,2011,9:63. doi: 10.1186/1477-7827-9-63.
[9] 杜湧瑞,张云山.质量管理系统在体外受精实验室中的应用[J].国际生殖健康计划生育杂志,2013,2013:498-501.
[10] 高亚可,杜姗姗.新建辅助生殖实验室的鼠胚报告[J].广西医学,2016,38:304-307.
[11] 侯文文,胡卫华,吴满意.新建IVF实验室使用前的生物学检测[J].安徽医学,2013,34:1062-1065.
[12] 刘东云,韩伟,黄国宁.如何进行IVF实验室的质控[J].广东医学,2010,31:2481-2483.
[13] Revil T,Gaffney D,Dias C,et al. Alternative splicing is frequent during early embryonic development in mouse[J].BMC Genomics,2010,11:399.doi: 10.1186/1471-2164-11-399.
[14] 刘超杰,鹿丽娜,祝献民,等.辅助生殖中光照影响早期胚胎发育的研究进展[J].中华医学杂志,2017,97:1516-1520.
[15] 朱娜,贾洪响,刘晓坤,等.小鼠发情周期卵泡发育动态及其对超数排卵的影响[J].动物学研究,2012,33:276-282.
[16] Gardner DK,Lane M.Alleviation of the “2-cell block”and development to the blastocyst of CF1mouse embryos:role of amino acids,EDTA and physical parameters [J]. Hum Reprod,1996,11:2703-2712.

