灵武长枣果实多糖中单糖组成分析
章英才,柴雅红,曹金霞
(宁夏大学生命科学学院, 宁夏 银川 750021)
灵武长枣(ZiziphusjujubaMill cv. Lingwuchangzao)为鼠李科枣属落叶果树,中国独有,宁夏特产,原产于宁夏回族自治区灵武市,已有800年的栽培历史,是枣(ZiziphusjujubaMill.)中一个较优良的、经过多年自然筛选、具有宁夏地方特色的药食同源鲜果品种,抗寒、耐盐碱、耐高温和干旱[1]。具有较高的食用价值、药用价值[2],含有多种矿物质元素以及维生素、萜类和糖类[3],被誉为“果中瑰宝”。枣果素以含糖量高著称,其中长枣多糖是灵武长枣中最重要的药用生物活性成分之一,灵武长枣多糖具有抗氧化,抗肿瘤、抗衰老、增强有机体免疫力等的生物活性[4-6]。糖分高低对灵武长枣品质有重要的影响,长枣多糖含量越高,药用品质越好。因此,果实多糖在灵武长枣综合品质形成中占有十分重要的地位,明确果实多糖含量变化规律及其单糖组成成分显得尤为重要。据文献报道,枣中糖类的含量极为丰富,枣果中的糖包括葡萄糖、果糖、低聚糖、多糖等[7]。功能性多糖和低聚糖因具有多种生理活性,成为当前糖类研究的热点。多糖具有增强机体免疫功能、抗肿瘤、抗病毒、抗衰老、降血糖、刺激造血等多种生物学功效[8],其积累程度对果实品质具有重要的影响[9],因而多糖结构的研究一直是多糖领域研究的热点、难点[10]。而多糖糖链的一级结构与其活性密切相关,一级结构的研究主要体现在组成多糖的单糖种类及各单糖的组成比例,因此,明确多糖的单糖组成对控制多糖质量标准及研究枣多糖活性具有重要意义[11]。
灵武长枣不仅是盐碱地和沙荒地种植的先锋树种,同时又是一种高效的药用植物资源,特殊的生长环境孕育了灵武长枣优良的品质。近年来,在灵武长枣鲜果保鲜、生理变化、栽培技术、品种选育等领域已有深入的研究[12-14],而有关灵武长枣多糖的研究仅限于枣果实中多糖的分离提取[6]、理化性质分析[15],多糖含量及变化规律[16-17]等方面,有关灵武长枣果实多糖中单糖成分分析方面尚缺乏系统研究,而揭示多糖的单糖组成对控制多糖质量标准及研究枣多糖活性等都具有重要意义。因此,本研究以宁夏地区特色鲜果品种灵武长枣为材料,应用热水浸提法、分光光度法及气相色谱-质谱联用法等,分别对不同发育时期的灵武长枣果实进行多糖提取及单糖成分分析研究,系统分析不同发育时期灵武长枣果实多糖中单糖的成分,为进一步提高灵武长枣有效成分含量等生产实践提供科学依据,为科学调控果实品质奠定基础。
1 材 料
在宁夏红枣工程技术研究中心试验基地选择生长发育良好、树势健壮、长势相似和花期相近、栽培管理水平一致的6年生普通型灵武长枣为供试材料,随机区组试验设计,3次重复,于6月10日选择同期开放的花朵分别用4种不同颜色的毛线标记。
在灵武长枣开花坐果到果实成熟的发育过程中共取样4次,具体分别在果实膨大前期(7月10日)、果实快速膨大期(8月9日)、果实着色期(9月8日)、果实完熟期(9月28日),每次采样时间均设定于上午9∶00—11∶00进行,按所标记植株从树冠的东、西、南、北四个方向以及上、中、下、里、外各个方向采取无病虫害的果实各500 g,所采样品放入取样箱带回实验室,45℃烘干至恒重,粉碎,过60目筛,备用。
2 实验仪器与药品
2.1 实验仪器
索氏提取器、TGL-16G台式离心机(上海安亭科学仪器厂)、RE-52A型旋转蒸发仪(上海亚荣生化仪器厂)、SBS-Z100数控计滴自动部分收集器(上海沪西分析仪器厂有限公司)、YZ1515X恒流泵(保定兰格恒流泵有限公司)、色谱柱(上海琪特仪器有限公司)、722N可见分光光度计(上海精密科学仪器有限公司)、AL204电子天平(梅特勒-托利多仪器有限公司)、DHG-9140A型电热鼓风恒温干燥箱(上海一恒科学仪器有限公司)、DZF-6021真空干燥箱(上海一恒科学仪器有限公司)、FD-4中型冷冻干燥器(北京博医康实验仪器有限公司)、气相色谱-质谱联用仪(日本岛津公司GCMS-QP2010)、紫外可见分光光度计(日本岛津公司UV-2450)。
2.2 实验药品
三甲基氯硅烷为色谱纯,其它均试剂为分析纯。DEAE-52纤维素产自Whatman公司、TOYOPEARL HW-55S凝胶树脂产自日本TOSOH公司。标准单糖:葡萄糖、阿拉伯糖、果糖、半乳糖均为高级纯,鼠李糖、甘露糖、木糖均为生化试剂,本实验所用水均为超纯水。
3 实验方法
3.1 不同发育时期灵武长枣果实粗多糖的提取
参照何进[18]等的方法,略有改动。具体步骤:精确称取15 g枣粉放入滤纸筒中,将滤纸筒置于索氏提取器中,加入100 mL石油醚, 80℃回流脱脂8 h。将残渣置于球形冷凝管中,加80%乙醇85℃冷凝回流2次,75 mL每次,每次2 h,除去小分子糖。然后将过滤后的残渣再用沸水提取3次,每次加水50 mL,第一次1.5 h,后两次分别1 h,每次提取后3 000 r·min-1离心10 min,合并上清液,上清液经40℃真空浓缩至体积约为50 mL,加入1/4浓缩液体积的Sevag试剂(氯仿:正丁醇=4∶1),涡旋混合30 min,再3 000 r·min-1离心10 min,取上清液,除去蛋白质,此步骤重复8次;除去蛋白后的浓缩液加入4倍体积的无水乙醇进行醇沉,置于4℃冰箱中过夜,滤纸过滤,再依次用50 mL 95%的乙醇、无水乙醇、丙酮、乙醚洗涤沉淀,最后将其置于50℃鼓风恒温干燥箱干燥,得粗多糖。
3.2 不同发育时期灵武长枣果实粗多糖的分离纯化
3.2.1 灵武长枣果实粗多糖分级 将DEAE-52纤维素预处理、装柱,然后取粗多糖60 mg,配成浓度为6 mg·mL-1的多糖溶液,过滤后,加样至DEAE-52纤维素柱床,分别用超纯水、0.1、0.2、0.3 mol·L-1NaCl洗脱各级分,流速1.0 mL·min-1,自动部分收集器收集洗脱液,5 mL·管-1,苯酚-硫酸法检测多糖中多糖含量,以洗脱管数为横坐标,吸光度值为纵坐标,作DEAE-52纤维素色谱柱洗脱曲线。根据洗脱曲线分别合并各主峰收集管液,定容至200 mL,检测每一个级分的多糖含量,旋转蒸发仪45℃真空浓缩,浓缩液经超纯水流水透析48 h,再改用静置透析24 h,每4 h更换一次超纯水,透析完成后收集透析袋内的多糖溶液,真空浓缩,冷冻干燥,得到各多糖级分。
3.2.2 灵武长枣果实多糖级分纯化 将TOYOPEARL HW-55S填料进行预处理后装柱与平衡。然后将上述冷冻干燥的多糖各级分分别溶于2 mL超纯水中,用一次性滴管把多糖溶液加到HW-55S柱床表面,用0.2 mol·L-1NaCl溶液洗脱,流速0.5 mL·min-1,收集洗脱液,4 mL·管-1,苯酚-硫酸法检测每管多糖中多糖含量,以洗脱管数为横坐标,吸光度值为纵坐标,作HW-55S色谱柱洗脱曲线。根据洗脱曲线收集主峰管液,定容至50 mL,检测多糖含量,按3.2.1中方法,浓缩、透析、冷冻干燥,得到果实精制多糖。
3.3 灵武长枣精制多糖纯度鉴定
3.3.1 紫外-可见分光光度法监测 将上述精制多糖配成浓度为0.1 mg·mL-1的多糖溶液,用紫外可见分光光度计于190~900 nm波长区间内进行全波段扫描,观察在260 nm、280 nm处有无吸收峰。
3.3.2 凝胶色谱纯度鉴定 将每个多糖级分经HW-55S柱纯化,作洗脱曲线,观察峰型。
3.4 不同发育时期灵武长枣果实精制多糖中单糖组成分析
3.4.1 精制多糖的GC-MS分析
(1) 果实精制多糖的水解
精确称取果实精制多糖4 mg于反应釜中,加入0.4 mL 2 mol·L-1的三氟乙酸(TFA),置于烘箱内110℃水解3 h,冷却至室温,放入真空干燥箱中70℃减压干燥。
(2) 气相色谱-质谱联用测定方法及条件
将水解干燥后的灵武长枣果实精制多糖加入0.4 mL吡啶,迅速加入0.08 mL三甲基氯硅烷和0.16 mL六甲基二硅胺烷,注意操作要迅速,防止空气中水分的进入。振荡待其充分溶解后,于50℃恒温干燥箱中反应40 min,冷却至室温,用0.45 μm微孔滤膜过滤后,滤液4 000 r·min-1离心10 min,取上清液稀释后进行气相色谱-质谱联用测定,进样量为0.1 μL。
气相色谱条件:色谱柱DB-5MS(3 m×0.25 mm×0.25 μm),进样口温度250℃,接口温度250℃,载气为氦气,柱压73.0 kPa,柱流量1.00 mL·min-1,分流比50∶1,程序升温从100℃保持2 min,以10 ℃·min-1升至260℃,保留10 min。
质谱条件:离子源温度200℃,M/Z范围35~800。
3.4.2 标准单糖标准曲线的制作 配制不同质量浓度的各标准单糖溶液,衍生及气相色谱-质谱联用测定方法同3.4.1。以标准单糖质量浓度为横坐标,峰面积为纵坐标,绘制单糖标准曲线。
3.4.3 精制多糖中单糖组成的定性与定量 通过将多糖各级分中单糖的出峰时间与各种标准单糖的出峰时间对照,及NIST谱库对照,对多糖各级分组成进行定性分析。本实验采用外标法对多糖各组分中的阿拉伯糖、鼠李糖、木糖、甘露糖、半乳糖、葡萄糖、果糖进行定量分析,根据各单糖的回归方程计算出多糖中单糖的含量。
外标法定量计算公式如下:
W=C×V
式中,W为单糖质量,C为带入标准曲线求得的单糖浓度,V为稀释后体积。
由于单糖标品种类的限制,根据NIST谱库对照,对核糖、岩藻糖、葡萄糖醛酸和半乳糖醛酸进行初步定性分析。
4 结果与分析
4.1 粗多糖的提取
不同发育时期灵武长枣果实粗多糖的提取得率分别为:膨大前期0.778%,快速膨大期0.865%,着色期0.983%,完熟期1.795%。
4.2 不同发育时期灵武长枣果实粗多糖的分离纯化
4.2.1 果实粗多糖经DEAE-52纤维素柱层析的分级结果 由图1知,不同时期果实多糖经DEAE-52纤维素柱层析时,洗脱效果都比较好,Ju-0、Ju-1、Ju-2、Ju-3得到较好的分离。
将各时期的4个组分分别标记为Ju-0、Ju-1、Ju-2、Ju-3:膨大前期(EB-Ju-0、EB-Ju-1、EB-Ju-2、EB-Ju-3)、快速膨大期(RE-Ju-0、RE-Ju-1、RE-Ju-2、RE-Ju-3)、着色期(C-Ju-0、C-Ju-1、C-Ju-2、C-Ju-3)、完熟期(M-Ju-0、M-Ju-1、M-Ju-2、M-Ju-3)。
由表1可知,不同时期灵武长枣果实4个多糖组分中Ju-2经DEAE-52纤维素色谱柱分离纯化后的得率均为最高,Ju-0组分在快速膨大期的得率最高,Ju-1和Ju-3组分在着色期的得率最高,Ju-2组分在完熟期的得率最高。
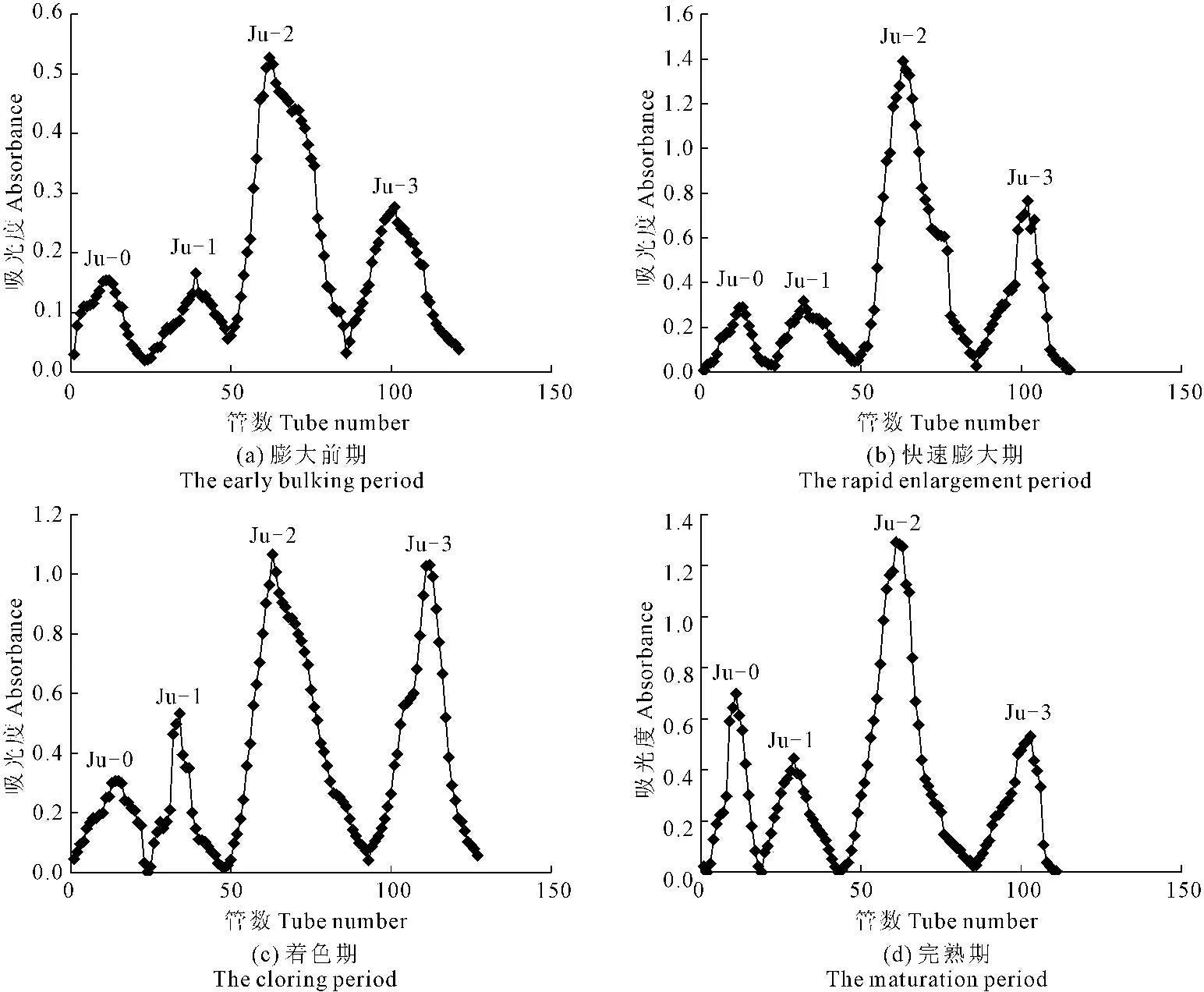
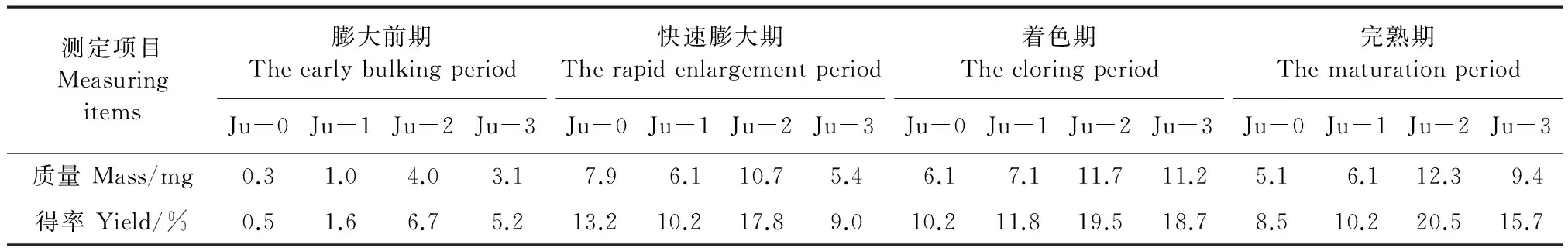
图1 不同时期果实粗多糖经DEAE-52纤维素洗脱曲线
4.2.2 HW-55S分子排阻柱层析 HW-55S分子排阻柱层析洗脱曲线如图2所示。由于膨大前期多糖含量较少,故没有过层析柱。可以看出,不同时期灵武长枣果实多糖各组分经HW-55S洗脱的曲线峰形单一且较对称。
4.3 灵武长枣精制多糖纯度鉴定结果
4.3.1 紫外-可见分光光度法监测 对各单糖组分分别进行紫外-可见分光光度法监测,分别得到如图3所示光谱图,可知,各多糖溶液在260 nm和280 nm处无吸收峰,表明各多糖组分中无核酸和蛋白质成分存在,为典型多糖吸收曲线。
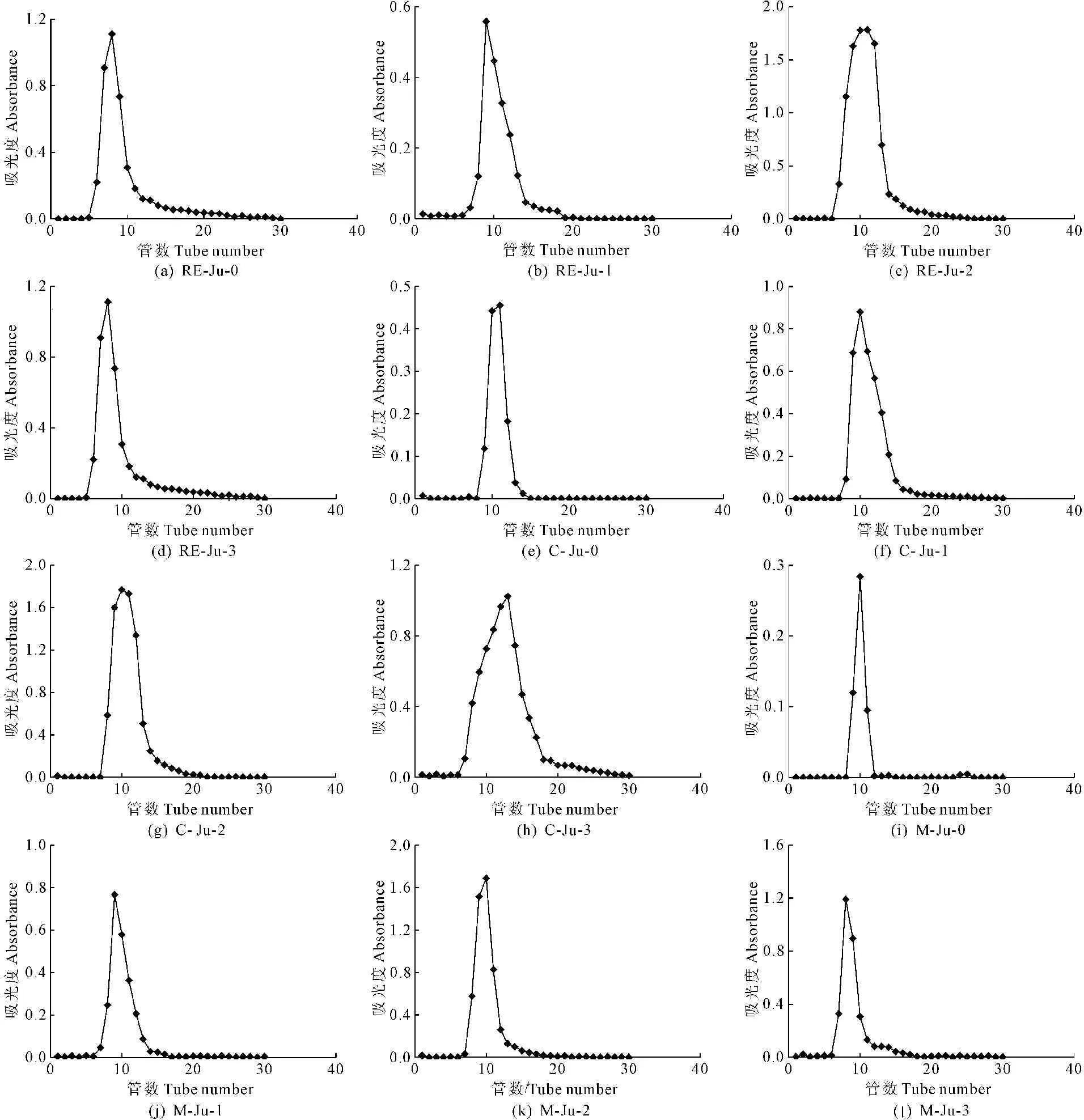

图2 不同时期果实多糖各组分经HW-55S洗脱曲线
图3精制多糖的紫外-可见光谱图
Fig.3 The UV spectra of refined polysaccharides
4.3.2 凝胶色谱纯度鉴定 洗脱曲线均为单一对称峰形,表明各多糖组分为均一组分。
4.4 不同发育时期灵武长枣果实精制多糖的单糖组成分析
4.4.1 单糖标准品标准曲线的制作 由表2可以看出,6种标准单糖均具有良好的线性关系。
4.4.2 不同发育时期灵武长枣果实精制多糖的单糖组成分析 将不同发育时期灵武长枣果实精制多糖各多糖级分水解,甲基硅烷化衍生后进行GC-MS分析,得到的图谱如图4所示。由图可知,不同时期灵武长枣果实精制多糖各组分的单糖已被成功分离。
不同发育时期灵武长枣果实精制多糖各组分的单糖组成及质量如表3所示。

表2 6种单糖的回归方程
注:X为质量浓度(mg·mL-1);Y为峰面积。
Note:X, mass concentration (mg·mL-1);Y, peak area.
① 不同时期灵武长枣果实精制多糖各多糖级分中阿拉伯糖、半乳糖、鼠李糖含量较高,葡萄糖含量次之,甘露糖、木糖含量较低,均不含有果糖。其中膨大前期的Ju-0、Ju-1,快速膨大期的Ju-1、Ju-2、Ju-3,着色期的Ju-0、Ju-1、Ju-3及完熟期Ju-1,均含有阿拉伯糖、半乳糖、鼠李糖、葡萄糖、甘露糖和木糖,其中膨大前期的Ju-0、Ju-1,快速膨大期的Ju-0、Ju-1,着色期的Ju-0及完熟期Ju-0、Ju-1中各单糖含量大小均为阿拉伯糖>半乳糖>鼠李糖>葡萄糖>甘露糖>木糖,但快速膨大期Ju-0、完熟期Ju-0无木糖;膨大前期Ju-2、Ju-3,快速膨大期Ju-2、Ju-3,单糖含量大小为鼠李糖>阿拉伯糖>半乳糖>葡萄糖>甘露糖>木糖,但膨大前期Ju-2、Ju-3无甘露糖;着色期的Ju-1、Ju-2单糖含量大小为半乳糖>阿拉伯糖>鼠李糖>葡萄糖>甘露糖>木糖,但着色期Ju-2不含甘露糖和木糖;着色期Ju-3单糖含量大小为阿拉伯糖>鼠李糖>半乳糖>葡萄糖>木糖>甘露糖;完熟期Ju-2和完熟期Ju-3单糖含量大小分别为阿拉伯糖>半乳糖>葡萄糖>甘露糖和阿拉伯糖>鼠李糖>葡萄糖。
② 针对Ju-0,鼠李糖、半乳糖、葡萄糖的含量随果实的生长发育而不断降低,即膨大前期>快速膨大期>着色期>完熟期;阿拉伯糖含量为膨大前期>着色期>快速膨大期>完熟期;甘露糖含量为膨大前期>着色期>快速膨大期=完熟期;木糖在快速膨大期和完熟期没有,膨大前期含量高于着色期。针对Ju-1,阿拉伯含量为着色期>膨大前期>完熟期>快速膨大期;鼠李糖含量为着色期>完熟期>快速膨大期>膨大前期;木糖和甘露糖含量均为膨大前期>着色期>完熟期>快速膨大期;半乳糖和葡萄糖含量均为着色期>完熟期>膨大前期>快速膨大期。针对Ju-2,阿拉伯糖和鼠李糖的含量随果实的生长发育而不断降低,即膨大前期>快速膨大期>着色期>完熟期,但鼠李糖在完熟期没有检测到;半乳糖含量为快速膨大期>着色期>膨大前期>完熟期;葡萄糖含量为快速膨大期>膨大前期>着色期=完熟期;木糖含量为快速膨大期>膨大前期,在着色期和完熟期没有木糖;甘露糖含量为快速膨大期>完熟期,而在膨大前期和着色期没有甘露糖。针对Ju-3,阿拉伯糖和葡萄糖含量均为完熟期>快速膨大期>膨大前期>着色期;鼠李糖含量为膨大前期>完熟期>快速膨大期>着色期;半乳糖和木糖在完熟期均没有被检测到,其含量分别为快速膨大期>膨大前期>着色期和快速膨大期>着色期>膨大前期;甘露糖在膨大前期和完熟期均没有,快速膨大期和着色期含量大小为快速膨大期>着色期。
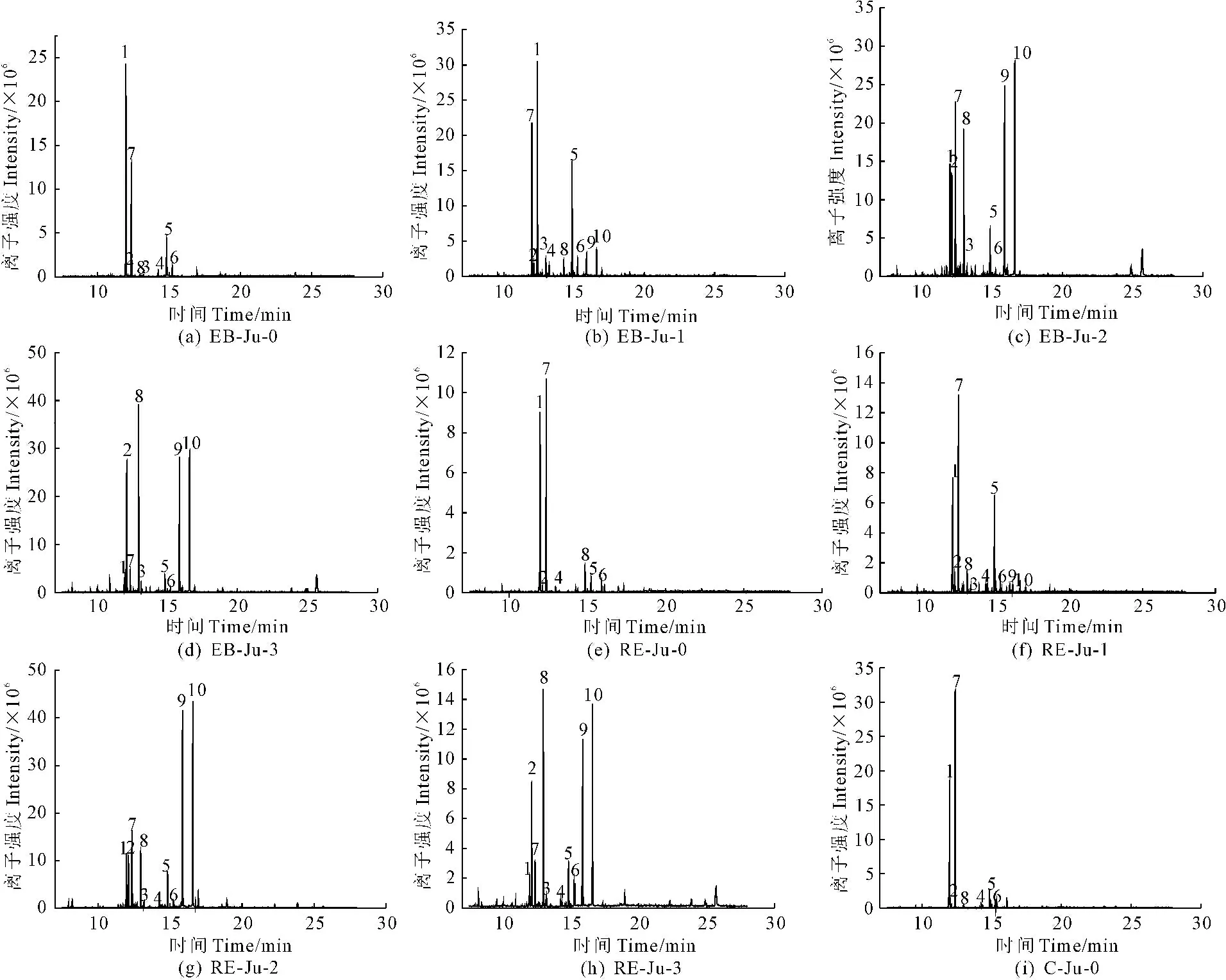
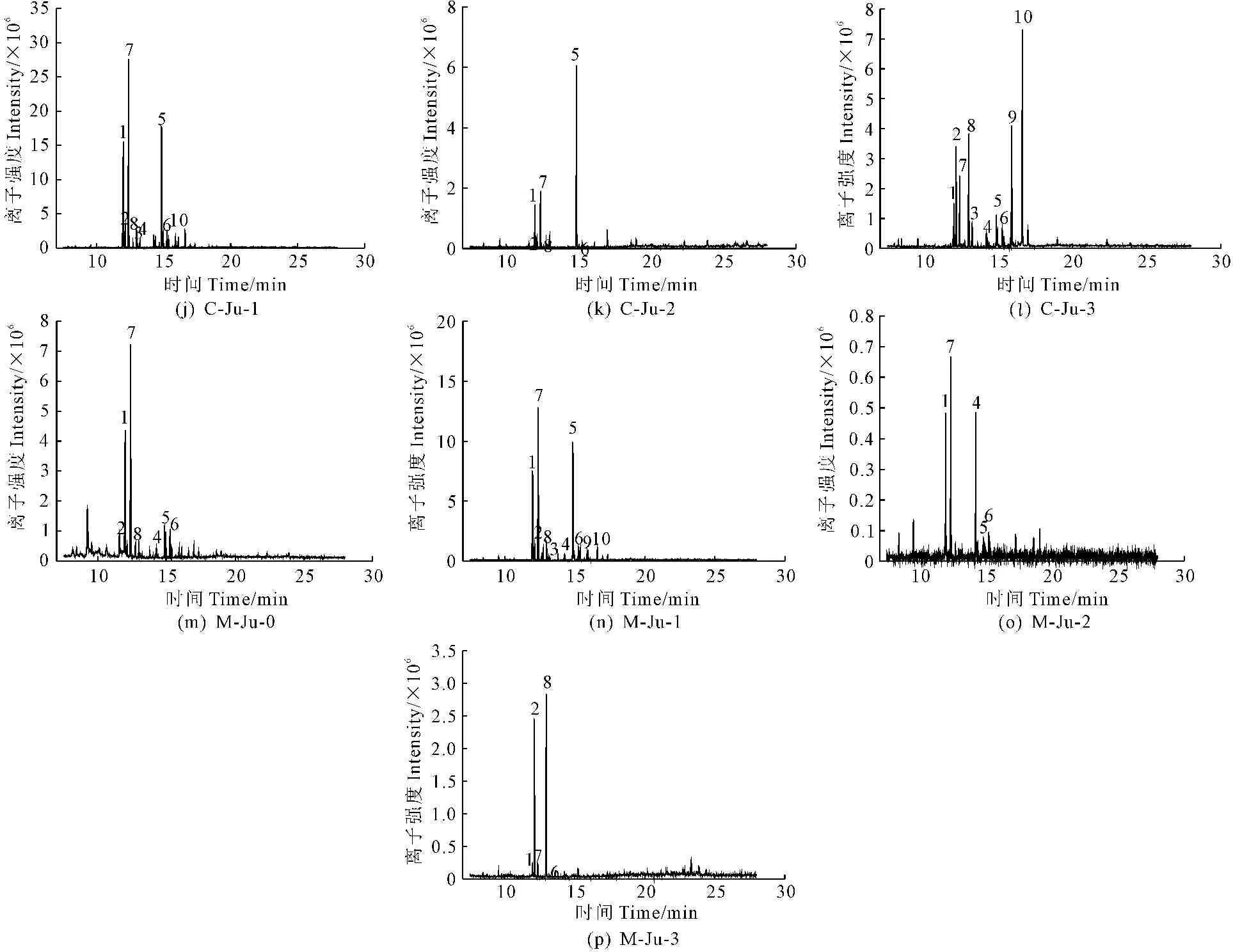
注:图中1~10依次为阿拉伯糖、鼠李糖、木糖、甘露糖、半乳糖、葡萄糖、核糖、岩藻糖、葡萄糖醛酸、半乳糖醛酸。
Note: In figure 1~10 : Arabinose, Rhamnose, Xylose, Mannose, Galactose. Glucose, Ribose, Fucose, Glucuronic acid, Galacturonic acid

图4 不同时期灵武长枣果实精制多糖各组分总离子流图
注:“—”表示单糖存在但未进行定量。Note:“—”Indicates the existence of monosaccharide but not quantitative.
③ 针对膨大前期,阿拉伯糖、木糖、半乳糖和葡萄糖含量大小均为Ju-0>Ju-1>Ju-2>Ju-3;鼠李糖含量大小为Ju-3>Ju-2>Ju-0>Ju-1;甘露糖含量大小为Ju-0>Ju-1,Ju-2和Ju-3中没有甘露糖。针对快速膨大期,阿拉伯糖含量大小为Ju-0>Ju-2>Ju-1>Ju-3;半乳糖含量大小为Ju-2>Ju-1>Ju-0>Ju-3;鼠李糖和木糖含量大小均为Ju-2>Ju-3>Ju-1>Ju-0,但快速膨大期Ju-0没有木糖;葡萄糖含量大小为Ju-2>Ju-3>Ju-0>Ju-1;甘露糖含量大小为Ju-2>Ju-1>Ju-3>Ju-0。针对着色期,阿拉伯糖和葡萄糖含量大小均为Ju-1>Ju-0>Ju-2>Ju-3;半乳糖和鼠李糖含量大小均为Ju-1>Ju-2>Ju-0>Ju-3;木糖和甘露糖含量大小均为Ju-1>Ju-0>Ju-3,Ju-2时没有木糖和甘露糖。针对完熟期,阿拉伯糖、葡萄糖和鼠李糖含量大小均为Ju-3>Ju-1>Ju-0>Ju-2,但Ju-2没有鼠李糖;半乳糖和甘露糖含量大小均为Ju-1>Ju-2>Ju-0,Ju-3不含有半乳糖和甘露糖;木糖只在Ju-1中存在且含量很小。
由于部分单糖标品种类的限制,根据NIST谱库对照对多糖中其他单糖进行初步定性,不同发育时期灵武长枣果实精制多糖中,中性多糖组分Ju-0中均含有核糖和岩藻糖。酸性多糖组分中,着色期Ju-1中含有核糖、岩藻糖和半乳糖醛酸;着色期Ju-2和完熟期Ju-3中均含有核糖和岩藻糖,完熟期Ju-2中仅含有核糖;膨大前期Ju-1、Ju-2、Ju-3,快速膨大期Ju-1、Ju-2、Ju-3,着色期Ju-3及完熟期Ju-1中均含有核糖、岩藻糖、葡萄糖醛酸和半乳糖醛酸。
5 结论与讨论
本试验用热水浸提法提取不同时期粗多糖,发现粗多糖得率和含量随着果实的发育进程呈现上升趋势,在完熟期达到最高值。采用DEAE-52纤维素层析柱对粗多糖进行分离纯化,得到1种中性多糖和3种酸性多糖,表明灵武长枣多糖的主要形式为酸性多糖,各时期均以酸性组分2得率最高,Ju-0组分在快速膨大期的得率最高,Ju-1和Ju-3组分在着色期的得率最高,Ju-2组分在完熟期的得率最高。GC-MS分析结果表明,不同时期灵武长枣多糖的单糖组分共有10种,其中以阿拉伯糖、半乳糖、鼠李糖为主,葡萄糖,甘露糖、木糖次之,还含有核糖、岩藻糖、葡萄糖醛酸、半乳糖醛酸,均不含果糖。且各时期的单糖含量各不相同,Ju-0和Ju-1各单糖含量组成在果实的发育进程中变化不大,四个时期均是以阿拉伯糖>半乳糖为主,主要差异在于Ju-2和Ju-3,在膨大前期和快速膨大期,Ju-2和Ju-3是以鼠李糖>阿拉伯糖>半乳糖为主,随着果实的发育进程,在着色期,Ju-2以半乳糖>阿拉伯糖>鼠李糖为主,完熟期Ju-2以阿拉伯糖>半乳糖为主;在着色期,Ju-3以阿拉伯糖>鼠李糖>半乳糖为主,完熟期Ju-3以阿拉伯糖>鼠李糖为主。另外,从核糖、核糖、岩藻糖、葡萄糖醛酸和半乳糖醛酸定性来看,主要差别也是在于着色期和完熟期。
采用DEAE-52纤维素层析柱对粗多糖进行分离纯化,得到1种中性多糖和3种酸性多糖,这与罗莉[19]、戴艳[20]分离纯化枣多糖结果在组分数量上有所差异,可能是填料或洗脱溶液浓度不同及枣果实品种不同造成的。柳杨[21]研究结果表明灵武长枣各多糖组分分子量最大为1.60×105,最小为7.61×104,实验采用适用分离多糖分子量范围为1000-2×105的HW-55S填料,得到的洗脱峰为对称的单一峰,效果较好,证明多糖为均一组分,且紫外检测证明多糖中不含有核酸和蛋白质。用GC-MS分析单糖组成,以标准单糖衍生物的出峰时间和样品单糖衍生物的出峰时间相对照,并结合NIST谱库对照进行定性定量分析,使结果更加准确。
王东营[22]研究滩枣多糖时,发现滩枣多糖是一种由阿拉伯糖、半乳糖、鼠李糖、葡萄糖、甘露糖、木糖、核糖、岩藻糖、葡萄糖醛酸、半乳糖醛酸10种单糖组成的多糖,且阿拉伯糖含量最高,与本实验研究结果一致。林勤保[23]等用高效液相色谱法测得大枣中性多糖由L-阿拉伯糖、D-葡萄糖和D-半乳糖组成,酸性多糖由L-阿拉伯糖、L-鼠李糖、D-甘露糖、D-半乳糖和D-半乳糖醛酸组成,与本实验结果有差异。友田正司等[24]发现日本大枣中性多糖单糖组成为D-半乳糖和L-阿拉伯糖,酸性多糖单糖组成为D-半乳糖、D-木糖、L-阿拉伯糖、L-鼠李糖和D-半乳糖醛酸,也与本实验研究结果不同。上述多糖中均不含有果糖,但彭艳芳[25]研究金丝小枣和冬枣时发现多糖中含有果糖,且果糖含量在各发育时期均高于其他单糖,这可能是枣种类不同、多糖的提取、分离纯化方法不同、单糖组成测定方法不同等因素造成的。灵武长枣果实多糖在不同时期中单糖组成种类几乎一样,而彭艳芳[25]等研究发现,随金丝小枣和冬枣果实的发育,多糖的单糖种类呈递增趋势,这可能是由于提取溶剂不同,及该实验用HPLC测多糖单糖组成时,未对单糖进行衍生,导致监测灵敏度低,未将枣果半红期多糖中含量较低的甘露糖、鼠李糖和阿拉伯糖检测出有关。由此可见,多糖结构复杂,多糖中单糖组成差异大,合理选择实验条件及测定方法尤为重要,这对后续研究多糖结构及生物活性具有重大的意义。
本试验为枣多糖组成GC-MS分析提供了快速、有效的检测手段。首次阐明灵武长枣果实多糖发育进程中的单糖组成变化特征,为灵武长枣的进一步开发利用提供了基础研究。
参考文献:
[1] 喻菊芳,朱连成,魏天军,等.灵武长枣品种特性及规范化栽培技术研究与示范[J].宁夏农林科技,2007,(2):1-4.
[2] 任玉锋,闫丽娟,陈 成,等.灵武长枣贮藏期间生理变化的研究[J].北方园艺,2008,(10):199-201.
[3] 杨淑娟,郑国琦,章英才,等.灵武长枣正常果及裂果中Ca2+的细胞化学定位研究[J].西北植物学报,2011,31(1):0084-0088.
[4] 姜晓燕,胡云峰,崔翰元.酶法提取灵武长枣多糖及抗氧化作用的研究[J].食品工业,2009,(6):31-33.
[5] 刘晓连,李亚蕾,罗瑞明,等.长枣多糖中抗肿瘤多糖的筛选研究[J].安徽农业科学,2012,40(29):14461-14463.
[6] 吴素萍.超声辅助酶法提取长枣多糖的研究[J].河南工业大学学报(自然科学版),2008,29(4):20-23.
[7] 齐小菊,王向红,迟 建,等.枣中糖测定的研究进展[J].河北林果研究,2005,20(2):179-182.
[8] 陶遵威,郑 夺,邸明磊.植物多糖的研究进展[J].药物评价研究,2010,33(2):148-151.
[9] 刘杰超,焦中高,周红平,等.水果活性多糖的研究现状与展望[J].食品科学,2008,29(10):675-679.
[10] Miao Yu, Yue Cao, Guosong Xin, et al. Advances in study on structure of polysaccharide[J]. Advance in Engieering Research, 2016,93(2):227-233.
[11] 倪力军,王媛媛,何婉瑛,等.8种多糖的单糖组成、活性及其相关性分析[J].天津大学学报,47(4):326-330.
[12] 魏天军,李百云,喻菊芳,等.灵武长枣新品系特性比较[J].宁夏农林科技,2013,54(1):19-20.
[13] 崔瀚元,张宏霞,张晓波,等.灵武长枣成熟特征分析[J].农产品加工,2009,(2):73-74.
[14] 李喜宏,班兆军,李 莉,等.灵武长枣贮藏的关键技术研究[J].果树学报,2009,26(1):94-97
[15] 刘晓连,李亚蕾,罗瑞明,等.灵武长枣水提多糖结构特征及理化性质[J].食品科学,2013,34(15):120-125.
[16] 杨 军,章英才,苏伟东.灵武长枣多糖含量的变化规律[J].北方园艺,2011,(20):13-16.
[17] 章英才,苏伟东,杨 军.灵武长枣多糖积累分布特征研究[J].北方园艺,2012,(21):7-11.
[18] 何 进,张声华.枸杞及枸杞多糖研究[J].食品科学,1995,16(2):14-21.
[19] 罗 莉.大枣生物活性多糖分离及抗氧化活性研究[D].郑州:河南工业大学,2012.
[20] 戴 艳.骏枣多糖提取纯化、结构分析及抗氧化活性研究[D].武汉:华中农业大学,2013.
[21] 柳 杨.灵武长枣中多糖的提取分离技术研究[D].银川:宁夏大学,2011.
[22] 王东营.陕北滩枣多糖的单糖组成分析及其药理功效研究[D].西安:陕西师范大学,2013.
[23] 林勤保,高大维,于淑娟,等.大枣多糖的单糖组成的高效液相色谱法研究[J].郑州粮食学院学报,1998,19(3):57-60,82.
[24] Tomoda M, Takahashi M, Nakatsuka S. Water-soluble carbohydrates of Zizyphi fructus. II. isolation of two polysaccharides and Sstructure of an arabinan [J]. Chemical & Pharmaceutical Bulletin, 1973,21(4):707-711.
[25] 彭艳芳,李 洁,赵仁邦,等.金丝小枣和冬枣果实发育过程中低聚糖和多糖含量的动态研究[J].果树学报,2008,25(6):846-850.

