生物表面活性剂鼠李糖脂对寄生水霉的体外抑制作用
刘韵怡,戚建华,王年,郁小娟,何轩灏,刘轩明,宋增福
(上海海洋大学 水产科学国家级实验教学示范中心,国家水生动物病原库,水产种质资源发掘与利用教育部重点实验室,上海 201306)
水霉病是一种以白色或灰黄色蓬松丝状菌丝斑块为特征,发生在鱼类、两栖动物身体上或覆盖在鱼卵表面的常见疾病[1],会对水产养殖业造成较严重的经济损失,也会对两栖动物种群多样性产生不利影响[2]。现有研究中已知的致病性水霉有多个种类,其中,寄生水霉Saprolegniaparasitica是淡水养殖中水霉病的主要病原菌之一[3]。寄生水霉无宿主选择性,温度适应范围广,抗逆性强,一年四季都可导致鱼体感染发病[4]。其感染鱼体后会引起表皮和真皮损伤及细胞坏死,并可进一步导致鱼体渗透压调节失败,从而致鱼死亡[5]。
孔雀石绿被认为是治疗水霉病最有效的化学物质[6]。但因孔雀石绿及其代谢产物无色且孔雀石绿具有高残留、高致癌、高致畸性的特点,2002年就被中国农业农村部列入水产养殖中禁止使用的药物[7]。近年来也相继出现多种预防和治疗水霉病的药物,如二硫氰基甲烷、复合树酯酸铜、氯化钠、中草药制剂和生化防腐制剂,但防控效果均远不及孔雀石绿,且容易出现疾病复发、产生耐药性及药物急性中毒等情况[8-9]。因此,开发新型绿色防控药物仍然是当前水霉病害防控的重要任务。
生物表面活性剂是由细菌、真菌或酵母菌产生于体外具有两亲性的分子化合物,并表现出优异的表面活性、结构多样性和环境相容性;同时,还具有抗细菌、抗真菌、抗病毒和抗黏附等特性,使其在环境修复,以及农业、医学领域和化妆品等行业得到广泛应用[8]。鼠李糖脂(rhamnolipid)是生物表面活性剂的一种,由鼠李糖单元通过β糖苷键连接到3-羟基脂肪防酸链而组成,也是至今研究最为详细的生物表面活性剂[10]。自然发酵产生的鼠李糖脂是不同同系物的混合物,这些同系物及其独特的组合可能在鼠李糖脂对特定真菌产生的抗真菌活性中发挥关键作用[11]。已有研究表明,鼠李糖脂是抗植物致病真菌的有效物质[12-14]。Stanghellini等[15]在1996年就发现鼠李糖脂在生物防控方面的潜力,由铜绿假单胞菌Pseudomonasaeruginosa产生的鼠李糖脂能使瓜果腐霉Pythiumaphanidermatum及辣椒疫霉Phytophoracapsici的游动孢子裂解死亡。也有研究发现,鼠李糖脂能裂解皮肤廯菌、白色念珠菌的细胞膜,可作为医学抗真菌制剂,用于治疗人的真菌病[16-17]。然而,鼠李糖脂对水霉菌的抑制作用尚未见相关报道。本研究中,通过进行鼠李糖脂对水霉的体外抑制试验,研究了鼠李糖脂对寄生水霉的作用,以期为研制新型绿色、安全、有效的防水霉制剂提供数据与理论支持。
1 材料与方法
1.1 材料
菌株:寄生水霉菌株SaprolegniaparasiticaATCC200013由上海海洋大学胡鲲教授课题组惠赠。
试剂:鼠李糖脂由国家水生动物病原库实验室发酵提取;马铃薯葡萄糖琼脂(PDA)、马铃薯葡萄糖水 (PD水)、孔雀石绿(含量≥95%)、亚甲基蓝均购自生工生物工程(上海)股份有限公司;甲霜灵购自浙江禾本科技有限公司。
主要仪器设备:扫描电镜(S3400N,日本日立高新技术公司),冷冻干燥仪(EZ550Q,美国FTS Systems公司),电导率仪(DDS-307,上海光学仪器厂),光学显微镜(Olympus BX53F,上海启步生物科技有限公司)。
1.2 方法
1.2.1 鼠李糖脂的提取 参考孟令一[18]的方法,将本课题组分离得到的铜绿假单胞菌PseudomonasaeruginosaA39-1菌株(NCBI登录号:CP068238)活化,以体积分数为2%的比例接种到100 mL无菌发酵培养液中,于37 ℃、180 r/min的恒温震荡培养箱中培养120 h后,将发酵液以12 000 r/min 离心12 min,留上清液,用浓HCl调节上清液的pH至2.0,加入等体积的氯仿甲醇萃取液(氯仿与甲醇体积比为2∶1),剧烈震荡混匀后于4 ℃下静置12 h,弃上清,将下层萃取液装入烧杯并置于旋转蒸发仪上挥发,直至出现棕黄色固体,随后将得到的黄色固体置于60 ℃烘箱中烘干4 h,待样品冷却至室温时,加入适量pH为8.3的NaHCO3溶液溶解固体,得到粗提产物。通过薄层色谱试验(TLC)证实所得产物为鼠李糖脂[19]。
1.2.2 寄生水霉菌株ATCC200013孢子悬浮液的制备 参考张世奇等[4]的方法,将水霉菌种在PDA平板20 ℃下培养后,切取水霉菌块转接到PDA平板继续培养3~4 d至菌丝铺满平板。在无菌条件下,将灭菌的油菜籽放入铺满菌丝的平板上,每个平板30粒,继续培养2~3 d至油菜籽上附着菌丝,随后将油菜籽放入装有30 mL无菌水的三角瓶中,20 ℃下以120 r/min培养36 h。待游动孢子大量产生后,用6层灭菌纱布过滤,血球计数板计数,调整孢子悬液浓度为106~107cfu/mL,备用。
1.2.3 最小抑菌浓度(MIC)与最小杀菌浓度(MFC)的测定
1)鼠李糖脂对寄生水霉ATCC200013菌丝体MIC与MFC的影响。参考董平等[20]的倍比稀释法。在长满菌丝的PDA平板上用直径8 mm的打孔器取菌丝块接种到24孔板中,孔中加入2 mL含不同鼠李糖脂浓度的马铃薯葡萄糖水(PD水),鼠李糖脂质量浓度分别设置为500、250、125、62.5、31.25、15.625、7.8、3.9 mg/L,以不加鼠李糖脂的孔为对照组,另以每个浓度下不加菌块的孔为空白对照组用于验证无菌环境。每个处理组设置3个平行。20 ℃下培养,以无菌丝生长的最低药物浓度确定为MIC。将显示无可见菌生长的孔中菌块转移到新的PDA平板上,20 ℃下培养14 d,PDA平板上仍无可见真菌生长的药物浓度视为MFC[21]。
同时设置参考药物亚甲基蓝、甲霜灵质量浓度均为400、200、100、50、25、12.5、6.25、3.125、0(对照)mg/L,孔雀石绿质量浓度为50、25、12.5、6.25、3.125、1.56、0.78、0.39、0(对照)mg/L。
2)鼠李糖脂对寄生水霉ATCC200013游动孢子MIC与MFC的影响。同样采用倍比稀释法,在24孔板中加入2 mL含不同鼠李糖脂浓度的马铃薯葡萄糖水(PD水)和等量水霉孢子悬浮液,鼠李糖脂质量浓度分别为250、125、62.5、31.25、15.625、7.8、3.9、1.9 mg/L,以不加鼠李糖脂的孔为对照组,另以每个浓度下不加水霉孢子悬浮液的孔为空白对照组用于验证无菌环境。每个处理组设置3个平行。20 ℃下培养,以无菌生长的最低药物浓度确定为MIC。将显示无可见菌生长的孔中培养液涂布于新的PDA平板上,20 ℃下培养14 d,PDA平板上仍无可见真菌生长的药物浓度视为MFC。
同时设置参考药物亚甲基蓝、甲霜灵质量浓度均为200、100、50、25、12.5、6.25、3.125、1.56、0(对照)mg/L,孔雀石绿质量浓度为1.56、0.78、0.39、0.2、0.1、0.05、0.025、0.012、0(对照)mg/L。
1.2.4 鼠李糖脂对寄生水霉菌株ATCC200013菌丝生长的影响 参考张晓波等[22]的生长速率抑制法。配制PDA培养基,待其冷却至45 ℃时分别加入鼠李糖脂后混匀,使各培养基中鼠李糖脂质量浓度分别为250、125、62.5、31.25、15.625、7.8、3.9、0(对照)mg/L。用直径为8.0 mm的打孔器取水霉菌块,将菌块移至含鼠李糖脂的PDA平板中央。每个处理组设置3个平行。置于20 ℃下培养至对照平板上菌落布满培养皿2/3左右时,用游标卡尺采用十字交叉法测量并记录菌落直径。生长抑制率(%)计算公式为
生长抑制率=[1-(处理组菌落直径-菌饼直径)/(对照组菌落直径-菌饼直径)]×100%。
(1)
以得到的生长抑制率为纵坐标y,鼠李糖脂质量浓度的对数为横坐标x,得出毒力回归方程,计算生长抑制率为50%时的鼠李糖脂浓度(IC50)。
1.2.5 鼠李糖脂对寄生水霉菌株ATCC200013孢子萌发的影响 参考樊炳君等[23]的载玻片悬滴法。利用带有凹槽的玻片,在PD水中加入不同质量浓度的鼠李糖脂和等量水霉孢子悬浮液,鼠李糖脂质量浓度依此为62.5、31.25、15.625、7.8、3.9、1.9、0(对照)mg/L。吸取每组样品滴于玻片的凹槽内,将玻片放在空培养皿中。每个处理设置3个平行。置于20 ℃下培养12 h后镜检孢子萌发数量,随机取一个视野计数约100个孢子,以菌丝芽管长度大于孢子半径视为萌发,计数并计算孢子萌发率(%)和孢子萌发抑制率(%),其计算公式为
孢子萌发抑制率=(对照组萌发数-处理组
萌发数)/对照组萌发数×100%。
(2)
以得到的孢子萌发抑制率为纵坐标y,鼠李糖脂浓度的对数值为横坐标x,得出毒力回归方程,计算IC50。
1.2.6 鼠李糖脂对寄生水霉菌株ATCC200013生长量的影响 参考菌丝干质量法[24],将鼠李糖脂加入30 mL无菌的 PD水中,使各培养基中鼠李糖脂质量浓度分别为250、125、62.5、31.25、15.625 mg/L,以添加等量灭菌蒸馏水的处理为对照。接入等量水霉菌孢子悬浮液,20 ℃下以120 r/min震荡培养7 d,每个处理设置3个平行。将培养后的培养液以4 000 r/min离心10 min,去除上清液,菌丝沉淀用清水离心洗涤3次,100 ℃下烘干,置于天平上称重(精确至0.000 1 g)。
1.2.7 鼠李糖脂对寄生水霉菌株ATCC200013细胞膜通透性的影响 参考夏晓明等[25]的电导率法。将水霉菌块接种到100 mL PD水中,20 ℃下以120 r/min震荡培养3 d后,以4 000 r/min离心15 min,去培养液,用无菌去离子水充分冲洗,称取0.5 g湿菌丝置于50 mL含不同质量浓度(250、125、62.5 mg/L)鼠李糖脂的无菌去离子水中;将不同质量浓度(31.25、15.625、7.8 mg/L)鼠李糖脂加入100 mL浓度为1×108cfu/mL的水霉孢子悬浮液中。均以不加鼠李糖脂的处理为对照组。考虑到鼠李糖脂本身对电导的影响,以只加不同浓度鼠李糖脂不加菌为空白对照。每个处理组设置3个平行,并置于20 ℃下以120 r/min震荡培养。采用电导率仪于0、2、4、6、8、10、12、24 h时分别测定培养液电导率值。
1.2.8 鼠李糖脂对寄生水霉菌株ATCC200013菌丝形态结构影响观察 取培养在250、125 mg/L鼠李糖脂中24 h后的菌丝,置于载玻片上,利用光学显微镜观察菌丝变化。
取培养在250、125 mg/L鼠李糖脂中24 h后的菌丝,用2.5%戊二醛(体积分数,下同)于4 ℃下固定,置于冰箱中过夜。随后用PBS缓冲液漂洗3次,每次10~15 min,依次用50%、70%、80%、90%乙醇(体积分数,下同)脱水,每次15 min,再用100%乙醇脱水2次,每次15 min,最后置于乙酸异戊酯中置换一次,再将样品用液氮速冻后置于冷冻干燥箱中干燥,取出喷金置于扫描电镜观察并拍照。
取培养在125 mg/L鼠李糖脂中24 h后的菌丝,用2.5%戊二醛于4 ℃下固定4~6 h后,用PBS清洗3次,每次10~15 min,用体积分数1% 的四氧锇酸再固定;无水丙酮脱水15 min后,用无水丙酮和包埋剂逐级渗透,比例依次为2∶1、1∶1、1∶2;最后放入包埋槽中,用包埋剂填埋后,修整经光学显微镜定位,在超薄切片机上切片,厚度为70~80 nm,经醋酸双氧铀及枸橼酸铅双重染色5 min后,用透射电镜观察并拍照。
1.3 数据处理
试验数据均以平均值±标准误(mean±S.E.)表示,采用SPSS 17.0软件进行单因素方差分析(one-way ANOVA),显著性水平设为0.05。
2 结果与分析
2.1 最小抑菌浓度(MIC)与最小杀菌浓度(MFC)
试验以亚甲基蓝、甲霜灵、孔雀石绿为阳性对照,结果显示:鼠李糖脂对寄生水霉菌丝生长的MIC为125 mg/L(表1、图1),将孔中菌块转接到PDA平板上无菌丝生长时,确定鼠李糖脂对寄生水霉菌丝生长的MFC为125 mg/L,鼠李糖脂对寄生水霉孢子的MIC为15.625 mg/L,MFC为31.25 mg/L(表2);甲霜灵对寄生水霉菌丝和孢子的MIC分别为100、12.5 mg/L;孔雀石绿对寄生水霉菌丝和孢子的MIC分别为0.39、0.1 mg/L(表1、表2)。

表1 鼠李糖脂对寄生水霉ATCC200013菌丝的抑制活性Tab.1 Inhibitory activities of rhamnolipid on mycelia of Saprolegnia parasitica ATCC200013

A~H—鼠李糖脂质量浓度分别为500、250、125、62.5、31.25、15.625、7.8、3.9 mg/L。A-H—rhamnolipid concentrations are 500,250,125,62.5,31.25,15.625,7.8 and 3.9 mg/L,respectively.图1 鼠李糖脂对寄生水霉ATCC200013菌丝的抑制效果Fig.1 Inhibitory effect of rhamnolipid on mycelia of Saprolegnia parasitica ATCC200013

表2 鼠李糖脂对寄生水霉ATCC200013孢子的抑制活性Tab.2 Inhibitory activities of rhamnolipid on zoospores of Saprolegnia parasitica ATCC200013
2.2 鼠李糖脂对寄生水霉ATCC200013菌丝生长的影响
寄生水霉菌丝在含不同浓度鼠李糖脂PDA平板上生长情况见图2。由表3可知,鼠李糖脂对寄生水霉菌丝具有显著的抑制效果,且抑制效果与其浓度呈正相关,当鼠李糖脂质量浓度为31.25 mg/L时,对菌丝的抑制率达到80.54%。以菌丝生长抑制率为纵坐标y,以鼠李糖脂浓度的对数为横坐标x,得到毒力回归方程为y=52.896x-11.73(R2=0.901 9),其IC50=14.69 mg/L。

A~H—鼠李糖脂质量浓度分别为250、125、62.5、31.25、15.625、7.8、3.9、0(对照)mg/L。A-H—rhamnolipid concentrations are 250,125,62.5,31.25,15.625,7.8,3.9 and 0(control)mg/L,respectively.图2 鼠李糖脂对寄生水霉ATCC200013菌丝生长的影响Fig.2 Effects of rhamnolipid on the mycelium growth of Saprolegnia parasitica ATCC200013
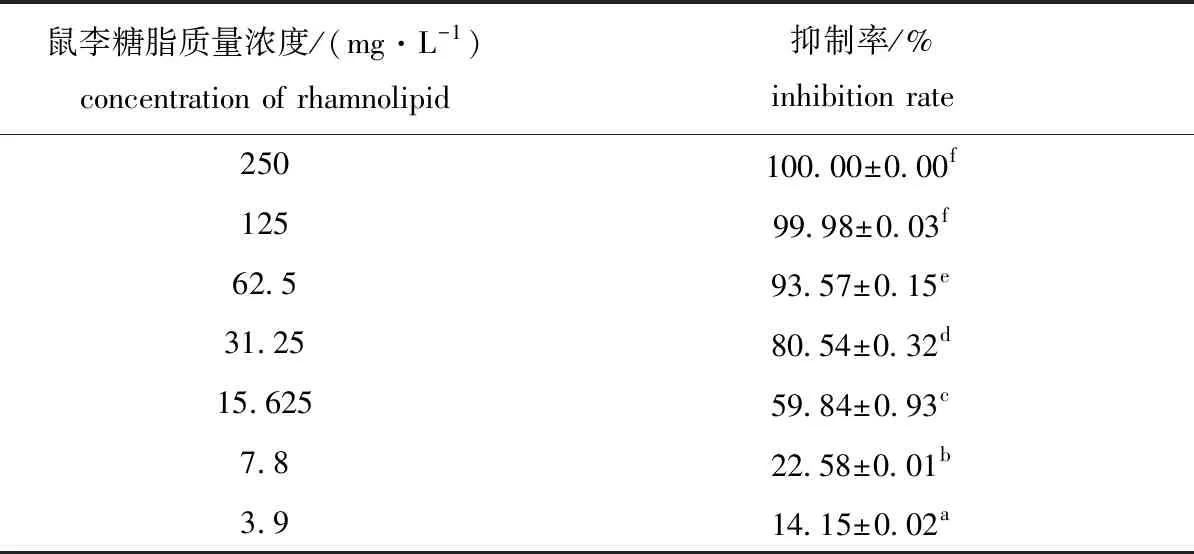
表3 鼠李糖脂对寄生水霉ATCC200013菌丝生长的抑制率Tab.3 Inhibition rate of rhamnolipid on mycelium growth of Saprolegnia parasitica ATCC200013
2.3 鼠李糖脂对寄生水霉菌株ATCC200013孢子萌发的影响
从表4可见:鼠李糖脂对水霉菌孢子萌发具有显著的抑制效果,且抑效果与其浓度呈正相关;当鼠李糖脂质量浓度为15.625 mg/L时,对孢子萌发抑制率达85.70%;质量浓度超过31.25 mg/L时,则可完全抑制孢子萌发。以孢子萌发抑制率为纵坐标y,以鼠李糖脂质量浓度的对数为横坐标x,得到毒力回归方程为y=75.656x-10.472(R2=0.931 2),其IC50=6.30 mg/L。
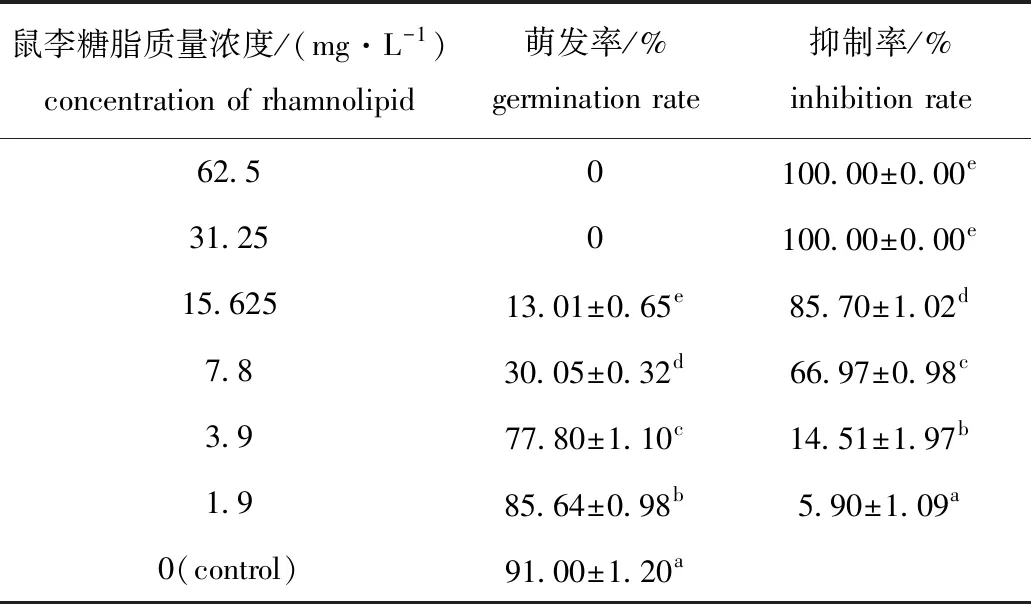
表4 鼠李糖脂对寄生水霉ATCC200013孢子萌发的抑制率Tab.4 Inhibition rate of rhamnolipid on zoospore germination of Saprolegnia parasitica ATCC200013
2.4 鼠李糖脂对寄生水霉菌株ATCC200013干质量的影响
从表5可见:用15.625 mg/L鼠李糖脂处理水霉菌丝后,与未经鼠李糖脂处理的组相比,菌丝干质量下降了42.79%;随着鼠李糖脂质量浓度的增加,水霉菌丝体干质量显著下降(P<0.05)。
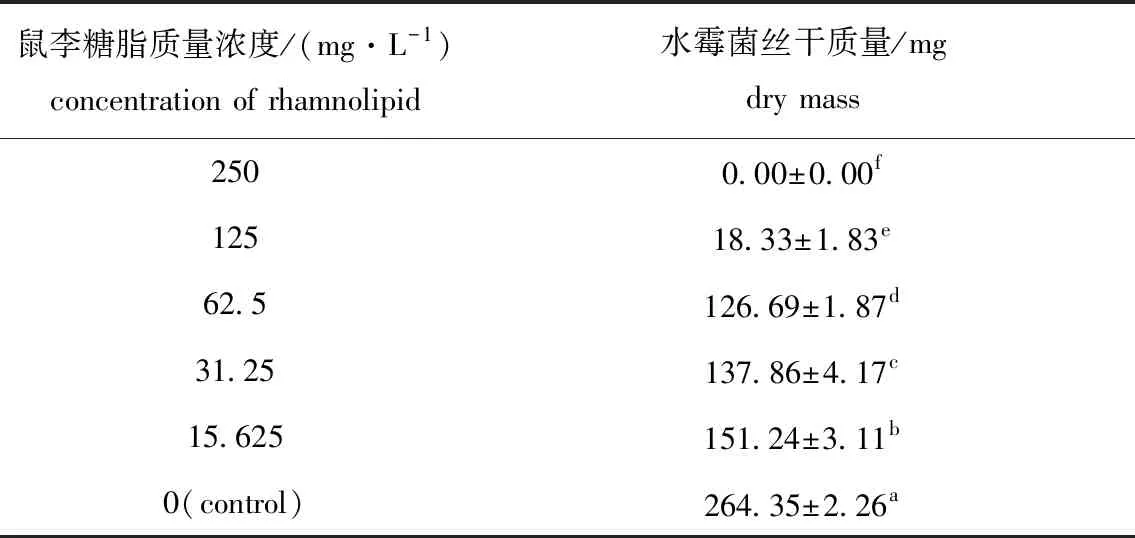
表5 鼠李糖脂对寄生水霉ATCC200013干质量的影响Tab.5 Effects of rhamnolipid on dry weight of Saprolegnia parasitica ATCC200013
2.5 鼠李糖脂对寄生水霉菌株ATCC200013电导率的影响
从图3可见:用鼠李糖脂处理寄生水霉菌丝6 h后,与未经鼠李糖脂处理的组相比,125 mg/L鼠李糖脂处理的寄生水霉菌丝培养液的电导率升高了68.10%,250 mg/L鼠李糖脂使得菌丝培养液电导率升高了约2.24倍,但在6 h后电导率变化较平稳;15.625 mg/L鼠李糖脂处理寄生水霉孢子10 h后,电导率升高了39.57%;低于鼠李糖脂MIC浓度处理的寄生水霉菌丝和孢子的电导率变化均不明显。
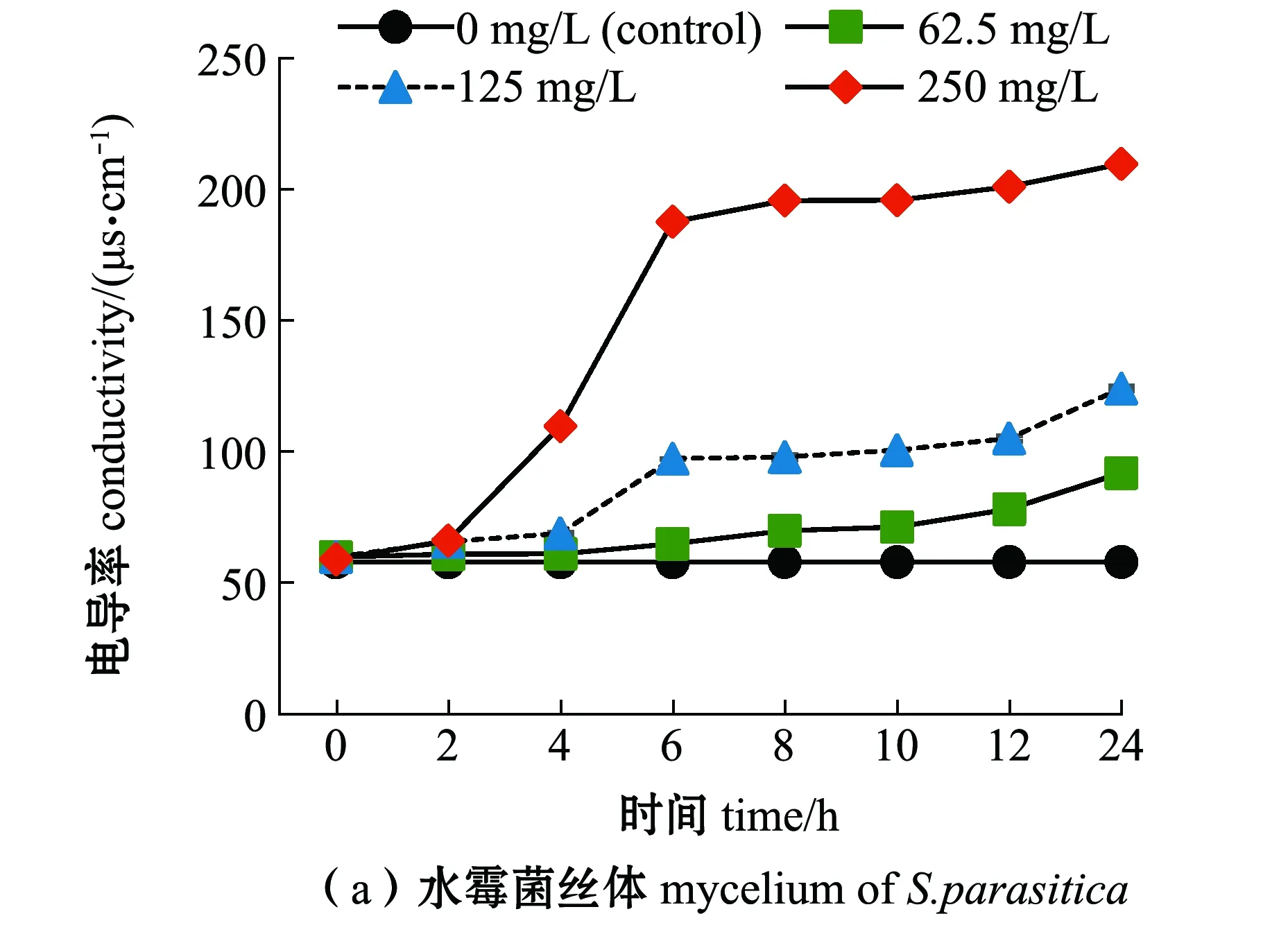
图3 鼠李糖脂对寄生水霉ATCC200013菌体电导率的影响Fig.3 Effects of rhamnolipid on the conductivity of Saprolegnia parasitica ATCC200013
2.6 鼠李糖脂对寄生水霉ATCC200013菌丝形态结构的影响
寄生水霉菌丝在光学显微镜(40倍)下观察发现:未经鼠李糖脂处理的组菌丝直挺光滑,分枝连接流畅,菌丝内部质地均匀(图4A);125 mg/L鼠李糖脂处理的菌丝发生变形扭曲,菌丝内部质地不均,出现聚集(图4B);250 mg/L鼠李糖脂处理的菌丝扁平扭曲断裂,菌丝出现完全透明现象(图4C)。扫描电镜进一步观察发现:未经鼠李糖脂处理的组菌丝体粗细一致,表面光滑(图4D);125 mg/L鼠李糖脂处理的菌丝粗糙扭曲(图4E);250 mg/L鼠李糖脂处理的菌丝扁平皱缩(图4F)。
透射电镜观察发现(图5):未经鼠李糖脂处理的寄生水霉菌丝体细胞中的细胞膜、细胞壁、细胞核、线粒体等超微结构清晰完整(图片总数n=30);用125 mg/L鼠李糖脂处理后的菌丝体,细胞壁变薄且有溶解现象,形成孔洞,有些出现严重变形弯曲,胞内出现大量空泡,细胞核、细胞器破裂溶解,细胞质内无完整的细胞器和核区(图片总数n=25)。

A~C—光学显微镜拍摄图;D~F—扫描电镜拍摄图;A、D—0 mg/L鼠李糖脂处理组;B、E—125 mg/L鼠李糖脂处理组;C、F—250 mg/L鼠李糖脂处理组。A-C—images of light microscope;D-F—scanning electron microscope;A,D—treated with 0 mg/L rhamnolipid;B,E—treated with 125 mg/L rhamnolipid;C,F—treated with 250 mg/L rhamnolipid.图4 不同质量浓度鼠李糖脂处理的寄生水霉ATCC200013菌丝形态Fig.4 Images of mycelial morphology of Saprolegnia parasitica ATCC200013 exposed to rhamnolipid
3 讨论
3.1 鼠李糖脂对寄生水霉ATCC200013的抑制活性
目前,防治水霉病的有效措施主要依赖于化学真菌抑制剂,但化学杀菌剂在使用中存在安全性不足和环境污染等问题且易产生耐药性。因此,筛选具有良好抗真菌性能的环境友好型制剂是水霉防治的重点工作。已有研究显示,鼠李糖脂对植物病原菌,如番茄灰霉病菌属、番茄红病菌属、炭疽菌属、腐霉属、镰刀菌属、疫霉属等,具有抗真菌活性[26-29],且抗真菌性能高、使用安全、可生物降解,具有更为明显的优势和发展潜力,符合当前发展环境友好型水产业的要求。本研究中,以寄生水霉ATCC200013作为目标病原菌,研究了鼠李糖脂对水霉菌丝与孢子的抑制作用,并进一步探讨了鼠李糖脂抑制水霉的作用机制,为新型绿色水霉病防治制剂的研制提供了科学依据。本研究显示,鼠李糖脂能有效抑制寄生水霉菌丝体和孢子的发育与生长,对寄生水霉菌丝体最小抑菌浓度为125 mg/L,对寄生水霉游动孢子最小抑菌浓度为15.625 mg/L,在15.625 mg/L鼠李糖脂质量浓度下,对菌丝生长的抑制率为59.84%,对孢子萌发抑制率为85.70%;鼠李糖脂抗寄生水霉的活性高于亚甲基蓝,与甲霜灵接近,但低于孔雀石绿(表1、表2),这表明,鼠李糖脂具有开发为水霉防治制剂的可行性,进一步证实了鼠李糖脂的抗真菌特性,拓展了鼠李糖脂的抗真菌范围。此外,本研究结果还发现,寄生水霉孢子比菌丝体对鼠李糖脂更为敏感,这与Zhang等[30]研究发现水霉孢子体对4种供试药物的敏感性均高于菌丝体的结果一致。Khomvilai等[31]研究同样发现,次氯酸钠对水霉菌丝体的抑制浓度是孢子抑制浓度的10倍,这种现象可能是两者的细胞壁组成差异导致[32]。因此,对于水霉的防治可以考虑从水霉孢子入手,加强水体中水霉孢子的监测与控制,从而既可减少水体用药剂量,降低环境污染,也可预防水霉病的发生与蔓延。
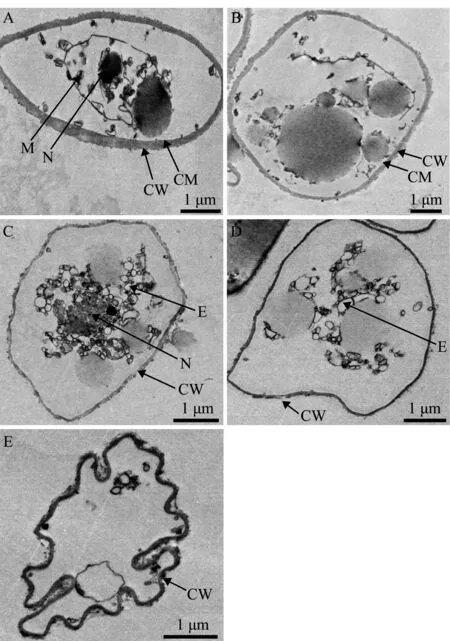
A~B—0 mg/L鼠李糖脂处理组(图片总数n=30);C~E—125 mg/L鼠李糖脂处理组(图片总数n=25)。CM—细胞膜;CW—细胞壁;N—细胞核;M—线粒体;E—空泡。A-B—0 mg/L rhamnolipid (number of pictures n=30);C-E—125 mg/L rhamnolipid (n=25).CM—cell membrane;CW—cell wall;N—nucleus;M—mitochondrion;E—edema vacuole.图5 透射电镜观察鼠李糖脂对寄生水霉菌丝细胞超微结构的影响Fig.5 Transmission electron microscopic observation of effect of rhamnolipid on the ultrastructure of mycelial cells of Saprolegnia parasitica
3.2 鼠李糖脂对寄生水霉ATCC200013的抑菌机制
鼠李糖脂作为亲脂亲水的两亲性分子,对其抗真 菌的机制已有些探索性的研究。鼠李糖脂抑制菌丝生长、孢子萌发和游动孢子溶解等效应被认为是与菌膜脂质成分相互作用的结果,通过诱导孔、离子通道的形成来干扰菌膜的完整性和通透性[14,33]。Otzen 等[34]通过差示扫描量热法、X射线衍射、荧光和红外光谱法研究发现,鼠李糖脂分子插入在磷脂双分子层中,促进了磷脂碳氢链的紊乱,达到破坏菌体细胞膜的效果;Nalini等[35]报道显示,鼠李糖脂生物表面活性剂在真菌防治中的作用方式还包括促使细胞壁形成通道。本研究中,从菌丝体电导率和显微观察的角度,初步研究了鼠李糖脂对水霉菌丝的抑制机制。菌体电导率的变化反映了菌体细胞膜通透性的改变,电导率越大,表明细胞内的导电离子出现外泄越严重,这些离子包括K+、Na+、Mg2+等,对维持真菌细胞的渗透平衡、代谢均有重要作用[36-37]。本研究中测定了鼠李糖脂处理后水霉菌体的电导率,结果显示,鼠李糖脂处理后的寄生水霉菌体电导率与未经处理的相比显著提高(图3),这表明菌体细胞内容物渗出。细胞质物质的明显渗漏通常被用作细胞质和质膜严重和不可逆损伤的标志[38-39],因此,从本试验结果可以推论,鼠李糖脂对水霉菌体造成了破坏。
本试验进一步通过光学显微镜、扫描电镜和透射电镜观察,证实了鼠李糖脂对寄生水霉菌丝体的损伤情况(图4、图5)。鼠李糖脂破坏了寄生水霉菌丝细胞壁、细胞膜的结构,并损伤细胞器,影响了它们正常的功能,因此,可以初步认为,鼠李糖脂对水霉的抑制作用是对水霉菌体细胞结构的破坏导致的,这与之前报道的用鼠李糖脂处理后的真菌菌丝完整性受损的观察结果一致[40-41],但具体的细胞表面结构如何发生改变还需进一步研究。本研究中用透射电镜观察到鼠李糖脂处理的寄生水霉细胞壁裂解消融。水霉菌属细胞壁主要是由纤维素和葡聚糖组成[42],纤维素是由D-葡萄糖以β-1,4-糖苷键连接组成的多聚糖,鼠李糖脂中的鼠李糖环也以β-1,4-糖苷键连接成2或3糖[43],这种结构的相似性可能会使鼠李糖脂竞争性与水霉细胞壁多糖结合,破坏寄生水霉纤维素的合成或链接。因此,加强鼠李糖脂组成结构与作用活性关系的研究,有可能会帮助提升鼠李糖脂对水霉抑制作用的有效性,从而为制备更加高效的真菌抑制剂提供理论支持。
4 结论
1)鼠李糖脂对寄生水霉具有优异的抗菌活性,并能破坏寄生水霉菌体细胞膜壁结构。
2)鼠李糖脂作为一种环境友好型的生物表面活性剂,其良好的水霉抑制活性有利于水产动物防治真菌感染制剂的研发,可促进水产业的健康发展。

