干燥方式对无花果酚类物质及其抗氧化活性的影响
秦丹丹,张生万,郭 萌,郭彩霞*,李美萍
无花果(Ficus carica L.)为桑科榕属植物,含有丰富的碳水化合物、蛋白质、粗纤维、脂肪酸、多酚、维生素、矿物质等,其中酚类物质具有很强的生理活性[1-3]。植物多酚是水果中含量最丰富的抗氧化物质之一,能够有效清除自由基、保护机体生物大分子以及抗肿瘤、抗动脉硬化等[4]。新鲜无花果皮薄质软、含糖量高,易被微生物感染而变质,不利于贮藏和长途运输,极大地影响了无花果的食用价值和经济价值[5]。因此,无花果常被加工成无花果干。干燥处理能够避免微生物感染导致的变质,并且可以抑制植物的呼吸作用及其他生理活动[6],同时不同的干燥方法会对理化性质产生不同的影响。
目前,无花果的干燥主要采用自然晒干、烘干等传统干燥方法以及真空冷冻干燥等现代干燥技术。强立敏[5]对真空冷冻干燥无花果的工艺进行了优化;Slatnar等[1]比较了晒干、烘干无花果及无花果鲜果中的糖、酸和多酚组分的差异,发现烘干的无花果干总酚含量高于晒干无花果;Vallejo等[7]研究了无花果鲜果及市售干果的酚类化合物的组成。除了以上提到的干燥方式,真空干燥、远红外干燥等也应用于果蔬的干燥加工过程。真空干燥是一种在真空状态下使物料快速干燥的加工新技术。王玉婷等[8]研究不同干燥方式对香蕉片多酚物质的影响,发现经真空干燥的香蕉片中总酚含量高于真空冷冻干燥和热风干燥。远红外干燥是一种辐射干燥方式,其温度较高、物料受热均匀,适宜干燥含水量较高的食品及果蔬等农副食品。朱香燕等[9]比较了热风干燥和远红外干燥对苦瓜粉品质的影响。丁莹[10]对远红外干燥萝卜的机理进行了研究。然而关于自然晒干、真空冷冻干燥、烘箱干燥、远红外干燥和真空干燥5 种干燥方式对无花果多酚的影响尚鲜见报道。本研究通过比较此5 种干燥方式对无花果总酚含量及酚类物质组成的影响,评价不同干燥方式对其体外抗氧化活性的影响,旨在为选择无花果的最适宜干燥工艺提供理论依据。
1 材料与方法
1.1 材料与试剂
无花果于2016年6月购于四川省金堂县(北纬30°51′51.54′,东经104°24′33.72′),采收时间为2016年6月,所有果实均为7~8成熟。
没食子酸 天津市光复精细研究所;福林-酚北京索莱宝科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-l-2-picrylhydrazyl,DPPH)、2,2’-联氨-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-azino-bis-(3-ehtybenzothiaazoline-6-sulfonic acid) diammonium salt,ABTS)、水溶性VE(Trolox) 美国Sigma公司;绿原酸、芦丁、表儿茶素、儿茶素、阿魏酸、没食子酸(色谱纯) 中国食品药品检定研究院;槲皮素、槲皮苷、P-羟基苯甲酸(色谱纯) 上海安谱实验技术有限公司;乙腈、甲醇和乙酸为色谱纯,其他试剂均为分析纯。
1.2 仪器与设备
WS70-1型红外线快速干燥箱 杭州齐威仪器有限公司;KWS1538J-F5N 38L厨房家用烘焙电烤箱 广东格兰仕集团有限公司;DZF-6032真空干燥箱 上海一恒有限公司;2XZ-2单相直联旋片式真空泵 圣科仪器有限公司;LGJ-05冷冻干燥机、SB25-12DTDN超声波清洗机 宁波新芝生物科技股份有限公司;JYL-012多功能榨汁机 九阳股份有限公司;SHZ-D(III)循环水式真空泵 郑州予华仪器制造有限公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器厂;HH-4数显恒温水浴锅 国华电器有限公司;SC-3614 低速离心机安徽中科中佳科学仪器有限公司;UV-2550双光束紫外光谱仪 日本岛津公司;1525型高效液相色谱仪 美国Waters公司。
1.3 方法
1.3.1 干燥处理
新鲜无花果洗净,吸干表面水分,切片,厚度为0.3 cm左右,分别进行自然晒干[11]、烘箱干燥[12]、真空冷冻干燥[13]、远红外干燥[9]和真空干燥处理。其中日晒干燥将无花果片放在通风良好、干燥、有阳光直射的室外进行,温度约为25 ℃;考虑到酚类物质的热敏性及干燥速率,烘箱干燥在温度为60 ℃的条件下进行;远红外干燥时所用远红外灯的功率为550 W,物料与灯的距离约为15 cm;真空干燥在60 ℃、真空度为0.08 MPa的条件下进行;真空冷冻干燥在-50 ℃、100 Pa条件下进行。所有干燥都需将无花果片干燥至恒质量后密封避光保存于干燥器中。
1.3.2 无花果酚类物质的提取及含量测定
采用超声波辅助法提取[14],具体步骤为:取待测样品1.0 g,加入16 mL体积分数60%的无水乙醇,50 ℃、360 W超声处理25 min,重复提取3 次,合并滤液。将上述滤液真空浓缩至6 mL左右,用蒸馏水定容至10 mL。此溶液即为无花果多酚提取液,用于总酚含量、多酚组成和抗氧化活性的测定。
1.3.2.1 总酚含量测定
总酚含量的测定参考王鹏[15]的方法,略作修改:取无花果多酚提取液50 µL,置于10 mL比色管中,加入250 µL 50%(质量分数,下同)福林-酚试剂,混匀后分别加入3.95 mL蒸馏水,混匀;在0.5~8.0 min内再加入750 µL 20%碳酸钠溶液,充分摇匀后,将混合液室温下避光放置2 h,于765 nm波长处测定吸光度,结果以每100 g无花果干样品中没食子酸当量表示,单位为mg GAE/100 g。标准曲线以没食子酸标准溶液绘制,其质量浓度范围为50~500 mg/L,建立标准曲线,得回归方程为y=0.001 0x+0.087 4(R2=0.997 2),式中x为没食子酸溶液质量浓度/(mg/L),y为A765nm。
1.3.2.2 酚类物质组成的测定
取50 mL多酚提取液,用30 mL乙酸乙酯萃取2 次,40 ℃减压蒸干,用1 mL甲醇定容,4 ℃保存备用。进样前用0.22 µm滤膜过滤。
测定方法参考杜国荣[16]的方法并略作修改。色谱条件为:Waters 1525高效液相色谱仪配以Waters 2996光电二极管阵列检测器,Empower色谱工作站,安捷伦ZORBAX SB-C18柱(250 mm×4.6 mm,5 µm),流动相A为体积分数2%乙酸溶液,流动相B为体积分数2%乙酸-乙腈溶液,柱温为30 ℃;流速恒定为0.6 mL/min,进样体积为20 µL。线性梯度洗脱程序为:0.00~1.00 min,15% B;1.01~2.00 min,15%~11% B,2.01~40.00 min,11%~25% B,40.01~60.00 min,25%~30% B。于不同物质的最大波长处进行检测,检测波长分别为260 nm(黄酮醇)、280 nm(羟基苯甲酸及黄烷-3-醇)和320 nm(羟基肉桂酸)。以多酚标准品的保留时间、色谱峰和峰面积对不同干燥方式处理的无花果所含的酚类化合物进行定性及定量分析。
1.3.3 体外抗氧化能力测定
1.3.3.1 DPPH自由基清除能力测定
DPPH自由基清除实验参考杨虎等[17]的方法并略作修改。移取50 µL无花果多酚提取液,分别加入4 mL 25 mg/L新鲜配制的DPPH无水乙醇溶液,振荡混匀,室温下放置20 min,于517 nm波长处测定吸光度A1。同时,将50 µL提取液和4 mL无水乙醇混匀反应后测定其吸光度A2,将50 µL无水乙醇和4 mL DPPH反应液混匀反应后测定其吸光度A3。DPPH自由基清除率按公式(1)计算,以每100 g无花果干样品中Trolox当量表示,单位为µmol Trolox/100 g。标准曲线以Trolox标准液绘制,其浓度范围为200~1 600 µmol/L,建立标准曲线,得回归方程为y=0.038 1x+6.960 9(R2=0.999 9),式中x为Trolox标准液浓度/(µmol/L),y为DPPH自由基清除率/%。
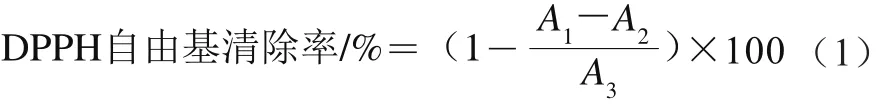
1.3.3.2 ABTS+·清除能力测定
ABTS+·清除实验参考邹容等[13]的方法并略作修改。将20 mg ABTS和5.2 mL 2.4 mmol/L的过硫酸钾溶液混合,在室温、避光条件下反应12 h,得到ABTS+·储备液。取1.6 mL ABTS+·储备液用无水甲醇稀释至100 mL作为ABTS+·工作液。在10 mL具塞试管中依次加入3.9 mL ABTS+·工作液和0.1 mL无花果多酚稀释液(1∶3,V∶V)混合均匀,室温、避光放置40 min,于734 nm波长处测定吸光度A1。将3.9 mL ABTS+·工作液和0.1 mL蒸馏水混匀反应后测定其吸光度A0。ABTS+·清除率按公式(2)计算,以每100 g无花果干样品中Trolox当量表示,单位为µmol Trolox/100 g。标准曲线以Trolox标准液绘制,其浓度范围为200~1 200 µmol/L,建立标准曲线,得回归方程y=0.304 8x-3.764 2(R2=0.999 8),式中x为Trolox标准液浓度/(µmol/L),y为ABTS+·清除率/%。
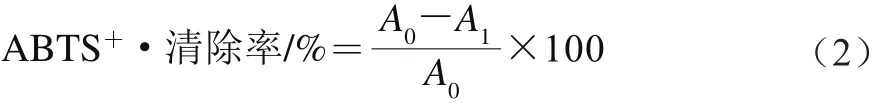
1.3.3.3 总还原力测定
总还原力的测定参考尚红梅等[18]的方法并略作修改。取2 mL无花果多酚稀释液(1∶10,V∶V),置于10 mL离心管中,加入2 mL的磷酸盐缓冲液(0.2 mol/L,pH 6.6)和2 mL质量分数1%铁氰化钾溶液,置于50 ℃水浴中处理20 min,冷却后加入2 mL 10%体积分数三氯乙酸溶液,混合物于4 000 r/min离心10 min,取上清液2 mL加入2 mL蒸馏水和0.4 mL 0.1%氯化铁溶液,在700 nm波长处测吸光度。结果以每100 g无花果干样品中Trolox当量表示,单位为µmol Trolox/100 g。标准曲线以Trolox标准液绘制,其浓度范围为0~2 000 µmol/L,建立标准曲线,得回归方程y=0.000 4x+0.125 5(R2=0.994 0),式中x为标准液浓度/(µmol/L),y为A700nm。
1.4 数据处理
所有实验均重复3 次,结果以平均值±标准差表示,用SPSS Statistics 17.0进行方差分析,并用Duncan’s法进行多重比较,相关性分析采用Pearson’s法。以P<0.05表示差异或相关性显著,以P<0.01表示差异或相关性极显著。
2 结果与分析
2.1 干燥方式对无花果失水率的影响
不同干燥方式下无花果的失水率分别为:真空冷冻干燥81.01%、自然晒干81.85%、烘箱干燥81.11%、远红外干燥81.52%、真空干燥83.77%;5 种方式下失水率均大于81.00%,且具有显著性差异(P<0.05),其中真空干燥的失水率最大,达到83.77%,这是因为真空干燥是在低压、高温条件下进行,有利于水分的散失[11]。
2.2 干燥方式对无花果总酚含量的影响
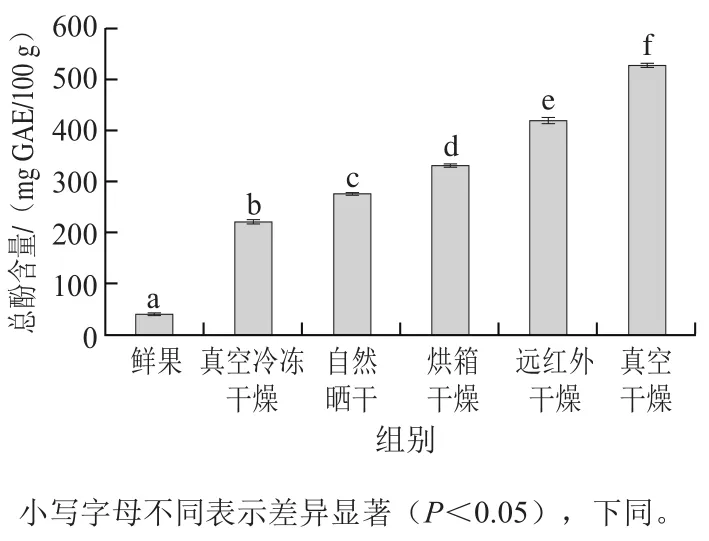
图1 干燥方式对无花果总酚含量的影响Fig. 1 Effects of drying methods on total polyphenol content of figs
不同干燥方式处理后无花果总酚的含量如图1所示。经不同干燥方式处理后,无花果总酚含量具有显著性差异(P<0.05),含量依次为真空干燥>远红外干燥>烘箱干燥>自然晒干>真空冷冻干燥。其中真空干燥样品中总酚含量最高,为526.73 mg GAE/100 g,而采用真空冷冻干燥后无花果总酚含量最低,仅为221.40 mg GAE/100 g。与真空冷冻干燥相比,有加热过程参与的干燥方式中总酚含量较高,这可能是由于在加热过程中有酚类物质的生成。Que Fei等[19]认为在加热过程中,酚类物质的前体酚醛分子的非酶转化导致了酚类物质的生成。相比自然干燥和烘箱干燥,远红外干燥由于是辐射干燥且温度较高[9],导致在干燥过程中有更多的酚类物质生成,所以样品中总酚含量较高。而真空干燥在真空状态下,隔绝氧气,酚类物质氧化损失较少,有报道称氧气的参与在干燥过程中对总酚含量的变化起着重要的作用[13],因此真空干燥得到的无花果中总酚含量显著高于其他干燥方式(P<0.05)。本实验中,真空冷冻干燥样品的总酚含量最低,造成这一现象的原因除在加热过程中没有酚类物质的生成外,还有多酚氧化酶的作用。郭泽美等[11]认为多酚氧化酶在冻干过程中较为稳定,但冻干结束后的回温过程其活性得到增强,造成酚类物质的损失。
2.3 干燥方式对无花果酚类物质的影响
酚类化合物是植物次生代谢产物,具有降血压、降血糖、预防心血管疾病等功效[20]。经查阅文献,无花果中研究较多的酚类物质有绿原酸、儿茶素、表儿茶素、芦丁、没食子酸、槲皮素、槲皮苷、花色苷、阿魏酸、4-羟基苯甲酸等[1,7]。因此本实验中选取绿原酸、儿茶素、表二茶素、芦丁、没食子酸、槲皮素、槲皮苷、阿魏酸、4-羟基苯甲酸9 种化合物作为主要考察的酚类物质。不同干燥方式处理后无花果的酚类物质及含量如表1所示,结果显示:鲜果、真空冷冻干燥(图2B)和烘箱干燥的样品均能检测到这9 种酚类物质,而自然晒干和真空干燥的样品中检测不到表儿茶素,远红外干燥的样品中检测不到表儿茶素与绿原酸。有研究分析丰水梨经过干燥之后,表儿茶素含量急剧下降,其原因主要是受干燥温度和氧气的影响[21]。而绿原酸易受温度的影响降解或生成其他物质[22-23],从而导致远红外干燥样品中检测不到绿原酸。
采用高效液相色谱法检测鲜果中酚类物质的含量,可得鲜果中各酚类物质含量分别为:没食子酸0.02 mg/100 g、绿原酸21.73 µg/100 g、儿茶素0.07 mg/100 g、4-羟基苯甲酸13.26 µg/100 g、表儿茶素0.09 mg/100 g、芦丁0.08 mg/100 g、阿魏酸23.63 µg/100 g、槲皮苷8.04 µg/100 g、槲皮素2.02 µg/100 g。而经过不同干燥之后,样品大量失水,酚类物质显著高于鲜果中含量(P<0.05),与Slatnar等[1]的报道一致,其原因是酚类物质在干燥过程中得到了浓缩。Dewanto等[24]认为酚类物质常与细胞壁上的物质以结合态的形式存在,热加工、巴氏杀菌以及冷冻干燥等可以使酚类物质从结合态释放出来,导致酚类物质的增加或减少。还有可能是干燥过程中酚类物质发生热分解、氧化,以及在酶的作用下转化为其他物质或由其他物质转化为酚类物质,导致其含量的变化[21]。由表1也可以看出,干燥后的无花果中含量较多的酚类物质为没食子酸、儿茶素和芦丁。其中除烘箱干燥和真空冷冻干燥外,真空干燥、远红外干燥及自然晒干得到的无花果中没食子酸含量均为最高,分别为12.83、10.01、7.15 mg/100 g。Rangkadilok等[25]认为在干燥过程中部分单宁物质降解为没食子酸,导致其含量增加。张颖等[26]研究报道芦丁的含量在低于50 ℃条件下随着干燥温度的升高而升高,之后随着温度升高,芦丁的含量呈现下降趋势,这可能就是远红外干燥样品中芦丁含量最低的原因。此外,真空干燥样品中芦丁含量显著高于烘箱干燥(P<0.05),推测真空条件使大分子物质降解生成芦丁,导致了真空干燥样品中芦丁含量升高。绿原酸不仅受到温度的影响,升高压力也可以使绿原酸发生降解[22],本研究也得到了类似结果,真空干燥样品中绿原酸含量显著低于烘箱干燥(P<0.05)。研究发现,槲皮素在高温下比较稳定,而其他物质在高温和真空条件下会发生水解和去糖基化反应,因此真空干燥样品中槲皮素含量显著高于其他干燥方式(P<0.05)[27-28]。此外,经真空干燥处理后的无花果中各酚类物质含量总和最高,为25.96 mg/100 g,这说明选择合理的加工方式对保留无花果中对人类健康有益的活性成分具有重要意义。

图2 酚类化合物混合标准品(A)及真空冷冻干燥样品(B)的高效液相色谱图Fig. 2 High performance liquid chromatograms of polyphenol compound standards (A) and polyphenol extracted from freeze dried figs (B)
2.4 干燥方式对无花果抗氧化活性的影响
DPPH法、ABTS+·法和总还原力法是评价化合物潜在抗氧化活性的常见方法。DPPH自由基和ABTS+·分别可以形成稳定的醇溶性自由基和水溶性自由基,因此常用于评价抗氧化物质清除自由基的能力。具有还原性的物质可以还原脂质过氧化过程中产生的中间体,因此总还原力可以表现抗氧化活性的强弱[29]。
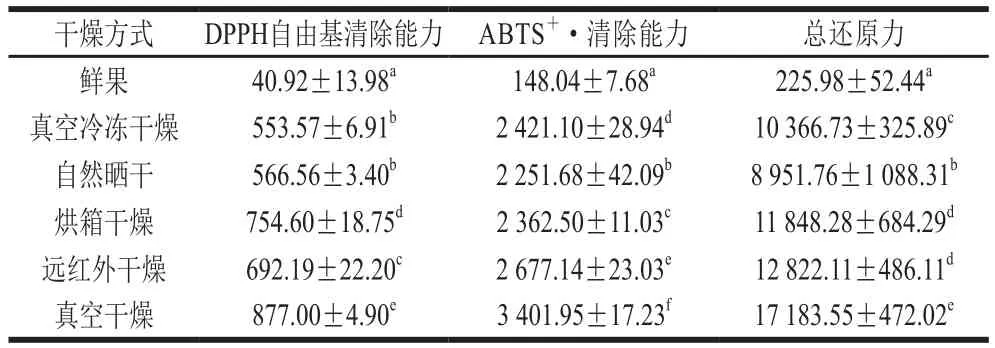
表2 不同干燥方式对无花果抗氧化活性的影响Table 2 Effects of drying methods on antioxidant activities of figsµmol Trolox/100 g
由表2可以看出,5 种干燥方式无花果的DPPH自由基清除能力大小依次为:真空干燥>烘箱干燥>远红外干燥>自然晒干≈真空冷冻干燥;5 种干燥方式无花果的ABTS+·清除能力大小依次为:真空干燥>远红外干燥>真空冷冻干燥>烘箱干燥>自然晒干;5 种干燥方式无花果的总还原力大小依次为:真空干燥>远红外干燥≈烘箱干燥>真空冷冻干燥>自然晒干。变化趋势与总酚含量变化不完全一致,可能是由于不同干燥方式下无花果的酚类物质不同,且每种酚类物质对抗氧化活性的贡献不同。真空干燥的3 种抗氧化活性均为最高,这与真空干燥的酚类物质显著高于其他干燥方式的结果一致(P<0.05)。此结果与王玉婷等[8]报道的真空冷冻干燥样品抗氧化活性最强的结果不一致,可能是酚类物质的组成和变化趋势不同所致。
2.5 相关性分析
为进一步研究无花果中酚类化合物与其抗氧化活性之间的关系,对不同干燥方式处理后无花果总酚含量、酚类物质组成及其抗氧化活性进行相关性分析,其相关系数R2和P值见表3。其中总酚含量与DPPH自由基清除能力、ABTS+·清除能力和总还原力之间均呈极显著相关(R2>0.80,P<0.01)。对DPPH自由基清除能力影响较大的酚类物质是槲皮苷(R2=0.862)、阿魏酸(R2=0.802)和儿茶素(R2=0.798);对ABTS+·清除能力影响较大的酚类物质是儿茶素(R2=0.838)、槲皮苷(R2=0.792)和4-羟基苯甲酸(R2=0.746);对总还原力影响较大的酚类物质是儿茶素(R2=0.844)、槲皮苷(R2=0.825)和阿魏酸(R2=0.778)。绿原酸含量与DPPH自由基清除能力呈显著相关(0.80>R2>0.50,P<0.05),但其与ABTS+·清除能力和总还原力的相关性不显著(P>0.05);表儿茶素与DPPH自由基清除能力、ABTS+·清除能力和总还原力之间的相关性均不显著(P>0.05)。因此,无花果抗氧化活性主要与儿茶素、槲皮苷、阿魏酸、4-羟基苯甲酸等酚类物质的含量有关。
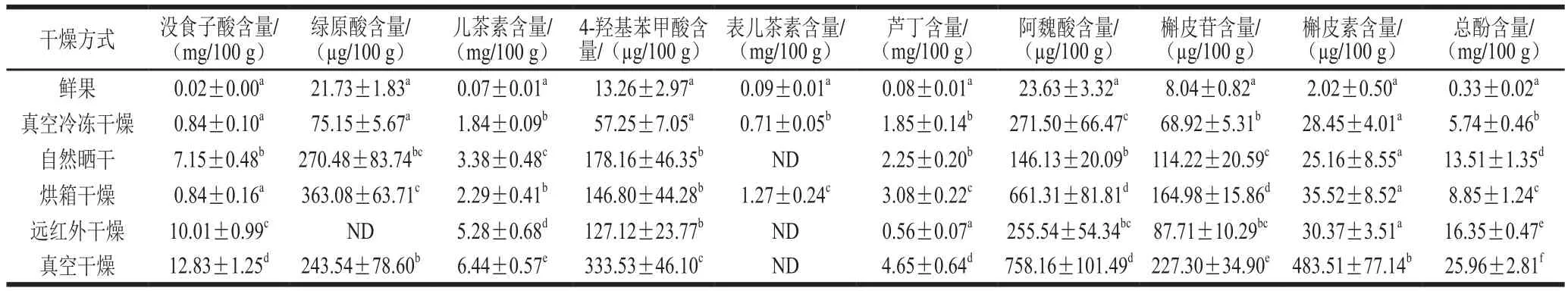
表1 不同干燥方式对无花果酚类物质含量的影响Table 1 Effects of drying methods on the contents of total and individual phenolic compounds in figs

表3 不同干燥方式无花果酚类物质含量及其抗氧化活性的相关性分析Table 3 Correlational analysis between polyphenol compounds and antioxidant activity of dried figs obtained by different drying methods
3 结 论
不同干燥方式对无花果多酚含量影响显著(P<0.05),其中经真空干燥处理的无花果中总酚含量最高,达到526.73 mg GAE/100 g,其次为远红外干燥、烘箱干燥和自然晒干,真空冷冻干燥的样品中含量最低。经高效液相色谱分析发现,不同干燥方式处理后无花果中的酚类物质组成均有显著性差异(P<0.05),其中真空干燥后无花果酚类物质含量总和最高。体外抗氧化结果表明,真空干燥后无花果的DPPH自由基清除能力、ABTS+·清除能力和总还原力最高。由相关性分析结果可知,无花果的抗氧化活性与儿茶素、槲皮苷、阿魏酸、4-羟基苯甲酸等酚类物质的含量有关。
综上所述,真空干燥处理后无花果总酚含量及酚类物质含量总和最多、抗氧化活性最强,优于其他4 种干燥方法,较适用于无花果的干制。下一步研究可优化真空干燥无花果的工艺,从而为无花果的干燥提供理论依据。
参考文献:
[1] SLATNAR A, KLANCAR U, STAMPAR F, et al. Effect of drying of figs (Ficus carica L.) on the contents of sugars, organic acids, and phenolic compounds[J]. Journal of Agricultural and Food Chemistry,2011, 59(21): 11696-11702. DOI:10.1021/jf202707y.
[2] MUJIĆ I, BAVCON K M, JOKIĆ S, et al. Characterisation of volatiles in dried white varieties figs (Ficus carica L.)[J]. Journal of Food Science and Technology, 2014, 51(9): 1837-1846. DOI:10.1001/s13197-012-0750-x.
[3] 吴子江, 马翠兰, 郭阳彬, 等. 无花果生产与研究进展[J]. 亚热带农业研究, 2013, 9(3): 151-157.
[4] 赵伟, 李建科, 何晓叶, 等. 几种常见植物多酚降血脂作用及机制研究进展[J]. 食品科学, 2014, 35(21): 258-263. DOI:10.7506/spkx1002-6630-201421051.
[5] 强立敏. 无花果真空冷冻干燥工艺的研究[D]. 保定: 河北农业大学,2013: 2-4.
[6] 陈玮琦, 郭玉蓉, 张娟, 等. 干燥方式对苹果幼果干酚类物质及其抗氧化性的影响[J]. 食品科学, 2015, 36(5): 33-37. DOI:10.7506/spkx1002-6630-201505007.
[7] VALLEJO F, MARÍN J G, TOMÁS-BARBERÁN F A. Phenolic compound content of fresh and dried figs (Ficus carica L.)[J].Food Chemistry, 2012, 130(3): 485-492. DOI:10.1016/j.foodchem.2011.07.032.
[8] 王玉婷, 陈奕, 李雨波. 干燥方式对香蕉片总多酚含量及其抗氧化性的影响[J]. 食品科学, 2013, 34(23): 113-117. DOI:10.7506/spkx1002-6630-201323024.
[9] 朱香燕, 张珺, 何义雁, 等. 热风与远红外干燥温度对苦瓜全粉品质的影响[J]. 现代食品科技, 2015, 31(7): 265-269; 325. DOI:10.13982/j.mfst.1673-9078.2015.7.042.
[10] 丁莹. 萝卜远红外干燥的试验研究[D]. 淄博: 山东理工大学, 2009:4-6.
[11] 郭泽美, 任章成, 陈腾, 等. 干燥方式对葡萄皮多酚及其抗氧化活性的影响[J]. 食品科学, 2013, 34(11): 117-121. DOI:10.7506/spkx1002-6630-201311026.
[12] SPIGNO G, FAVERI D M D. Antioxidants from grape stalks and marc: influence of extraction procedure on yield, purity and antioxidant power of the extracts[J]. Journal of Food Engineering,2007, 78(3): 793-801. DOI:10.1016/j.jfoodeng.2005.11.020.
[13] 邹容, 游玉明, 陈泽雄, 等. 干燥方式对金银花酚类物质及其抗氧化活性的影响[J]. 食品科学, 2016, 37(5): 78-83. DOI:10.7506/spkx1002-6630-20160515.
[14] 任晓婷, 张生万, 李美萍, 等. 不同品种猕猴桃总酚含量与清除自由基能力相关性研究[J]. 山西农业大学学报(自然科学版), 2016,36(5): 341-344. DOI:10.3969/j.issn.1671-8151.2016.05.009.
[15] 王鹏. 丹东地区野生软枣猕猴桃中多酚提取工艺[J]. 辽东学院学报(自然科学版), 2013, 20(1): 8-11. DOI:10.3969/j.issn.1673-4939.2013.01.003.
[16] 杜国荣. 猕猴桃、柿和苹果果实的抗氧化能力及其抗氧化活性成分的分析[D]. 杨凌: 西北农林科技大学, 2009: 75-79.
[17] 杨虎, 张生堂, 高国强. 玫瑰黄酮的提取及其清除DPPH自由基活性研究[J]. 食品科学, 2012, 33(24): 152-155.
[18] 尚红梅, 郭玮, 潘丹, 等. 干燥方式对菊苣根多酚含量和抗氧化活性的影响[J]. 食品科学, 2015, 36(1): 84-88. DOI:10.7506/spkx1002-6630-201501016.
[19] QUE Fei, MAO Linchun, FANG Xuehua, et al. Comparison of hot air-drying and freeze-drying on the physicochemical properties and antioxidant activities of pumpkin (Cucurbita moschata Duch.)flours[J]. International Journal of Food Science and Technology, 2008,43(7): 1195-1201. DOI:10.1111/j.1365-2621.2007.01590.x.
[20] 李楠, 师俊玲, 王昆. 14 种海棠果实多酚种类及体外抗氧化活性分析[J]. 食品科学, 2014, 35(5): 53-58. DOI:10.7506/spkx1002-6630-201405011.
[21] 唐璐璐. 干燥方式对丰水梨片干燥特性及品质影响的研究[D]. 阿拉尔: 塔里木大学, 2016: 68-70.
[22] KEENAN D F, BRUNTON N, GORMLEY R, et al. Effects of thermal and high hydrostatic pressure processing and storage on the content of polyphenols and some quality attributes of fruit smoothies[J].Journal of Agricultural and Food Chemistry, 2011, 59(2): 601-607.DOI:10.1021/jf1035096.
[23] MURAKAMI M, YAMAGUCHI T, TAKAMURA H, et al. Effects of thermal treatment on radical-scavenging activity of single and mixed polyphenolic compounds[J]. Journal of Food Science, 2004, 69(1):C7-C10. DOI:10.1111/j.1365-2621.2004.tb17848.x.
[24] DEWANTO V, WU X, LIU R X. Processed sweet corn has higher antioxidant activity[J]. Journal of Agricultural and Food Chemistry,2002, 50(17): 4959-4964. DOI:10.1021/jf0255937.
[25] RANGKADILOK N, WORASUTTAYANGKURN L, BENNETT R N, et al. Identification and quantification of polyphenolic compounds in longan (Euphoria longana Lam.) fruit[J]. Journal of Agricultural and Food Chemistry, 2005, 53(5): 1387-1392. DOI:10.1021/jf0403484.
[26] 张颖, 郭盛, 朱邵晴, 等. 不同干燥方法对酸枣叶中核苷类、氨基酸类及黄酮类成分的影响[J]. 食品工业科技, 2016, 37(9): 296-303.DOI:10.13386/j.issn1002-0306.2016.09.049.
[27] ROHN S, BUCHNER N, DRIEMEL G, et al. Thermal degradation of onion quercetin glucosides under roasting conditions[J]. Journal of Agricultural and Food Chemistry, 2007, 55(4): 1568-1573.DOI:10.1021/jf063221i.
[28] COSTA E M D, FILHO J M B, NASCIMENTO T G D, et al.Thermal characterization of the quercetin and rutin flavonoids[J].Thermochimica Acta, 2002, 392/393(18): 79-84. DOI:10.1016/S0040-6031(02)00087-4.
[29] ZHAO H F, CHEN W F, LU J, et al. Phenolic profiles and antioxidant activities of commercial beers[J]. Food Chemistry, 2010, 119(3):1150-1158. DOI:10.1016/j.foodchem.2009.08.028.

