生物净水栅对凡纳滨对虾肠道菌群组成的影响
裴鹏兵,吴洁琼,梁宏豪,杜 虹,2,4
( 1.汕头大学 理学院 生物系,广东 汕头 515063;2.汕头大学 理学院,海洋生物研究所,广东省海洋生物技术重点实验室,广东 汕头 515063;3.福建省水产研究所,福建省海洋生物增养殖与高值化利用重点实验室,福建 厦门 361013;4.汕头大学 理学院,汕头大学—马尔凯理工大学藻类联合研究中心,广东 汕头 515063 )
凡纳滨对虾(Litopenaeusvannamei)又称南美白对虾,具有个体大、生长快、营养需求低、抗病力强等优点,是目前世界上三大养殖对虾中单产量最高的对虾品种之一。近年来,在凡纳滨对虾养殖过程中,病害尤其是细菌性疾病、水质恶化等现象频发[1],像白斑病、红腿病、软壳病等[2-3]。水质的好坏直接影响着对虾肠道菌群组成,近几年的研究表明[4-5],细菌在虾肠道中的作用受到越来越多的关注,其对宿主动物的肠道发育、营养、免疫应答和疾病抗性发挥着重要作用。对虾肠道内的一些有益共生菌对疾病有一定的抗病性[6-7],同时也存在着一些条件致病菌,二者共同维持着肠道菌群的动态平衡[8]。因此,研究对虾肠道菌群动态分布对了解对虾的健康和可持续养殖有着积极作用。杨莺莺等[9]利用纯化培养法,从人工饲料饲养的对虾肠道和养殖水体中共分离出71株细菌,而环境中99%的细菌是不可培养的,所以纯化培养法不能全面地反映对虾肠道菌群组成及多样性。刘淮德等[10]应用变性梯度凝胶电泳技术在凡纳滨对虾肠道中检测出了12种细菌。王春忠等[3]采用构建16S rRNA基因克隆文库的方法对长毛对虾(Penaeuspenicillatus)海水养殖环境以及虾肠道微生物群落组成进行研究,检测到对虾肠道细菌优势种群为厚壁细菌(75.79%)、梭杆菌(13.68%)和γ-变形杆菌(10.53%)。Illumina Miseq高通量测序作为新一代测序技术,具有速度快、测序容量大、精确度高等特点[11],能够较为真实、全面地反映样品中微生物群落组成的基本特征,广泛地应用于各个领域。
生物净水栅——以聚酯为材质通过缠绕成结而形成线性附着基质作为微生物附着的载体[12],微生物在其表面不断聚集、生长、繁殖,逐渐形成一层结构复杂的生物膜,生物净水栅在池塘水产养殖上受到广泛关注[13-14]。笔者以传统池塘养殖(对照组)和添加生物净水栅池塘养殖(试验组)的凡纳滨对虾肠道为试验对象,采用高通量测序技术对两组对虾肠道的菌群组成进行分析,比较两组对虾肠道菌群组成的差异,以期为生物净水栅应用于池塘养殖提供参考意见。
1 材料与方法
1.1 试验设计
试验实施的地点位于广东省汕头市西郊牛田洋养殖基地,设置一个添加生物净水栅池塘(试验组)和一个传统池塘(对照组),对照组未添加生物净水栅,其他条件均一致。两个池塘在养殖期间均不投药和添加抗生素。对虾的养殖时间为2015年6月23日至2015年12月19日,样品采集时间是2015年10月31日,采样日停止投喂饲料。凡纳滨对虾起始规格为(2.0±0.1) cm,两个池塘投苗量均为200尾/m2。
每日7:00开始充氧,充氧3~4 h,并于10:00投喂饲料,投喂量视具体情况而定,前3周日投喂2次(第2次于18:00投喂),之后每日投喂1次。当遇到恶劣天气,如酷热或台风暴雨天气时,分别采取补充水源(附近的沟渠水源)和及时排出雨水等措施。
1.2 试验试剂、仪器
DNA提取试剂盒(E.Z.N.A.® Stool DNA Kit)购自Omega公司、DNA Marker(λ-Hind Ⅲ digest)购自Takara公司、DNA Marker(D2000)购自Tiangen公司、Eppendorf高速冷冻离心机(5424R型)购自厦门市诺源泰仪器设备有限公司,Eppendorf舒适型恒温混匀器(5355型)购自上海创奕科教设备有限公司,Scientz-48型高通量组织研磨器购自宁波新芝生物科技股份有限公司。
1.3 试验材料
1.3.1 生物净水栅
生物净水栅由汕头市阿科蔓环保科技有限公司生产,材料为PET材质。该生物净水栅由多条线性生物基(直径约5 cm)固定于单一绳子上而一排一排自然悬浮于水面上,使其遍布整个池塘。每组生物净水栅之间间隔1 m,每组有20条生物基,自然悬浮高度为1.5 m,并且于投苗前将其安置池塘内(图1)。
图1 生物净水栅铺设
1.3.2 凡纳滨对虾
试验所用凡纳滨对虾取自广东省汕头市西郊牛田洋养殖基地,从虾塘随机捕捞体色正常、体表无损伤、大小均一的成熟期凡纳滨对虾,置于冰盒中保存,带回实验室立即处理。每组随机取30尾虾,随机分为3个重复,分别命名为试验组1、试验组2、试验组3、对照组1、对照组2、对照组3。在无菌条件下,先用无菌水漂洗试验用凡纳滨对虾3次,再用75%的无水乙醇冲洗虾体表3次,用灭菌的解剖刀剖开虾体腔,用灭菌的镊子小心取出虾肠道,再置于0.9%的无菌生理盐水中漂洗3次,随后分别置于无菌离心管中,所有样品均放置-80 ℃超低温冰箱冻存备用。取相同量的虾肠道,置于Scientz-48高通量组织研磨器中充分研磨,研磨后用无菌生理盐水冲洗得到虾肠道匀浆。
1.4 试验方法
采用Illumina Miseq高通量测序技术(委托深圳华大基因科技服务有限公司进行测序和生物信息学分析),根据细菌16S rRNA基因V4区序列设计引物如下:正向引物515F 5′-GTGCCAGMGCCGCGGTAA-3′;反向引物806R 5′-GGACTACHVGGGTWTCTAAT-3′。
1.5 数据分析
所获得的原始数据经过数据过滤,滤除低质量的序列,剩余高质量的整理过的数据方可用于后期分析。通过序列之间的重叠关系将序列拼接成标签,利用uparse(v7.0.1090)软件在97%相似度下将标签聚成1个可操作分类单元,得到可操作分类单元的代表序列。然后通过可操作分类单元与数据库比对,对可操作分类单元进行物种注释,基于可操作分类单元和物种注释结果进行样品物种复杂度分析以及组间物种差异分析。样品多样性分析包括物种指数、Chao指数、Ace指数、Shannon指数以及Simpson指数。利用SPSS 19.0软件对数据做差异显著性分析,设置差异显著性水平α=0.05,当P<0.05时表示差异显著。
2 结 果
2.1 物种分类及丰度统计
2.1.1 可操作分类单元及其丰度统计
6个样品获得的有效序列条数分别为31 512(试验组1)、31 351(试验组2)、31 255(试验组3)、31 411(对照组1)、30 367(对照组2)和31 329(对照组3),共产生187 225条序列(表1)。6个样品各产生的可操作分类单元数分别为214(试验组1)、125(试验组2)、118(试验组3)、172(对照组1)、109(对照组2)和83(对照组3),试验组样品平均可操作分类单元数约150,对照组样品的平均可操作分类单元数约120(表1)。
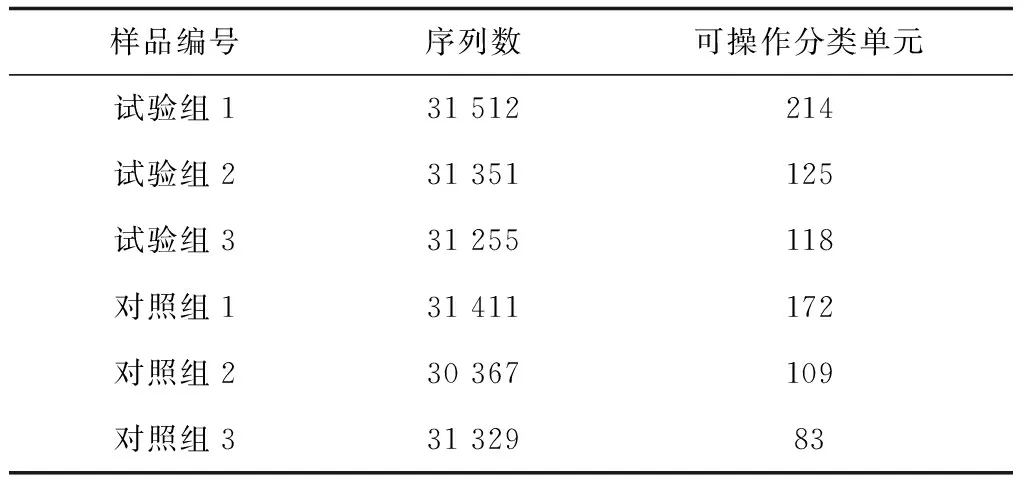
表1 样品可操作分类单元数统计
2.1.2 可操作分类单元维恩图
基于试验组和对照组样品中所用的可操作分类单元做维恩图,比较两组对虾肠道菌群的物种丰富度差异。两组对虾肠道样品有效可操作分类单元总数为418个,共有的可操作分类单元数为117个,占试验组样品可操作分类单元总数的39.53%,占对照组样品可操作分类单元总数的48.95%。其中试验组样品独有可操作分类单元数为179个,对照组样品独有可操作分类单元数为122个,试验组物种的独有率达到60.47%,而对照组物种的独有率为51.05%(图2)。数据表明,两组对虾肠道菌群的物种丰富度存在差异,试验组样品的物种丰富度要高于对照组,即添加生物净水栅池塘凡纳滨对虾肠道菌群丰富度比传统池塘凡纳滨对虾肠道菌群丰富度高。所得可操作分类单元结果用R语言工具统计和作图软件做等级丰度曲线图(图3)。等级丰度曲线结果显示,6个样品中的试验组1的物种丰富度最高,均匀度最低,表明该样品中物种组成最丰富,但样品中各物种所占比例差异较大。试验组样品中试验组1、试验组2、试验组3的物种丰富度分别高于对照组样品中对应的对照组1、对照组2、对照组3,而试验组1的均匀度最低(图3)。整体上看,试验组样品的物种丰富度要比对照组样品高,且均匀度要高于对照组(表2)。
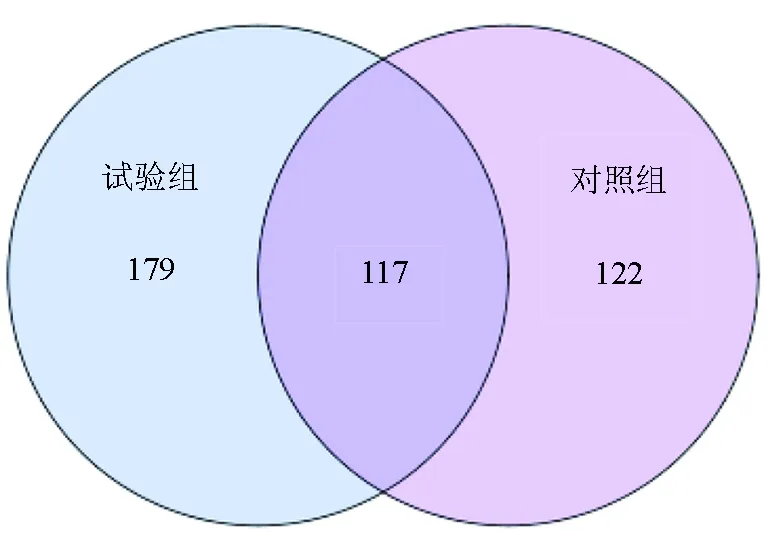
图2 两组样品的维恩图
2.2 细菌多样性指数
从各组样品的多样性指数(表2)可见,试验组样品的各项指数均高于对照组样品,其中,试验组样品的Chao指数和Ace指数分别高于对照组样品的26.34%、24.49%(P>0.05),说明试验组虾肠道的细菌菌群丰富度高于对照组虾肠道。试验组样品的Shannon指数高于对照组样品的13.33%(P>0.05),说明试验组虾肠道菌群多样性高于对照组。
2.3 细菌菌群组成
对两组样品的有效序列进行归类操作分析,统计不同分类单元所对应的细菌门类及其相对丰度。试验结果表明,两组样品之间的菌群结构相似,结构组成所占比例上存在一定的差异性。在门水平上,添加和未添加生物净水栅池塘凡纳滨对虾肠道菌群结构主要由13个细菌门组成,分别为变形菌门、拟杆菌门、软壁菌门、放线菌门、绿弯菌门、浮霉菌门、厚壁菌门、疣微菌门、蓝藻门、梭杆菌门、绿菌门、酸杆菌门和硝化螺旋菌门。其中,试验组样品和对照组样品均以变形菌门含量最高,分别占试验组样品中细菌总数的58.97%和对照组样品中细菌总数的40.74%(表3,图4a)。两组样品中另外两大优势门类分别是拟杆菌门和软壁菌门,两者分别占试验组样品中细菌总数的26.90%和11.69%,在对照组样品中的占比分别为28.46%和29.34%(表3)。梭杆菌门和绿菌门均在试验组样品中鉴定到,而在对照组样品中并未鉴定出这两个细菌门类,这可能跟添加生物净水栅有关。另外,硝化螺旋菌门出现在了对照组样品中而未出现在试验组样品中,硝酸螺旋菌门下的硝化螺旋菌属作为硝化细菌,可将亚硝酸盐氧化成硝酸盐。
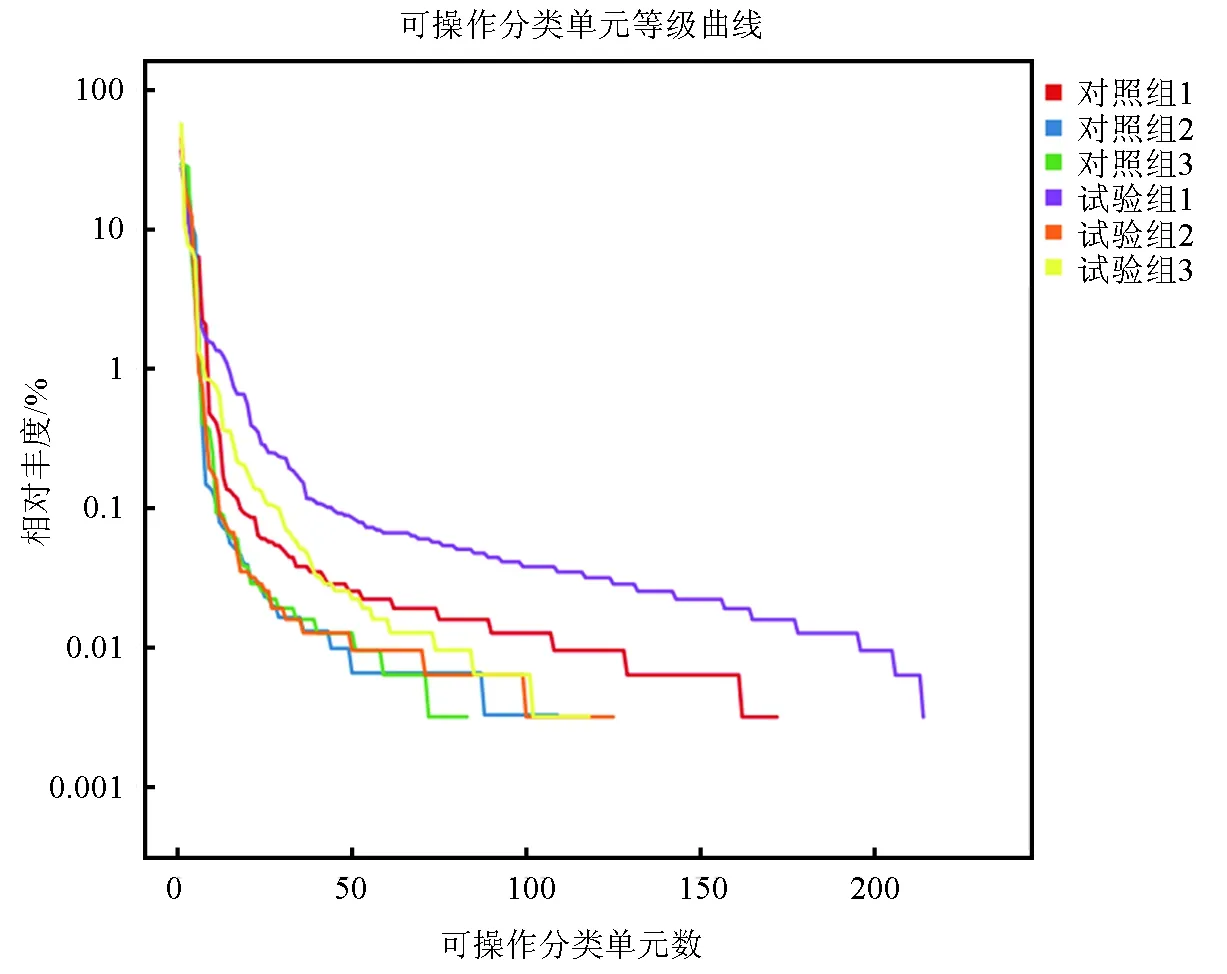
图3 各样品之间物种多样性比较
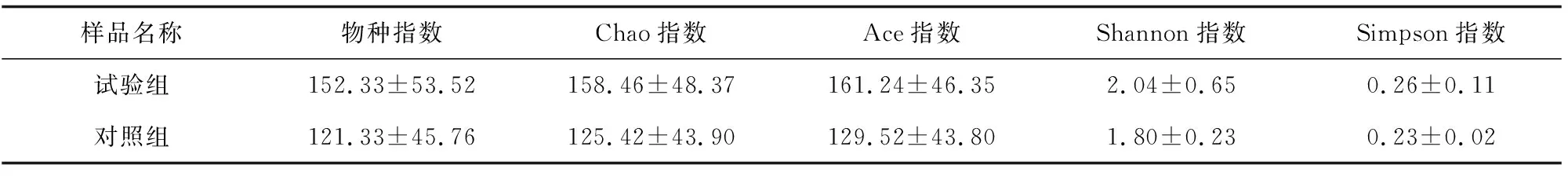
样品名称物种指数Chao指数Ace指数Shannon指数Simpson指数试验组152.33±53.52158.46±48.37161.24±46.352.04±0.650.26±0.11对照组121.33±45.76125.42±43.90129.52±43.801.80±0.230.23±0.02
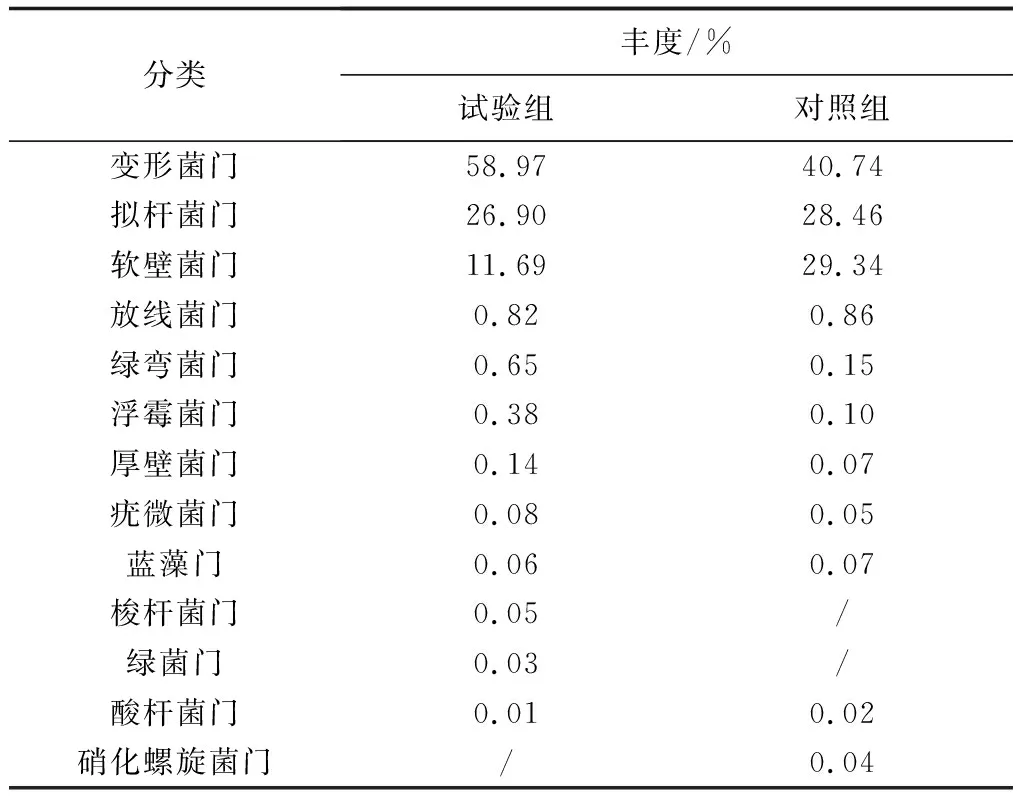
表3 两组样品优势细菌门类及其相对丰度
注:表格中“/”表示未鉴定出.下同.
在属水平上,添加和未添加生物净水栅池塘凡纳滨对虾肠道菌群结构主要由弧菌属(Vibrio)、希瓦氏菌属(Shewanella)、Cloacibacterium、黄杆菌属(Flavobacterium)、红杆菌属(Rhodobacter)、Herbaspirillum、噬氢菌属(Hydrogenophaga)、短根瘤菌属(Bradyrhizobium)、苍白杆菌属(Ochrobactrum)、Lutibacterium等细菌属组成(表4,图4b)。将两组样品中占比>1%的细菌属定义为该组样品的优势菌属。在两组样品中,优势菌属的构成及所占比例有明显不同,试验组样品的优势菌属有弧菌属、希瓦氏菌属、Cloacibacterium、黄杆菌属、红杆菌属,分别占该组样品的70.83%、18.29%、1.97%、1.38%和1.06%,这5种优势菌属共占据该组样品的93.53%。对照组样品的优势菌属仅有弧菌属和希瓦氏菌属,分别占该组样品的58.51%和37.67%,两种优势菌属共占据该组样品的96.18%。在试验组样品中发现的优势菌属Cloacibacterium和红杆菌属在对照组样品中并未发现,两组样品中共有的优势菌属分别为弧菌属和希瓦氏菌属(表4)。可以看出,试验组样品中菌群结构比对照组样品中菌群结构复杂,且优势菌属也比对照组样品多,这表明,添加生物净水栅池塘凡纳滨对虾肠道菌群结构比传统池塘凡纳滨对虾肠道菌群结构复杂,应证了添加生物净水栅池塘凡纳滨对虾肠道菌群多样性高于传统池塘凡纳滨对虾肠道菌群多样性(表2)。
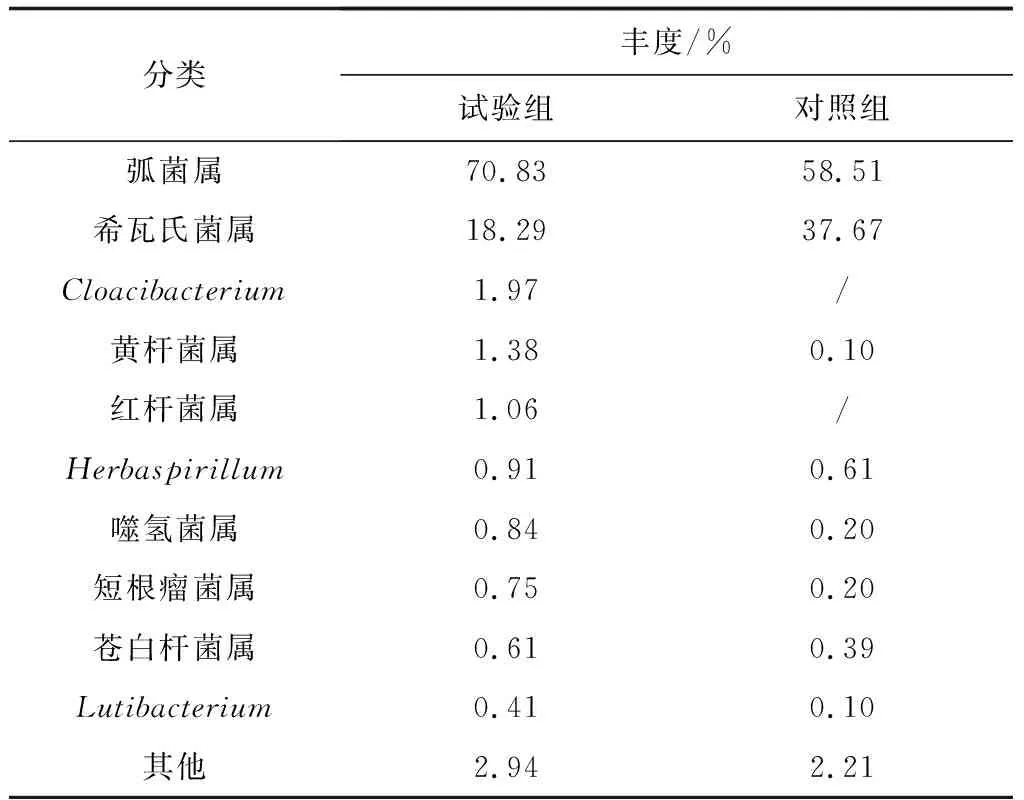
表4 两组样品优势细菌属类及其相对丰度
3 讨 论
3.1 细菌菌群丰富度分析
近十几年来,一些学者对动物肠道菌群结构进行了一系列研究。现有的技术中,纯化培养法[8]只能研究1%可培养的细菌,99%不可培养的细菌将无法研究[18],PCR-DGGE法[15-16]和16S rRNA基因克隆文库法[17]研究菌群结构的信息量不够充分,也就不能全面反映肠道区系内的菌群结构及多样性。近几年兴起的高通量测序技术(如Illumina测序和454测序)[19-20]则克服了这些缺陷,比较全面地揭示了肠道区系内的菌群结构及多样性。本研究通过高通量测序技术,从两组池塘凡纳滨对虾肠道中共检测出16个细菌门105个细菌属。
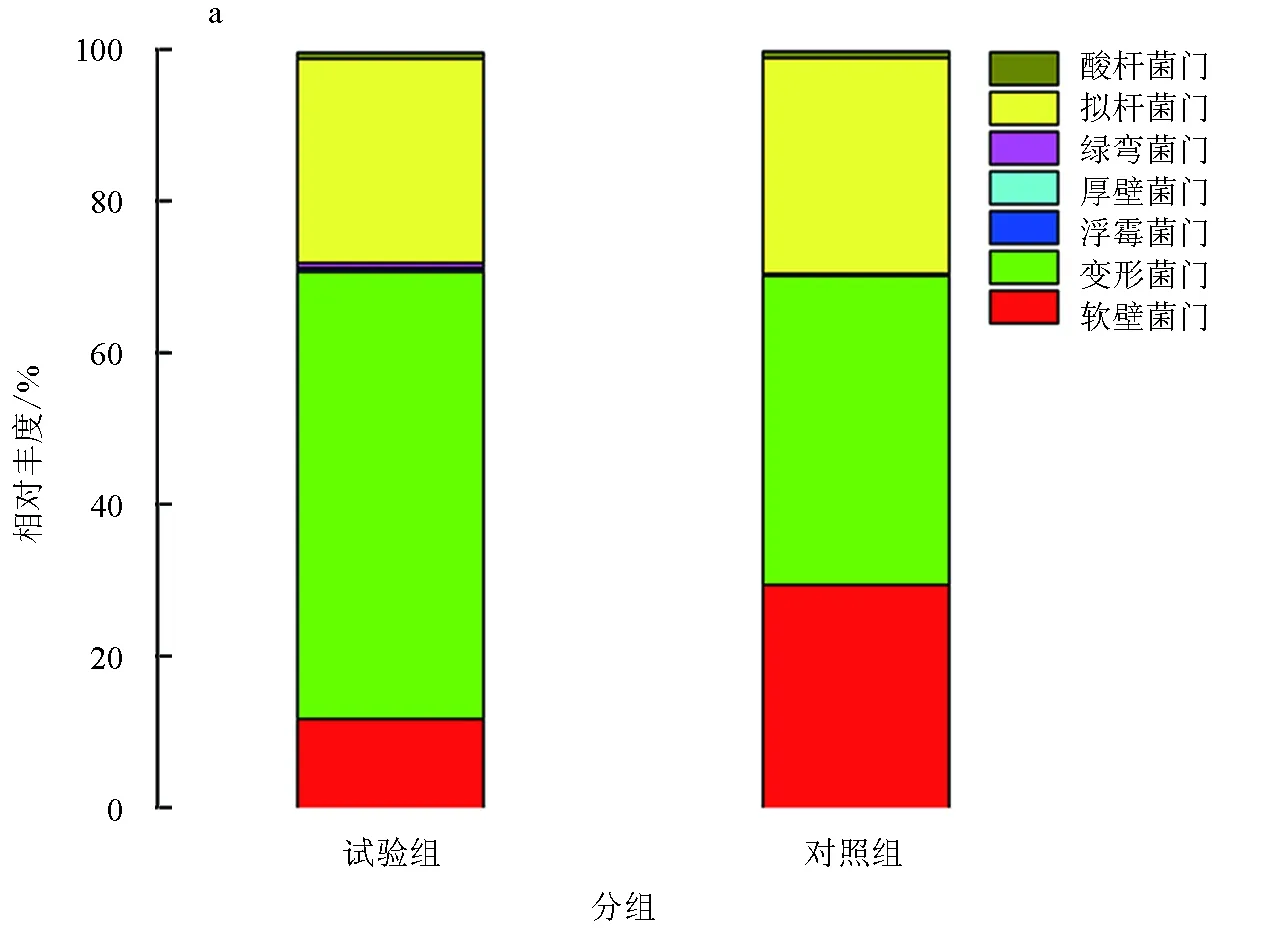
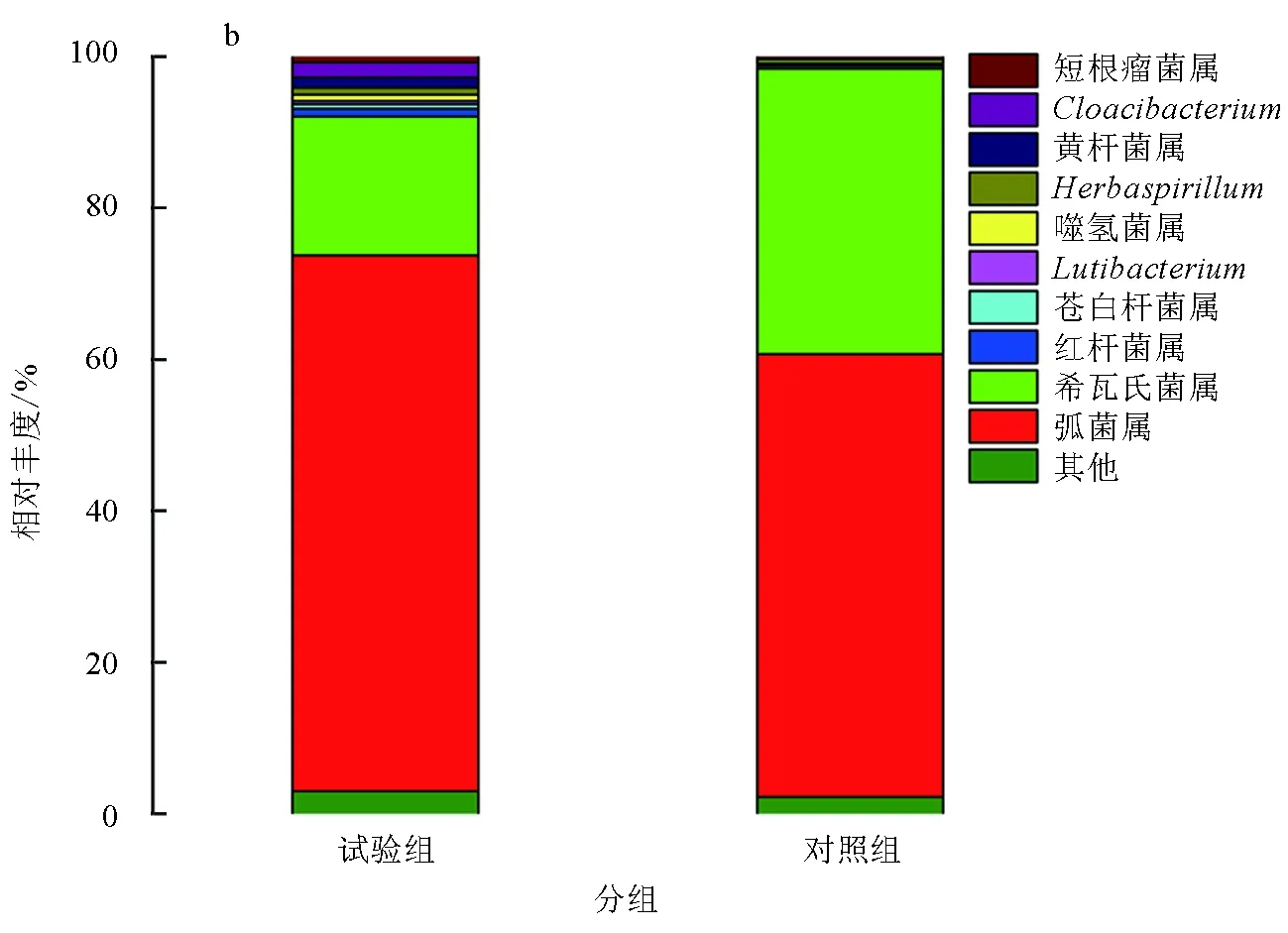
图4 两组样品在门和属水平上细菌菌群结构及分布a表示两组样品在门水平上细菌菌群结构及分布;b表示两组样品在属水平上细菌菌群结构及分布.
关于对虾肠道菌群结构及养殖环境微生物菌群结构已有诸多报道[21-24],而添加生物净水栅池塘凡纳滨对虾肠道菌群结构还未见报道。笔者前期的研究结果显示[12],生物净水栅作为一种附着基质,能够富集一些微生物和细菌,这些微生物和细菌聚集在一起形成一层生物膜。本研究中,试验组凡纳滨对虾肠道菌群丰富度高于对照组。有研究表明[13],凡纳滨对虾会以一些附着基质作为栖息场所,并以该附着基质上的微生物作为额外的食物来源。生物净水栅上的微生物大多来源于水体环境[25],水体环境微生物丰富度远远高于对虾肠道菌群丰富度[26]。试验组凡纳滨对虾肠道菌群有较高的丰富度,可能其肠道内含有外界微生物。依托于包括生物净水栅在内的各种基质或载体而发展起来的生物膜技术大多用于污水处理中[27],目前在水产养殖上也有着广泛应用。研究表明[28],养殖水体中的氮、磷元素有赖于水体中大量的固氮细菌、硝化细菌和反硝化细菌,依靠生物净水栅表面附着的生物膜建立了去除氮、磷元素的氨氧化细菌、硝化细菌等有益微生物。生物净水栅不仅稳定了水质,而且增加了凡纳滨对虾肠道菌群丰富度。
3.2 细菌多样性分析
在本研究中,试验组对虾肠道菌群多样性高于对照组,添加生物净水栅将有助于提高对虾肠道菌群结构及多样性。有研究表明[29-30],由于生物基载体具备可供附着的栖息环境,水体中一部分营附着生活的细菌逐渐在生物膜上形成优势种群,生物膜上出现了难以在水体中形成优势种群的细菌。生物净水栅作为可供微生物、细菌附着的生物基载体,其表面可能积累了一些优势细菌。而生物净水栅又为凡纳滨对虾生长提供了栖息场所,那些优势种群的细菌就会成为凡纳滨对虾额外的食物来源,这就解释了试验组凡纳滨对虾肠道菌群多样性高于对照组。
3.3 细菌菌群组成分析
有研究显示[31],不同养殖季节下,凡纳滨对虾肠道菌群中主要优势菌门类为放线菌门、未分类细菌门、变形菌门和拟杆菌门,分别占细菌总数的53.5%、22.4%、18.8%和4.32%。本试验结果显示,两组凡纳滨对虾肠道菌群结构中均以变形菌门、拟杆菌门和软壁菌门为优势细菌门类,分别占试验组样品细菌总数和对照组样品细菌总数的58.97%、26.90%、11.69%和40.74%、28.46%、29.34%。本研究与前人的研究比较发现,对虾肠道菌群结构组成有一定的相似性,但在组成比例上存在差异,这可能与对虾的养殖季节、栖息地不同有关,也可能与对虾的生理状态不同有关[32]。两组凡纳滨对虾肠道菌群结构均以变形菌门为最大优势细菌门类,所占比例上试验组高于对照组。变形菌门是细菌中最大的一门,试验组凡纳滨对虾肠道内存在的外界微生物可能大部分都属于变形菌门类。
凡纳滨对虾肠道微生物菌群结构和功能在对虾生长中具有重要作用,是维持机体肠道内环境稳定的关键因素[33]。相关研究表明[23],工厂化养殖凡纳滨对虾肠道内优势菌属主要是不可培养细菌、芽孢杆菌属(Bacillus)和弧菌属。Wang等[34]从野生的中国明对虾(Fenneropenaeuschinensis)中分离出47株菌属,弧菌属和发光杆菌属(Photobacterium)在整个肠道内为优势菌属。本试验对池塘养殖的凡纳滨对虾肠道菌群结构研究显示,两组凡纳滨对虾肠道均以弧菌属和希瓦氏菌属为主要优势菌,研究的差异可能在于养殖模式、对虾品种和养殖环境的不同,但均有弧菌属的存在,这就表明弧菌属是凡纳滨对虾肠道内较为常见的菌属。且有研究指出[9],对虾肠道菌群结构组成受外部环境影响较大,以弧菌属为常见菌属。本研究中,试验组凡纳滨对虾肠道内优势菌属为弧菌属、希瓦氏菌属、Cloacibacterium、黄杆菌属和红杆菌属,对照组凡纳滨对虾肠道内优势菌属为弧菌属和希瓦氏菌属,两组凡纳滨对虾肠道内共有的优势菌为弧菌属和希瓦氏菌属。红杆菌属能够抑制致病菌的存活,其广泛地存在于生物絮凝团水体中[35,19],在试验组凡纳滨对虾肠道内发现红杆菌属,而在对照组中并未发现。试验组凡纳滨对虾肠道内弧菌属所占比例要高于对照组,有可能试验组凡纳滨对虾肠道内弧菌属下大多都是有益菌,一些致病菌可能被抑制生长。造成两组凡纳滨对虾肠道内菌群结构差异的可能因素是跟添加生物净水栅有关。
4 结 论
以高通量测序技术为手段,比较了添加生物净水栅池塘和传统池塘凡纳滨对虾肠道细菌群落结构及多样性,了解了凡纳滨对虾在这两种养殖条件下对虾肠道菌群的一般结构、优势菌群及相应的比例。通过比较分析发现,添加生物净水栅池塘凡纳滨对虾肠道菌群丰富度比传统池塘组高,其菌群多样性也高于传统池塘。凡纳滨对虾肠道菌群结构及多样性与添加和不添加生物净水栅有着密切联系,这也为今后池塘对虾养殖提供了参考意见,为虾塘的健康可持续发展提供理论依据。
[1] 温崇庆, 何瑶瑶, 薛明,等.高通量测序分析DNA提取引起的对虾肠道菌群结构偏差[J].微生物学报,2016,56(1):130-142.
[2] 郑天伦, 孔蕾, 朱凝瑜.浙江省南美白对虾病害流行情况及防控对策[J].科学养鱼,2011,3(12):48-49.
[3] 王春忠, 林国荣, 严涛,等.长毛对虾海水养殖环境以及虾肠道微生物群落结构研究[J].水产学报,2014,38(5):706-712.
[4] Chaiyapechara S, Rungrassamee W, Suriyachay I,et al.Bacterial community associated with the intestinal tract ofP.monodonin commercial farms[J].Microbial Ecology,2012,63(7):938-953.
[5] Schryver P D, Vadstein O.Ecological theory as a foundation to control pathogenic invasion in aquaculture[J].ISME Journal,2014,8(12):2360-2368.
[6] Round J L, Mazmanian S K.The gut microbiota shapes intestinal immune responses during health and disease[J].Nature Reviews Immunology,2009,9(5):313-323.
[7] Sonnenburg J L, Chen C T, Gordon J I.Genomic and metabolic studies of the impact of probiotics on a model gut symbiont and host[J].PloS Biology,2006,4(12):2213-2226.
[8] 李继秋, 谭北平, 麦康森.白斑综合征病毒与凡纳滨对虾肠道菌群区系之间关系的初步研究[J].上海水产大学学报,2006,15(1):109-113.
[9] 杨莺莺, 李卓佳, 林亮,等.人工饲料饲养的对虾肠道菌群和水体细菌区系的研究[J].热带海洋学报,2006,25(3):53-56.
[10] 刘淮德, 王雷, 王宝杰,等.应用PCR-DGGE分析南美白对虾肠道微生物多样性[J].饲料工业,2008,29(20):55-58.
[11] 秦楠, 栗东芳, 杨瑞馥.高通量测序技术及其在微生物学研究中的应用[J].微生物学报,2011,51(4):445-457.
[12] 裴鹏兵, 杜虹, 黄晓颖,等.PET净水栅对虾池养殖生态环境的影响研究[J].南方水产科学,2017,13(4):42-51.
[13] 江兴龙, 邓来富.凡纳滨对虾(Litopenaeusvannamei)池塘生物膜低碳养殖技术研究[J].海洋与湖沼,2013,44(6):1536-1543.
[14] 江兴龙.日本鳗鲡(Anguillajaponica)土池生物膜原位修复低碳养殖技术的研究[J].海洋与湖沼,2012,43(6):1134-1140.
[15] 张云鹏, 朱立颖, 肖朝耿,等.南美白对虾体表与肠道细菌菌群结构的DGGE分析[J].中国食品学报,2016,16(8):218-224.
[16] Liu H D, Wang L, Liu M,et al.The intestinal microbial diversity in Chinese shrimp (Fenneropenaeuschinensis) as determined by PCR-DGGE and clone library analyses[J].Aquaculture,2011,317(1/4):32-36.
[17] 李可, 郑天凌, 田蕴,等.南美白对虾肠道微生物群落的分子分析[J].微生物学报,2007,47(4):649-653.
[18] 杨坤杰, 王欣, 熊金波,等.健康和患病凡纳滨对虾幼虾消化道菌群结构的比较[J].水产学报,2016,40(11):1765-1773.
[19] Cardona E, Gueguen Y, Magre K,et al.Bacterial community characterization of water and intestine of the shrimpLitopenaeusstylirostrisin a biofloc system[J].BMC Microbiology,2016,16(1):1-9.
[20] Wu S G, Tian J Y, Gatesoupe F J,et al.Intestinal microbiota of gibel carp (Carassiusauratusgibelio) and its origin as revealed by 454 pyrosequencing[J].World Journal of Microbiology and Biotechnology,2013,29(9):1585-1595.
[21] 吴金凤, 熊金波, 王欣,等.肠道菌群对凡纳滨对虾健康的指示作用[J].应用生态学报,2016,27(2):611-621.
[22] 孙振丽, 宣引明, 张皓,等.南美白对虾养殖环境及其肠道细菌多样性分析[J].中国水产科学,2016,23(3):594-605.
[23] 李玉宏, 柴鹏程, 胡修贵,等.应用RFLP和DGGE技术分析工厂化养殖凡纳滨对虾肠道微生物群落特征[J].渔业科学进展,2014,35(2):83-89.
[24] Rungrassamee W, Klanchui A, Chaiyapechara S,et al.Bacterial population in intestines of the black tiger shrimp (Penaeusmonodon) under different growth stages[J].PloS One,2013,8(4):e60802.
[25] Zhao P, Huang J, Wang X H,et al.The application of bioflocs technology in high-intensive, zero exchange farming systems ofMarsupenaeusjaponicus[J].Aquaculture,2012,354/355(2):97-106.
[26] Wang C Z, Lin G R, Yan T,et al.The cellular community in the intestine of the shrimpPenaeuspenicillatusand its culture environments[J].Fisheries Science,2014,80(5):1001-1007.
[27] 刘晴, 杨兰, 王东田,等.净水污泥为载体的生物膜法在印染废水处理中的应用[J].环境工程学报,2017,11(1):188-196.
[28] 孙寓姣, 赵轩, 王蕾,等.沣河水系脱氮微生物群落结构研究[J].生态环境学报,2014,23(9):1451-1456.
[29] Qiu C S, Zhang D D, Sun L P,et al.Purification of high ammonia wastewater in a biofilm airlift loop bioreactor with microbial communities analysis[J].World Journal of Microbiology and Biotechnology,2015,31(1):49-57.
[30] Pang S, Zhang S H, Lv X Y,et al.Characterization of bacterial community in biofilm and sediments of wetlands dominated by aquatic macrophytes[J].Ecological Engineering,2016,97(1):242-250.
[31] Tang Y Y, Tao P Y, Tan J G,et al.Identification of bacterial community composition in freshwater aquaculture system farming ofLitopenaeusvannameireveals distinct temperature-driven patterns[J].International Journal of Molecular Sciences,2014,15(8):13663-13680.
[32] Xiong J B, Wang K, Wu J F,et al.Changes in intestinal bacterial communities are closely associated with shrimp disease severity[J].Applied Microbiology and Biotechnology,2015,99(16):6911-6919.
[33] 张家松, 段亚飞, 张真真,等.对虾肠道微生物菌群的研究进展[J].南方水产科学,2015,11(6):114-119.
[34] Wang X H, Li H R, Zhang X H,et al.Microbial flora in the digestive tract of adult penaeid shrimp (Penaeuschinensis)[J].Journal of Ocean University of Qingdao,2000,30(3):492-498.
[35] Cytryn E, Van R J, Schramm A,et al.Identification of bacteria potentially responsible for oxic and anoxic sulfide oxidation in biofilters of a recirculating mariculture system[J].Applied and Environmental Microbiology,2005,71(10):6134-6141.

