高效液相色谱法检测罗非鱼血浆中L-肉碱的方法研究
唐 笑,黄 凯,杨淇龄,罗志远,武林华,左 腾
( 1.广西大学 动物科学技术学院,广西 南宁 530000; 2.河池市水产畜牧兽医局,广西 河池 547000 )
肉碱是动物体内常见含氮非蛋白质类小分子,对其生长发育、繁殖等方面有重要的功能,已被应用于机能性食品添加剂、饲料添加剂及药品领域。畜牧业的快速发展,如何合成安全、方便和高效的促生长剂成为药物及营养学研究的热点问题[1]。目前研究发现,L-肉碱使用方便,在饲料中添加L-肉碱具有提高水产动物生长、抗脂肪肝、提升鱼肉品质和减轻杀虫剂、药物、氨等毒性物质对水产动物的毒害作用等效果,肉碱作为一种新型的饲料添加剂在多行业进行了研究利用[2]。因而,建立检测肉碱的准确、快速、灵敏度高、重现性好的高效液相色谱法迫切而有实际意义。
目前国内外应用高效液相色谱法检测肉碱的报道不多,其他较为先进的检测方法有:色谱法[3-5]、生物法[6]、化学比色法[7]、酶法[8]、光谱法[9]、荧光法[10]、放射酶分析法[11]和酮戊二酸脱氢酶法[12]。但肉碱极性强、紫外吸收弱,笔者根据其理化性质,采用对溴苯乙酰基溴紫外衍生法来降低极性,能增加检测的灵敏度,同时结合正相色谱分离技术,建立测定罗非鱼血浆中肉碱含量的柱前衍生—正相高效液相色谱法。
1 材料与方法
1.1 仪器、试剂与试验鱼
UltiMate 3000高效液相色谱系统、精密电子天平、高速台式离心机、Vortex-Genie 2型漩涡混合器、HW-100型恒温水浴箱、5200DT型超声清洗机。
肉碱标准品、鱼旺四号、甲醇、乙腈、异丙醇、三乙胺、三乙醇胺、柠檬酸、磷酸氢二钠、磷酸二氢钾、氧化银、对溴苯乙酰基溴、10%和40%四丁基氢氧化铵、肝素钠、10 mmol/L的肉碱储备液、50 μmmol/L肉碱工作液。
选取体质量为(82.71±1.28) g的吉富罗非鱼(Oreochromisniloticus, GIFT)。试验前3 d停止投喂饲料。试验在玻璃水族箱中进行,水温(28±1) ℃,pH 6.9±0.1,持续保持充气状态。
1.2 正向色谱的基本条件
色谱柱:Kromasil Sil 色谱柱(250 mm × 4.6 mm,5 μm);流动相配制:用电子天平称取柠檬酸(C6H8O7·H2O)1.89 g,加入约400 mL超纯水溶解,定容至500 mL以配置柠檬酸缓冲液。乙腈—柠檬酸缓冲液(90∶10,体积比),其中每升流动相中含有0.25 mL三乙胺,在上机前流动相及样品均用0.45 μm 滤膜减压过滤,流速1.2 mL/min,柱温35 ℃,检测波长260 nm,进样量20 μL[13-14]。
1.3 色谱条件的优化方案
1.3.1 样品的处理方法
处理方法1:取标准品0.3 mL溶液至离心管,加入乙腈∶甲醇(9∶1,体积比) 1 mL,混匀后加入400 mg的磷酸氢二钠+氧化银混合物(9∶1,质量比)和400 mg的磷酸二氢钾,漩涡振荡5 min,离心5 min,用移液枪移取上清液900 μL,再次加入NaH2PO4∶Ag2O (9∶1,体积比) 混合物及KH2PO4各250 mg,漩涡振荡2 min后静置 20 min,10 000 r/min 离心10 min。取上清液600 μL, 加入衍生剂10%四丁基氢氧化铵50 μL,混匀后70 ℃水浴 90 min,取出流水冷却后吸取20 μL,按上述色谱条件进样测定。
处理方法2:前面步骤同方法1,将磷酸二氢钾换成无水磷酸二氢钾后,立即剧烈振摇5 min,8000 r/min离心5 min,取上清液600 μL,后面步骤同方法1。
1.3.2 流动相的选择
试验考察了每1000 mL流动相中三乙胺含量(0.10、0.20、0.25、0.30、0.35 mL)对试验结果的影响。
1.3.3 柱温的选择
在柱温分别为25、30、35 ℃时进样,考察其柱温变化对衍生后的肉碱衍生物分离效果的影响。
1.4 标准曲线的制备
用超纯水稀释肉碱储备液至1、5、25、50、100、200、400 μmol/L,按制样方法各步骤进行处理后测定,重复3次。经高效液相色谱法分析后得到峰面积与浓度的标准曲线。根据相关系数估计样本中肉碱的定量的线性范围。
2 结 果
2.1 不同处理方法对肉碱衍生物色谱峰的影响
结果显示,两种样品处理方法对肉碱标准品色谱峰的影响差异显著,处理方法2相对于处理方法1操作更简便,缩短样品处理时间,但两者对出峰时间影响较小。另外,相同浓度肉碱标准品,按方法2处理制备样品,肉碱提取量增加,肉碱与衍生试剂反应更完全,峰面积增大,肉碱衍生物色谱峰峰形良好,不受其他杂质干扰峰的干扰。因此,采用方法2处理样品来进行后续试验。两种方法制备出的肉碱衍生物色谱图见图1。
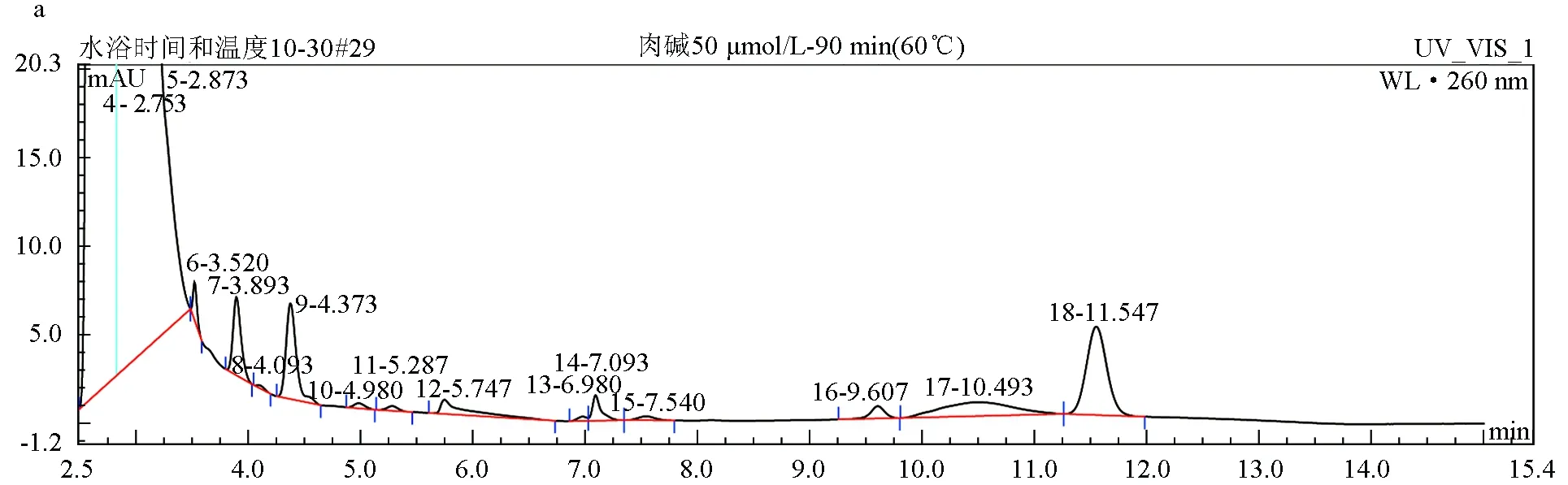
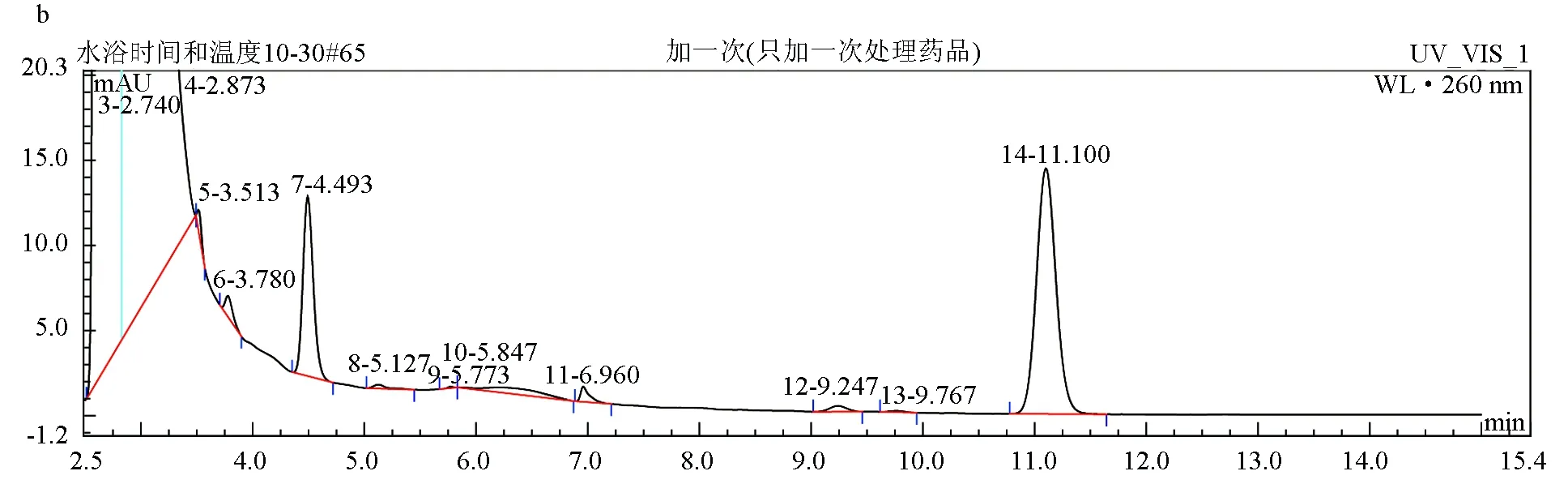
图1 不同处理方法对肉碱衍生物色谱峰的影响a:方法1处理;b:方法2处理
2.2 流动相的选择
结果显示,在流动相中添加三乙胺可延长肉碱衍生物在色谱柱上的保留时间(图2),但色谱柱压上升,过高的三乙胺会损坏色谱柱。本试验选择的流动相为乙腈—柠檬酸缓冲液(90∶10,体积比), 其中每升流动相中含有三乙胺0.25 mL。
2.2.3 柱温的选择
柱温的变化对分离效果无显著影响,肉碱衍生物的出峰时间随着柱温的升高而保留时间缩短,25、30、35 ℃时肉碱保留时间分别为11.213、11.113、11.073 min,为缩短检测样品的时间,确定本试验的检测柱温为35 ℃(图3~图5)。
3 方法学上的验证
3.1 专属性试验
按上述条件进行测定,肉碱标准品的保留时间约为11.03 min,血清样品肉碱衍生物的保留时间为11.82 min。肉碱衍生物与内存性物质分离完全,无杂峰干扰。约15 min内可完成一次进样分析。肉碱标准品及罗非鱼血清样品色谱图见图6和图7。
3.2 标准曲线与线性范围
在1~400 μmol/L浓度线性范围内,肉碱衍生物色谱峰面积与待测样品的浓度呈良好的线性关系(图8)。

图2 流动相三乙胺含量对肉碱衍生物保留时间的影响
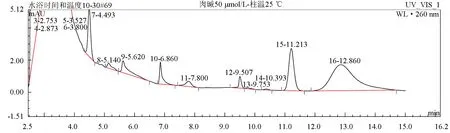
图3 柱温为25 ℃时肉碱标准品色谱

图4 柱温为30 ℃时肉碱标准品色谱
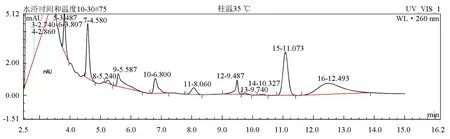
图5 柱温为35 ℃时肉碱标准品色谱
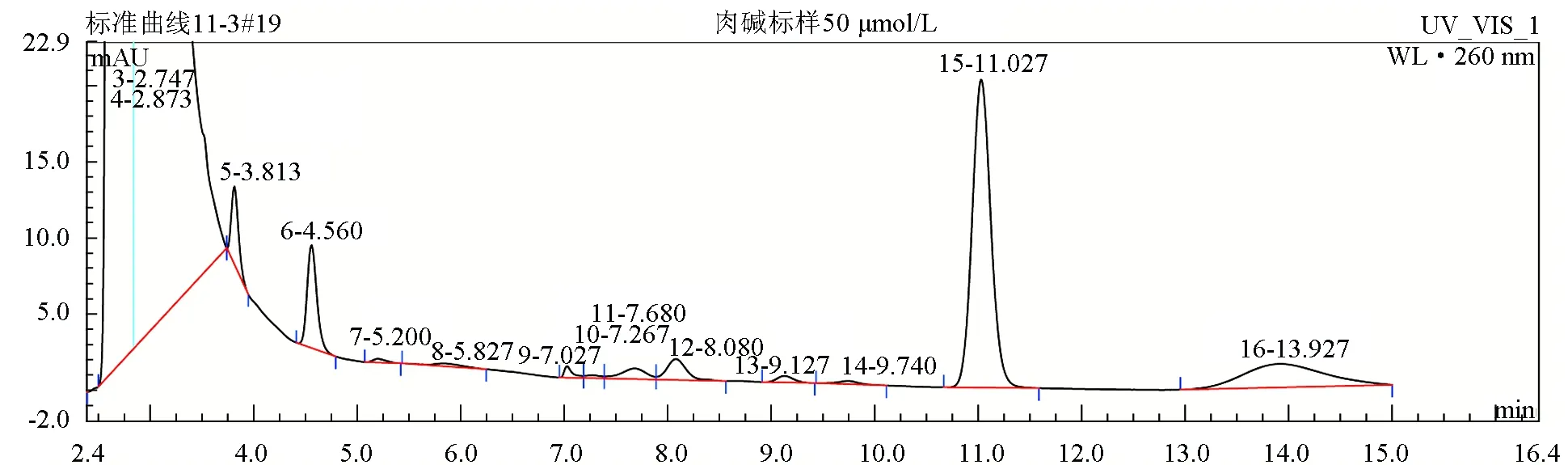
图6 肉碱标准品色谱
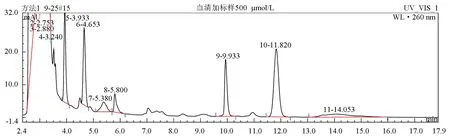
图7 罗非鱼血清样品色谱
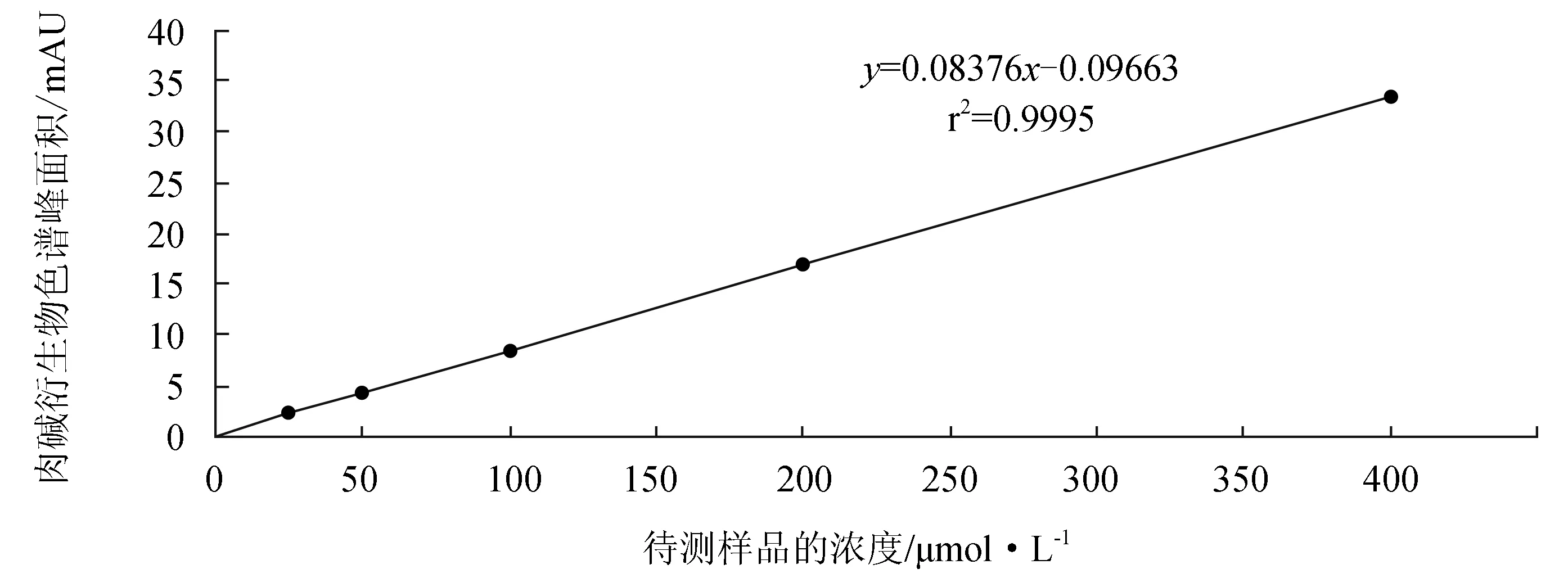
图8 肉碱标准曲线
3.3 最低检测限
配置不同浓度的肉碱样品,测得在本试验色谱条件下L-肉碱的最低检测限为1 μmol/L。
3.4 精密度
配制不同浓度的L-肉碱标准溶液(1、25、100、400 μmol/L)按照本试验确定的样品方法处理之后,测定肉碱的日内、日间精密度,其结果见表1。
由表1可知,肉碱标准品的日内变异系数为1.79%~5.56%,日间变异系数为9.83%~11.81%。
3.5 回收率
配制不同浓度(1、25、100、200 μmol/L)罗非鱼血清样品,测定肉碱回收率。结果显示,罗非鱼混合空白血清样品中肉碱含量为(2.10±0.34) μmol/L,测定回收率为88.16%~101.48%,平均回收率95.83%(表2)。
3.6 样品稳定性
将浓度为50 μmol/L的肉碱标准品,按上述方法制样,置于室温下(25~30 ℃),在衍生反应完成后每隔3 h测一次,重复3次,连续测定12 h以观其稳定性。结果表明,肉碱衍生物在反应12 h内稳定,12 h峰面积变化相对标准偏差为6.58%,符合检测要求。
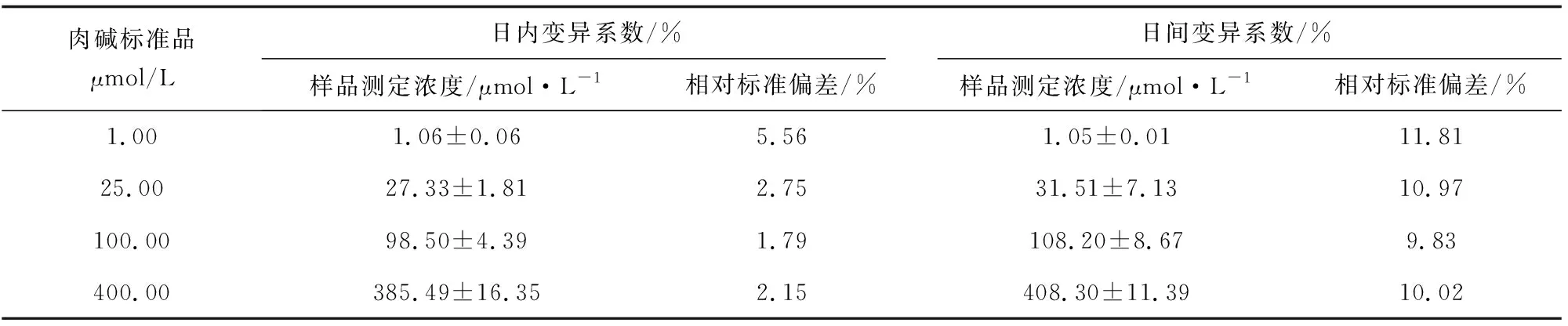
表1 肉碱标准品的日内、日间精密度(平均值±标准差,n=6)

表2 不同浓度肉碱的相对回收率(平均值±标准差,n=5)

表3 12 h内肉碱稳定性的测定
3.7 样品分析
自尾静脉抽取罗非鱼血液,4000 r/min离心15 min,分离血浆。测定血清中游离肉碱水平为(2.10±0.34) μmol/L。
4 讨 论
4.1 L-肉碱的检测方法选择
目前,关于测定血液中游离肉碱测定方法中较为实用的是酶法[15]、放射同位素酶法[16]、质谱法[17-18]。酶法测定过程复杂,样品测定时间较长,且检测结果的准确性与酶活性及共存物等因素关联较大;放射同位素酶法相对于酶法较灵敏,但测定方法精密度较差,其测定过程仍复杂,且有损伤操作者和污染环境的缺点;质谱法仪器成本高,测定过程复杂,故质谱法虽有良好的精密度和准确度却无法大规模的推广应用。采用正相液相色谱法时发现,保留时间延长,出峰时间约为11.1 min,肉碱衍生物与其他物质分离完全,峰型良好。孙庆宝等[19]将肉碱衍生化反应后,以二氧化硅为固定相,在乙腈—柠檬酸缓冲液为流动相,260 nm波长的色谱条件下定量检测兔血清游离肉碱的含量。肉碱衍生物的出峰时间约为12.5 min,峰形清晰对称,与样品中其余内源性物质分离完全。但其处理样品时间长,操作相对繁琐。肉碱的结构式为β-羟-γ-三甲氨基丁酸,肉碱极性较强,在用反相色谱法测定肉碱时,可通过加入离子对试剂庚烷磺酸钠溶剂[20]、辛烷磺酸钠溶液[21]可使色谱柱中对L-肉碱保留时间延长,加入离子对试剂的缺点是其对色谱柱具有吸附作用,长期使用对色谱柱损害较大,另外柱子的平衡和冲洗时间长。考虑到以上情况,本试验采用柱前衍生正向色谱法,通过加入具有强紫外吸收的衍生试剂,与肉碱反应后生成对紫外吸收敏感的酯化物,从而达到降低肉碱极性,增加其紫外吸收。流动相中柠檬酸浓度的改变对于肉碱衍生物分离度影响较小,但过高浓度的三乙胺会对色谱柱造成损伤[19]。所以相比较而言,在流动相中加入纯水稀释柠檬酸是更优选择,对色谱柱影响较小。肉碱中含有活性基团,即羟基和羧基,故常用的衍生化试剂有邻苯二甲醛[22]、芴甲氧羰酰氯[1]、9-氰酸蒽、L-丙氨酸-β-萘胺[23]、4-溴苯酰三氟甲烷磺胺[24]、对溴苯乙酰基溴[25]等。选用对溴苯乙酰基溴作为衍生试剂,它是一种芳香族试剂,其与肉碱的羧基发生反应,该反应条件温和、产物稳定、适用范围广泛。
4.2 HPLC法测定血浆样品影响因素分析
检测在血浆L-肉碱的应用中,应注意:(1)冻融因素。本试验的血浆L-肉碱的日内变异系数为1.79%~5.56%,达到了血清检测变异系数需<10%的要求[26],日间变异系数为9.83%~11.81%,未达到检测要求。赵亚明等[27]研究人体血浆L-肉碱的日内变异系数均<5%,而日间变异系数>10%,与本试验结果相似。推测原因可能是血样采用-20 ℃冷冻保存,在每次试验前需要解冻,导致精密度下降。为避免以上情况发生,建议测定L-肉碱样品时尽量用新鲜血样。(2)水分因素。肉碱衍生化反应须在无水情况下进行[28],对所用试剂、血浆中的水分均须去除完全,否则将影响到衍生化反应的进行,进而影响测定结果的准确性。(3)混合均匀度因素。血浆中的氯离子和水分对试验衍生物的分离度有较大的干扰,故须将衍生化试剂与肉碱充分的混合以试剂中的银离子能与血浆中的氯离子充分作用达到去除血浆中的氯离子的作用,同时,充分的混合可去除血浆中的水分,提高肉碱衍生物的产率。据文献报道,在处理样品时通过振摇1 h的方法以保证反应能充分完全[29]。本试验则采用在漩涡振荡仪上漩涡振荡5 min,试验结果表明这种方法也能达到同样的效果,且缩短了样品的处理时间。
本试验通过考察流动相、柱温对色谱峰的影响和样品处理方法等方面,建立了相应的高效液相色谱法。该方法具有良好的专属性,肉碱衍生物与内存性物质分离完全。且重复性、线性关系、精密度均达到要求,最低检测度为1 μmol/L也达到了要求,肉碱衍生物在反应12 h内稳定说明试验稳定性良好,故可将其作为检测L-肉碱的分析方法。
[1] 王聪. 章鱼中肉碱、章鱼肉碱检测方法研究[D]. 青岛:中国海洋大学, 2011.
[2] 王永侠,占秀安,郑严严. L-肉碱及其在水产养殖中的应用研究进展[J]. 广东饲料,2008, 17(5):39-40.
[3] 孙志浩,王雷. L-肉碱制备和应用研究的概况[J]. 食品与发酵工业, 1996, 212(2):64-68.
[4] 祝虹,吉承平. 运用Linux系统打造NAT防火墙的技术研究与实现[J]. 电子设计工程,2013, 21(3):17-19.
[5] 廖晖,史雯静,何晓峰,等. Blended Learning在运动系统疾病课程教学中的应用研究[J].中国医学教育技术,2013(1):11-14.
[6] Travassos L R, Celuta O. Microbiological assay of carnitine[J]. Anal Biochem,1974, 58(2):485-499.
[7] Friedman. Determination of carnitine in biological materials[J]. Archives of Biochemistry and Biophysics, 1958, 75(1):24-31.
[8] Marquis N, Fritz I. Enzymological determintation of free carnitine concentration in rat tissues[J]. J Lipid Res, 1964,5(2):184.
[9] Cederblad G, Lindstedt S. A method for the determination of carnitine in the picomol range[J]. Clin Chim Acta, 1972, 37(3):235-243.
[10] 李红艳,陈小珍,张慧.液相色谱—荧光法测定婴幼儿奶粉中右旋肉碱[J]. 分析试验室,2013, 32(7):1-4.
[11] 李晨钟,张素华,邱鸿鑫,等. 放射酶分析法检测红细胞胰岛素降解酶活性[J]. 重庆医科大学学报, 1998, 23(1):1-3.
[12] Jochen Schafer,Heinz Reichmann. A spectrophotometric method for the determination of free and esterified carnitine[J]. Clinica Chimica Act A, 1989, 182(1):87-94.
[13] 邹雨佳,聂实践,李东. L-肉碱的检测方法[J]. 生物工程进展,1999, 19(1):72-75.
[14] Minkler P, Ingalls S, Kormos L,et al. Determination of carnitine butyrobetaine, and betain as 4-bromaphenacyl ester derivatives by high-performance liquid chromatography[J]. J Chromatogr,1984,336(2):271-283.
[15] 焦莉莉,杨文双,蔺小红,等. 健康成人与肝脏疾病患者血浆肉毒碱的检测[J]. 检验医学,2007, 22(5):528-530.
[16] 梅长林,徐洪实,顾书华,等. 血液透析病人血浆游离肉碱测定及临床意义[J]. 中华医学检验杂志,1998, 21(6):34-37.
[17] 蔡燕娜. 串联质谱检测正常儿童干血滤纸片中游离肉碱和酰基肉碱含量[D].广州:广州医学院,2011.
[18] 修娴. 非肥胖型PCOS患者血清中左旋肉毒碱浓度和代谢指标的检测及意义[D]. 长沙:中南大学,2009.
[19] 孙庆宝,刘小传,李克. 柱前衍生—正相高效液相色谱法测定兔血清中游离肉毒碱[J]. 中国组织工程研究与临床康复,2007, 11(49):9929-9932.
[20] 林淼,赵志辉,雷萍. 反相高效液相色谱法测定饲料及饲料添加剂中L-肉碱含量[J]. 理化检验:化学分册,2009, 45(11):1268-1270.
[21] 徐连明,王振中,毕宇安,等. HPLC法测定减肥胶囊中左旋肉碱的含量[J]. 海峡药学,2009, 21(11):46-47.
[22] 梁冬生,常碧影. 柱前衍生高效液相色谱法测定氨基酸[J]. 色谱,1993, 11(1):140-143.
[23] 祝伟霞,杨冀州,刘亚风,等. 保健品中左旋肉碱的反相高效液相色谱法测定[J]. 分析测试学报,2008, 27(10):1124-1127.
[24] Engalls S T, Minkler P E, Hoppel C L,et al. Derivatization of carboxylic acids by reaction with 4′-bromophenacyl trifluorome thanesulfonate prior to determination by high-performance liquid chromatography[J]. J Chromatography,1984(299):365-376.
[25] 甘宾宾,黎少豪. HPLC法测定保健食品中左旋肉碱含量的研究[J]. 中国卫生检验杂志, 2010, 20(7):1688-1689.
[26] Musser R E,Goodband R D,Tokach M D, et al. Effects of L-carnitine fed during gestation and lactation on sow and litter performance[J]. Professional Animal Scientist, 1998, 14(1):28-35.
[27] 赵亚明,李任,王得新,等. 高效液相色谱法检测血浆左旋肉碱方法的建立[J]. 中国临床神经科学,2006, 14(5):528-532.
[28] 宋涛. 高效液相色谱在生命科学中的应用[R]. 济南: 中国出版年鉴社, 1998.
[29] Nezu J,Tamai I. Primary systemic carnitine deficiency is caused by mutations in a gene encoding sodium ion-dependent carnitine transporter[J]. Nature Genet,1999(21):91-94.

